文献解读|Cell Rep Med(14.3):人肺腺癌发展的免疫细胞图谱揭示了 Tfh 依赖性三级淋巴结构的抗肿瘤作用
✦ +
+
论文ID
原名:An immune cell map of human lung adenocarcinoma development reveals an anti-tumoral role of the Tfh-dependent tertiary lymphoid structure
译名:人肺腺癌发展的免疫细胞图谱揭示了 Tfh 依赖性三级淋巴结构的抗肿瘤作用
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.03.01
DOI号:10.1016/j.xcrm.2024.101448
背 景
肿瘤的发展是一个多步骤的过程,涉及起始、侵袭、进展和转移。肺腺癌(LUAD)是最常见和致命的肺癌类型。早期 LUAD 及其前兆包括非典型腺瘤性增生 (AAH)、原位浸润性腺癌(AIS)、微浸润性腺癌 (MIA) 以及最终的浸润性腺癌 (IAC)。LUAD发展的起始和侵袭阶段的免疫反应在很大程度上是未知的。
实验设计
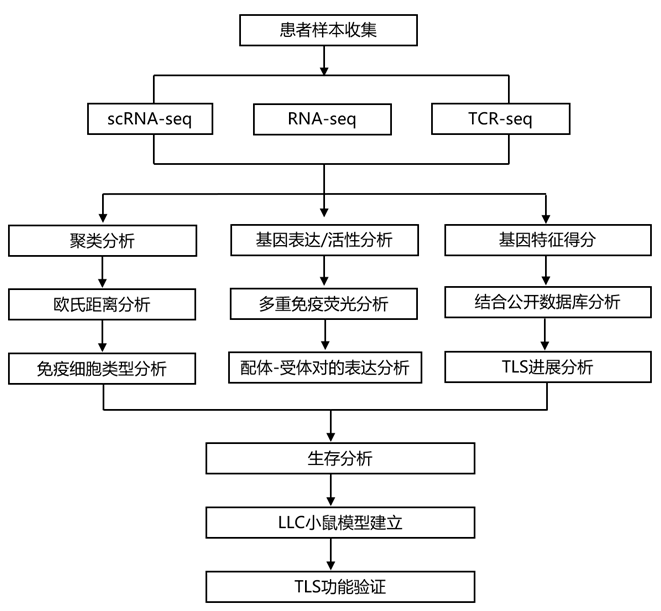
结 果
01
人类 LUAD 发育过程中免疫动态的时间分辨 scRNA-seq 图
为了研究 LUAD 发展过程中的免疫动态,研究者团队从 61 名 LUAD 患者的 93 个临床样本中收集了免疫细胞进行单细胞转录组分析(scRNA-seq),共获得63687个免疫细胞,覆盖正常肺34个,AIS 4个,MIA 22个,IAC 33个样本,反映了早期LUAD的发生、侵袭和进展过程(图1A)。他们使用宏细胞算法根据1333个最易变基因的聚类特异性表达模式来识别细胞群,从而得到324个元细胞的详细图谱,分为9个广泛的谱系,包括CD4+ T细胞、CD8+ T细胞、自然杀伤(NK)细胞、树突状细胞(DC)、巨噬细胞、单核细胞、B细胞、浆细胞和先天淋巴样细胞(图1B)。他们进一步将每个谱系细分为几种亚型和细胞状态,产生 32 个亚型/状态,代表 LUAD 发育过程中免疫景观的转录多样性(图 1 C-D)。值得注意的是,比较 AIS-正常、MIA-正常、IAC-正常和 IAC-MIA 之间的距离显示,从正常到 IAC 阶段的距离逐渐增加,表明肿瘤通过肺上皮下方的基底膜侵袭前后的免疫微环境(图1E)。
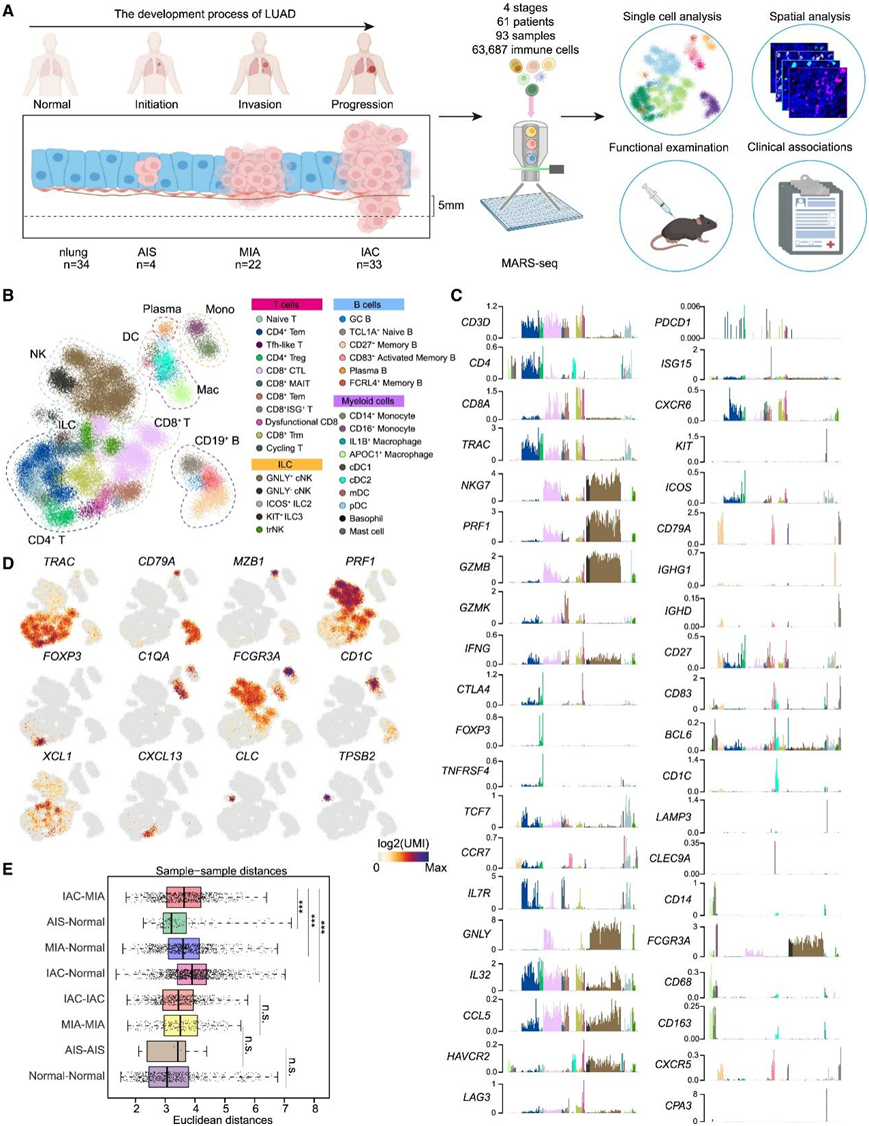
图1. 早期LUAD和正常肺组织CD45 +免疫细胞的单细胞图谱。
(A) 实验设计的图形概述。(B) nLung 和 LUAD 免疫细胞亚聚类的 2D 投影。(C) 所选基因在细胞模型上的标准化表达。(D) 选定的标记基因在元细胞模型上的 2D 投影。(E) 仅nLung(正常-正常)、仅肿瘤(AIS-AIS、MIA-MIA、IAC-IAC、IAC-MIA)或nLung-肿瘤(mia -正常、iac -正常、ais -正常)之间样本对之间的欧氏距离。
02
肿瘤侵袭过程中 CD4+ T 和 B 细胞频率增加伴随着 NK 细胞减少
他们通过计算每组投影细胞的二维密度(控制细胞和患者的数量)来可视化免疫区室的变化,并观察 LUAD 进展期间免疫细胞群的整体重组(图 2 A)。为了进一步了解哪些细胞类型发生了显著变化,他们计算了贡献分数并进行了差异分析(图 2B-C)。在疾病进展过程中,NK 细胞和单核细胞逐渐减少,同时伴随着 CD19 + B、CD4 + T 和浆细胞频率的增加,主要发生在 IAC 患者中。流式细胞分析还证实,从MIA阶段过渡到IAC阶段时, CD45 +、CD19 + B和CD4 + T细胞显著增加,表明肿瘤侵袭过程可诱导B和CD4 + T细胞突然增加(图2D)。相反,在 CD8+ T 细胞、巨噬细胞或 DC 中未观察到显著变化(图 2C-D),这些结果表明B细胞和CD4 + T细胞可能主要在肿瘤侵袭后发挥作用。
由于T细胞和NK细胞的抗肿瘤活性受到一系列细胞毒性相关基因和刺激/抑制受体的严格调控,因此他们通过计算CD4+ T细胞、CD8+ T细胞和NK细胞的细胞毒性和抑制受体基因标记分数来检测它们的抗肿瘤活性(图2E)。细胞毒性基因活性评分下降,抑制受体基因活性评分上升,表明这些细胞从抗肿瘤细胞状态过渡到功能失调细胞状态。他们进一步细分T细胞和NK细胞,得到基于29个差异表达基因(DEG)的14个亚聚类。这些细胞包括TCF7+幼稚T细胞、GZMK+ CD8-效应记忆T细胞(Tem)、ZNF683+ CD8-组织驻留记忆T细胞(Trm)、GZMB+ CD8-细胞毒性T细胞(CTL)、SLC4A10+ CD8-粘膜相关不变T细胞(MAIT)、干扰素刺激基因阳性 CD8+ T细胞、FOXP3+ cd4 -调节性T细胞(Treg)、CD4-Tem、表达cxcl13的功能失调CD8+ T细胞和tfh样细胞、GNLY+和GNLY -常规NK细胞以及组织驻留NK细胞(图2F)。虽然CD8+ T细胞的频率保持相对恒定,但通过分数分析,他们观察到细胞毒性、GZMB+ CD8- ctl亚型逐渐减少,同时功能失调的CD8+ T、tfh样、CD8+ Trm和Treg细胞增加(图2G-H)。
为了进一步了解这些增加的 T 细胞群的增殖和克隆动态,他们对另外两名 IAC 患者的样本进行了T 细胞受体 (TCR) 测序(TCR-seq),并鉴定了 8 种 T 细胞亚型。与 IAC 阶段频率增加一致,功能失调的 CD8 + T 和滤泡辅助性 T (Tfh)样细胞在 IAC 组织中显示出更大的克隆型大小(图 2 I)。为了探究观察到的克隆扩增是否可能是由于 T 细胞增殖所致,他们通过汇集细胞周期基因的表达来计算每个细胞的增殖评分。功能失调的 CD8 + T 和 Tfh 样细胞的很大一部分处于循环状态(图 2 J)。
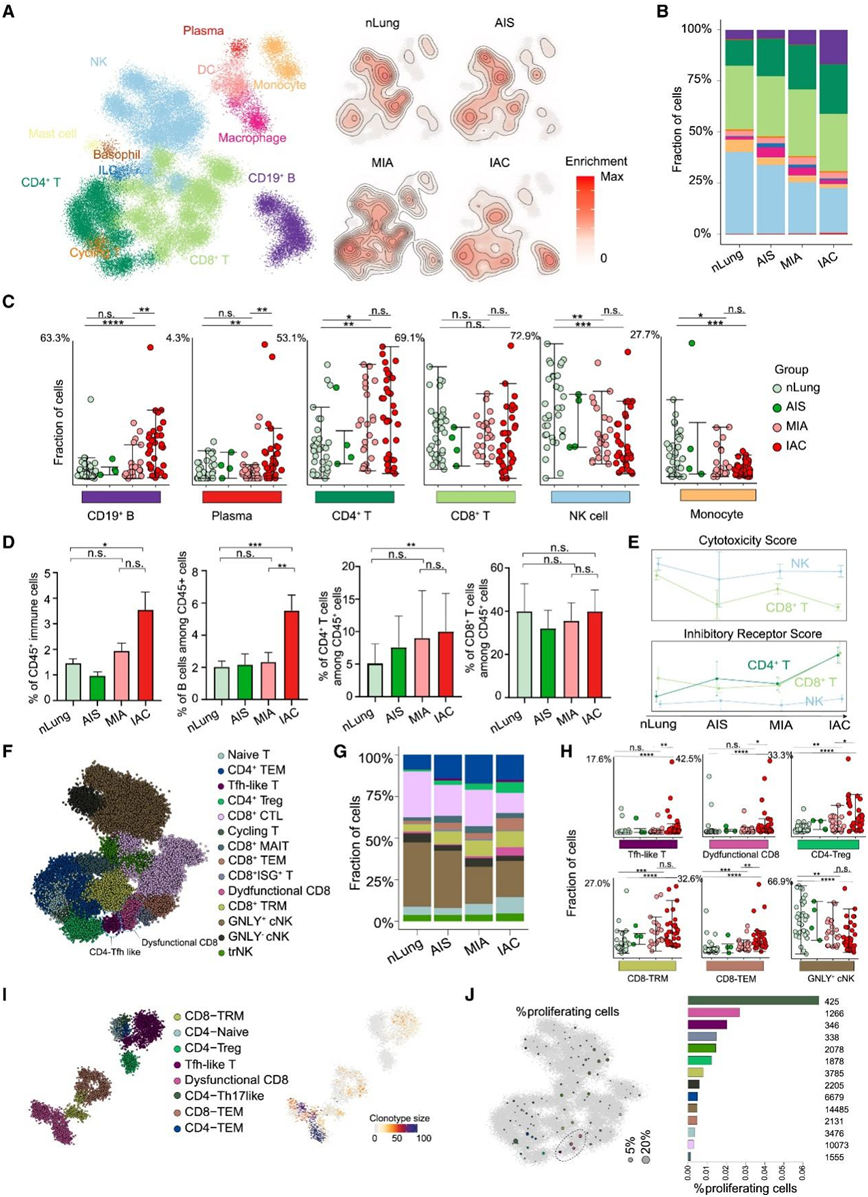
图2. LUAD进展过程中免疫细胞的组成。
(A) 2D 密度图显示 LUAD 患者组中宏细胞模型中免疫细胞群的富集情况。(B) 条形图显示每组中 nLung 以及 AIS、MIA 和 IAC 患者内的免疫细胞类型组成。(C) 点图显示 nLung 以及 AIS、MIA 和 IAC 患者内部分免疫细胞亚群的百分比。(D) 条形图显示不同细胞比例。(E) 线图显示四个阶段中抑制性受体基因和细胞毒性基因的活性评分的变化。(F) T 和 NK 细胞亚聚类的 2D 投影。(G) 条形图显示每组 nLung 以及 AIS、MIA 和 IAC 患者内的 T 和 NK 细胞类型组成。(H) 点图显示 nLung 以及 AIS、MIA 和 IAC 患者中部分 T 和 NK 细胞亚群的百分比。(I) 从基因组数据预测 T 细胞亚聚类和 TCR 克隆型大小。(J) 每个宏细胞的增殖细胞分数,通过将细胞周期基因表达占总表达的分数定义为增殖细胞来计算。
03
LUAD进展过程中B细胞的瘤内增殖和分化
由于B细胞和CD4+ T细胞在侵袭过程中表现出最显著的变化,因此他们使用多重免疫染色来进一步检查这些细胞的空间特征。抗CD19、抗CD4和抗CD8抗体的结果证实B细胞从正常肺增加到AIS、MIA和IAC阶段,平均从0.55%增加到1.27%、1.41%和5.59%,并且CD4+ T细胞从2.4%增加到4.24%、5.25%和5.37%(图3A-B)。CD4 + T 细胞在 B 细胞之前从 AIS 阶段开始增加,而 B 细胞从更高级的 IAC 阶段开始增加。值得注意的是,CD4 + T 和 B 细胞在肿瘤中表现出聚集状态而不是分散(图 3 A)。为了进一步探讨 B 细胞的异质性,他们鉴定了 6 个 B 细胞聚类,包括TCL1A + 幼稚B、BCL6 + 生发中心 (GC) B、FCRL4+记忆 B、CD27 +记忆 B、CD83 + CD27 +激活记忆 B 和免疫球蛋白 A(IgA) /IgG+浆细胞(图 3C-D)。与正常肺相比,他们观察到IAC肿瘤中除 了幼稚B细胞外,大多数B细胞亚型显著增加(图3E-G)。来自癌症基因组图谱(TCGA)和基因型组织表达数据库的正常肺和LUAD样本的bulk RNA-seq分析进一步证实,与正常肺相比,IAC肿瘤中CD27+CD83+活化记忆B细胞增加(图3H)。此外,多重免疫染色显示,包括CD27+记忆B、CD83+CD27+记忆B和浆细胞在内的B细胞亚型主要定位于B细胞聚集体中(图3I)。
他们对 B 细胞进行了增殖活性分析,并观察到大量增殖的 B 细胞,主要是 GC B 细胞亚群(图 3 J)。此外,对 B 细胞上 KI67 表达的多重免疫染色分析表明,KI67+ B 细胞约占 B 细胞聚集体中所有 B 细胞的 10%(图 3 K)。
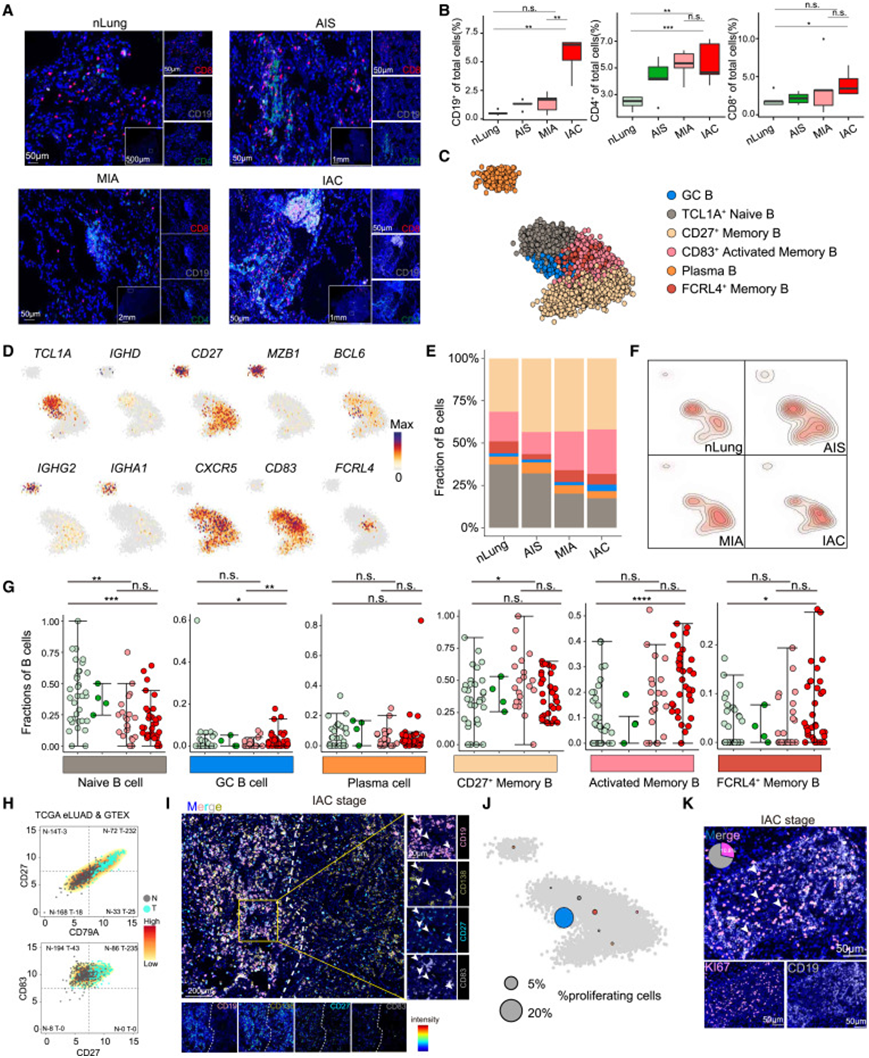
图3. 早期LUAD各组B细胞特征及动态。
(A) LUAD 患者的肿瘤切片染色。(B)分别显示总细胞中CD19 + /CD4 + /CD8 +细胞定量的箱线图。(C) 所有 nLung 和 LUAD 样本中 B 细胞亚聚类的二维投影,显示了六个主要聚类的形成。(D) 选定的 B 细胞标记基因在细胞模型上的 2D 投影。(E) 条形图显示每组中 nLung 以及 AIS、MIA 和 IAC 患者内的 B 细胞类型组成。(F) nLung 和 AIS、MIA 和 IAC 患者的 B 细胞用等高线显示,表明投影细胞的密度。(G) 点图显示 nLung 以及 AIS、MIA 和 IAC 患者中 B 细胞亚群的百分比。(H)密度图显示了TCGA I期LUAD和基因型组织表达(GTEx) nLung数据中分别表达高水平CD79A和CD27以及CD27和CD83的肿瘤样本和nLung组织的比例。(I) LUAD 患者的肿瘤切片染色。(J) 每个宏细胞增殖 B 细胞的分数。(K) LUAD 患者的肿瘤切片染色。
04
Tfh 样细胞、GC B 细胞和功能失调的 CD8 + T 细胞形成三级淋巴结构(TLS)
由于细胞间相互作用在针对肿瘤的免疫反应中起着至关重要的作用,因此他们将 IAC 肿瘤中的谱系归一化细胞类型频率相关联,以研究它们在肿瘤中的相互作用。值得注意的是,Tfh 样细胞与 GC B、FCRL4 +记忆 B、血浆和功能失调的 CD8 + T 细胞具有高度相关性(图 4 A)。Tfh 样细胞表达 Tfh 和 1 型辅助 T 细胞的特征,包括BHLHE40、TOX、TOX2和CXCR5,但也表现出组织驻留标记特征,如ITGAE、CD69和RBPJ(图 4 B)。
他们发生参与B细胞分化和成熟的趋化因子基因和Ig相关基因与CD4和CXCL13的表达强相关,这些基因包括MS4A1、CXCR5、CCL19、IGHA和IGHG(图4C),证实了 Tfh 样细胞亚型和 B 细胞亚型之间观察到的相关性。与 B 细胞分化和募集相关的多个配体受体对在 Tfh 样 B 细胞和 GC B 细胞之间高表达,包括 CXCL13-CXCR5、IL-21-IL-21R、CD40LG-CD40 和 CCL17 -CCR4(图4D)。多重免疫染色分析显示,多细胞中枢的 T 细胞区中存在 Tfh 样细胞,靠近 B 细胞区,这表明 Tfh 样细胞直接与 B 细胞相互作用(图 4 E)。在 TCGA 数据中,具有较高 Tfh 样细胞基因表达特征的患者具有较高的 TLS 相关基因表达(图 4 F)。
通过比较功能失调的 CD8 + T 和 Tfh 样细胞的特征评分,这种关联也在bulk RNA-seq 数据中得到了证实(图 4 G)。同时,在 TCGA 数据中,CD8 + T 基因表达特征高度功能失调的患者也具有较高的 TLS 评分(图 4 H)。总之,这些结果证明了关键免疫细胞亚群之间的细胞相互作用。
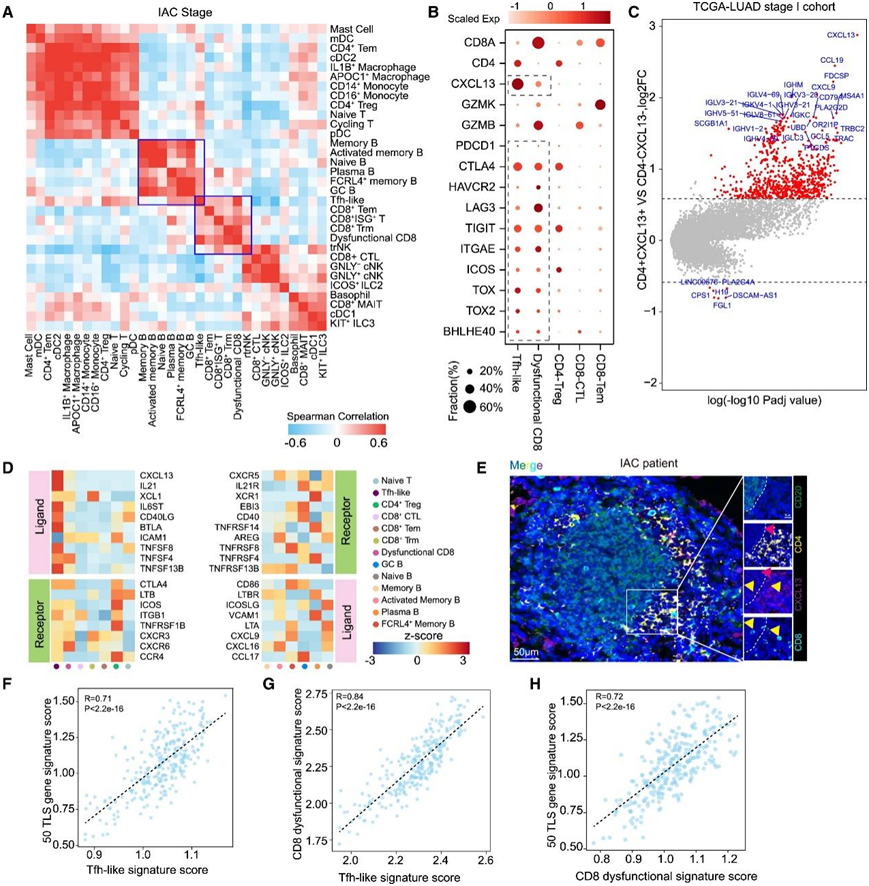
图4. Tfh 样、功能失调的 CD8 + T 和 GC B 细胞形成 TLS。
(A) 33 个 IAC 肿瘤中谱系归一化细胞类型频率的相关性。(B) IAC 浸润 T 细胞聚类中选定基因的表达。(C) 火山图显示 I 期 LUAD TCGA 患者的差异表达基因 (DEG)。(D) 热图显示 B 细胞和 T 细胞中高度表达的配体-受体对的表达。(E) IAC 患者的肿瘤切片染色。(F) 散点图显示 50 个 TLS 基因特征得分(y 轴)的基因表达与 Tfh 样特征得分(x 轴)的差异。(G) 散点图显示功能失调的 CD8+ T 特征得分(y 轴)的基因表达与 Tfh 样特征得分(x 轴)的差异。(H) 散点图显示 50 个 TLS 基因特征得分(y 轴)的基因表达与功能失调的 CD8+ T 特征得分(x 轴)的差异。
05
LUAD 发生和入侵过程中 TLS 的逐步形成
多种免疫荧光分析显示,正常肺组织中CD4+ T、CD8+ T、B细胞分散分布(图5A),肿瘤组织肺泡周围存在多种表型的淋巴细胞聚集体。他们进一步将TLS的形成过程定义为三个阶段:前兆、早期和成熟。肿瘤发生时,CD4+ T细胞首先在肺泡上皮细胞周围聚集。在这一阶段,CD8+ T细胞和B细胞零星分布。因此,他们将这一阶段称为TLS的前兆(pTLS)。(图5 B)。随着肿瘤的侵袭,Tfh样细胞出现,B细胞开始积累和聚集,将其定义为CD4+ T和B聚集的早期TLS(eTLS)(图5C)。随后,随着肿瘤的进展,形成成熟的B和T细胞区域,将其定义为成熟TLS(mTLS)(图5D)。进一步证实,mTLS 包含 GC、PNAd +内皮小静脉和 CD21 +滤泡 DC,而 pTLS 和 eTLS 仅包含零散 PNAd +细胞,不含滤泡 DC(图 5 E-G)。从正常肺到IAC肿瘤,CD20+ B细胞密度和TLS密度以及TLS与肿瘤面积的比值均有所增加(图5H-J)。此外,pTLS和etls在AIS和MIA肿瘤中富集程度更高,而mTLS主要存在于IAC肿瘤中,这表明TLS随着肿瘤的发展而成熟(图5K)。这些数据与上述结果一致,AIS和MIA肿瘤中CD4+ T细胞数量较正常肺组织显著增加,而B细胞数量直到IAC期才显著增加(图2C-D)。
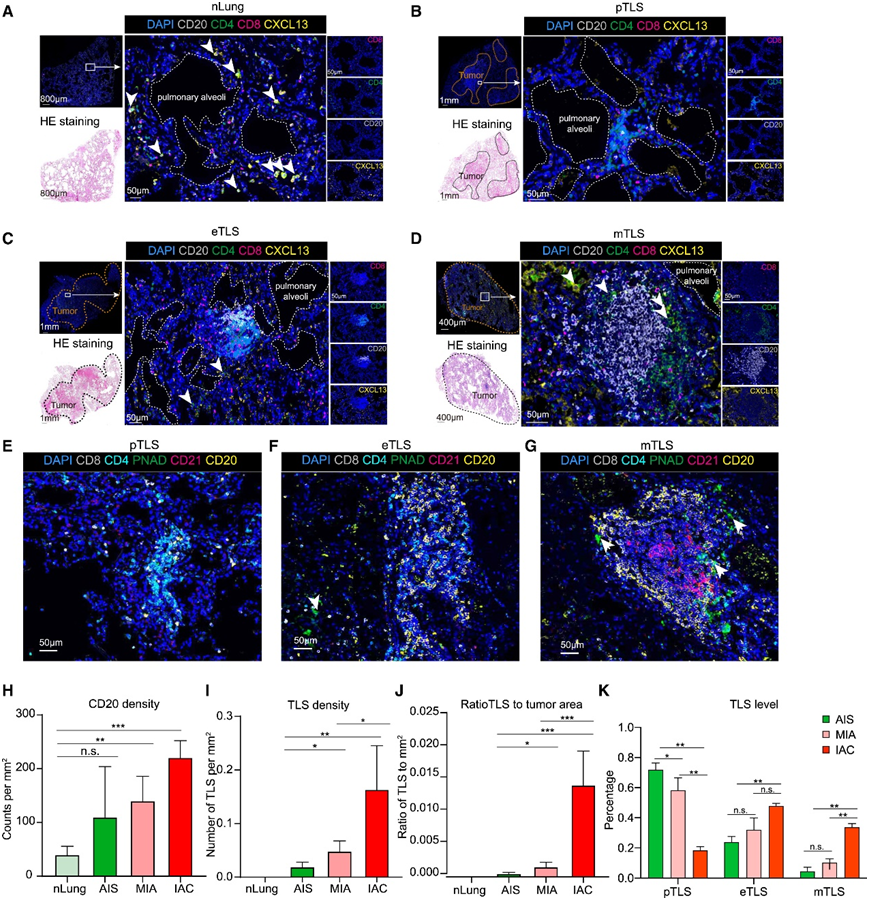
图5. 早期LUAD进展过程中TLS的形成。
(A–G)多重免疫染色分析。 (H–J) nLung 以及 AIS、MIA 和 IAC 患者中 CD20 + B 细胞的定量、TLS 密度以及 TLS 所占肿瘤面积的比率。(K) AIS、MIA 和 IAC 患者不同阶段 TLS 的量化。
06
TLS与LUAD患者更好的生存率相关
为了探索鉴定出的TLS在TME中的功能,他们首先分析了其相关细胞的作用。对TCGA数据库中LUAD样本的bulk rna-seq分析显示,活化的记忆B、GC B和tfh样细胞都与早期LUAD患者更好的生存有关(图6A-B)。根据CD20+ B细胞的百分比、TLS的密度以及TLS与肿瘤面积的比值,将IAC患者分为tlShigh或TLSlow(图6C)。总生存期(OS)分析显示,tlShigh患者预后优于TLSlow患者(图6D)。
最后,他们试图证明 TLS 在小鼠肺癌中的抗肿瘤功能。首先使用了Lewis肺癌(LLC)的皮下模型,在该肿瘤模型中发现了分散的B细胞和T细胞,但没有发现TLS。多重免疫染色分析表明,T 细胞和 B 细胞最初是分散的,但在肿瘤诱导 20 周后变得聚集。这些 T/B 聚集体类似于临床肿瘤样本中观察到的 TLS,但在小鼠肺癌中的丰度较低。在该原位肿瘤模型中消除 B 细胞显著促进了肿瘤生长(图 6E-F)。为了进一步探索 TLS 的功能,他们构建了 CD4CRE; Bcl6fl/fl 小鼠,其中 Tfh 细胞可以特异性耗尽。与皮下 LLC 模型相反,当 LLC 细胞腹膜内注射时,可以诱导淋巴细胞聚集。腹腔注射LLC细胞后,没有Tfh细胞的小鼠的肿瘤明显大于对照组(图6G -I)。与此一致的是,在 Tfh 缺陷小鼠中,肿瘤中 TLS 的数量也显著减少(图 6J-L)。
此外,配体-受体分析表明,Tfh和GC B细胞之间可能通过IL-21-IL-21R信号通路相互作用(图4D)。IL-21与类别转换、浆细胞形成和GC功能有关,使用il - 21r中和抗体处理的小鼠的肿瘤明显大于对照组(图6H-I)。同时,il - 21r中和小鼠肿瘤中淋巴细胞聚集体的数量也显著减少。然而,在tfh缺陷小鼠中进一步中和IL-21R,肿瘤大小和淋巴细胞聚集数量没有明显变化(图6J-L)。综上所述,这些结果证明tfh依赖性TLS的抗肿瘤作用可能是通过IL-21-IL-21R信号介导的,这与对临床样本的分析一致。
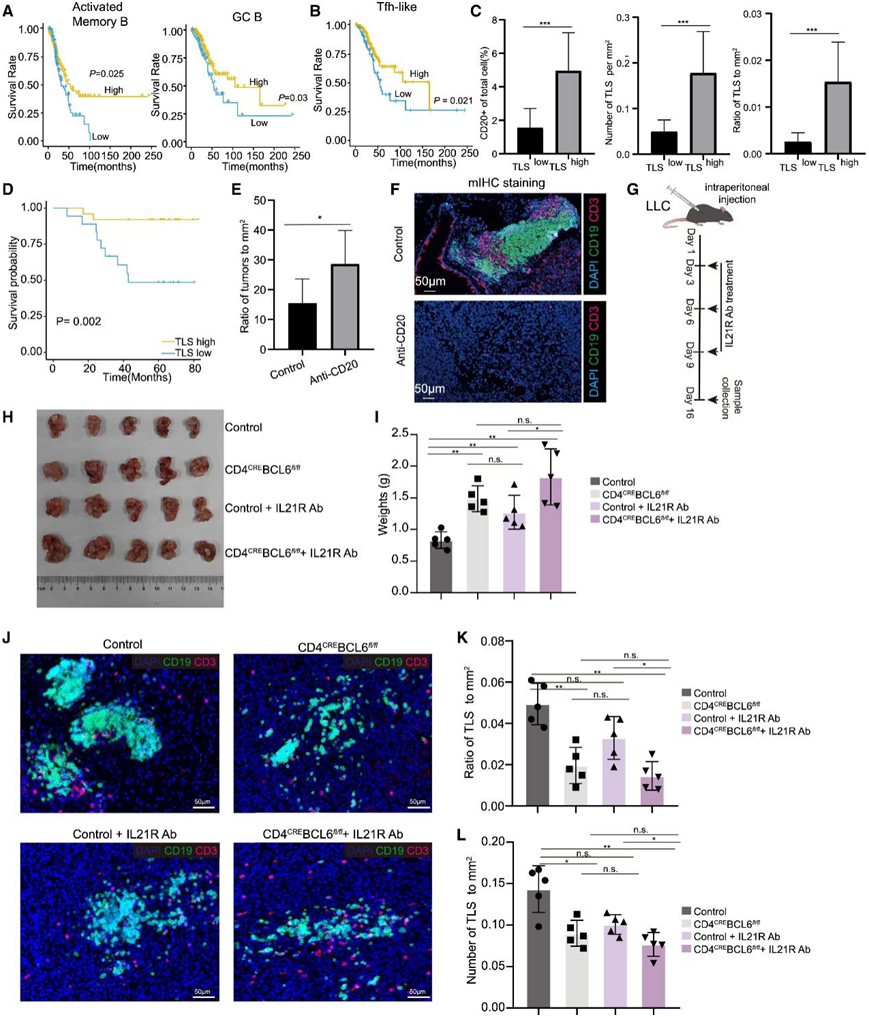
图6. Tfh依赖的TLS预测早期LUAD患者的肿瘤预后并抑制肿瘤生长。
(a-b)生存曲线分析。(C) TLShigh和 TLSlow患者中 CD20 +细胞的定量、TLS 密度以及 TLS 所占肿瘤面积的比率。(d) 生存曲线分析。(E)肿瘤与从抗CD20-Ab处理的KPC小鼠获得的肺组织的mm2的比率。(F)多重免疫染色分析。(G)显示对照和荷瘤小鼠的IL-21R Ab中和的示意图。(H-I)肿瘤大小和肿瘤分析。(J)多重免疫染色分析。(K-L) TLS的密度所占肿瘤面积的比率。
+ + + + + + + + + + +
结 论
本项研究通过scRNA-seq发现Tfh样细胞、GC B 细胞和功能失调的 CD8 + T 细胞在肿瘤发生/侵袭过程中增加,并在肿瘤内形成三级淋巴结构 (TLS)。这种 TLS 首先是 促进CD4+ T 细胞的聚集和表达 CXCL13 的 Tfh 样细胞的产生,随后是 B 细胞的聚集,然后形成 CD4 + T 和 B 细胞聚集体。TLS 及其相关细胞与患者更好的生存率相关。通过 Tfh 或 B 细胞耗竭抑制 TLS 形成可促进小鼠模型中的肿瘤生长。Tfh 依赖性 TLS 的抗肿瘤作用是通过白细胞介素 21 (IL-21)-IL-21 受体信号传导介导的。本项研究证实了 Tfh 依赖性 TLS 在 LUAD 发展中的抗肿瘤作用。
+ + + + +



 English
English


