文献解读|Nat Commun(14.7):月经周期和更年期人类输卵管的细胞图谱
✦ +
+
论文ID
原名:A cell atlas of the human fallopian tube throughout the menstrual cycle and menopause
译名:月经周期和更年期人类输卵管的细胞图谱
期刊:Nature Communications
影响因子:14.7
发表时间:2025.01.03
DOI号:10.1038/s41467-024-55440-2
背 景
输卵管 (FT) 在女性生殖功能中发挥着至关重要的作用。排卵后,输卵管伞部从卵巢“拾取”卵子,肌肉收缩和纤毛上皮表面细胞将卵子通过输卵管壶腹部运送到子宫,在那里进行受精。然后,受精卵进入到输卵管狭窄的宫内部分,胚泡从这里下降并植入子宫。输卵管可作为防止病原体在腹腔内定植的解剖和免疫屏障。通过阴道上行感染引起的输卵管腔感染(输卵管炎)可能导致输卵管伞部末端阻塞。这可能会导致输卵管积水、异位妊娠的高风险以及输卵管因素不孕。在更年期,由于失去了保护性的激素环境,输卵管会萎缩。然而,人们对与更年期过渡相关的输卵管细胞变化以及这些变化是否会使女性易患疾病知之甚少。
实验设计
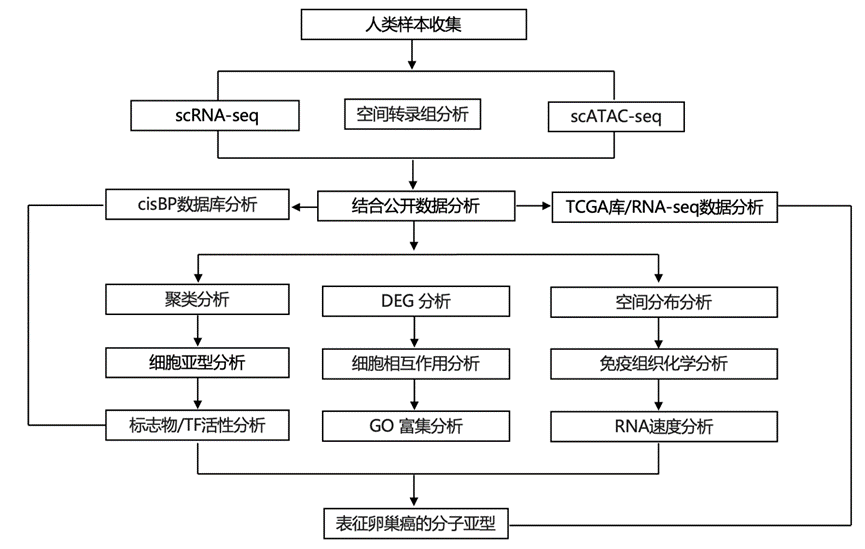
结 果
01
绝经前人类输卵管的细胞组成
研究团队收集了绝经前供体的 85107 个细胞和绝经后供体的 46111 个细胞,并进行了单细胞转录组分析(scRNA-seq)细胞(图 1A),无监督聚类确定了 19 个聚类,代表在苏木精和伊红染色的绝经前 FT 中通常可显微镜识别的细胞类型(图 1B,图 2A)。基于典型标记基因的表达,19个FT 聚类可分为 12 种主要细胞类型:纤毛上皮 (CE)、分泌上皮 (SE) 1-3、平滑肌 (SM)、周细胞/血管 (P/V) 1-2、内皮 (EN) 1-2、淋巴管内皮 (LE)、基质 (ST) 1-3、肥大细胞 (MA)、T 和自然杀伤 (T/NK) 细胞、巨噬细胞 (MP)、单核细胞 (MN)、B 和浆细胞 (BP) 1-2。比较三个不同的 FT 解剖位置,发现几乎所有细胞类型的细胞分布相似。峡部的 SM 细胞百分比最高,CE 和 SE 细胞百分比最低,这与峡部将卵子输送到宫腔的功能一致。在输卵管伞部中,主要的细胞是 CE 细胞和SE 细胞,这与增加 FT 拾取卵子的机会所需的大表面积相一致。
几种细胞类型包含不同的亚型。在 SE 细胞类型中,他们发现了三种亚型。SE1 和 SE2/3 可通过不同水平的OVGP1表达来区分,SE3 细胞表达几种细胞周期基因(图 2B)。虽然很少见,但他们在所有绝经前样本中都观察到了 SE3(检测到 58 个细胞)。所有 ST 细胞聚类都表达间充质祖细胞标志物PDGFRA。ST1 细胞强烈表达肌成纤维细胞标志物POSTN和NR2F2。ST2 细胞具有高表达CD34的特征,CD34 是一种干细胞标志物和粘附分子,也是正常组织中分泌胶原蛋白并促进细胞迁移的组成性基质成分。ST3 细胞表达典型的成纤维细胞和肌成纤维细胞标志物(COL1A1、POSTN)。他们进一步根据KDR和CLDN5的表达模式将 EN 细胞分别细分为 EN1 和 EN2。P/V 的两个亚型在典型周细胞标志物MCAM、ACTA2、MYH11和TAGLN的表达水平上有所不同,P/V2 中的这些表达水平明显低于 P/V1。然而,P/V2 显示出强烈的NR2F2表达。最后,B/P 细胞包含两个亚型:B/P1 表达 B 和浆细胞标志物,而 B/P2 仅表达 B 细胞标志物CD79A(图 2B)。
他们对一组绝经前样本进行了单细胞染色质可及性测序(scATAC-seq),并将其与相应的 scRNA-seq 数据进行匹配。对来自 10 位捐赠者的壶腹部和输卵管伞部的细胞进行了单独处理,并在计算机模拟中整合。他们通过从其相应的 scRNA-seq 转移标签来注释每个样本的聚类身份。具体而言,使用 scRNA-seq 聚类信息作为参考,通过搜索来自同一样本的最佳匹配聚类来注释 scATAC-seq 中的每个细胞。他们从scATAC-seq 中鉴定了 68150 个来自绝经前 FT 的细胞(图 2C)。大多数 scRNA-seq 和 scATAC-seq 聚类匹配良好,证实了两个数据集的高质量。然而,在 scATAC-seq 中未检测到 SE3、EN2 和 B/P2 细胞亚型。
为了分析绝经前 FT 的调控方式,他们评估了cisBP数据库17中列出的 870 种转录因子(TF)在所有主要细胞类型的活性,揭示了显著的细胞类型特异性 TF 活性,例如 B/P1 中的强 TCF 家族活性;EN1 中的 STAT 活性。CE 细胞中 FOX 家族成员的活性增加,负责纤毛发生、细胞生长和分化;ETV 家族中的 T/NK 细胞,参与单核细胞分化;以及 MA 中的 GATA 活性,TF 富集分析确定了不同细胞亚型中 TF 活性的差异。SE1 对 GATA、TCF 和 HOX TF 表现出更高的可及性,而 SE2 则以 HOX(决定细胞和组织身份)、SOX(调节细胞命运)和转录抑制因子 BACH 的可及性为特征。ST1 和 ST2 在 TCF 和 CEBP 家族的活性方面表现出差异。P/V1 和 P/V2 在 EBF1(参与周细胞中的细胞谱系特化)和 MEF 家族(调节血管成熟)的活性方面有所不同(图 2D)。

图1. 研究设计和输卵管组织学分析。
(A) 使用 scATAC-seq 和 scRNA-seq 表征绝经前输卵管 (FT) 伞部 (F; n = 10)、壶腹部 (A; n = 10) 和峡部(I; n = 5)。(B) 正常绝经前 FT 伞部的代表性苏木精和伊红 (H&E) 染色。

图2. 正常绝经前输卵管的细胞组成。
(A) 在 正常绝经前输卵管的壶腹部和输卵管伞部中发现的典型细胞类型和亚型。UMAP 图可视化了使用 scRNA-seq 鉴定出的 19 个细胞聚类。(B) 点图显示与数据集 (scRNA-seq) 中鉴定出的常见细胞类型相关的典型标记基因的标准化基因表达水平。(C) UMAP图可视化了使用 scATAC-seq 在绝经前壶腹部和输卵管伞部中鉴定出的 16 个细胞聚类。(D) 热图显示基于 scATAC-seq 数据的细胞聚类对转录因子 (TF) 活性的富集。
02
更年期改变输卵管细胞的基因表达
他们将绝经前 FT 样本的细胞组成与之前分析的绝经后 FT 样本进行了比较。结果表明,FT 的细胞组成和基因表达在绝经期间发生了显著变化(图 3A)。在所有细胞类型中,绝经后女性的 CE、SE 和 T/NK 细胞的丰度显著下降,而 EN1、EN2、P/V1 和 P/V2 细胞的丰度增加。绝经后女性的基质细胞(ST2、ST3)有增多的趋势,但样本之间的观察到的差异性很大。虽然他们观察到细胞组成发生了显著变化,但典型细胞标志物的表达在绝经期间并没有显著变化。
为了了解绝经前和绝经后 FT 之间基因表达谱的变化,他们使用伪批量供体水平数据进行了细胞类型特异性差异表达基因分析。在所有细胞类型中,SE 细胞表现出最多的差异表达基因 (DEG)(图 3B),其次是 MP、ST1、T/NK、ST2 和 CE。几个基因是绝经状态所特有的:绝经后供体表达衰老和老化标志物,例如ICAM1(MP、MN、MA 和 EN1-2)、CXCL2(SE、MP、MN、LE 和 EN1-2)、ZNF31(P/V1-2、所有免疫和基质细胞)、ELL2(B/P1、P/V1-2 和免疫细胞)和BAG3(P/V1-2、EN1-2、SM 和 ST1-3)(图 3C)。PCSK1N(SM 和 P/V1-2)、OVGP1(SE 细胞)、CRISP3和CYBA(SE 细胞、B/P1-2 和免疫细胞)在绝经前细胞类型中表达较高(图 3C)。绝经前女性表现出IFITM1/2 (ST1-3、EN1-2、P / V2 和 T/NK)和PLCG2(EN1-2和LE)的表达,这些基因对于病毒防御和与年龄相关的炎症反应至关重要。
绝经后,壶腹部和伞状部中基质和免疫细胞的相互作用均减少。将绝经后 FT 中 TF 的细胞类型特异性活性评分与绝经前水平进行比较时,JUN 和 FOS 家族 TF 在绝经后在除 ST3 之外的所有细胞类型中都表现出明显更高的活性(图 3D),这与它们在细胞衰老中的作用一致。同样,衰老和衰老的标志物 BACH1 和 BACH2 TF在绝经后所有细胞类型(ST3 和 P/V2 除外)中均表现出更好的染色质可及性(图 3D)。为了避免忽视相对变化大但绝对变化低的 TF,他们评估了相对于绝经前水平的活动变化百分比(图 3E)。在绝经后捐赠者中,雄激素受体 (AR) 和糖皮质激素受体 (NR3C1) 在 ST3 和 SM 中表现出增加;早期生长反应 (EGR) 家族活动在 SE1 和 MA 中增加;而 EMT 标志物 TWIST1 在 ST1 和 MP 中增加(图 3E)。
在更年期,输卵管中的基质细胞会发生显著变化,导致输卵管壁组织学变薄,输卵管腔侧上皮细胞的褶皱复杂性降低。分析揭示了与这些生理变化相关的分子剧变(图 3F)。更年期前,ST1 细胞表现出IGF1、TMSB4X、COX5B、COX4I1、NDUFB2、NDUFS5和核糖体蛋白编码基因等基因的高表达水平,这些基因在绝经后样本中均急剧下降,表明线粒体和核糖体功能随着年龄的增长而下降。同样,NUPR1和PIH1D1表达在绝经前 ST2 细胞中很高,但在绝经后 ST2 细胞中降低。相反,绝经后 ST1 中NCL、HNRNPK、SELENOK和GADD45B的表达激增。同样,染色质结合蛋白PSIP1基因和MYC在 ST2 中增加,而FUS、MALAT1、SON、RBM39、HNRNPH1和HNRN2B1在 ST3 中高表达。此外,绝经后 ST2 和 ST3 中EGR1的表达急剧增加(图 3F)。对每个 ST 组中表达最高的基因进行的 GO 富集分析显示,绝经前 ST 富含代谢活动所需的基因(例如核糖体生物合成、ATP 代谢)(图 3G)。相反,绝经后 ST 富含参与 RNA 不稳定、细胞衰老和凋亡的基因。

图3. 更年期改变正常人类输卵管中的细胞组成和细胞类型的基因表达谱。
(A) 绝经前女性和绝经后女性在综合解剖部位(壶腹部和伞部)细胞组成的差异百分比。(B) 差异表达基因的数量分析。(C) 点图显示单个细胞聚类(scRNA-seq) 中选定的、特定于绝经状态的差异表达基因的标准化基因表达水平。(D) 热图显示使用 scATAC-seq 的细胞聚类中选定的转录因子 (TF) 活性的绝对差异。(E) 热图显示使用 scATAC-seq 数据的细胞聚类中选定的TF活性的相对变化。(F) 点图显示绝经前和绝经后 ST 亚型中选定基因的标准化基因表达水平。(G)GO分析。
03
更年期显著改变分泌上皮细胞
他们之前曾研究过绝经后捐献者的 FT 细胞组成。他们对绝经前和绝经后样本差异的分析发现了绝经后群体特有的细胞聚类。他们将此聚类命名为 SE 特异性,以将其与其余绝经后 SE 区分开来。他们还在绝经前样本中发现了细胞聚类,并将其命名为 SE1/2/3-pre。在任何绝经后样本中均未检测到 SE3-pre(图 4A)。
绝经前 SE1 的特征是 MHC II 类蛋白(HLA-DPA1、HLA-DQA1)和PAX8表达增加(图 4B),PAX8是高级别浆液性卵巢癌的已知谱系标记,用作临床生物标记。相反,SE2-pre 的特征是 PEG 细胞标记(LGR5、PGR、TNFRSF19、CD24)的高表达。最后,SE3-pre 的特点是染色质重塑标记(RUVBL1、HMGB2、SMC1A)、DNA 修复标记(FANCD2、MSH2和MSH6)和TUBB,TUBB 是微管的主要成分,对有丝分裂很重要,并且表明这些细胞正在循环。相反,绝经后 SE 细胞聚类的 PEG、MHC II、DNA 修复和染色质重塑标志物的表达水平下降(图 4B)。这进一步表明 SE 细胞在绝经期间发生了显著变化。
绝经前和绝经后的 SE 细胞在激素受体表达方面也不同(图 4C)。SE1-pre 细胞强烈表达AR、INSR和NPR1,而 SE2-pre 以其强烈表达孕酮受体 (PGR) 为特征,SE3-pre 显示PGR和 PGR 膜成分 1 (PGRMC1)的中等表达。在绝经后 SE 细胞中,激素受体的总体表达水平降低。尽管如此,仍有一小部分以 SE聚类为代表的细胞具有较高的ESR2、IGF1R和LEPR平均表达。角蛋白 (KRT) 是一种中间丝蛋白,可为上皮组织提供机械支撑和组织。他们发现KRT 13、15和17与绝经有关,并且仅在 SE 后特异性细胞中表达(图 4D)。
TF 富集分析表明,不同 SE 组之间的 TF 活性存在很大差异(图 4E-F)。参与组织修复和再生的 SOX TF 家族(尤其是 SOX9/13)在所有绝经前 SE 组中均表现出活性,但在 SE2-pre 中表现出最高活性,表明再生潜力更高。PAX-1/5/9 在 SE1-pre 和 SE-post 中均有活性,这与它们在调节 SE 基因表达中的作用一致。相比之下,参与调节细胞凋亡过程的TP-53/63/73仅在绝经后样本中活跃。SE 后特异性细胞聚类具有最强的 TP53 活性(图 4E-F),以及最高的 TFCP2L1、FOX-A1/A2/B2 和 RUN-X2/X3 活性,表明 p53 介导 DNA 损伤信号传导。AR 活性降低,而 MAF TF 家族的原癌基因在绝经后表现出很强的染色质可及性(图 4E-F)。
GO富集分析表明每个细胞聚类都有特定的功能(图 4G)。SE1-pre 对激素有反应并与免疫细胞相互作用。SE2-pre 表达由成纤维细胞生长因子和微管功能激活的基因。SE3-pre 表达许多参与 DNA 复制和免疫效应过程的基因。绝经后 SE 细胞富含迁移和激素反应所必需的基因,而 SE 后特异性表现出 p53 介导的细胞应激反应所需的基因的富集。
为了验证 scRNA-seq 的发现,他们对独立的绝经前样本进行了完整的空间转录组学分析。使用KRT7作为 SE 绝经前细胞的标记,他们发现TUBB、OVGP1和INSR与KRT7表达区域共定位,为它们在 SE 细胞绝经前功能中的作用提供了额外的证据。正如预期的那样,他们没有在任何分析的细胞中检测到KRT15的表达(图 4H)。

图4. 更年期会导致上皮细胞基因调控和表达发生显著变化。
(A) 使用 UMAP 分析识别的绝经前和绝经后 SE 细胞。(B) 点图显示基于 scRNA-seq 数据的绝经前和绝经后 SE 亚型中与增殖、干性和 PEG 细胞相关的选定标志物的归一化基因表达水平。(C) 点图显示基于 scRNA-seq 数据的绝经前和绝经后 SE 亚型中激素受体的归一化基因表达水平。(D) 基于 scRNA-seq 数据(壶腹部和输卵管伞)的热图显示了单个样本水平上 SE 绝经前和绝经后亚型中靶基因的平均表达。(E) 使用 scATAC-seq 数据显示 SE 亚型中的绝对转录因子活性的热图。(F) SE 亚型中的相对转录因子活性的热图。(G)GO分析。(H) 使用 10x Genomics Visium对正常绝经前输卵管伞部进行空间转录组学分析。
04
月经周期激素调节分泌细胞的细胞状态
为了检测月经周期增殖期和分泌期基因表达的变化,他们从月经周期正常(25-32 天)的供体中分离了细胞。初步观察表明,SE2-pre 细胞主要见于增殖期样本,且OVGP1蛋白表达较高,而 SE1-pre 细胞主要见于分泌期,且OVGP1蛋白表达明显较低(图 5A-D)。为了验证 SE 细胞中OVGP1的月经周期特异性表达,他们对患者匹配的样本进行了免疫组织化学分析(IHC)。在增殖期,FT 上皮中出现了强烈的 OVGP1 蛋白染色,但在分泌期染色减弱(图 5B)。雌激素信号和 OVGP1 表达在晚期增殖期和排卵期达到峰值,此时雌激素支持精子去能、精子-卵子结合和胚胎发育。他们验证了 OVGP1 在绝经后的表达,证实了 SE1-pre 细胞是孕酮治疗期间的主要 SE 细胞聚类,这表明孕酮可能对 SE1-pre 细胞很重要,而 SE2-pre 细胞和OVGP1表达与雌激素水平有关(图 5C-D),这与scRNA-seq 和 ATAC-seq 结果一致(图 3D-F)。这表明它们代表不同的细胞状态,而不是单独的细胞亚型,每种状态都与月经周期的特定阶段/激素有关。
SE 细胞在两个月经期显示出最多的 DEG 数量(图 5E),其次是 ST1 细胞。通过这项分析,除了使用细胞水平分析确定的标志物之外,他们还发现了 SE1-pre 和 SE2-pre 细胞的其他标志物(图5C-D)。在增殖期,SE2-pre 中的 DEG 主要与 COPI 包被的囊泡功能有关,后者在高尔基体和内质网之间运输物质。相反,在分泌期,SE1-pre 显示出富含网格蛋白包被的囊泡功能的 DEG。同样,在 ST1 细胞中,能量消耗增加和蛋白质折叠与增殖期有关,而整合素结合和细胞基质粘附与分泌期有关(图 5F)。月经期期间,ST1 细胞中的IGF1和IGF2表达呈逆向。
用孕酮刺激因良性疾病接受手术的患者的原代人类基质细胞和上皮细胞的共培养,可诱导 IGF2 蛋白表达,而雌激素治疗 (E2) 可诱导 IGF1(图 5G)。他们进一步使用CellPhoneDB数据库研究了月经周期各阶段受体:配体相互作用的变化。在绝经前 SE 细胞中,增殖期的特点是胶原分子与整合素 α2β1 复合物之间的通讯增加。同时,他们观察到分泌期 BMP7 和 EFNB1 相互作用显著增加(图 5H)。总体而言,增殖期的受体:配体相互作用比分泌期少(图 5H)。
RNA 速度分析利用未剪接(新生)和剪接(成熟)的 mRNA 分子来预测潜在的方向性和在不同细胞状态之间转换所需的时间。他们将速度矢量叠加在 UMAP 空间中,以揭示月经周期期间 SE1-pre和 SE2-pre 之间细胞转换的方向。绝经前 SE 细胞中的 RNA 速度矢量形成一个圆圈,表明是周期性生物过程的一部分(图 5I)。这与月经周期模式一致,即月经周期期间 SE 细胞状态之间重复转换。分泌期的中位潜伏期要短得多,表明成熟 mRNA 在分泌期输出到细胞质的速度更快(图 5J)。SE 细胞在分泌期的转录活性更高,这与CellPhoneDB分析一致(图 5H)。

图5. 上皮细胞在月经周期的增殖期和分泌期发生显著的细胞和分子变化。
(A) 基于 scRNA-seq 数据的月经周期增殖期和分泌期之间的细胞组成差异。(B) 增殖期和分泌期患者输卵管中的代表性 OVGP1 免疫组织化学。(C)比较绝经前 SE1(分泌期)和 SE2 细胞(增殖期)的基因表达水平的散点图。(D) 火山图显示了基于增殖期和分泌期 SE 细胞(SE 1/2/3-pre)中表达基因的差异表达基因分析。(E) 基于 scRNA-seq 数据的细胞聚类在月经周期增殖期和分泌期之间差异表达基因的数量。(F) 点图显示在 ST 亚型中在增殖期和分泌期不同的选定基因的标准化 scRNA-seq 衍生基因表达水平。(G) 代表性免疫荧光染色。(H) CellPhoneDB 检测到的 SE和ST 亚型(左)之间以及月经期分隔的 SE 细胞(右)之间的配体-受体相互作用。(I) SE1-pre和 SE2-pre 细胞的 RNA 速度分析。(J) 月经周期增殖期和分泌期绝经前 SE 细胞的中位潜伏期,突出显示 SE1-pre和 SE2-pre 的时间位置。
05
分泌性上皮细胞标志物可对卵巢癌进行亚型分析
鉴于越来越多的证据表明 FT 上皮细胞是高级别浆液性癌 (HGSC)的起源细胞,他们结合癌症基因组图谱 (TCGA) 数据集中,试图确定研究中发现的不同 FT 上皮细胞标志物,该数据集报告了各种癌症的大量转录组分析(RNA-seq)数据。他们重点研究了在绝经前 (SE1/2/3-pre) 和绝经后样本 (SE-post、SE-post-specific) 的 SE 细胞中发现的DEG,并对卵巢癌、乳腺癌、头颈部癌和肺鳞状细胞癌的不同 TCGA 分子亚型进行了反卷积分析(图 6A)。
绝经后女性中上调的 SE 标志物(740 个基因)巧妙地概括了先前描述的 HGSC 分子亚型:免疫反应性、增殖性、间质性和分化性。136 个基因的子集在 HGSC 的间质亚型中高度表达(图 6A)。进一步仔细研究在不同绝经前和绝经后 SE 细胞类型中发现的表达最高的标志物后,他们发现前 50 个 SE3-pre 基因标志物在免疫反应性的 TCGA HGSC 亚型中突出表达(图 6B)。通过将这些模式与来自其他细胞类型和 TCGA 癌症类型的模式并列,他们能够确认这些关联与卵巢癌中的 SE-post 细胞具有独特的联系,将与免疫反应性 HGSC 相关的前 50 个 SE3-pre 基因标记(图 6B)和与绝经后 FT 中的间充质 HGSC 相关的 136 个 SE-post 标记结合起来,并进行了主成分分析。令人惊讶的是,186 个标记有效地分离了免疫反应性、增殖性和间充质 TCGA HGSC 亚型,但不能分离分化亚型(图 6C)。与间充质亚型相关的 136 个 SE-post 基因在与细胞迁移和细胞连接组装相关的通路中表现出富集(图 6A)。与免疫反应性亚型相关的 50 个 SE3-pre 基因标记(图 6B)在细胞凋亡、趋化性、对肿瘤坏死因子的反应和细胞粘附方面表现出富集(图 6D)。由 50 个 SE3-pre 基因识别的免疫反应亚型与增殖亚型和间质亚型的总和相比,显示出明显更好的存活率。

图6. 使用分泌上皮细胞标记物表征卵巢癌的分子亚型。
(A) 热图显示了 TCGA 描述的高级别浆液性卵巢癌、乳腺癌 (BRCA)、头颈部鳞状细胞癌 (HNSC) 和肺鳞状细胞癌 (LUSC) 各种分子亚型中绝经后 SE 细胞中上调最多的 740 个基因。(B) 热图显示了 TCGA 确定的卵巢癌分子亚型中绝经前和绝经后 SE 亚型中表达最多的 50 个标志物。(C)对 TCGA 样本(n = 304)进行主成分分析图。 (D) 通路富集分析。
+ + + + + + + + + + +
结 论
本研究使用scRNA-seq和scATAC-seq技术构建了月经周期和更年期健康人类输卵管的综合细胞图谱,对 85107 个绝经前输卵管细胞和 46111 个绝经后输卵管细胞进行了比较,发现在绝经和月经周期期间细胞类型频率、基因表达、转录因子活性和细胞间通讯发生了显著变化。月经周期依赖性的激素变化调节输卵管分泌上皮细胞的不同分子状态。绝经后输卵管在与衰老相关的转录因子(如 Jun、Fos 和 BACH1/2)中表现出较高的染色质可及性,而激素受体普遍下调,一小部分分泌上皮细胞具有ESR2、IGF1R和LEPR的高表达。绝经前分泌上皮基因聚类在免疫反应分子亚型中富集,而绝经后分泌上皮细胞中表达的一组基因在高级别浆液性卵巢癌的间充质分子类型中富集。
+ + + + +



 English
English


