文献解读|Nat Genet(29.0):胆囊癌的多组学分析确定了与疾病进展相关的不同肿瘤微环境
✦ +
+
论文ID
原名:Multi-omic analysis of gallbladder cancer identifies distinct tumor microenvironments associated with disease progression
译名:胆囊癌的多组学分析确定了与疾病进展相关的不同肿瘤微环境
期刊:Nature Genetics
影响因子:29.0
发表时间:2025.06.26
DOI号:10.1038/s41588-025-02236-9
背 景
胆道癌包括胆管癌(肝内、肝门周围和肝外)和胆囊癌 (GBC)。GBC通常在晚期才诊断出来,因此预后不佳。肿瘤异质性对理解和治愈癌症构成了重大挑战。然而,单细胞组学技术和计算算法的快速发展使研究者们能够解开肿瘤生态系统的复杂性。人们已投入大量精力来描绘各种癌症类型(包括乳腺癌、肺癌、肝癌、结直肠癌、胰腺癌和胶质母细胞瘤)在肿瘤进展、转移和复发过程中的单细胞景观。然而,对 GBC 的大规模单细胞多组学研究仍然很少,这阻碍了对肿瘤进化的全面了解和有效治疗策略的发展。
实验设计
结 果
01
GBC 的大规模单细胞图谱
为了研究 GBC 中肿瘤微环境(TME)的异质性,研究团队收集了 86 例 GBC 患者的原发性肿瘤 (Pri)[75 例腺癌 (Adeno)、4 例腺鳞癌 (Adeno Squa)、4 例神经内分泌肿瘤 (Neuro)、2 例未分化癌 (Undiff) 和 1 例鳞状细胞癌 (Squa)],以及 16 例无肿瘤患者的胆囊癌前(GB) 病变[9 例黄色肉芽肿性胆囊炎 (XGC)、4 例慢性胆囊炎 (CC)、2 例低级别肿瘤 (LG) 和 1 例高级别肿瘤 (HG)]。除了这 102 个 GB 样本外,他们还收集了 2 例息肉 (PO)、11 例肝脏侵袭性病变 (LI) 和 20 例来自不同组织的远处转移瘤,包括 12 例淋巴结 (LN)、6 例肝脏 (LM) 和 2 例大网膜 (OM),他们对这些135 个样本进行了单细胞转录组分析(scRNA-seq),再加上来自同一队列的 81 个匹配的外周血单核细胞(PBMC),总共对189 个样本进行了全外显子组测序(WES)(图1a)。
对 scRNA-seq 数据进行质量控制后,他们获得了 1117245 个细胞,并鉴定出 11 种细胞类型(图1b)。肿瘤微环境(TME)和肿瘤免疫微环境(TIME)均在样本间表现出明显的细胞组成异质性(图1c)。与之前的结果一致,本研究的队列证实腺癌是 GBC 的主要组织学类型,其高危因素包括高龄、胆囊息肉和胆结石。通过观察值与预期值细胞比率(Ro/e) 进行细胞富集分析,揭示了不同 GBC 组织学类型、组织类型和危险因素分层组的细胞成分存在差异(图1d)。值得注意的是,TME 中中性粒细胞含量高与 GBC 患者预后不良相关。此外,他们通过对每种细胞类型进行细胞聚类,总共确定了 118 种亚型,并保留了熵值高的常见亚型以供后续分析(图1e)。

图1. GBC 的单细胞图谱。
(a) 本研究策略的示意图。(b) 主要细胞类型的均匀流形近似和投影 (UMAP) 可视化。(c) 堆叠条形图显示每个样本中主要细胞类型的分布。(d) Ro/e表示不同胆囊疾病中细胞类型的富集。(e) UMAP 图显示细胞亚型。
02
巨噬细胞介导的中性粒细胞富集P_Mets
对 144893 个单核细胞和巨噬细胞以及 120380 个中性粒细胞进行聚类,并通过鉴定出 多种常见亚型(图1e)。通过差异表达基因(DEG)分析、SCENIC、基因特征评分和使用Ro/e的细胞富集分析,他们鉴定出功能不同的亚型及其在组织学类型中的差异富集模式(图2a-g)。值得注意的是,使用 Monocle 的伪时间分析显示 N_C0_MNDA 和 N_C7_MNDA_S100A8 是第一个受到募集的中性粒细胞亚型(图2c-d)。
由于GBC组织学分类的异质性,他们重点关注最常见的腺癌类型,研究了两个关键方面:首先,为了了解局部微环境中与肿瘤发生相关的改变,他们比较了Adeno_Pri组(原发性腺癌的缩写;文中所有类似的缩写均代表组织学类型和组织部位)和非肿瘤组(包括CC_GB、XGC_GB、LG_GB和HG_GB)的微环境成分。其次,为了研究局部TME的转移相关改变,他们根据临床诊断将Adeno_Pri分为局限性Adeno_Pri组(P组)和伴有转移的Adeno_Pri组(P_Mets组),并比较了它们的微环境差异。巨噬细胞和中性粒细胞亚型在整个疾病进展过程中均表现出动态变化(图2h-i)。重要的是,几乎所有常见的中性粒细胞亚型在 P_Mets 中均显著增加(图2i),提示存在促转移的中性粒细胞富集的肿瘤微环境 (TME)。
鉴于 N_C0_MNDA 和 N_C7_MNDA_S100A8 是肿瘤相关中性粒细胞 (TAN) 的来源,他们使用 CellChat 进行细胞间相互作用分析,以寻找中性粒细胞募集的关键参与者。结果表明,多种巨噬细胞亚型有助于中性粒细胞的募集,趋化因子基因在这些巨噬细胞亚型中显著上调,尤其是 M_C0_FOLR2 和 M_C2_SPP1(图2j-k)。有趣的是,这两种巨噬细胞亚型中CXCL2、CXCL3和CXCL8 的表达随 TNM 分期呈现逐渐增加的趋势(图2l)。与N_C0_MNDA不同,与不良临床预后相关的N_C7_MNDA_S100A8表现出中性粒细胞胞外陷阱形成增多,这通过评分和CODEX证实(图2m-p)。与细胞间相互作用的结果一致,他们使用CODEX技术检测到了中性粒细胞和巨噬细胞的空间可及性(图2p)。
综上所述,这些结果表明巨噬细胞可能募集两种早期浸润的中性粒细胞亚型—N_C0_MNDA 和 N_C7_MNDA_S100A8-它们随后在TME的诱导下分化为 TAN 亚型,最终形成富含 TAN 的促转移性腺癌微环境。其中,N_C7_MNDA_S100A8 是一种与中性粒细胞胞外陷阱形成相关的亚型,与不良预后相关。

图2. 巨噬细胞介导的富含 TAN 的 P_Mets。
(a) 中性粒细胞亚型间 DEG 表达。(b) 不同组织位置的中性粒细胞特征评分。(c-d) 中性粒细胞的拟时间轨迹。(e-f) 特异性转录因子和CD274的表达。(g) 热图显示通过Ro/e估计的不同疾病患病率。(h) 箱线图比较非肿瘤和 Adeno_Pri之间的中性粒细胞亚型比例。(i) 箱线图比较 P(局限性原发性胆囊腺癌;n = 20)和 P_Mets(转移性原发性胆囊腺癌;n = 55)之间的中性粒细胞亚型比例。(j) 弦图描绘了 P_Mets 与P之间相互作用的增加。(k) 巨噬细胞亚型的趋化因子表达。(l) 跨 TNM 分期的巨噬细胞亚型趋化因子表达模式。(m) 按 N_C7_MNDA_S100A8 百分比分组的 Kaplan–Meier 生存图。(n) Adeno_Pri 与非肿瘤组织中 N_C0_MNDA 和 N_C7_MNDA_S100A8 的上调通路。(o) 中性粒细胞亚型中中性粒细胞胞外陷阱 (NET) 特征得分。(p) H&E 和 CODEX 成像用于识别患者中 NE 标记的 NET、CD66b 和 S100A8/9 标记的 S100A8 +中性粒细胞以及 CD68 标记的巨噬细胞。
03
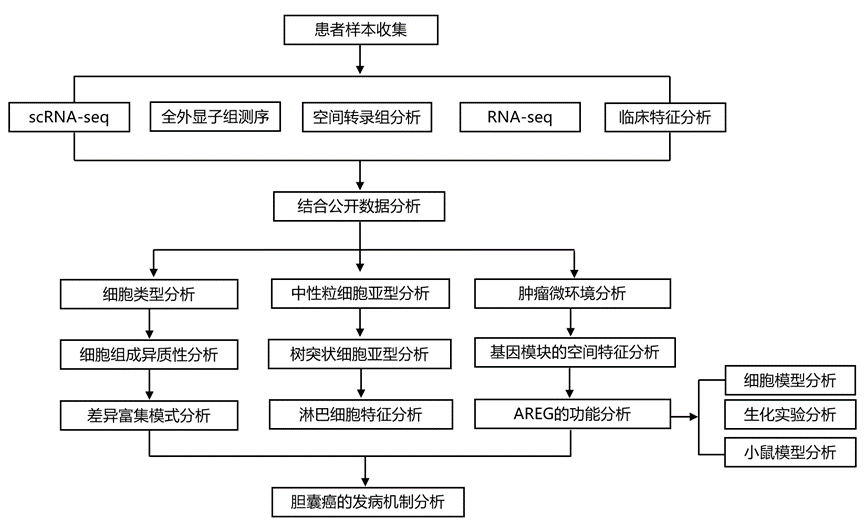
富含P_Mets的促肿瘤发生树突状细胞亚型
他们将13571个树突状细胞(DC)分为8个聚类,并选取7个常见聚类用于后续分析(图1e)。在鉴定DC亚型后,通过比较分析发现,大多数DC亚型在Adeno_Pri中有所减少,这已通过单独的配对样本队列验证(图3a-e)。值得注意的是,DC_C4_PPP1R14A_cDC2在P_Mets中富集程度更高(图3f)。通过伪时间分析、SCENIC 分析和标志物表达,他们发现 DC_C4_PPP1R14A_cDC2 代表 cDC2 内的脂质抗原呈递树突状细胞。其标志物之一CD1A在疾病进展过程中表达显著增加,表明这些细胞的产生与疾病进展有关(图3g-k)。先前的研究报告也支持这一结论,即 CD1A+ DC 浸润与喉癌临床结果不良相关。细胞-细胞相互作用分析显示,DC_C4_PPP1R14A_cDC2 通过 ANXA1-FPR1 与髓系亚型(尤其是 M_C1_S100A8)相互作用,ANXA1-FPR1 在细胞募集过程中起作用(图3l-m)。CODEX 结果证实这两种亚型在空间上彼此接近,这表明 DC_C4_PPP1R14A_cDC2 可能通过 ANXA1–FPR1 招募 M_C1_S100A8(图3n)。
综上所述,这些结果表明,DC_C4_PPP1R14A_cDC2 可作为脂质抗原呈递细胞,并代表了胆管癌 (GBC) 中的恶性 cDC2。此外,他们还发现 DC_C4_PPP1R14A_cDC2 可能通过 ANXA1–FPR1 募集 M_C1_S100A8,并与 P_Mets 中的其他髓系亚型表现出强烈的相互作用。
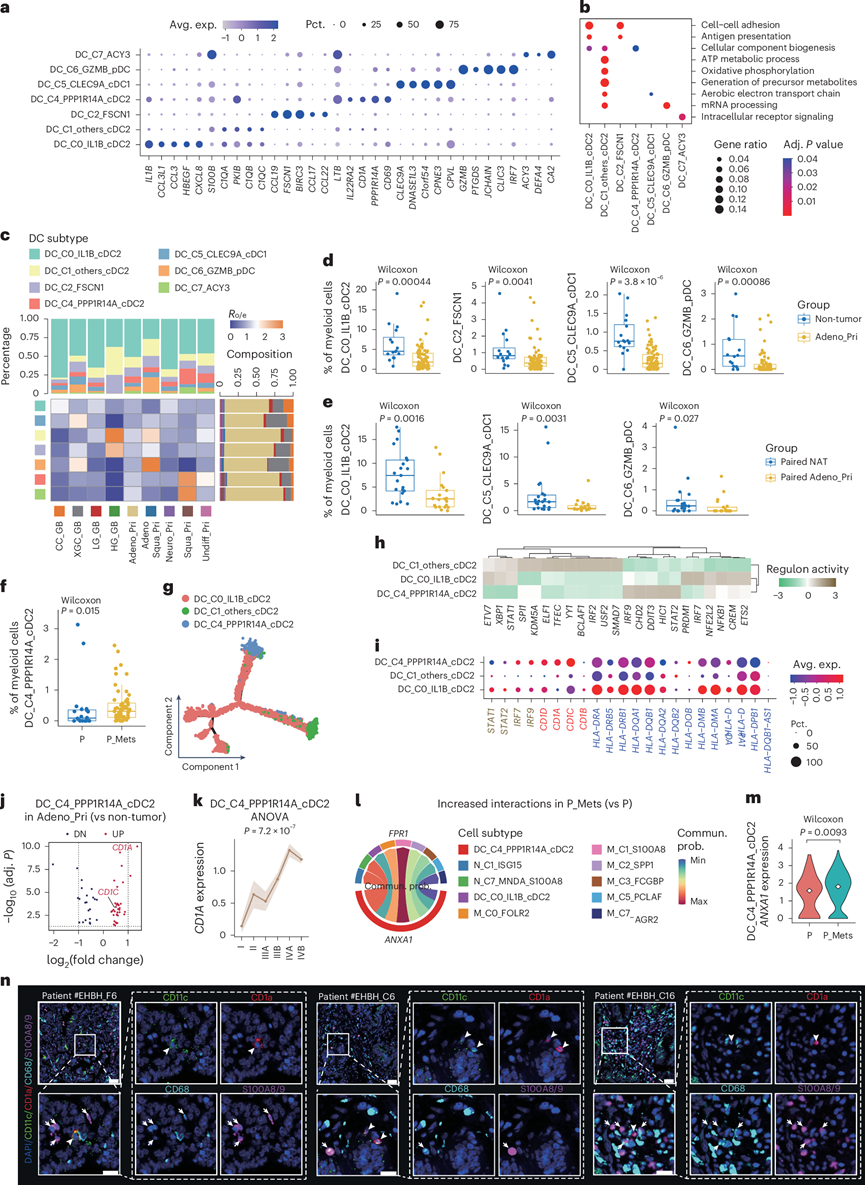
图3. 肿瘤发生过程中的 DC 动态。
(a-b) DC 亚型的 DEG和富集通路。(c) 热图显示通过R o/e预计的不同疾病患病率。(d-f) DC 亚型的比例。(g) cDC2 亚型的拟时间轨迹。(h) cDC2亚型的转录因子。(i) 不同cDC2亚型中转录因子、CD1和HLA-D的表达。(j) 火山图显示Adeno_Pri与非肿瘤中DC_C4_PPP1R14A_cDC2中的DEG。(k) DC_C4_PPP1R14A_cDC2中CD1A的动态表达及其TNM分期。(l) 弦图显示P_Mets与P之间相互作用增加。(m) DC_C4_PPP1R14A_cDC2中P和P_Mets之间的ANXA1表达。(n) CODEX 成像用于识别患者中由 CD11c 和 CD1a 标记的CD1a +树突状细胞和由 CD68 和 S100A8/9 标记的 S100A8 +巨噬细胞。
04
胆道AREG +富含P_Mets的幼稚CD4 + T细胞
对于淋巴细胞亚型,他们通过熵值过滤将 CD8+ T 细胞、CD4+ T 细胞、自然杀伤细胞、B 细胞和浆细胞分别聚类为 10 种、8 种、8 种、5 种和 2 种常见亚型(图1e)。在明确亚型的功能和分布特征后,他们重点研究了从非癌性到癌性状态的转变过程中亚型功能和比例的显著变化(图4a-b)。值得注意的是,在 Adeno_Pri 中富集的 CD8T_C1_CXCL13_T EX在早期表现出增强的细胞毒性和免疫检查点活性,但从 IIIB 到 IVB 经历了细胞毒性衰减,表明在晚期疾病中转变为衰竭状态(图4c)。功能转变可能是通过 CD86–CTLA4 与 M_C1_S100A8 的相互作用来调节的(图4d-e)。
通过研究转移相关的细胞和分子特征,他们注意到在P_Mets中富集的CD4T_C2_CCR7_T N表达AREG和幼稚标志物(图4f-g)。有趣的是,随着病情进展,Adeno_Pri中AREG的表达和CD4T_C2_CCR7_T N的比例逐渐增加,并伴有与TNM分期相关的动态功能变化(图4h-i)。在不同类型的转移中,CD4T_C2_CCR7_T N在 Adeno_LN 中最为普遍,并且AREG表达仅在 Adeno_LN 中检测到,而在正常淋巴结中未检测到(图4j-l)。
为了阐明AREG在幼稚 CD4+ T 细胞中的表达模式,基于泛癌症调查结果,他们发现AREG仅在来自 GBC、肝内胆管癌和远端胆管癌的幼稚 CD4+ T 细胞中表达,而在配对 PBMCs中几乎不表达(图4m-p)。然而,在Adeno_Pri 和非肿瘤中均观察到 CD4T_C2_CCR7_T N的存在,表明该亚型出现在非肿瘤微环境中。为了探索该类型在 TME 中的功能,GO分析显示 Adeno_Pri 中 IL-10 信号上调,IL-10 信号是一种可能调节免疫激活的抗炎信号(图4q)。
综上所述,这些结果揭示了淋巴细胞亚型的百分比和功能在不同TNM分期之间存在显著变化。在富含P_Mets的亚型中,他们鉴定出CD4T_C2_CCR7_T N ,其特征是AREG表达水平高。值得注意的是,该亚型特异性存在于胆道组织微环境中,可能通过分泌IL-10来影响TME。
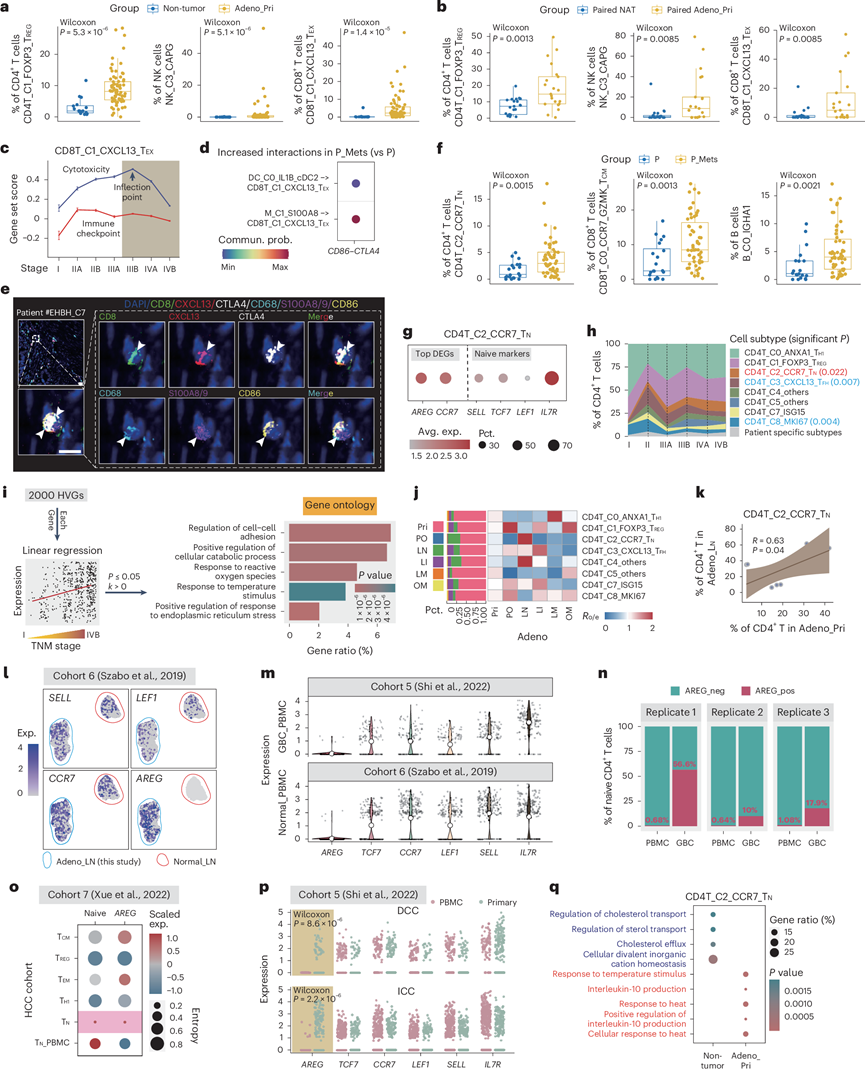
图4. 淋巴细胞的异质性和时间特性。
(a-b) 肿瘤与 Adeno_Pri以及配对 NAT与 Adeno_Pri之间的亚型比例。(c) 跨 TNM 分期的细胞毒性和免疫检查点评分。(d) P_Mets 与 P 之间相互作用增加。(e) 代表性 CODEX 图像显示 CTLA4 + CXCL13 + CD8 + T 细胞和 CD86 + S100A8 +巨噬细胞。(f) P和P_Mets之间的亚型比例。(g) DEG 和幼稚 T 标志物的表达。(h) TNM 分期中亚型组成的动态变化。(i) 实验流程显示 TNM 分期变量基因选择(双侧t检验)和通路富集直方图。(j) 通过Ro/e估计的不同组织部位患病率。(k) Adeno_Pri 和 Adeno_LN 之间百分比的Pearson 相关性。(l-m) Adeno_LN 和 Normal_LN以及 GBC_PBMC 和 Normal_PBMC中幼稚 CD4 + T 细胞的基因表达。(n) 通过流式细胞分析检测到的AREG +幼稚CD4 + T细胞百分比。(o-p) CD4 + T 亚型的基因表达。(q) 非肿瘤和 Adeno_Pri 之间的 CD4T_C2_CCR7_TN富集通路。
05
腺癌微环境的分层
为了探究肿瘤基因突变诱导的TME重塑变化,他们汇总了突变组中显著富集的亚型。在这些突变中,MUC5B突变导致多个亚型显著富集,包括CD8T_C0_CCR7_GZMK_T CM、CD4T_C7_ISG15和CD4T_C2_CCR7_T N。这一发现提示,微环境中细胞成分的改变可能与患者的遗传背景相关。
接下来,为了对患者进行分层,他们选取随病情进展而发生显著变化的亚型对腺癌患者进行聚类,并获得了五种局部微环境类型(MI1-MI5)(图5a)。在表征了微环境特异性细胞共存模式(图5a-b)后,预后分析显示,晚期样本中富集的MI2与不良临床预后相关(图5c)。为了验证微环境分类,通过对外部RNA测序数据进行反卷积分析,并使用CIBERSORTx分析细胞分数(图5a-d),他们对每位患者的估算细胞分数进行了评分,以确定微环境类型,并确认归类为MI2的患者预后不良(图5e)。进一步分析细胞比例发现,MI2特异性细胞亚型(CD8T_C0_CCR7_GZMK_T CM、CD8T_C12_TRDC_γδT和CD4T_C2_CCR7_T N)均显著富集(图5f)。
综上所述,他们根据显著变化的细胞成分构建了五种微环境。在这五种微环境中,MI2 在本研究队列和外部队列中均显示出不良预后。MI2 和 MI5 均为淋巴细胞相关的微环境,但它们的临床结局不同,这表明 MI2 中独特的淋巴细胞亚型可能是其预后表现的关键。

图5. 胆囊腺癌的分层。
(a) 根据 75 名胆囊腺癌患者原发性肿瘤中动态细胞成分的百分比,将 5 种不同的微环境聚类。(b) 网络图显示亚型共存的 Jaccard 相似指数。(c)患者的总生存期 (OS)。(d)实验流程。(e) MI2 患者的 OS。(f) 箱线图比较了 MI2和其他微环境中 MI2 特异性亚型的比例。
06
TME 交互的空间特征
为了识别常见的肿瘤细胞亚型,他们提出了一种名为AI-EPI的计算方法(图6a),获得了七个患者共有的基因模块(GM),并基于这些GM将肿瘤细胞聚类到不同的细胞状态中(图6b-d)。
在这些 GM 中,他们发现 GM16 在 P_Mets 中得分较高,这在外部数据集中得到了进一步验证(图6e)。此外,他们观察到 GM16 在 IIIB 期得分最高,这表明转移的开始(图6f )。肿瘤内异质性与 GM16 评分之间的强相关性(图6g),以及高 GM16 评分与不良预后之间的关联(图6h),表明 GM16 代表高度恶性的癌细胞。为了评估 GM16 在参数化过程中的稳健性。此外,他们还探讨了 GM16 与突变之间的关系,结果显示FAT2突变频率与 GM16 评分之间存在显著相关性。
为了探究GM16与P_Mets富集亚型之间的空间细胞相互作用,他们对两个GM16得分较高的样本进行了空间转录组学分析。在确定上皮细胞比例最高的点后,他们分析了每个点内GM16与P_Mets富集亚型得分之间的相关性。结果显示,GM16与多个亚型具有较高的空间相关性,包括B_C0_IGHA1、M_C1_S100A8、DC_C4_PPP1R14A_cDC2、CD4T_C2_CCR7_T N和 CD8T_C0_CCR7_GZMK_T CM(图6i)。细胞间相互作用分析也验证了这一结果,该分析显示在P_Mets中这些亚型之间的相互作用显著增强(图6j)。
总之,他们开发了 AI-EPI 来识别肿瘤细胞中的 GM,并识别出一种称为 GM16 的恶性肿瘤细胞类型,它与上皮-间质转化、P_Mets 富集、与肿瘤内异质性呈正相关、临床结果不佳以及与这些恶性 TIME 亚型的空间接近性有关。
图6. 肿瘤细胞和 TIME 亚型的空间接近度。
(a) AI-EPI 示意图。(b) 不同患者的平均基因模块得分。(c) 每个基因模块的富集通路。(d) 患者共有基因模块内选定的标记基因的表达。(e) 本研究中P和 P_Mets之间(左)以及外部数据集中 P和 P_Mets之间的 GM16 特征得分分布(右)。(f) 跨 TNM 分期的动态 GM16 得分。(g) GM16 与肿瘤内异质性 (ITH) 评分的 Pearson 相关性。(h) Kaplan-Meier 图显示按 GM16 评分分组的患者的 OS。(i) H&E 图像显示在左上角。(j) 由 CellChat 推断的差异相互作用强度。
07
近端P_Mets富集亚型中的AREG促进转移
为了进一步研究这些空间聚集的恶性亚型的作用,他们尝试确定它们的共同特征。有趣的是,他们发现AREG基因仅在靠近GM16的细胞亚型(包括CD8T_C0_CCR7_GZMK_T CM、CD4T_C2_CCR7_T N、DC_C4_PPP1R14A_cDC2、M_C1_S100A8和B_C0_IGHA1)中表达,而在远离GM16的内皮细胞、成纤维细胞和中性粒细胞亚型中不表达(图7a)。为了验证这一发现,他们进行了多重免疫组织化学分析,发现AREG基因不仅在巨噬细胞、B细胞和T细胞中表达,而且在上皮细胞中也表达(图7b)。因此,他们推断这些聚集的恶性微环境亚型产生的 AREG 基因可能在 GBC 中具有促肿瘤发生作用。
为了进一步探索AREG刺激下肿瘤细胞的功能变化,他们使用接受和未接受AREG处理的GBC-SD细胞产生的转录组分析(RNA-seq)数据进行了DEG和GO分析,发现肿瘤细胞上调了白细胞迁移通路,其中CXCL5显著富集(图7c-d)。通过qPCR,他们发现肿瘤细胞在接受AREG处理6小时后CXCL5表达显著升高(图7e)。
鉴于AREG蛋白是EGF家族的成员,他们推断AREG蛋白可能通过EGFR调控CXCL5的表达。qPCR结果表明,AREG可增加GBC-SD细胞中的CXCL5表达,而抗EGFR治疗可抑制这种效应(图7f-g),ELISA结果也验证了该结论(图7h-i)。使用另一种人胆囊腺癌细胞系SGC996和多个新鲜提取自人胆囊腺癌肿瘤的类器官,他们获得了与GBC-SD一致的结果。基于这些发现,他们证明AREG蛋白可以通过EGFR提高CXCL5的表达。
先前的研究发现,EGF通过EGFR–pERK–EGR1信号转导上调多种趋化因子的表达,他们猜测AREG可能通过类似的信号转导调节CXCL5的表达。通过免疫印迹实验,他们观察到在GBC-SD细胞中,AREG蛋白促进EGR1上调(图7j)。结合EGFR干预实验,他们发现AREG显著提高了EGR1和pERK1/2水平,而EGFR干预则逆转了这种表型(图7k)。他们还在SGC996细胞系和类器官中验证了这些结果。这些发现表明AREG蛋白通过EGFR–pERK–EGR1信号转导促进CXCL5蛋白的表达。
与先前的研究一致,他们发现体外中性粒细胞趋化性在使用分化的HL-60细胞中表现出更高的CXCL5增强中性粒细胞迁移(图7l-m)。接下来,他们将GBC-SD细胞注射到人源化小鼠的脾内,以分析肿瘤细胞是否在体内募集中性粒细胞。注射后7天,他们解剖了肝组织,并使用CD66b染色的免疫组织化学方法,发现AREG诱导的CXCL5上调可以促进肿瘤中的中性粒细胞浸润(图7n)。
为了进一步研究中性粒细胞浸润在GBC中的作用,他们试图测试中性粒细胞浸润是否与免疫治疗疗效相关。基于上述体内试验,在接种抗PD-L1和IgG后治疗各组后,观察到未接受AREG治疗组的免疫治疗效果更好(图7o)。接下来,他们通过肝重与体重的比率进行定量,结果显示,未接受AREG治疗的组在抗PD-L1治疗后下降幅度更大(图7p)。为了验证中性粒细胞浸润会阻碍免疫治疗的疗效,他们进行了CD66b染色的免疫组织化学分析(IHC),并证实了AREG治疗组中的中性粒细胞更多(图7q)。
综上所述,这些结果表明,相对恶性的TIME亚型和肿瘤细胞倾向于聚集并高表达AREG。在AREG的刺激下,肿瘤细胞不仅易于转移,而且还通过EGFR-pERK-EGR1信号上调CXCL5表达,从而增强中性粒细胞浸润,从而产生对免疫疗法的抵抗(图7r)。
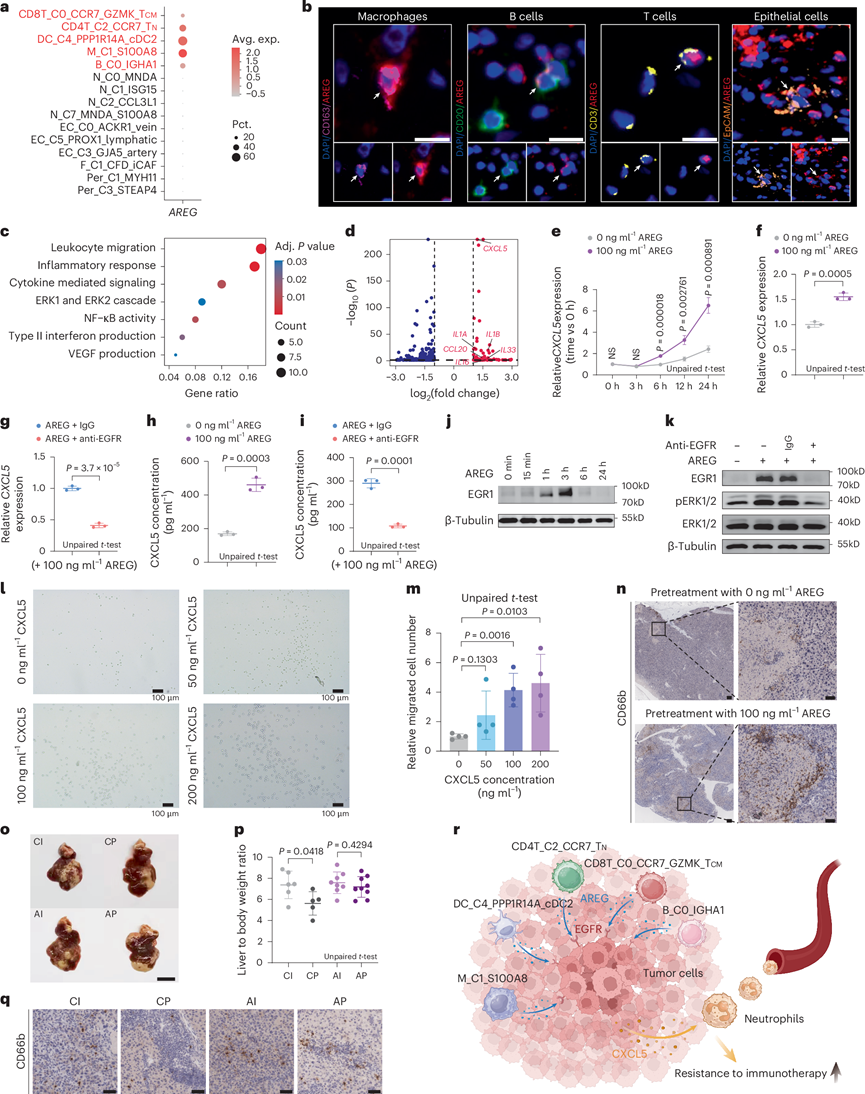
图7. AREG-CXCL5 募集中性粒细胞并抵抗治疗。
(a) 不同亚型的 AREG表达。(b) 代表性多重免疫组织化学图像,显示巨噬细胞、B 细胞、T 细胞和上皮细胞中的 AREG 表达。(c-d) AREG 处理后GBC -SD 细胞中上调的通路和 DEG。(e) 在不同时间点(每组n =3)用 qPCR 测量 GBC-SD 细胞中CXCL5的表达。(f-i) CXCL5 RNA 和蛋白质水平。(j-k)免疫印迹分析。(l-m) HL-60 细胞迁移的代表性图像和定量。(n) 免疫组织化学显示中性粒细胞浸润。(o-p) 不同条件下的代表性图像和肝重与体重的比率。(q) 使用肿瘤切片通过免疫组织化学测量的中性粒细胞浸润的代表性图像。(r) AREG 在 GBC 中的作用示意图。
+ + + + + + + + + + +
结 论
本研究构建了包含 1117245 个细胞的单细胞图谱,并绘制了 102 例患者的突变图谱,揭示了细胞组成、空间相互作用和分子功能的时空特征,并概括了五个局部生态系统,用于分层临床结果。整合的上皮细胞程序 AI-EPI 结合空间转录组分析,揭示了高度恶性肿瘤亚型 (GM16) 以及 AREG+ T 细胞、B 细胞、树突状细胞和巨噬细胞亚型在原发性腺癌的促转移微环境内的同步定位。体外和体内实验表明,AREG除了促进转移外,还通过EGFR-pERK-EGR1信号通路促进肿瘤细胞中CXCL5的表达,从而增加中性粒细胞浸润,并抑制免疫疗法的有效性。本研究提供了胆管癌微环境的时空图景,并揭示了预防免疫疗法耐药的潜在策略。
+ + + + +



 English
English


