文献解读|Nat Commun(14.7):超急性 HIV-1 感染期间血浆蛋白质组的动态
✦ +
+
论文ID
原名:Dynamics of the blood plasma proteome during hyperacute HIV-1 infection
译名:超急性 HIV-1 感染期间血浆蛋白质组的动态
期刊:Nature Communications
影响因子:14.7
发表时间:2024.12.05
DOI号:10.1038/s41467-024-54848-0、
背 景
虽然健康个体的血浆蛋白质组通常保持稳定,但已有记录表明,在应对不同感染(包括严重急性呼吸综合征冠状病毒以及细菌性和病毒性肺炎)时会出现扰动。了解这些感染中血浆蛋白质组学的差异表达对于诊断、预防和治疗干预起着关键作用。在HIV-1 感染中,感染最早阶段——超急性 HIV-1 感染(hAHI,定义为从血浆病毒血症开始到病毒载量达到峰值的时期)——的病毒-宿主相互作用会触发复杂的细胞和组织信号事件网络。这会导致快速的全身免疫激活和细胞微环境重组。超急性 HIV-1 感染期间血浆中蛋白质表达的复杂动态及其与急性逆转录病毒综合征、病毒控制和疾病进展的关系在很大程度上是未知的。
实验设计
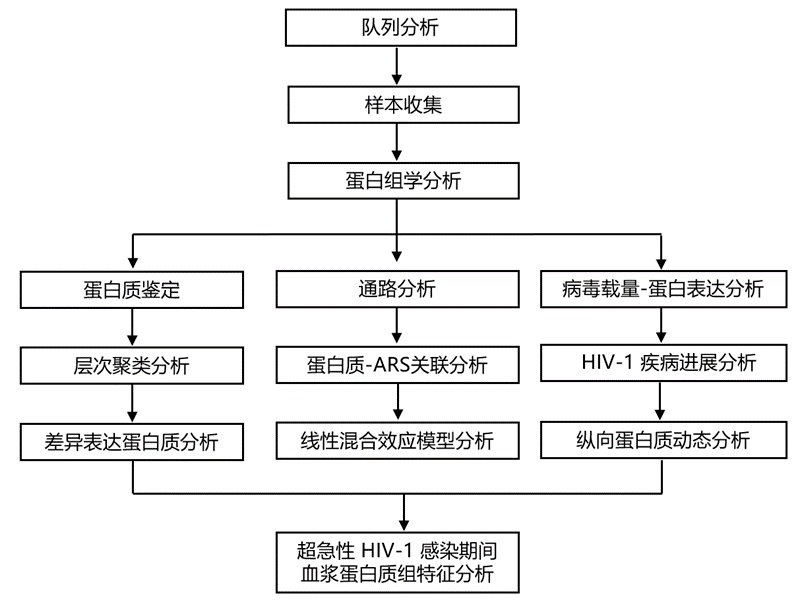
结 果
01
超急性 HIV-1 感染期间的血浆蛋白质组动力学分析
研究团队纳入了 来自中非和东非(国际艾滋病疫苗倡议 [IAVI] 队列,n = 39)和南非(德班队列,n = 15 )的 54 名参与者(图1)。参与者贡献了来自三个时间点的 157 份纵向链接的血浆样本,包括访视 0(V0),收集时间为 HIV-1感染前中位数 62 天;V1,HIV-1 感染后中位数 10 天;V2,HIV-1 感染后中位数 31 天。大多数参与者为男性,年龄在 25 岁以下,来自肯尼亚,感染 HIV-1 亚型 A1,并且确定为男男性行为者(MSM)。。54 名参与者中有 18 名拥有保护性 HIV-1 HLA I 等位基因,包括 B*58:01、B*57:02、B*57:03 和 A*74:01,而 11 名拥有易患疾病的 HLA I 等位基因,包括 B*58:02 和 B*18:01。

图1. 研究参与者的特征。
他们对每个样本进行了蛋白组学分析,总共检测到 1549 种蛋白质,其中 213 种因在 80% 以上的样本中不存在而排除。在剩余的 1336 种蛋白质中,有 379 种是在纯血浆样本中检测到的,而 957 种是在去除血浆后检测到的。在 1028 种具有唯一 UniProt ID 和规范蛋白质形式的已鉴定蛋白质中,242 种蛋白质之前归类为主动释放到血浆中的分泌蛋白,而 618 种蛋白质归类为来自组织或死亡细胞的细胞内或组织渗漏蛋白。其余蛋白质要么分泌到其他位置,要么代表免疫球蛋白。为了确定已识别的 1336 种血浆蛋白中每种蛋白在 V0、V1 和 V2 方向上的纵向宿主内动态,他们使用了 k均值分析和层次聚类。分析显示有六种不同的纵向表达谱(图 2a)。其中,两种蛋白在 hAHI 期间显著下降,在 hAHI 后反弹至感染前水平(称为“快速下降-快速上升”和“略微下降-快速上升”);两种蛋白在 hAHI 期间和之后均下降(“逐渐下降”和“快速下降-略微上升”);一种蛋白在 hAHI 期间增加,在 hAHI 后下降至感染前水平(“快速上升-快速下降”);一种蛋白在 hAHI 期间和之后持续增加(“持续增加”)。基于平均蛋白质强度,分析了基于群体的蛋白质动态,并揭示了不同的功能分组。“快速减少-快速增加”组蛋白质占测定蛋白质的 7%,主要参与细胞粘附和细胞外结构组织。“逐渐减少”组蛋白质占 32%,通常参与激活免疫反应、细胞骨架组织、蛋白质运输和细胞凋亡调控。“持续”组蛋白质占 18%,包括与上皮发育、补体激活、细胞外渗和病毒进入宿主细胞相关的蛋白质。
接下来,在个体层面上,确定了显著差异表达蛋白质。探索性主成分分析(PCA)显示,不同队列的蛋白质表达模式不同,德班参与者与 IAVI 参与者分开聚类。为了解释这个潜在的混杂因素,他们应用了一个线性混合效应模型,其中包括年龄、队列、访问以及队列和访问之间的相互作用,同时还调整了主成分(PC1 和 PC2)和患者特定的随机效应。使用该模型,他们分别在 V1-V0、V2-V0 和 V2-V1 访问之间确定了 97、168 和 149 种差异表达蛋白质(图 2b)。其中,两种(V1-V0)、18 种(V2-V0)和八种(V2-V1)蛋白质表现出显著变化(图 2c)。
在 V1-V0 的 97 种差异表达蛋白质中,51 种蛋白质上调,包括基于人类蛋白质图谱归类为分泌至血液的 28 种蛋白质和 23 种为泄漏蛋白质。V1 中上调的蛋白质在多种通路上高表达,包括与先天免疫反应、应激反应、适应性免疫反应、运输、蛋白质成熟和囊泡介导运输的调节相关通路(图 2d)。在 V0 的 46 种下调蛋白质中,18 种(40%)归类为分泌至血液的蛋白质。富集表达分析表明,13 种蛋白质与调节水解酶/肽酶活性和建立内皮屏障等相关通路有关(图 2e)。此外,V1-V0 中的组织特异性转录特征表明与食管粘膜和心脏相关的组织损伤标志物显著激活。
将V2与V0进行比较时,77种蛋白质上调,其中58种(75%)归类为渗漏蛋白(leakage proteins),39种上调的蛋白质与各种通路相关,包括血液凝固、纤维蛋白凝块形成、蛋白质成熟、细胞-底物粘附的正调节、金属离子反应、底物粘附依赖性细胞扩散的正调节和细胞粘附(图 2d)。在V2中下调的95种蛋白质中,48种(51%)归类为渗漏蛋白,53种与调节肽酶活性、炎症反应、应激反应、伤口愈合、免疫反应、肿瘤坏死因子超家族的细胞因子产生和中性粒细胞趋化作用的通路有关。此外,组织特异性转录特征分析表明,损伤标志物在肌肉骨骼组织和肺中发生激活,同时在全血中受到抑制,表明 V0 和 V2 之间存在大量组织损伤和细胞应激反应。
最后,V1 和 V2 之间有 149 种蛋白质存在差异表达,其中 86 种蛋白质上调。基于过度代表分析,其中 28 种蛋白质(33%)与基因表达、蛋白质成熟和大分子生物合成过程有关。在 86 种下调蛋白质中,53 种与炎症、应激和先天免疫反应以及解毒、对生物刺激的反应、补体激活和中性粒细胞趋化性有关(图 2e)。进一步分析表明,V2-V1 之间上调的蛋白质与脂肪、颈部、肌肉骨骼和肺组织中的损伤特征有关;而下调的蛋白质与皮肤和全血中的组织损伤有关。总体而言,这些发现表明 HIV-1 感染会诱导蛋白质表达的无数动态变化,这些变化超出了免疫反应的范围,影响各种生物过程,如细胞迁移、代谢功能和细胞凋亡。
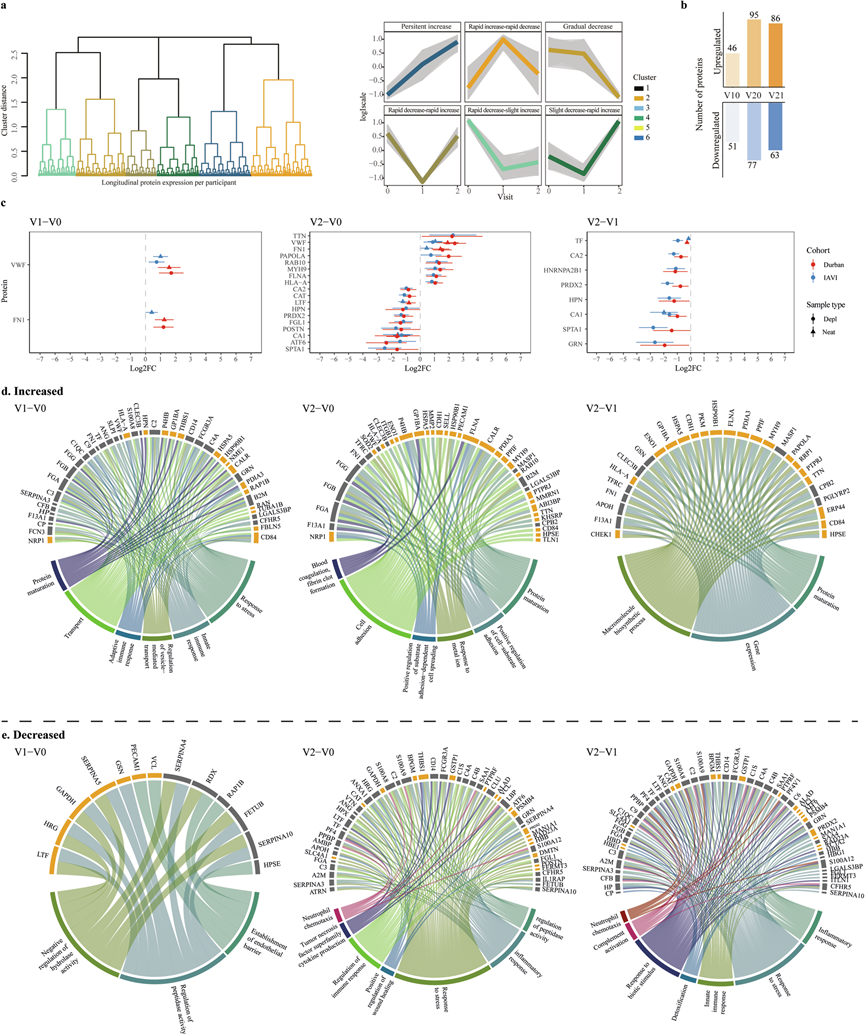
图2.急性 HIV-1 感染改变人类血浆蛋白质组。
(a)确定6个不同的聚类。(b) 条形图显示差异表达蛋白质数量的比较。(c) 在估计感染日期 (EDI) 后 2 周和 1 个月时显著差异表达的蛋白质的效应大小和 95% 置信区间,以及 EDI 后 2 周和 1 个月 (V2-V1) 之间的差异。(d-e) Circos图以圆形布局可视化不同访问差异中差异表达的蛋白质。
02
ZYX、SCGB1A1 和 LILRA3 水平与 ARS 相关
德班队列中缺少关于 AHI 症状的数据。因此,仅对来自 IAVI 队列的参与者(n = 33)进行了蛋白质动力学与急性逆转录病毒综合征(ARS)的关联研究(图3A)。ARS 是通过潜在类别分析确定的,基于发烧、头痛、肌痛、疲劳、厌食、咽炎、腹泻、盗汗、皮疹、淋巴结肿大和口腔溃疡 11 种症状。分析表明,33 名参与者中有 20 名(61%)患有 ARS。患有 ARS 的参与者在十一种症状中的 9 种症状中的患病率明显高于没有 ARS 的参与者(图 3b)。偏最小二乘判别分析(PLS-DA)用于识别与 ARS 相关的蛋白质。鉴于 V1-V0 和 V2-V0 之间差异的 PLS-DA 模型在 50 个测试集中预测 ARS 时表现出最高的平均性能指标。该模型的平均准确率为 78%,受试者工作特征曲线下面积为 82%,误分类误差为 20%(图 3c)。PLS-DA 分析表明 20 种差异表达蛋白质(方差重要性得分 >2)是 ARS 的潜在指标(图 3d-e)。V1-V0 中约有一半的蛋白质主动分泌到血浆中,主要参与调节炎症反应、免疫和宿主-病毒相互作用。在 V2-V0 中鉴定的蛋白质主要归类为与细胞运动和信号传导相关的组织渗漏蛋白。
接下来,他们使用线性混合效应模型来评估 ARS 与蛋白质表达随时间的变化关系。分析表明,在 PLS-DA 分析中确定为 ARS 强潜在指标的七种 V1-V0 蛋白中,三种也单独与 ARS 相关(图 3e-f)。更具体地说,与没有 ARS 的参与者相比,ARS 参与者的 Zyxin(ZYX,一种细胞骨架蛋白,调节内皮细胞的炎症反应)和 Secretoglobin 家族 1A 成员 1(SCGB1A1,一种肺表面活性抗炎蛋白,在肺部起抗炎作用)的平均蛋白质强度均低约 8 倍。相比之下,患有 ARS 的参与者的白细胞免疫球蛋白样受体亚家族 A 成员 3(LILRA3,一种由单核细胞和巨噬细胞分泌的可溶性蛋白,作为免疫调节受体,在感染期间平衡免疫反应/炎症)大约是没有 ARS 的参与者的两倍(图3g-i)。此外,先前的研究表明 ZYX 可以影响 HIV-1 复制。总之,这些发现强调了炎症、先天免疫和细胞运动与 ARS 表现之间的密切联系。

图3. Zyxin、分泌球蛋白家族 1A 成员 1 和白细胞免疫球蛋白样受体亚家族 A 成员 3 与 ARS 相关。
(a) 流程图表示ARS分类中使用的样本总数和排除标准。(b) 条形图比较了患有和不患有 ARS 的参与者 (N = 33) 之间的 AHI 症状分布。(c) 箱线图显示基于以下数据集的 ARS PLS-DA 模型的交叉验证性能指标(准确度)的结果。(d) 基于 ( c ) 中的V1 -V0 + V2-V0 数据集(具有最高准确度值)的分数图,表示每个样本的组成员身份。(e) 箱线图显示了基于 V1-V0 或 V2-V0 的 PLS-DA 模型中每种蛋白质的投影变量重要性 (VIP) 分数。(f) 森林图表示与感染前水平(分别为 V1-V0 和 V2-V0)相比,在估计感染日期 (EDI) 后 2 周和 1 个月显著差异表达的蛋白质的效应大小和 95% 置信区间。(g) 基于所选蛋白质的 V1-V0 和 V2-V0 表达的层次聚类,与 ARS 相关的蛋白质热图。(h)蛋白表达分析。(i) 表格表示与 ARS 相关的蛋白质的纵向蛋白质表达谱。
03
NAPA、RAN 和 ITIH4 水平与 HIV-1 控制相关
不同研究参与者监测病毒载量 (VL)的时间段各不相同。随访时间中位数为估计感染日期 (EDI) 后 4 年。为了确定与 HIV-1 控制相关的血浆蛋白,9 名在感染第一年内开始抗逆转录病毒治疗 (ART) 或随访时间少于 1 年的研究参与者排除在分析之外(图 4a)。 其余45 名研究参与者在 HIV-1 感染后通常表现出高水平病毒血症,随后下降并在 EDI 后约 50 天达到病毒载量设定点(图 4b)。中位峰值 VL 为 6.0(IQR 5.2–6.4)log10 拷贝/ml,中位 EDI 后 19(IQR 15-31)天,中位最低 VL 为 4.5 log10 拷贝/ml,中位 EDI 后 64(IQR 43–73)天。根据感染第一年 VL 谱,使用层次聚类将 45 名研究参与者分为两组(图 4c)。两组定义为病毒控制者(未接受 ART,VL 通常在 12 个月内低于 10000 拷贝/毫升,n = 15)和非病毒控制者(未接受 ART,VL 通常在 12 个月内高于 10000 拷贝/毫升,n = 30)(图 4d),临床参数或 ARS 与病毒控制无关(图 4e)。
接下来,使用线性混合效应模型来确定病毒载量如何随时间影响蛋白质表达。在 V1-V0 和 V2-V0 中,VL 控制者的 Alpha 可溶性 N-乙基马来酰亚胺敏感因子附着蛋白(NAPA,一种参与细胞内膜融合和囊泡运输的蛋白质,以及通过与 HIV Gag 蛋白相互作用以促进出芽和有效的病毒颗粒组装而导致 HIV 中的病毒释放)是非控制者的两倍多(图 4f)。此外,在 V2-V0 和 V2-V1 时,VL 控制者的 GTP 结合核蛋白 Ran(RAN,一种小 GTP 结合蛋白,主要参与调节核质运输、有丝分裂纺锤体组装和核膜形成,已证明对 HIV-1 预整合复合物的核输入和病毒 DNA 整合到宿主基因组中至关重要)大约是非控制者的三倍。最后,在 V2-V0 时,VL 控制者 的Inter - α-胰蛋白酶抑制剂重链 H4 (ITIH4 ,一种参与稳定细胞外基质和调节炎症的急性期蛋白,有助于免疫激活、组织损伤和 HIV-1 感染者的疾病进展)大约比非控制者低四倍。总的来说,这些结果表明病毒控制与病毒-宿主相互作用之间存在密切的关系,特别是与膜融合和核输入有关。
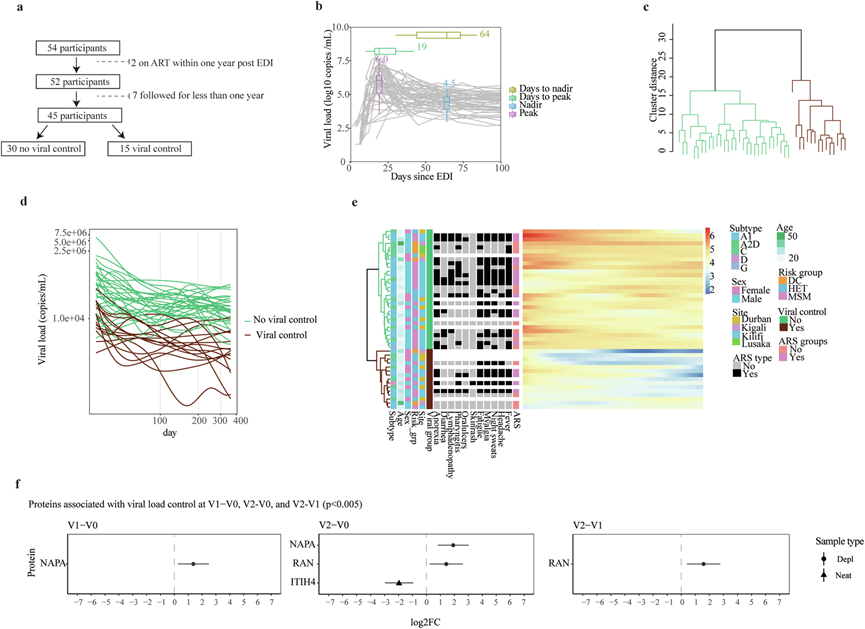
图4. α-可溶性 NSF 附着蛋白、GTP 结合核蛋白 Ran 和 Inter-α-胰蛋白酶抑制剂重链与 HIV-1 控制相关。
(a) 流程图说明病毒控制分类中使用的样本总数以及排除标准。(b) 纵向病毒载量与所有 54 名参与者的估计感染日期 (EDI) 后的天数的对比。(c) 树状图展示病毒载量谱的完整链接层次聚类。(d) 表示三次样条函数在均匀分布的时间点预测的病毒载量图。(e) 热图说明病毒控制与各种人口统计参数和 ARS 症状之间的关联。(f) 在估计感染日期 (EDI) 后 2 周和 1 个月显著差异表达的蛋白质,以及 EDI 后 2 周和 1 个月 (V2-V1) 之间的差异。
04
HPN、PRKCB 和 ITGB3 水平与 HIV-1 疾病进展相关
使用 CD4+ T 细胞反应来定义疾病进展。在 EDI 后的 12 个月随访中,参与者贡献了中位数为 13的 CD4+ T 细胞计数值。快速进展者定义为在 EDI 后 12 个月内达到 CD4+ T 细胞计数 <500 细胞/mm3 的参与者(不包括前 6 周内的测量值),而缓慢进展者定义为在同一时期维持 CD4+ T 细胞计数 >500 的参与者。在 54 名参与者中,12 名(22%)归类为缓慢进展者,42 名(78%)归类为快速进展者。与 IAVI 研究参与者相比,来自德班的研究参与者疾病进展较慢的可能性更高。使用 Cox 回归模型(控制年龄和队列)比较访问期间蛋白质水平的变化。在 V1-V0、V2-V0 和 V2-V1 时,分别有 7 种、6 种和 14 种蛋白质与 HIV-1 疾病进展加快相关。具体而言,在 V1–V0 处,Hepsin (HPN)、蛋白激酶 Cβ (PRKCB)、促皮质素释放激素结合蛋白 (CRHBP)、蛋白酶体亚基 β 型 6 (PSMB6)、硫氧还蛋白结构域蛋白 5 (TXNDC5) 和载脂蛋白 C4 (APOC4) 水平的升高与 HIV-1 疾病进展风险的增加有关(图5)。V1-V0 时谷胱甘肽 S-转移酶 Mu 2 (GSTM2) 水平降低与疾病进展加快相关。HR 为 1.3 表示从 V0 到 V1 蛋白质水平翻倍与 EDI 后 1 年内 CD4+ T 细胞计数降至 500 个细胞/μl 血液以下的风险增加 30% 相关。有趣的是,根据 HIV-1 相互作用数据库,所有已鉴定的蛋白质均已显示与 HIV-1 包膜相互作用。此外,整合素亚基β3(ITGB3)、热休克70 kDa蛋白8(HSPA8)、D-多巴色素互变异构酶样蛋白(DDTL)和泛素B(UBB)在V2-V0时的水平升高与疾病进展风险增加有关。CD84和潜在转化生长因子β结合蛋白1(LTBP1)水平降低与疾病进展风险降低有关。值得注意的是,所有这些蛋白质都与不同的 HIV-1 蛋白相互作用进行介导。
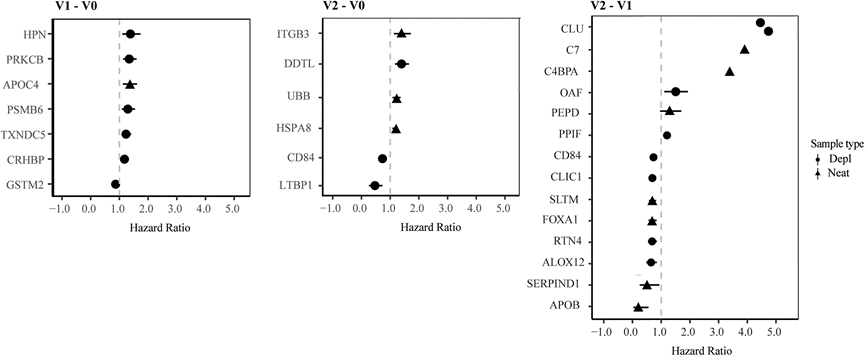
图5. Hepsin、蛋白激酶 Cβ 和整合素亚基β3 与疾病进展风险增加有关。
最后,使用滑动窗口方法生成样条曲线,该曲线反映 hAHI 期间血浆中已识别关键蛋白质的基于人群的平均动态(图 6)。绘制了每个研究参与者在 EDI 后样品采集当天的蛋白质水平相对于感染前水平的图表。根据上述分析,选择了与 ARS、病毒控制和疾病进展相关的关键蛋白质。组间比较中具有相似动态的蛋白质排除在本分析之外。结果显示,不同蛋白质的轨迹随时间的推移表现出极大的变化,并表明在 hAHI 期间,过表达蛋白质(定义为stormers)和表达不足蛋白质(定义为slumpers)的动态都很常见。
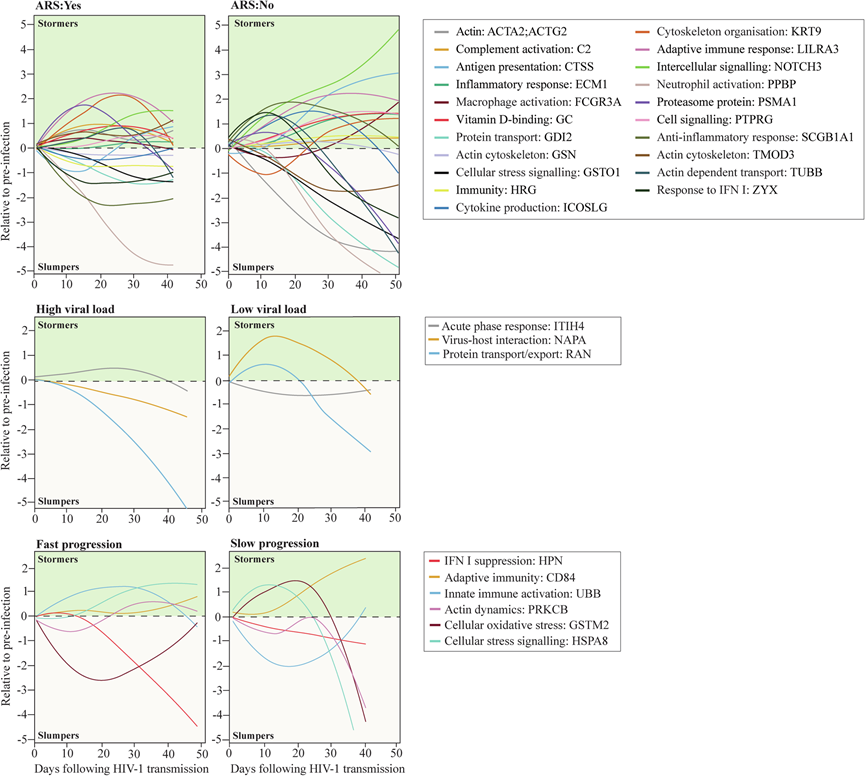
图6. 超急性 HIV-1 感染期间与 ARS、病毒载量和疾病进展相关的关键差异表达蛋白的纵向动态。
+ + + + + + + + + + +
结 论
本研究对来自四个撒哈拉以南非洲国家的 54 名参与者在超急性 HIV-1 感染之前、期间和之后采集的 157 个纵向相关血浆样本进行了蛋白组学分析,确定了六种不同的纵向表达谱,其中四种表明 HIV-1 感染后蛋白质水平持续下降。在从感染前到感染后一个月的过渡期间,参与炎症反应、免疫调节和细胞运动的蛋白质发生了显著改变。具体而言,ZYX 和 SCGB1A1 水平降低以及 LILRA3 水平升高与急性逆转录病毒综合征风险增加有关;NAPA 和 RAN 水平升高,ITIH4 水平降低与病毒控制有关;HPN、PRKCB 和 ITGB3 水平升高与疾病进展风险增加有关。总体而言,这项研究深入了解了超急性 HIV-1 感染中的早期宿主反应,并提出了与 HIV-1 疾病进展和病毒载量相关的潜在生物标志物和机制。
+ + + + +



 English
English


