文献解读|Nat Commun(14.7):人类肝脏昼夜转录组图谱及其受丙型肝炎病毒感染的干扰
✦ +
+
论文ID
原名:An atlas of the human liver diurnal transcriptome and its perturbation by hepatitis C virus infection
译名:人类肝脏昼夜转录组图谱及其受丙型肝炎病毒感染的干扰
期刊:Nature Communications
影响因子:14.7
发表时间:2024.08.29
DOI号:10.1038/s41467-024-51698-8
背 景
慢性肝病和癌症是全球性的健康挑战。在啮齿类动物中,昼夜节律钟(CC)作为肝脏生理和疾病调节器的作用已得到充分证实,然而,在人类疾病中,节律性表达基因的特征和表观遗传调控研究较少。
实验设计
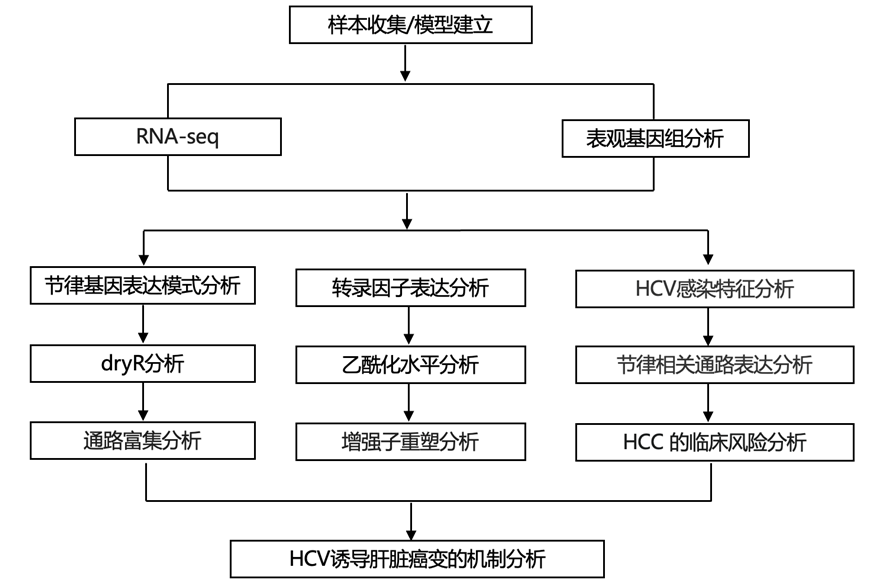
结 果
01
人类和小鼠肝细胞节律性转录组的比较分析
评估人类肝脏转录组的节律性具有挑战性,因为这需要在 24 小时内进行多次活检样本,这对患者来说是不可接受的风险。因此,研究团队使用人肝嵌合小鼠 (HLCM) 模型作为替代。这些小鼠具有免疫缺陷,并植入了原代人肝细胞 (PHH),是重现患者肝病生物学关键方面的完善模型,包括慢性病毒性和代谢性肝病。为了识别在人类肝细胞中表现出节律性表达模式的基因,他们研究了雄性 HLCM 肝组织样本中转录本丰度的时间变化(图 1a)。两个实验中移植的人肝细胞中的核心 CC 基因表现出与残留鼠肝细胞类似的基因谱,并显示出这些基因的特征性节律性(图1b)。这些包括含有 RORE 的基因CRY1、BMAL1、NPAS2、CLOCK和NFIL3,它们在活动期(ZT12-ZT0)达到最大表达,在静息期达到最低水平。相反,包含 BMAL1/CLOCK 转录活性依赖性 E-Box 的基因DBP、TEF、PER1和PER2主要在静息期表达(图 1b)。
接下来,他们应用最近开发的dryR算法来分析 HLCM 肝脏中基因表达的差异节律性。该算法确定了昼夜节律直系同源基因表达的幅度、相位(峰值表达时间)和平均表达水平的变化,从而可以比较具有多种条件和物种之间的数据集。dryR算法将基因组分配给不同的节律模型。通过dryR,他们在 HLCM 肝脏中确定了五种不同的转录谱类别,包括在人类肝细胞中循环的基因(模型 2;在制图图中以绿色表示)、在小鼠肝细胞中循环的基因(模型 3;在制图图中以粉红色表示)、未改变的节律 [模型 4,灰色:粉红色(小鼠)和绿色(人类)的合并] 和改变的节律(模型 5;两个物种在相位或幅度上表达不同,但表现出一定的节律性)(图 1c)。dryR揭示了 HLCM 肝脏的人肝细胞中约 1700 个有节律的蛋白质编码直系同源基因(模型 2、4 和 5)。其中包括 824 个在人类细胞中具有独特节律的基因(模型 2)(图 1c)。他们还发现 103 个基因(模型 5)的表达在人类和小鼠肝细胞之间发生了改变,而 749 个基因(模型 4)在 HLCM 肝脏中的两个物种中显示出未改变的节律表达(图 1c)。
他们使用分子特征数据库 (MSigDB)对 HLCM 人肝细胞中的节律基因的生物学功能进行分类,以便与小鼠肝脏中已知的“时钟”控制的生理过程进行比较(图1d)。时间分辨的富集分析揭示了肝脏时钟在调节涉及瘦素、胆汁酸、胆固醇、脂肪酸和血红素代谢的途径中起着压倒性的作用。此外,他们发现与应激反应(DNA 修复、活性氧、p53 信号传导)、信号通路(NOTCH、KRAS、TGF-β)和细胞周期有关的人类节律通路聚集在可比的时间窗口(“峰值”表达±1 ZT)中(图 1d)。人类肝细胞表现出细胞过程(凋亡、缺氧反应)、细胞因子信号传导(IFNα、IFNγ、IL6、TNFα、补体系统)、VEGF(血管生成)和未折叠蛋白反应的节律性表达。
转录因子 (TF) 的节律性表达可产生靶基因表达的时间模式。为了识别 HLCM 人肝细胞中节律性表达的 TF,他们分析了一个包含 1600 个人类 TF的数据集。通过对dryR分类的节律基因的分析,在 HLCM 肝脏的人肝细胞中识别出约 140 个节律性表达的 TF(约占所有节律基因的 8%)(图 1e),它们是众所周知的生理病理调节因子。通过评估人类和小鼠 HLCM 细胞中 TF 的表达,他们发现IRF2、NCOR2、JUNB、RELB和IRF1等关键 TF在人类肝细胞中具有独特的节律性(模型 2)(图 1f),表明人类和小鼠肝脏中的几种细胞因子和应激反应通路在时间上是不同的(图 1d)。他们发现调节外来化合物代谢的 TF 的表达阶段发生了变化(NR1I2和HLF),并且CEBPG的表达发生了改变(模型 5)(图 1e-f)。重要的是,在两个物种中 HLCM 肝脏中节律性表达的 TF 中均包含 CC 调节 TF(BMAL1/ARNTL 、CLOCK、NR1D1)和代谢协调因子(PPARD 和 CREB3L3)。在 HLCM 肝脏中,他们鉴定了几种人类锌指 TF(ZNF)直系同源物,它们在不同的 dryR 类别中表达,例如 ZNF(217、248和318;模型2 -仅在人类肝细胞中循环),而ZNF (330、277、362和367 ,模型4 -在两个物种中未发生改变)。
基因表达需要启动子和增强子区域的表观遗传变化。为了确定转录水平的这些节律性是否与染色质的昼夜表观遗传重塑有关,他们对 HLCM 肝脏样本进行了 ChIP 测序 (ChIP-seq)(图 1a)。他们最初关注组蛋白3赖氨酸27乙酰化(H3K27ac)水平的时间变化,H3K27ac是启动子和增强子激活的已知标志物,其失调与慢性肝病相关。对比分析揭示了H3K27ac在人肝细胞和WT小鼠肝脏的增强子区和启动子区水平的节律性。分析增强子活化模式表明,CC 输出调节 TF D-box 结合蛋白(DBP)的变化在人类和鼠肝细胞中遵循相似的模式,而IRF2启动子-增强子周围的 H3K27ac 水平变化仅在人类肝细胞中有节律性(图 1g)。
综上所述,这些研究结果提供了人类肝细胞节律性转录组图谱,揭示了其体内表观基因组变异。重要的是,据报道,几种已鉴定的节律性基因和过程的表达改变与慢性肝‘’病有关。
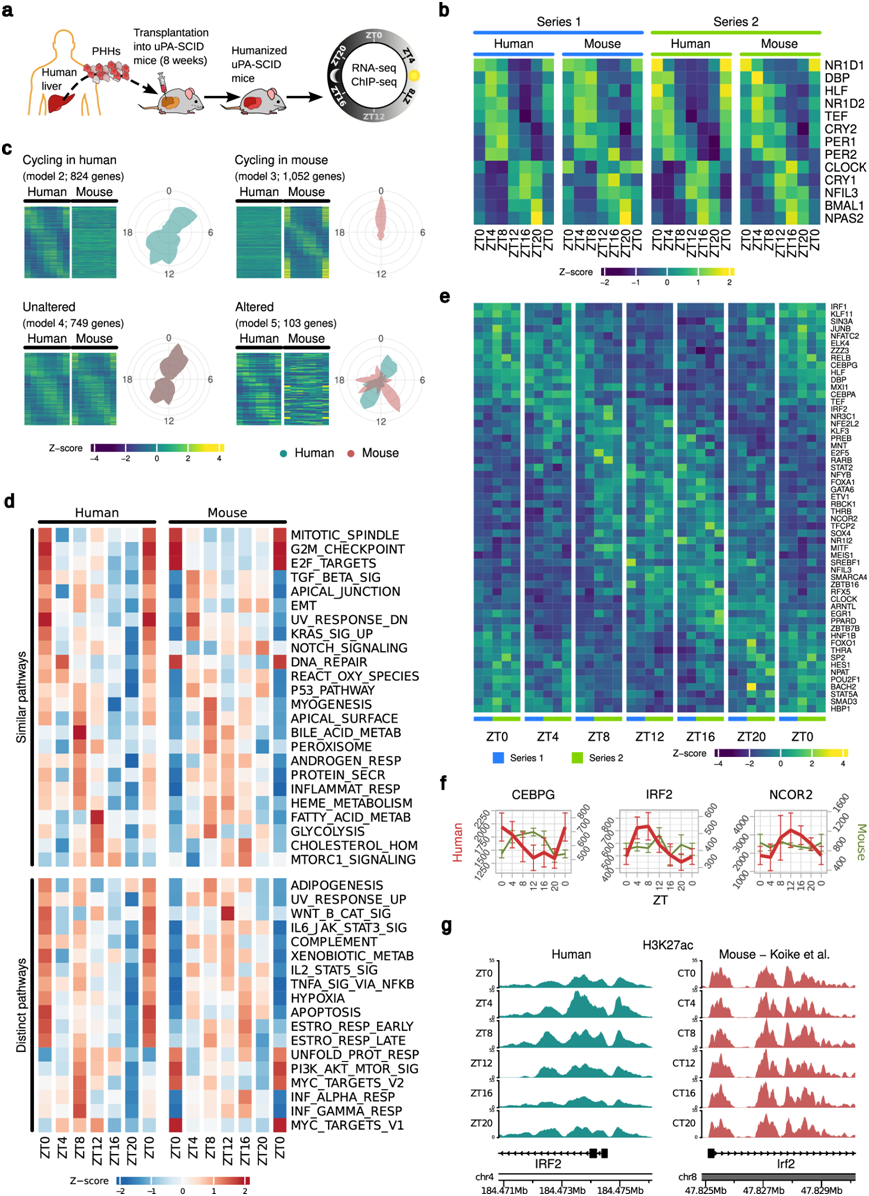
图1. 人类肝细胞在体内的节律性转录组。
(a) 免疫缺陷人源化肝嵌合小鼠 (HLCM) 的生成示意图。(b) 两个独立实验(系列 1 和 2)中 HLCM 的人和小鼠肝细胞中核心 CC 振荡器基因和 CC 输出调节器的平均节律表达模式。(c) dryR预测的 HLCM 中人和小鼠肝细胞中表现出节律性的基因的平均表达模式。(d)通路富集分析。(e) DryR预测 的HLCM 中人类肝细胞转录因子 (TF) 的节律表达。(f) dryR识别的 TF的平均表达模式示例。(g) ChIP-seq 覆盖图显示人类肝细胞和 WT 小鼠肝脏中IRF2中H3K27ac水平的昼夜变化。
02
丙型肝炎病毒 (HCV)感染扰乱体内人类肝脏转录组的节律
为了了解人类肝细胞节律性转录组的紊乱是否与肝脏疾病和癌症有关,他们在两个独立的动物实验(系列1和系列2)中研究了HCV感染对昼夜基因表达的影响。HCV只感染人肝细胞,在小鼠细胞中既不感染也不复制。HLCM由患者来源的HCV感染10周(图2a),并评估了肝脏的昼夜基因表达。来自HCV感染的HLCM肝脏的RNA-seq产生了以无监督方式聚集的特异性转录组谱。在HLCM的人肝细胞中,他们使用dryR研究了HCV诱导的节律性转录组和通路的扰动。他们在HCV感染的HLCM肝脏中确定了5类不同的转录谱(节律丢失、节律获得、节律未改变和节律改变)(图2b),以及与非感染对照相比的另外一类非节律基因。HCV诱导的肝细胞昼夜转录组扰动的整体影响(约占所有节律基因的22%;模型2、3和5)反映了几个生理过程的失调,包括HCV诱导的蛋白质基因组变化通路(图2c)。重要的是,通路(富集于循环基因)是慢性肝病的关键驱动因素,包括代谢改变(脂肪酸、脂质、过氧化物酶体组织)、纤维化(TGF-β信号、SMAD活性、成纤维细胞增殖和EMT反应)和与HCC发展相关的致癌通路(肝癌特征、MYC、H-RAS和EGFR信号)(图2c)。所有这些通路之前都由dryR确定为在模型2(节律性丧失)内循环(图2c)。接下来,他们对MYC进行了免疫染色,MYC是一个驱动慢性肝病和HCC各个方面的著名癌基因。虽然MYC在未感染的肝脏中几乎检测不到,但在HLCM肝脏中,HCV感染后MYC显著上调,支持下游靶通路在转录组水平的激活(图2c)。一些研究指出,缺乏适应性免疫细胞可以阻止脂肪变性的发展,并且在HLCM肝脏中仅发生边缘性纤维化。
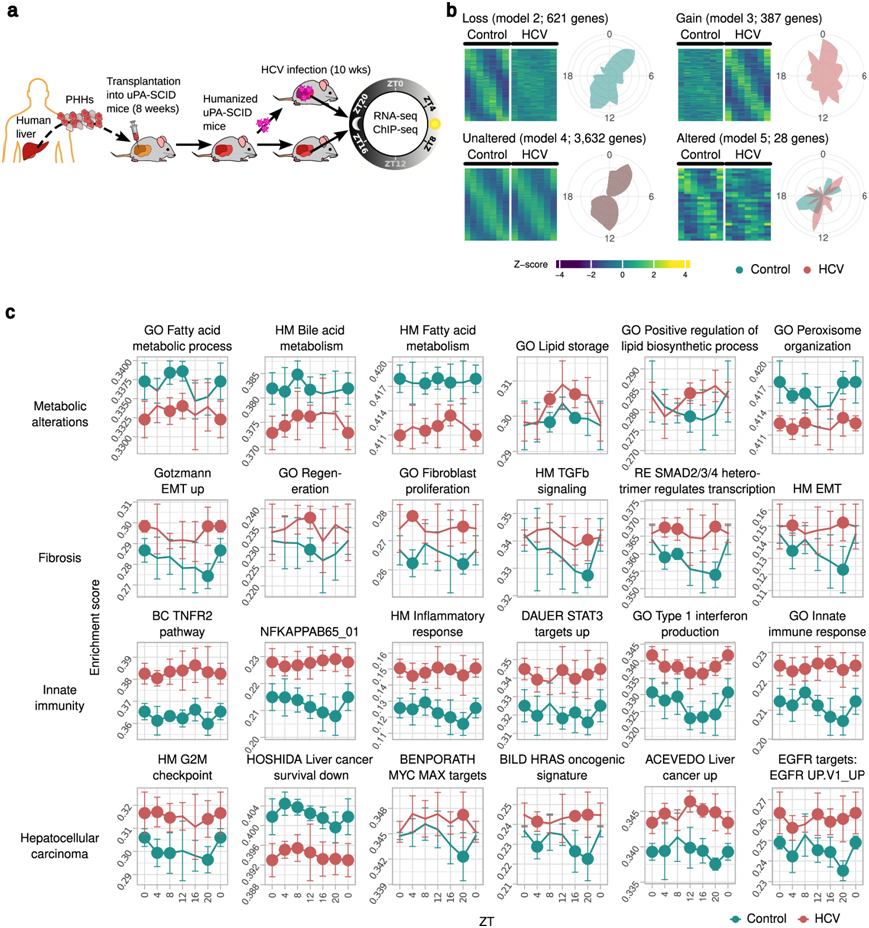
图2. 慢性 HCV 感染会破坏体内人类肝脏转录组的节律。
(a) HLCM 慢性 HCV 感染的示意图。从这些感染的 HLCM 中获得的肝组织用于进行 RNA-seq 和 ChIP-seq。(b) 根据 HLCM 中对照和 HCV 感染的人肝细胞中的表达,由 dryR 确定的四类 CC 干扰和未改变的基因。(c) 在指定时间点上显著富集节律基因。
03
HCV 感染会破坏体内驱动基因表达的节律性表观遗传变异
在健康和慢性肝病的人类肝细胞中,驱动启动子-增强子激活/抑制的表观基因组变化的昼夜变化尚未探索。因此,他们分析了感染和未感染 HLCM 肝脏中两个基因激活表观遗传标记的 24 小时变化:组蛋白 3 赖氨酸 27 乙酰化 (H3K27ac) 和组蛋白 3 赖氨酸 9 乙酰化 (H3K9ac)。他们在未感染肝脏中循环基因启动子-增强子区域的 H3K27ac 和 H3K9ac 水平上发现了整体节律性(图 3a-d)。在循环基因中,他们确定了 H3K27ac 和 H3K9ac 的转录起始位点 (TSS) 富集峰。此外,他们还在基因体和基因间区域内发现了 H3K27ac 和 H3K9ac 的峰值,这表明尚未表征的远端增强子区域可能存在昼夜表观遗传调控(图 3a-f)。重要的是,在受感染的肝脏中,H3K27ac 的整体昼夜变化完全消失。H3K27ac 变异的消失表现为 TSS 相关 H3K27ac 峰的普遍稳定(图 3a-c)。此外,在受感染的肝脏中,观察到的昼夜基因间增强子区域持续过度 H3K27 乙酰化(图 3a)。与 H3K27ac 相反,HCV 诱导的 H3K9ac 水平较高,主要在静息期结束时和活跃期,与未感染动物相比,其峰值数量达到饱和(ZT8-ZT20)(图 3d-f)。因此,HCV 在启动子增强子(H3K27ac 和 H3K9ac)和基因体(H3K9ac)水平上改变了昼夜表观基因组(图 3a-f)。此外,对肝病驱动基因(XBP1和RAF1)和 CC 成分CRY1的 H3K27ac 和 H3K9ac 水平的基因特异性昼夜变化的分析证实了 HCV 诱导的表观遗传扰动(图 3g)。
为了揭示 HCV 感染的 HLCM 肝脏中 H3K27ac 峰中富集最多的 TF 基序,他们将 TSS 和增强子相关峰与 JASPAR中的TF 结合位点预测相交(图 3h),这揭示了由 CC调节 TF(例如 DBP、HLF、TEF、NFIL3;D-Box 基因的调节剂)导致 H3K27ac 水平的整体抑制。重要的是,他们还观察到 HCV 感染的 HLCM 中已知的慢性肝病进展转录驱动因子的增强子区域中 H3K27ac 峰的富集,例如 NRF1/NFE2L1(脂质代谢、氧化/缺氧应激的调节剂)、E2F 和 EGR(细胞周期、应激反应的调节剂)(图3h)。总之,这些结果表明 HCV 感染会扰乱肝脏转录组和表观基因组,从而创造有利于肝病和癌症发展的环境。
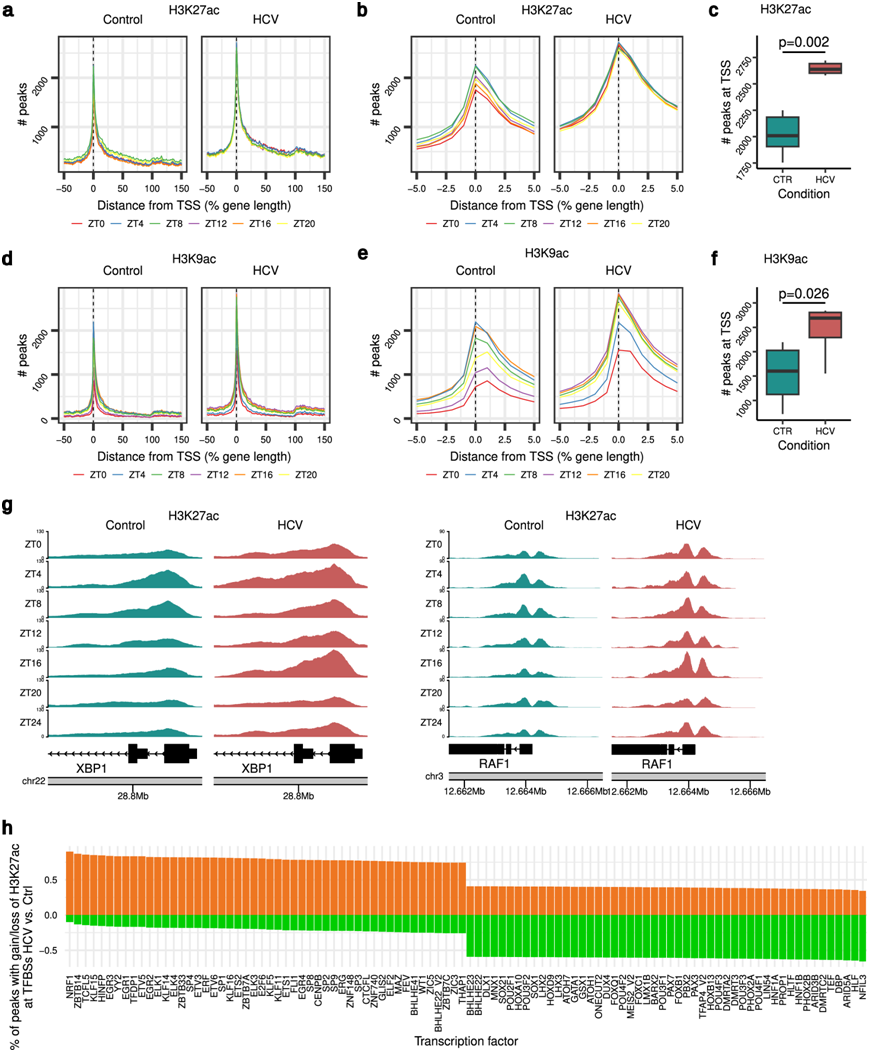
图3. 慢性 HCV 感染会损害体内时间调控增强子的重塑。
(a) HLCM 中对照和 HCV 感染的人肝细胞中基因体不同时间点的 H3K27ac 峰密度。(b) HLCM 中对照和 HCV 感染的人肝细胞中不同时间点的 TSS 相关 H3K27ac 峰密度。(c) CTR 对照(绿色)、HCV感染 (红色)的TSS 处 H3K27ac 峰数的定量分析。(d) HLCM 中对照和 HCV 感染的人肝细胞中基因体在不同时间点的 H3K9ac 峰密度。(e) HLCM 中对照和 HCV 感染的人肝细胞中不同时间点的 TSS 相关 H3K9ac 峰密度。(f) TSS 处的 H3K9ac 峰数定量。(g) 人类肝细胞中 HCV 宿主因子XBP1和RAF1的启动子富集H3K27 乙酰化。(h) Jaspar 数据库中列出的基因靶标中与转录因子结合位点重叠的增强子/TSS 富集峰的百分比,其中 H3K27 乙酰化增加(橙色)或减少(绿色)。
04
HCV 昼夜基因表达紊乱与慢性肝病患者的 HCC 风险相关
为了研究这些发现的临床影响,他们研究了病毒引起的慢性丙型肝炎患者节律通路的扰动。他们对这些患者转录组变化的分析支持了在 HLCM 中的观察结果,揭示了慢性 HCV 感染会扰乱与肝脏疾病相关的节律通路的表达(图 4a)。对186个预后肝脏特征(PLS)基因的系统解剖显示,与肝细胞癌 (HCC)高风险/预后不良基因的表达相比,与HCC低风险和预后良好相关的基因循环比例要高得多(图4b)。因此,HCV 诱导的转录组扰动似乎对良好预后基因的表达的影响比对不良预后基因的影响更大。
他们将HCV感染和对照肝细胞的“早期”(ZT0-ZT8)和“晚期”(ZT12-ZT20)昼夜时间点的基因集定义为在每种条件下具有>4倍变化的上调基因。他们观察到HCV感染肝细胞早期时间点的部分基因集与几种疾病严重程度特征具有相关性(图4b)。来自未感染肝细胞和 HCV感染肝细胞晚期时间点的基因组与 PLS 的低风险状态相关。使用这些基因集作为HCVCLOCK的共同标志,他们能够将HCC患者分为高风险(预后差)和低风险(预后好)组。重要的是,他们观察到基因集富集指数(GSEI)的变化,这表明根据HCVCLOCK分类,GSEI与总生存期存在“相关幅度”(图4c-d),提示可能存在临床相关性。最后,他们在HLCM和患者队列中对HCV破坏的节律通路进行的分析显示,HCV破坏的节律通路与癌症的所有主要“特征”均有紧密联系(图4e)。综上所述,HCV诱导的人肝细胞节律性转录组的干扰与发展为HCC的临床风险相关。
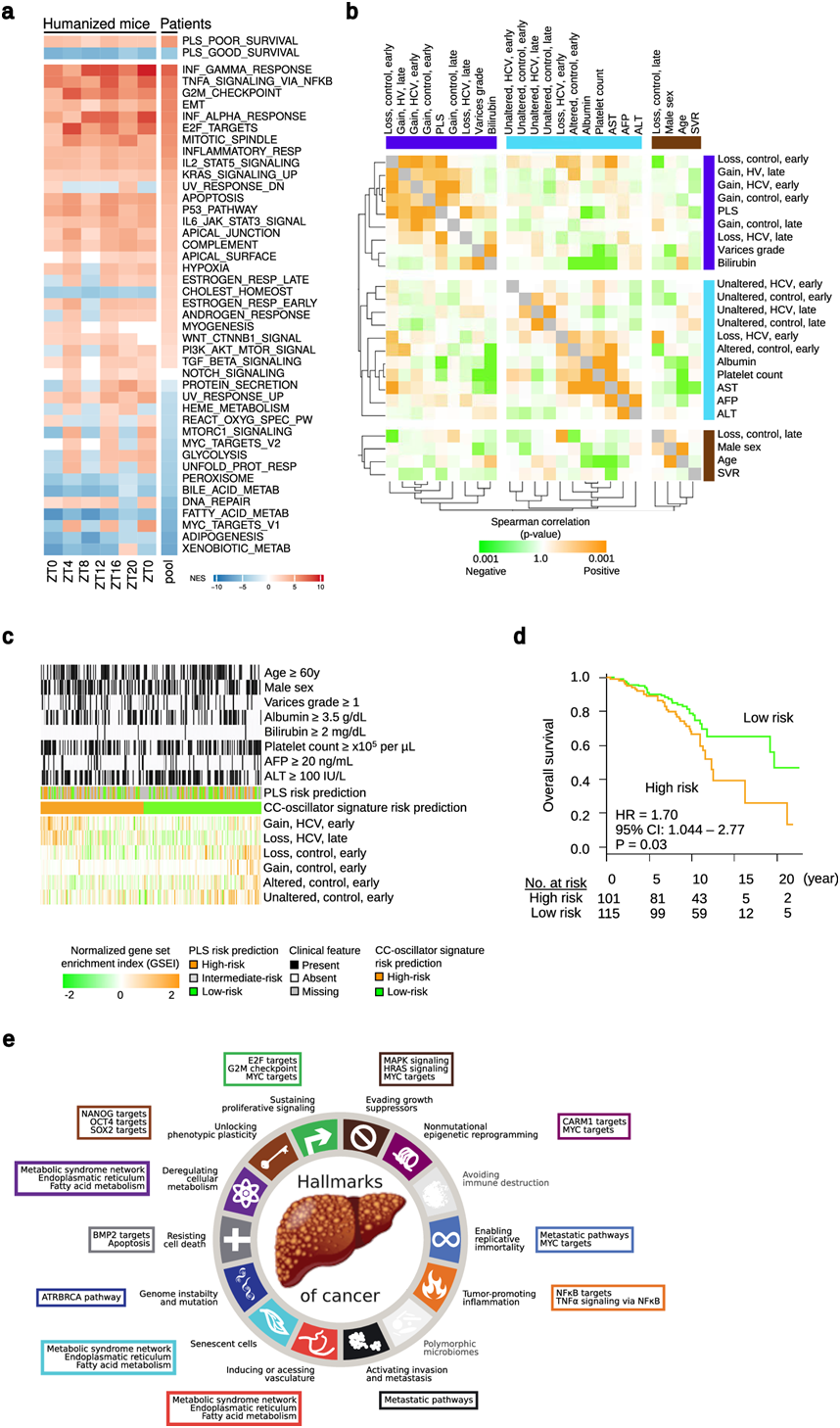
图4. 慢性 HCV 感染会扰乱患者的节律通路表达和癌症风险。
(a) 富集的人类节律基因。(b) 在216例早期HCV肝硬化患者中,CC振荡特征的诱导与临床人口统计学和PLS之间的Spearman相关性。(c) 对 216 名早期肝硬化患者进行分类。(d) 216 名早期 HCV 肝硬化患者中疾病严重程度相关 HCV CLOCK 特征分类与总生存期的关联。(e) HCLM的癌症特征和紊乱的节律通路。
+ + + + + + + + + + +
结 论
本项研究使用雄性人肝嵌合小鼠揭示了人类肝细胞的节律性转录组和表观基因组,在雄性嵌合小鼠的人类肝细胞中发现了大量节律性表达的蛋白质编码基因,其中包括关键转录因子、染色质修饰剂和关键酶。HCV感染是肝病和癌症的主要原因,它通过改变 1000 多个基因表达的节律性来扰乱转录组,并影响表观基因组,导致介导代谢改变、纤维化和癌症的关键通路发生激活。HCV 扰乱的节律通路在晚期肝病患者中仍然失调。总的来说,这些数据支持病毒诱导的肝脏节律转录组和途径的扰动在癌症发展中发挥作用,并可能为癌症预防和预测 HCC 风险的生物标志物提供机会。
+ + + + +



 English
English


