文献解读|Science Advances(13.6):幼稚人类多能干细胞获能过程中的表观遗传动力学
✦ +
+
论文ID
原名:Epigenetic dynamics during capacitation of naïve human pluripotent stem cells
译名:幼稚人类多能干细胞获能过程中的表观遗传动力学
期刊:Science Advances
影响因子:13.6
发表时间:2023.09.29
作者/通讯作者:João Agostinho de Sousa/ Ferdinand von Meyenn
单位:苏黎世联邦理工学院健康科学与技术系营养与代谢表观遗传学实验室
DOI号:10.1126/sciadv.adg1936
背 景
人类多能干细胞 (hPSC) 在再生医学中具有重要意义。人类多能性研究经常使用在引发状态下衍生并长期培养的 hPSC,也称为传统 hPSC,已知其会在 DNA 甲基化和 X 染色体状态中获得培养诱导的表观遗传畸变,因此可能会错误地再现植入后外胚层的特征。幼稚 hPSC 有希望克服传统hPSC 的一些局限性,包括复发性表观遗传异常。幼稚到引发的转变(获能)遵循人胚胎外胚层的转录动力学,这对于幼稚 hPSC 的体细胞分化是必需的。
实验设计

结 果
01
与传统 hPSC 相比,获能 hPSC 在转录上更接近胚胎植入后外胚层
研究者团队首先使用了已发表的两个 hPSC 系(胚胎来源的 HNES1 和化学重置的 cR-H9-EOS)的转录组数据进行分析,同时还整合了以下公开的单细胞转录组分析(scRNA-seq)的数据集:从植入前到原肠胚前期的体外培养人类胚胎、体外培养的猕猴原肠胚和子宫内的人类原肠胚(图1A-B)。他们发现原肠胚形成时胚胎外胚层的转录特性发生显著变化,这与物种(人类与非人类)和胚胎来源(体外与子宫内)无关。然后,他们使用所有表达的基因进行了Pearson相关性分析(图1C),幼稚 hPSC 与植入前外胚层最相似。此外,在获能过程中,hPSC 逐渐变得与植入后阶段相似,并且在获能 10 天后与原肠胚形成前外胚层最相似。在扩增培养期间,获能的 hPSC 增加了与后来原肠胚形成的外胚层的相似性,同时在整体上保持与原肠胚形成前阶段最相似(图 1C)。与获能细胞相比,他们在传统引发的 hPSC 中鉴定出 799 个表达较低的基因和 849 个表达较高的基因。这些基因中只有一小部分与人类胚胎的变化相匹配(分别为 122 和 23 个基因)(图 1D),表明长期培养的常规引发的 hPSC 可能会积累与发育进程无关的转录变化。
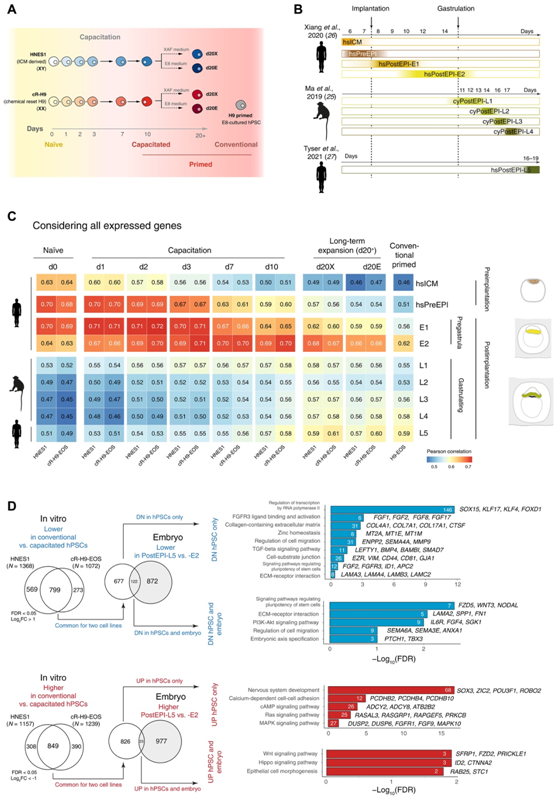
图1. 将多能状态映射到灵长类动物胚胎外胚层进展。
(A) 获能过程中 RNA-seq 的实验方案。(B) 用于比较的胚胎的单细胞 RNA-seq 数据,与发育时间一致。(C) 使用所有表达基因计算的体外获能过程中的 hPSC 与不同发育阶段的胚胎外胚层之间的 Pearson 相关性。(D) 获能 hPSC 和传统 hPSC 之间不同的基因组与胚胎外胚层进展过程中动态表达的基因的比较。
02
获能 hPSC 与传统引发的 hPSC 具有相似的表观遗传景观
为了表征幼稚和引发的多能细胞的表观遗传景观,并确定获能和常规引发的 hPSC 之间潜在的表观遗传差异,他们对幼稚、获能和传统引发的 hPSC 进行了整体染色质分析。使用 ChIP-seq(染色质免疫沉淀,然后测序)分析组蛋白修饰 H3K4me3、H3K4me1、H3K27me3、H3K27ac 和 H3K9me3,使用 ATAC-seq(通过测序分析转座酶可接近染色质)分析染色质可及性,并使用 PBAT 分析 DNA 甲基化(亚硫酸氢盐后接头标记)(图2A)。
使用主成分分析 (PCA) 和层次聚类,他们观察到每个表观遗传修饰将幼稚细胞与获能细胞(d10、d20X和d20E)分开,这强调了幼稚细胞到启动细胞转变期间的表观遗传重塑影响所有修饰,无论它们的激活或抑制作用(图2B)。此外,整合所有数据类型的降维分析显示了从naïve-to-primed(幼稚-引发)状态明显的“表观遗传”和转录转变(图2C)。然而,他们注意到 d10 获能细胞与传统引发的 hPSC 略有分离,突出了它们的表观遗传差异,长期扩增导致细胞与传统引发的细胞具有更相似的表观遗传景观。这种差异在染色质可及性、H3K4me3 和 DNA 甲基化结果中更为明显(图 2B)。组蛋白标记的H3K27ac和H3K4me1与远端调控元件相关,将d10、d20X和d20E的获能细胞聚集在一起,表明增强子在获能过程中发生重塑,并在启动状态建立后保持相对稳定(图2B)。此外,培养条件也影响了表观遗传特征:E8 培养的常规 hPSC 和 E8 扩增的获能 hPSC 在大多数测序分析中形成更紧密的聚类(图 2 B-C)。
然后,他们表征了组蛋白修饰的 ChIP-seq 峰和染色质可及性的 ATAC-seq 的全基因组分布(图 2D),并通过免疫印迹鉴定了修饰组蛋白的整体水平,组蛋白标记总量显示 H3K4me3、H3K4me1 和 H3K27ac 水平大幅增加(图2E)。在获能过程中,H3K27me3 ChIP-seq 峰的数量大幅减少,与 CpG 岛重叠的峰比例增加,表明 H3K27me3 的重新分布(图 2D)。此外,H3K27me3 蛋白水平整体下降,表明 H3K27me3 重新分布以占据引发细胞中的较少区域,并且主要集中在 CpG 岛上。
在从幼稚状态到引发状态的转变过程中,DNA 甲基化整体增加(图2F)。这种增加影响了大多数基因组区域,包括幼稚特异性和引发特异性增强子、包含非 CpG 岛的启动子、基因和基因间区域以及重复序列,但不影响 CpG 岛。
隐马尔可夫模型 (HMM) 分析根据所有样本中组蛋白修饰和可及性的特定组合,将基因组分割为 13 个染色质状态(图 2G)。状态 1 和 2 显示低 DNA 甲基化水平,并分别代表具有活性和非活性启动子特征的 CpG 相关区域。其他染色质状态在获能过程中增加了 DNA 甲基化水平,包括增强子(状态 3 至 5)、内含子(状态 6)、重复区域(状态 7 至 11,包括获得 H3K9me3 或失去 H3K27me3 的区域)和 X 染色体相关区域(状态12,其显示在获能过程中雌性cR-H9细胞中H3K27me3的预期增益,但在常规H9细胞中水平显著降低,并且状态13在常规细胞中K9me3升高)。
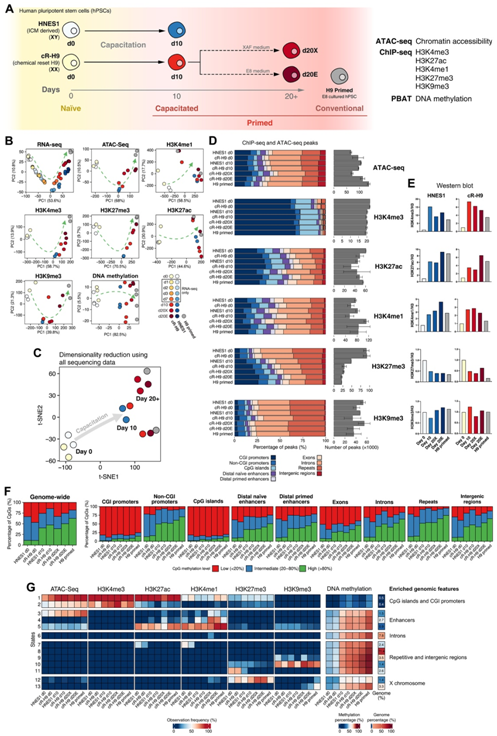
图2. 人类初始 PSC 和引发 PSC 的表观遗传分析。
(A) ATAC-seq、ChIP-seq 和 PBAT(亚硫酸氢盐后接头标记)分析的实验设计图。(B) 对所有条件下 200 个含 CpG 的基因组窗口中前 500 个差异最大的差异表达基因、组蛋白修饰 ChIP-seq 差异峰、ATAC-seq 差异峰和 DNA 甲基化平均值进行主成分分析。(C) t 分布随机邻域嵌入 (t-SNE) 图。(D) ChIP-seq(H3K4me3、H3K27me3、H3K4me1、H3K27me3 和 H3K9me3 标记)和 ATAC-seq 峰与注释基因组区域重叠的百分比以及每个条件的峰总数。(E) 每个组蛋白修饰和免疫印迹标准化结果。(F) 以 CpG 分辨率计算的全基因组 DNA 甲基化百分比分布以及以 CpG 分辨率计算的注释基因组区域的 DNA 甲基化百分比分布。(G) ChromHMM 13-状态全基因组模型使用 ATAC-seq 和组蛋白修饰的 ChIP-seq 对齐读数构建。
03
PRC2 抑制不会干扰多能性
H3K27me3的整体减少是获能过程中最显著的变化之一。在H3K27me3写入者(Writer)(PRC2复合体)和擦除者(Eraser)(KDM6A、KDM6B和KDM7A)中,只有KDM6A的转录增加与H3K27me3的减少相关(图3A)。
先前的研究表明,EZH1/2 活性的急性抑制不会干扰幼稚或引发的多能性。此外,EZH1/2抑制促进幼稚人造血干细胞向胚胎外谱系分化,而EZH2缺失导致常规引物的人造血干细胞发育程序的抑制。
接下来,他们使用 EZH1/2 抑制剂 (UNC1999) 处理初始 HNES1、获能 HNES1 和 cR-H9-EOS 以及常规引发的 H9-EOS。用不同浓度(1 μM、1.75 μM和2.5 μM)的UNC1999抑制剂处理4天或更长时间后,H3K27me3整体减少(图3B)。这种抑制也没有引起幼稚或引物hPSC中多能性标记物表达的实质性变化。此外,在UNC1999抑制剂的存在下延长传代14至22天,细胞形态没有改变(图3C),也没有影响多能因子的表达。他们在幼稚HNES1中敲除H3K27me3,并在UNC1999存在的情况下进行获能(图3D),H3K27me3在整个获能过程中仍然显著减少(图3E)。
主要幼稚(KLF4、KLF5、DNMT3L、TFCP2L1、DPPA3和DPPA5)和引发(HES1、MYC、SOX11、ID3、CDH2和TCF7L1)多能性标记物的动态在PRC2抑制的获能过程中没有显著改变(图3F)。因此, H3K27me3 耗尽既不促进也不阻止多能状态转换。
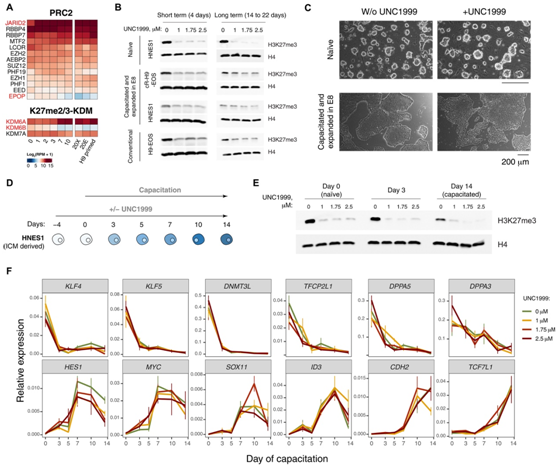
图3. PRC2 抑制不会干扰体外的多能性区室。
(A) 获能过程中 H3K27me3 写入和擦除复合体成员的表达。(B) Western blot 显示,用 UNC1999 抑制剂抑制 PRC2 活性可降低 hPSC 中 H3K27me3 的整体水平。(C) 使用 PRC2 抑制剂 UNC1999 延长培养后,初始和引发的 hPSC 的形态。(D) 测试获能过程中 PRC2 抑制效果的实验设计。(E) Western blot显示,在 UNC1999 存在的情况下,hPSC 获能期间 H3K27me3 水平降低。(F) 通过实时荧光定量实时 PCR (qRT-PCR) 显示在 PRC2 抑制剂 UNC1999 存在的情况下获能过程中的标记物表达。
04
多能状态转变过程中表观遗传动力学的基因组热点
他们使用 Bioconductor 软件进行了多组学因子分析,使用每个表观遗传修饰变化最大的区域,模型提取了一个按多能性状态分隔样本的因子,即因子 1。该因子产生的样本聚类主要是由 DNA 甲基化增加和 H3K27me3 减少驱动的,证实这些是从幼稚到引发的过渡期间最显著的表观遗传变化,染色质可及性的变化和 H3K4me3 也发挥着重要作用(图 4A)。
然后,他们探索了对因子1贡献最高的表观遗传区域的基因组分布,并对功能基因组特征进行了富集分析(图4B-C)。他们观察到这些区域显著重叠重复元件、CpG岛和多能性相关转录因子结合位点(图4C)。此外,与幼稚hPSC相比,在引发中H3K4me1水平升高的区域与远端CpG岛(也称为“孤儿”CpG岛)有显著重叠(图4C)。
对重复元件进行更详细的分析表明,某些反转录转座子组在两种多能性状态之间具有差异的表观遗传标记(图4D-E)。在幼稚hPSC中,Alu元件显示出更高水平的平稳增强子相关标记H3K4me1和H3K27me3,而SVA元件高度可及,并与活性启动子相关标记H3K4me3和H3K27ac重叠(图4F)。
他们的分析还强调,在获能过程中,一部分调控区域变得更容易接近,并与假定的远端增强子重叠(图4C)。这些区域富含NANOG、OCT4 (POU5F1)和SOX2(典型多能转录因子)的特异结合位点。在naïve-to-primed转换过程中,这些区域失去了H3K27me3和H3K9me3标记,并保持低DNA甲基化水平。与此同时,H3K27ac和H3K4me1修饰改变了它们的特征:从幼稚状态下位于可及区域中心的最高值变为引发状态下位于峰值区域的侧翼(图4G)。基序分析显示,POU5F1-SOX2 异二聚体基序、POU5F1 和 SOX 家族的各个基序以及 TEAD4 推定结合位点在引发特异性可及区域中富集。幼稚多能性因子转录因子 AP-2 γ (TFAP2C) 和胚胎外命运的主要调节因子 TFAP2A 和 TFAP2B 的结合基序在幼稚特异性可及区域中富集 (图 4G)。
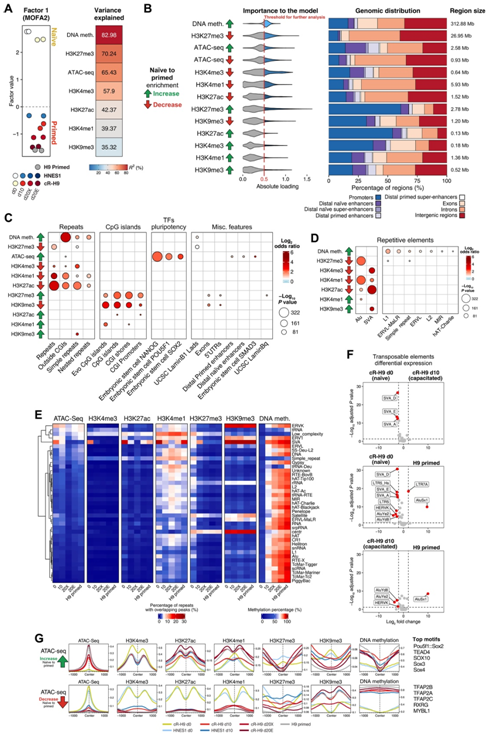
图4. 跨多能状态的表观遗传富集动态建模。
(A)组蛋白修饰的ChIP-seq、ATAC-seq差异峰中提取的因子1的MOFA2因子值,以及基于不同条件下甲基化百分比的顶部200个含cpg的可变区域。(B) 按模型加载权重排序的热门特征(表示为“对模型的重要性”)。(C)在注释的基因组区域上富集因子 1 中的顶部特征。(D) 因子 1 中的顶级特征比重复元素富集。(E) DNA 甲基化百分比以及 ATAC-seq 和 ChIP-seq 峰与重复元件重叠的百分比。(F)“cR-H9 d0”和“cR-H9 d10”细胞、“cR-H9 d10”和“H9 primed”细胞以及“cR-H9 d10”和“H9 primed”之间转座元件类别的差异表达。(G) 以 ATAC-seq 顶部峰为中心的区域的表观遗传图谱。
05
基因表达与启动子表观遗传修饰动态之间的整体关联
为了探索表观遗传修饰如何与基因表达相关,他们分析了 hPSC 中差异表达基因启动子的表观遗传动态(图 5A)。首先根据 RNA-seq 数据集中所有样本之间的差异表达基因定义了 8 个聚类。该聚类分析将基因分为在获能过程中具有不同动态的两个主要组:下调基因(聚类 1 和 2)和上调基因(聚类 3 至 8)。
只有一小部分在获能期间上调的基因在 d20+(XAF 或 E8)和传统引发的 H9-EOS 细胞(聚类 5,85 个基因)中的延长培养期间保持其表达。大部分基因在这些条件之间具有高度动态的表达(聚类3至4和6至8,1004个基因)。在获能过程中表达增加,随后在扩增培养中下调的基因(聚类3,4269个基因)富集的基因涉及迁移、黏附和基质生产、上皮组织和泛素连接酶活性(图5B)。
然后他们分析了差异表达基因聚类启动子中表观遗传修饰的动态(图5C)。下调基因的启动子显示活跃表达相关标记 H3K4me3 和 H3K27ac 水平降低,而抑制标记 H3K27me3(聚类 1)或 H3K9me3 和 DNA 甲基化(聚类2)水平增加。获能过程中基因表达动态上调反映在染色质可及性、H3K4me3和H3K27ac的增加以及启动子中H3K27me3和H3K9me3的减少,而这些区域的DNA甲基化仍然相对较低。
差异基因表达的建模主要与幼稚 hPSC 中的启动子 H3K27ac 和 H3K27me3 水平相关,而 H3K4me3 在引发的细胞中具有最高的相对重要性。其余的表观遗传修饰与这些状态下的模型基因表达的相关性相对较低(图5D)。他们还发现,幼稚表观遗传景观可以更好地模拟引发基因表达,而引发表观遗传景观可以更好地模拟幼稚基因表达(图 5E)。
他们观察到H3K27ac和H3K4me3峰大多共同出现在蛋白质编码基因的启动子上,很少单独出现(图5F-H),其中一部分基因在获能过程中丢失了H3K27ac标记。
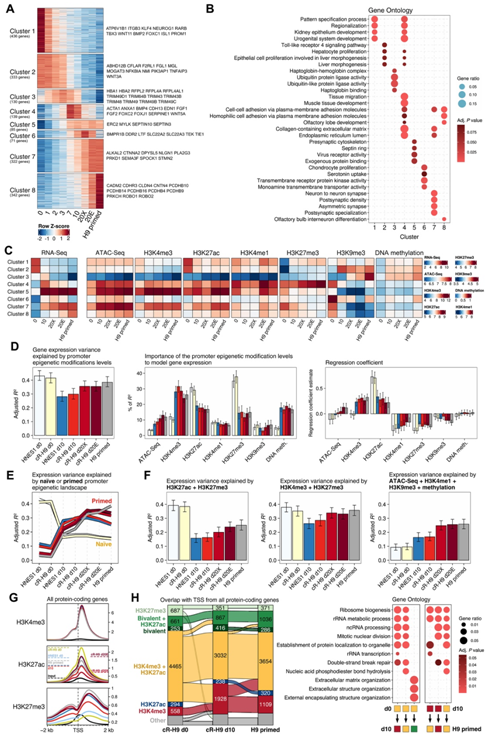
图5. 表观遗传状态与基因表达之间的关联。
(A) RNA-seq 基因聚类根据所有条件和表达模式之间的显著表达差异进行定义。(B) GO分析。(C) RNA-seq 聚类基因的平均表达及其平均启动子染色质可及性和表观遗传修饰标准化计数。(D) 多元线性回归,使用基因表达作为目标变量,启动子表观遗传修饰水平作为预测变量。(E)启动子表观遗传修饰水平。(F)基于启动子H3K27ac和H3K27me3水平的多元线性回归建模基因表达;启动子H3K4me3和H3K27me3水平;启动子ATAC-seq、H3K4me3、H3K9me3和甲基化水平。( G ) 所有蛋白质编码基因中与 TSS ± 2 kb 重叠的 H3K4me3、H3K27ac 和 H3K27me3 组蛋白修饰的概况。(H) 蛋白质编码基因的数量及其 TSS 根据与 H9 细胞中以下 ChIP-seq 峰组合的重叠进行分类。
06
通过一轮重置和获能逆转X染色体侵蚀
X 染色体失活由长 ncRNA XIST和XACT以及组蛋白修饰调节:活性 X 染色体在有或没有XIST的情况下被XACT结合,而失活的 X 染色体被XIST包被并表现出高 H3K27me3 水平。在传统引发的 H9-EOS 雌性细胞中,映射到 X 染色体的 H3K27me3 峰的百分比较低,与雄性 HNES1 细胞相当。同时,与其余细胞相比,传统引发的 H9-EOS 中映射到 X 染色体的 H3K9me3 峰的百分比更高(图 6A -C)。这些差异仅在X染色体中观察到,而在常染色体中未观察到,进一步证实了X染色体侵蚀。出乎意料的是,在对常规引发的H9-EOS进行重置和获能后,X染色体上的H3K27me3的峰的百分比增加,而H3K9me3的峰的百分比降低,这表明破坏的X染色体在获能过程中恢复到一个与失活相关的表观遗传景观。
对RNA-seq数据中XIST水平的分析进一步支持了这一假设:与男性HNES1相比,XIST在女性常规引发的H9-EOS细胞中表达较低,但在一轮重置后上调,并在获能期间和获能后保持相同的表达水平(图6D)。除d20X细胞XACT表达降低外,XACT表达在复位和获能过程中没有显著变化。
接下来,他们检测了X染色体单个区域中H3K27me3和H3K9me3标记的动态变化。为此,将X染色体分成10 kb窗口,并根据每种条件下的H3K27me3和H3K9me3水平进行分类,并跟踪其状态(图6E)。和这些组蛋白修饰峰的数量及其密度相一致(图6A-B),与幼稚和获能细胞相比,传统H9-EOS细胞只有少量的H3K27me3-标记的区域,H3K27me3/H3K9me3区域数量减少,而H3K9me3-标记的区域比例较高。此外,在获能细胞中,由H3K27me3/H3K9me3组合标记的区域,以及仅在常规细胞中由H3K9me3标记的区域,富集了重复序列和逆转录转座子(图6F)。
最后,他们通过免疫荧光原位杂交验证了H3K27me3、XIST和XACT的水平和分布(图6G-H),并通过qPCR实验验证了XIST的表达(图6I)。这些结果表明,基于获得能力和常规培养的hPSC之间的表观遗传学差异和XIST/XACT水平,一轮重设置和获能恢复了X染色体的失活,逆转了培养诱导的X染色体侵蚀。
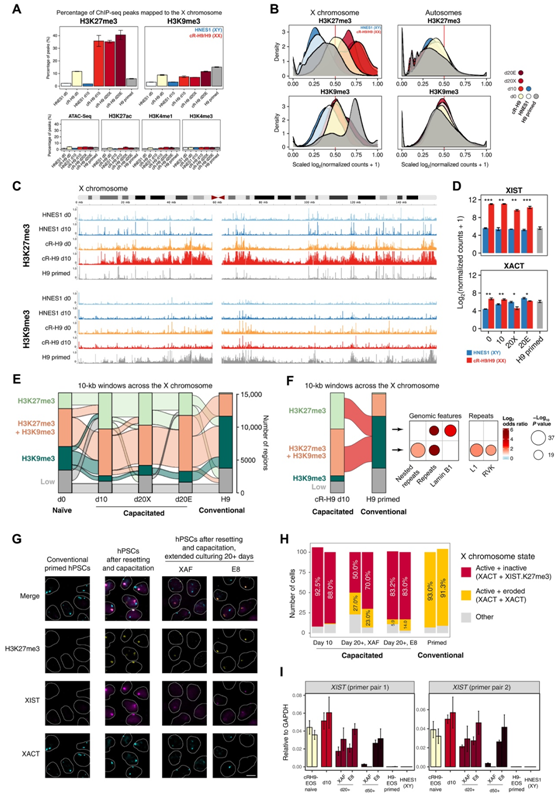
图6. 常规hPSC的一轮重设和获能挽救了X染色体失活的环境。
(A) 映射到 X 染色体的所有 ChIP-seq 和 ATAC-seq 峰的百分比。(B) X 染色体和常染色体上 10 kb 窗口中 H3K27me3 和 H3K9me3 的缩放对数转换标准化计数的分布。(C) H3K27me3 和 H3K9me3 读取幼稚细胞、获能第 10 天细胞和传统 H9 细胞的 X 染色体计数概况。(D) 长ncRNA XIST和XACT的基因表达水平。(E)基于H3K27me3和H3K9me3缩放log2FC归一化计数阈值为0.5的X染色体10-kb窗口数流程图。流程图显示了 cR-H9 第 10 天(获能)和 H9 引发细胞(常规)中 X 染色体中 10-kb 窗口的数量。( G ) H3K27me3、 XIST和XACT的免疫 FISH 。(H) 免疫 FISH 的定量。
+ + + + + + + + + + +
结 论
本项研究证明了CpG 岛、基因调控元件、和逆转录转座子是获能过程中表观遗传动态的关键因素,特定表观遗传修饰在幼稚 hPSC 和引发 hPSC 之间的基因表达控制中可能发挥不同的作用。出乎意料的是,PRC2 活性似乎对于获能来说并不重要。本项研究发现获能的 hPSC 具有与传统 hPSC 类似的表观遗传状态。然而,值得注意的是,在传统雌性 hPSC 中经常观察到的 X 染色体侵蚀可以通过重置和随后的获能来逆转。
+ + + + +



 English
English


