文献解读|Science(56.9):人类癌症中肿瘤浸润 B 细胞的蓝图
✦ +
+
论文ID
原名:A blueprint for tumor-infiltrating B cells across human cancers
译名:人类癌症中肿瘤浸润 B 细胞的蓝图
期刊:Science
影响因子:56.9
发表时间:2024.05.03
DOI号:10.1126/science.adj4857
背 景
肿瘤浸润 B 细胞已成为癌症免疫的重要参与者,并可作为免疫治疗反应的预测因子。这些 B 细胞显示出多种功能,主要是通过分化为浆细胞以产生抗体的能力,但在不同的癌症类型中存在时空差异。
实验设计
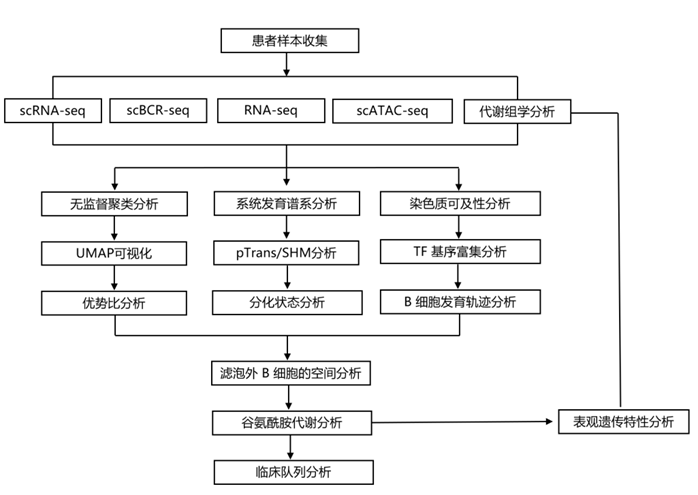
结 果
01
跨人类癌症的单个 B 细胞转录组蓝图
不同人类癌症类型的 B 细胞浸润差异很大。为了了解 B 细胞的整体浸润模式,研究队根据六种现有反卷积算法的共识,评估了癌症基因组图谱 (TCGA) 泛癌症数据集中的 B 细胞浸润丰度,选择了肿瘤内 B 细胞评分高和中等的癌症类型进行进一步采样。从 15 种人类癌症类型的 66 名患者的 153 个样本中分选CD19+ B 细胞,涵盖匹配的肿瘤、淋巴结转移 (LN_Met)、邻近正常组织和外周血,然后进行配对单细胞转录组分析(scRNA-seq) 和单细胞 B 细胞受体测序 (scBCR-seq)(图 1A)。
无监督聚类分析确定了 15 个不同的 B 细胞亚群,所有这些亚群在各种癌症类型中都可重复观察到,并表现出不同的组织和癌症类型差异(图 1B)。其中,鉴定了代表不同B细胞成熟阶段的典型B细胞亚群,包括一种幼稚B细胞(TCL1A、FCER2和IGHD)、三种活化B细胞(ACB)(CD69和CD83)、一种记忆 B 细胞 (Bm)(CRIP2和ITGB1)、三个 生发中心 (GC) 细胞 [ LMO2 +亮区 (LZ)、CXCR4 +暗区 (DZ) 和MKI67 +循环] 和两个 抗体分泌细胞 [ASC,包括浆母细胞 (PB) 和浆细胞 (PC)](TXNDC5+ PB 和MZB1+ PC)(图1C)。
接下来,他们确定了之前基本上未表征的四个亚群。第一个是干扰素刺激的基因阳性幼稚 B 细胞亚群 (B_02),其高表达IFIT3、IFI44L和ISG15,与损伤相关,并在粘膜愈合过程中扩增。第二个亚群是应激 B 细胞 (B_03),主要存在于热休克蛋白高表达的肿瘤中。第三个亚群是GC前B细胞(B_10),与邻近的正常组织和血液相比,其在LN_Met和肿瘤中高度富集,表达PSME2、NME1和ENO1。 GC前B细胞分别表现出与初始B细胞、GC B细胞和PB的转录相似性,表明它们的过渡阶段(图1C)。他们确定的第四个亚群是以前未知的 非典型记忆 (AtM) B 细胞亚群 (B_09),表达DUSP4、ITGAX ( CD11c )、FCRL5、ZEB2和FGR,该亚群广泛存在于肿瘤微环境(TME)中。
对组织分布以及转录和谱特征的综合分析强调了来自不同组织来源的潜在肿瘤反应性 B 细胞。肿瘤浸润 B 细胞 (TIB)比来自非肿瘤组织的B细胞含有更多的IGHG和IGHA,而血液中的B细胞富含IGHD和IGHM,这表明TIB经历过抗原并经历了类别转换重组 (CSR)(图1D)。通过优势比(OR)分析,HSP+ B细胞、EGR1+ACB、PB在肿瘤中表现出强烈的倾向性;MT1X+ B细胞、循环GC B细胞、前GC B细胞、GCLZ、GCDZ和IFIT3+ B细胞在LN_Met中显著富集;TCL1A+幼稚B细胞和DUSP4+ AtM B细胞在血液中含量最高;MZB1+ PC在癌旁正常组织中占优势(图1E)。同样,TIB 的 IGH 突变明显多于其他组织,GC B 细胞和两个 ASC 亚群表现出肿瘤特异性克隆扩增,表明它们具有强抗原驱动抗体亲和力的肿瘤反应性(图 1F)。
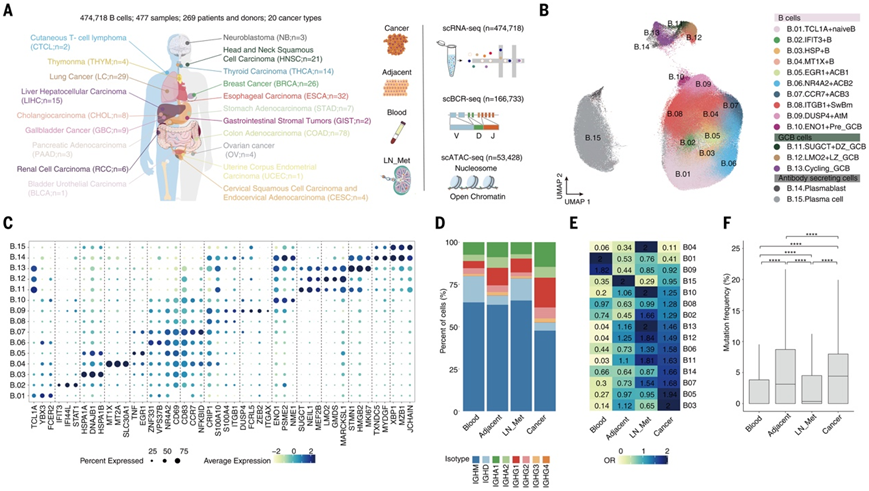
图1.不同人类癌症 B 细胞的单细胞分析。
(A) 泛癌单细胞转录组、BCR 库和 B 细胞染色质可及性的示意图。(B) 15 个 B 细胞亚群的均匀流形近似和投影 (UMAP) 可视化。 (C) B 细胞亚群中标记基因表达的点图。颜色代表标记基因的最大标准化平均表达,大小代表表达这些基因的细胞的百分比。 (D) 堆积条形图显示总 B 细胞内相应组织中的同种型分布。 (E) 热图显示每个组织中 B 细胞子集分布的优势比 (OR)。(F) 不同组织中总 B 细胞的免疫球蛋白 H (IgH) 链超突变频率的箱线图。
02
肿瘤浸润抗体分泌细胞的异质性
ASC 是终末分化的 B 细胞,通过产生抗体来执行效应功能。ASC 区室的亚聚类(除去TXNDC5+ PB)揭示了 10 个具有特定基因特征和组织分布的不同 PC 亚聚类(图 2A-B)。在这些基因中,PC04.HSPA1A、PC05.NEAT1 和 PC08.IFI6 在肿瘤中占据主导地位,PC09.RGS13 和 PC10.SPINK2 在邻近的正常组织中富集,而 PC02.RGS13 在淋巴结转移中占据优势。与此同时,PC01.NME2 和 PC07.CD83 在淋巴结转移和血液中表现出相当的富集,PC03.DUSP5 在淋巴结转移和肿瘤中分布均匀,PC06.SLC3A2 在肿瘤和邻近的正常组织中分布相似(图2C)。这些发现可能有助于解释PC在患者预后中的争议作用,这可能归因于不同的PC亚群和癌症类型的变异性。综上所述,这些数据表明癌症来源对ASC的频率有相当大的影响,也意味着ASC的不同B细胞来源。
尽管源自生发中心 (GC) 或滤泡外 (EF) 反应的 B 细胞通路通常在自身免疫性疾病和慢性感染中观察到,但肿瘤生态系统对不同 B 细胞进化轨迹的潜在影响尚未得到充分探索。因此,他们使用基因表达推断了 ASC 分化的轨迹,并观察到 ASC 主要来源于 GC B 细胞,这与之前的研究结果一致。然而,鉴于 ASC 亚群通过无监督聚类在高表达 PC 标志物的基础上显著区别于其他亚群,传统的基于转录组的轨迹分析可能无法准确反映真实的分化状态。为了解决这一问题,他们使用 BCR 克隆分析策略和无监督聚类,并结合 STARTRAC [通过 RNA-seq 和 TCR(T 细胞受体)跟踪进行的单 T 细胞分析] 的成对转换指数 (pTrans)、Jaccard 指数和体细胞高频突变 (SHM) 来识别 ASC 的祖细胞,因为 BCR 库是追踪 ASC 系谱的可靠分子标签。他们发现 AtM 和 Bm 细胞是与 ASC 克隆共有的两类主要 B 细胞,这表明 ASC 可能起源于TME中的传统 GC 和替代 EF 通路(图2D)。为了验证这一点,他们分选了肝细胞癌(LIHC)患者肿瘤浸润的幼稚 B、Bm和AtM B细胞,并通过体外B细胞分化方法进行刺激。事实上,AtM B细胞比幼稚 B细胞更能有效地分化为ASC,但比Bm细胞分化更弱(图2E-F)。除AtM和Bm细胞外,他们还发现了与PB共有BCR的前GC、循环GC和GCLZ B细胞,以及与PC共有BCR的IFIT3+ B、HSP+ B和EGR1+ ACB,并通过ASC与这些亚群共有克隆的系统发育谱系树进行了验证(图2G)。
接下来,他们评估了这两条通路的普遍程度,并将与经典 Bm 共有BCR 的 ASC(66% 的 GC 来源 ASC)、循环 GC(13%)、GCLZ(12%)和 GCDZ(7%)归类为 GC 来源 ASC,而与其他 B 细胞亚群重叠的 ASC,包括 AtM(47% 的 EF 来源 ASC)、ACB(29%)、IFIT3+ B(8%)、HSP+ B(6%)、pre-GC(5%)和 MT1X+ B(3%),归类为细胞水平的 EF 来源 ASC。随后,他们使用标签转移,根据已经分类的 ASC 的基因表达谱获取更多的 EF 和 GC 来源 ASC,并验证标签转移的准确性。通过确定的 EF 来源和 GC 来源 ASC,他们进一步计算了 EF 指数,并结合 SHM 将患者分为两组:EF 优势或 GC 优势。通过 pTrans 分数进一步验证和优化了这种分类。尽管存在明显的患者和癌症类型偏好,但在个体患者和癌症中都可以观察到这两条通路,这表明 GC 和 EF 反应都是 ASC 分化的普遍通路(图 2H)。结肠癌 (COAD) 和甲状腺癌 (THCA) 更偏好 GCDZ、GCLZ 和循环 GC B 细胞,而胆囊癌 (GBC)、胃癌 (STAD)、肺癌 (LC) 和胸腺瘤 (THYM) 则更偏向于富集Bm 细胞和GC 通路。相反,富含 AtM B 细胞的 EF 通路在肝细胞癌 (LIHC)、胰腺导管腺癌 (PAAD)、宫颈鳞状细胞癌和宫颈腺癌 (CESC) 以及头颈部鳞状细胞癌 (HNSC) 中富集,而 pre-GC、ACB 以及富含 IFIT3+ B 细胞的 EF 通路则分别在肾细胞癌 (RCC)、膀胱尿路上皮癌 (BLCA) 和胃肠道间质瘤 (GIST) 中大量存在(图2H)。
与以往在自身免疫性疾病中的研究结果一致,肿瘤中EF来源的ASC的SHM显著低于GC来源的ASC(图2I)。同型分析显示,EF来源的ASC具有较高的干扰素诱导的免疫球蛋白G (IgG)同型和相对于肿瘤中IGHG1的CSR,并且更高的IGHM富集,在邻近正常组织和血液中未发生CSR(图2J)。相比之下,GC来源的ASC在肿瘤、癌旁正常组织和血液中的扩增和CSR显著高于IGHA1和IGHA2,这与肿瘤抗原特异性识别和抗肿瘤免疫有关(图2K)。这些差异可能源于EF来源的ASC和GC来源的ASC之间的内在差异,EF来源的ASC高表达IRF8、CD83和HLA-DR,表现出更早的免疫应答表型,并富集了缺氧和炎症反应通路。为了比较EF和GC来源的ASC的早期和晚期分化阶段,他们使用三种方法推断分化状态,包括cytoTRACE, scTour和Monocle3,结果显示,与GC来源的ASC相比,EF来源的ASC处于早期分化阶段,表明EF反应早,GC反应晚(图2L)。这些数据表明,不同的癌症生态系统具有了两条进化路径(EF和GC),并揭示了EF和GC衍生的ASC之间BCR库和转录特征的差异,突出了它们在抗肿瘤反应中的独特作用(图2M)。

图2. 人类癌症中浆细胞的两种发育通路。
(A) 10 个 PC 亚群的 UMAP 可视化。 (B) 已识别的 PC 亚群的标记基因表达的点图。 (C) 热图显示每个组织中 PC 子集分布的 OR。 OR值代表相应组织中的偏好分布。 (D) 成对转移指数 (pTrans) 显示非 ASC 和 ASC 之间的 BCR 重叠。(E-F)通过 FACS 检测CD19 + B 细胞中 ASC 的代表性流动图和频率。 (G)(上)ASC 细胞和 AtM B 细胞之间以及(下)ASC 和 Bm 或 GC B 细胞之间共有克隆型的系统发育谱系树。(H) 热图显示根据不同癌症类型的 ASC 和其他 B 细胞亚群之间的 pTrans。(I) 箱线图显示不同组织中 EF 和 GC 衍生的 ASC 的体细胞超突变 (SHM) 频率。(J) 堆积柱形图显示不同组织中 EF 和 GC 衍生的 ASC 中 IGH 同种型的频率。 (K) 癌症中 EF 衍生(上)和 GC 衍生(下)ASC 的 CSR 频率。(L) UMAP 图显示 EF 和 GC 衍生的 ASC 的识别(左上)、CytoTRACE 的发育顺序(右上)、scTour 推断的分化状态(左下)以及 Monocle3 推断的分化状态(右下) 。 (M) 示意图显示 EF 与 GC 反应的分化路径。
03
调控元件通过表观遗传学许可卵泡外和生发中心的平衡
他们采用配对的scRNA-seq 和单细胞 ATAC 测序 (scATAC-seq) 来表征 TIB的表观基因组学,并为来自五种癌症类型的九位患者的 53428 个 TIB绘制了染色质可及性图谱。这些癌症类型包括以 GC 通路为主导的癌症(结肠癌 COAD、甲状腺癌 THCA、肺癌 LC 和胃癌 STAD)以及以 EF 通路为主导的癌症(肝细胞癌 LIHC)。每个细胞的中位数独特比对片段数量为 11853 个,且 ATAC-seq 峰中 Tn5 插入比例约为 67.87%(图3A)。通过整合scATAC-seq和scRNA-seq数据,他们观察到8个类似的B细胞亚群,包括幼稚、两个ACB、Bm、AtM、GC(DZ和LZ)和PC亚群(图3A)。因此,scRNA-seq和scATAC-seq中注释的亚群身份和亚群特异性标志物之间具有很强的一致性(图3B)。B细胞亚群的特征基因如TCL1A、RGS13、ITGAX和XBP1的开放染色质可及性进一步证实了它们的细胞身份(图3C)。为了确定参与改变不同 B 细胞亚群染色质可接近性的转录因子 (TF),他们识别出了染色质可及性与其基因表达显著正相关的 TF。这样的分析生成了完整的富集 TF 谱,包括已知的 B 细胞谱系 TF,如 PAX5、EBF1 和 SPIB。通过结合 TF 的印迹和特征,他们在 B 细胞亚群中识别出了共有和独特的调控模式(图3D)。例如,调控 TF 活性在相似的细胞状态之间呈现出共有的模式,如在幼稚B 细胞、ACB 和 Bm 中活跃的(即 BCL11A、ELF2、SPIB 和 STAT6)或在 GCDZ 和 GCLZ B 细胞中活跃的(即 CTCFL、EBF1、HMGA1 和 POU2F1)(图 3D)。相反,一系列 TF 在特定的 B 细胞亚群中特异性富集(如 ETS1 在幼稚B 细胞中,TBX21 和 FOSL2 在 AtM 中,POU2F1、MEF2B 和 BCL6 在 GC B 细胞中,以及 IRF2/3/4/5/6/7/8、PRDM1 和 ZNF652 在浆细胞中)(图3D-E)。与 GC 为主的癌症中表现出较高RUNX1-3偏差评分的 PC 相比,EF 为主的癌症中的 PC 显示出调节干扰素-β (IFN-β) 和炎症 TME 快速诱导的 TF 的高活性,包括IRF1/3 /4/5/8和STAT2(图3F)。
总的来说,这些结果强调了一个动态表观遗传调控网络,该网络在癌症生态系统内微调 B 细胞分化和选择中发挥作用,并强调了谱系 TF 在管理 EF 和 GC 通路之间的平衡方面的基本作用(图 3G)。
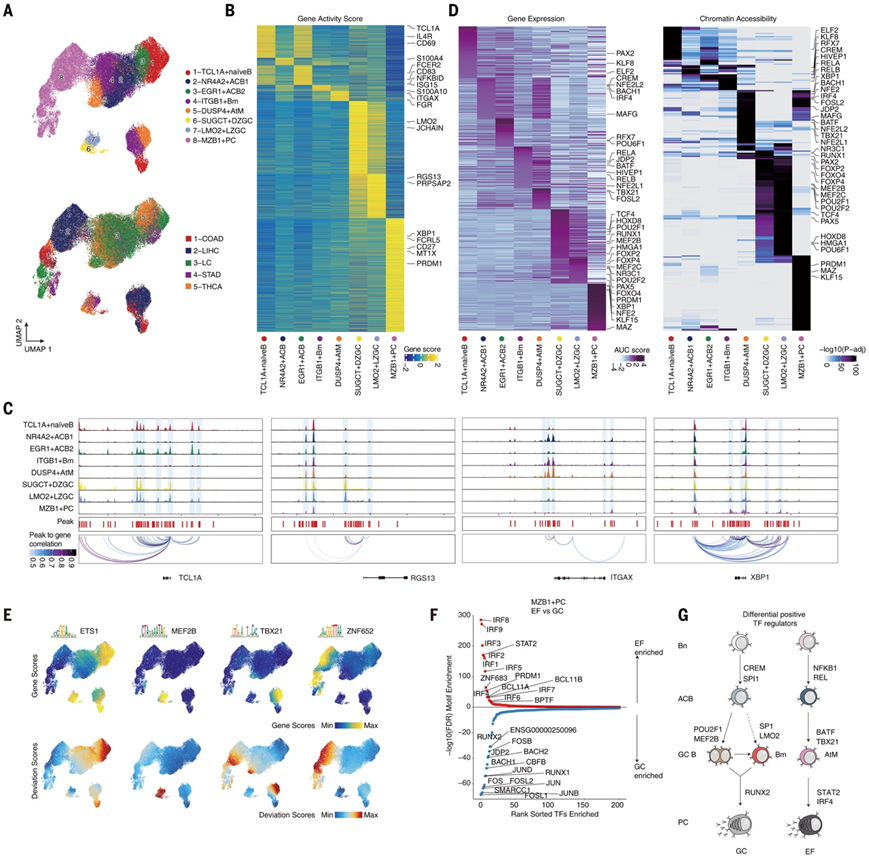
图3. 人类癌症中 EF 和 GC 反应的单细胞表观基因组图谱。
(A) scATAC-seq 注释的 B 细胞亚群(上)和癌症类型(下)的 UMAP 可视化。 (B) 由来自每个子集的所有标记基因的 scATAC-seq 确定的基因活性评分热图。(C) B 细胞亚群中指定特征基因位点的基因组可及性轨迹。 (D) SCENIC 的 TF 活性热图(左)和注释 B 细胞亚群的特定开放染色质区域(右)的 TF 基序富集。(E) B 细胞亚群特定 TF 的 RNA 表达(上)和基序偏差评分(下)的 UMAP 可视化。(F)计算了EF 显性和 GC 显性癌症衍生的MZB1+ PC 之间差异表达的 TF 偏差评分。在(红色)EF 主导型与(蓝色)GC 主导型癌症衍生的MZB1+ PC 内,按P调整值对 TF 偏差评分进行排名。 (G) 在(左)GC 为主的癌症和(右)EF 为主的癌症中驱动 B 细胞从初始 B 细胞分化为 PC 的差异推定调节 TF 的示意图。
04
滤泡外 AtM B 细胞具有衰竭表型
认识到 AtM B 细胞在TME中作为 EF 通路主要前体的关键作用,他们全面研究了它们的表型和功能。与非肿瘤环境中先前定义的标志物相比,肿瘤浸润的 AtM B 细胞与 Bm 细胞(GC 来源 ASC 的成熟前体)相比,表现出 CD27、CD38、IRF8 和 SDC1 表达降低,同时 PRDM1、IRF4 和 XBP1 表达增加。众所周知,XBP1 能抑制 B 细胞增殖并促进向 ASC 分化,进一步支持了 AtM 向 ASC 分化的潜力(图 4A)。AtM B 细胞表现出耗竭和驻留记忆表型,有别于 Bm 的效应表型。简而言之,AtM B 细胞上调了免疫检查点 (PDCD1、CD274、CTLA4、ENTPD1、LAG3 和 HAVCR2)、与耗竭相关的转录因子 (TOX、TOX2、ZBED2、BATF、RBPJ 和 VDR) 以及涉及免疫球蛋白和免疫复合物结合的 Fc 受体家族 (FCRL2/3/4/5 和 CD32A/B)(图 4A)。
其中,FCRL4 与组织驻留记忆细胞有关,能够抑制 BCR 信号传导。CD32B 作为低亲和力的抑制性受体,能够抑制抗体依赖的细胞毒性 (ADCC)、抗体依赖的细胞吞噬 (ADCP) 和 B 细胞激活。与 TCR 信号过度活化的耗竭 T 细胞类似,AtM B 细胞也高度表达 BCR 信号传导 (SYK)、免疫调节和激活 (TLR7/9、CD80、CD86 和 CD72) 相关的基因(图 4B)。这些数据共同证明了滤泡外 AtM B 细胞的独特免疫表型和分子特征。
为了进一步探究滤泡外 AtM B 细胞的免疫库,同种型分析表明,肿瘤浸润的 AtM B 细胞较少发生转换,与Bm细胞相比,AtM B有较高水平的 IGHD 和 IGHM (P < 0.01),而 IGHA1、IGHA2 和 IGHG2 在 Bm 细胞中占优势 (P < 0.01)。此外,从 LIHC 患者体内收集的肿瘤 AtM B 细胞,在经过 11 天的体外激活和分化后,其上清液中 IgG、IgA 和 IgM 含量低于 Bm 细胞。进一步通过抗原微阵列测试这些上清抗体的反应性,结果显示,源自 AtM B 细胞的 ASC 产生了较高水平的自身抗体,而源自 Bm 细胞的 ASC 产生了较高水平的肿瘤相关抗原反应性抗体(图 4C),包括 IgG、IgA 和 IgM 三种类型。
他们重构了 AtM 和 GC B 细胞的最大扩增克隆的系谱树,显示克隆谱系主要来源于 AtM 或 GC B 细胞。伪时轨迹分析证实,AtM 和 GC B 细胞完全分离在两个独立的分支上,初始 B 细胞位于开端,AtM(路径 1)和循环 GC B 细胞(路径 2)位于末端分支(图 4D)。沿着轨迹,高亲和力特征分数和 CD24、CD38、SELL 在路径 2 中逐渐上调,而低亲和力和与耗竭相关的特征分数相关基因(即 PDCD1、ENTPD1 和 HAVCR2)相应在路径 1 中上调,重现了 B 细胞从初始状态经过活化状态最终到达 AtM 状态的发育过程(图4E)。
他们进一步确定了 AtM 细胞的动态基因表达、染色质活性和足迹。与 Bm 和 GC B 细胞相比,AtM B 细胞表现出与 CSR(类交换重组)和耗竭表型相关的TF高活性,并增强了同种型特异性 IgG+ Bm 的免疫功能,包括 TBX21 和 BATF,表明存在独特的调控机制(图 3D)。与 CSR 相关的特征分数和基因(APEX1、APEX2、XRCC5、XRCC6、POLD2 和 AICDA)沿轨迹逐步上调,这表明 AtM B 细胞可能在未经历 GC 反应的情况下进行 CSR(图4E)。总的来说,这些发现表明AtM和GC B细胞经历了不同的发育过程,导致EF和GC衍生的ASC。
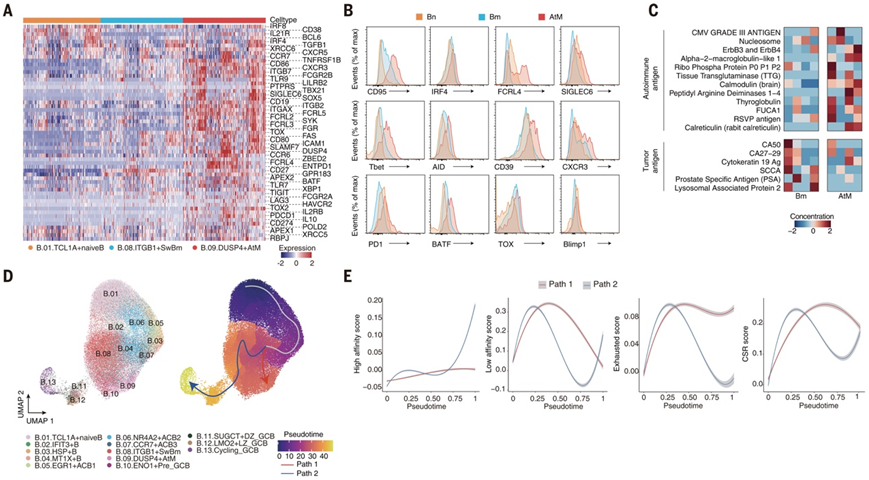
图4. 人类癌症中 AtM B 细胞的不依赖于 GC 的发育。
(A) 热图显示了幼稚、Bm 和 AtM B 细胞中代表性基因的相对表达。(B) 通过 FACS 检测来自 LIHC 患者的肿瘤浸润幼稚 B 细胞、Bm 和 AtM B 细胞的代表性标志物。 (C) 热图显示了体外刺激 11 天后,在来自 LIHC 患者的肿瘤浸润的幼稚、Bm 和 AtM B 细胞的上清液中检测到自身抗原和肿瘤相关抗原的特异性 IgA。 (D)(左)Monocle3 轨迹分析描绘了非 ASC 的发育轨迹。(E) 二维图显示沿着推断的伪时间分析。
05
滤泡外 B 细胞在空间上驻留在未成熟的三级淋巴结构中
三级淋巴结构(TLS)通常由不同大小和细胞组成的 B 细胞形成。然而,TLS 和 TIB(特别是 AtM B 细胞)之间的空间结构和关系仍不清楚。鉴于 TLS 成熟度的临床意义(成熟的 TLS:含有滤泡树突状细胞(fDC)的 III 期和 IV 期 GC 样结构;未成熟的 TLS:I 期和 II 期淋巴细胞聚集体)以及 TME 中 GC 样 TLS 的稀有性,他们进一步筛查了来自 LIHC和 COAD 的不同 TLS 阶段的全组织切片。根据 T 细胞和 B 细胞的数量以及 fDC 染色,将TLS 分为四个阶段(图5A)。在COAD和LIHC中,AtM B细胞在未成熟TLS中显著富集,而Bm细胞主要位于成熟TLS中(图5B)。在空间上,他们计算了 TLS 或滤泡内外边缘 200 μm 范围内 AtM B 细胞的密度以及 AtM B 细胞到界面的距离,观察到 AtM B 细胞主要位于未成熟 TLS 的中心,这与早期 EF 反应和 TLS 形成的促进一致(图 5D-E)。
使用配对的CD45+ scRNA-seq数据作为参考,贝氏统计模型推断细胞类型组成,显示AtM B细胞与PD1Hi衰竭T细胞呈正相关,特别是PD1HiCD4+ T细胞表现出PD1HiCXCL13+CXCR5 -表型(称为外周辅助性T细胞,Tph),可以促进自身免疫病中TLS形成和B细胞末端分化(图5F)。配体受体分析提供了额外的证据支持PD1HiCD4+ Tph细胞和AtM B细胞之间的相互作用,特别是通过IL-21R-IL-21轴,与Bm细胞相比。这一相互作用表明了PD1HiCD4+ Tph细胞在促进AtM B细胞分化方面的潜在作用(图5G)。
通过已发表的空间转录组学数据集来可视化CD4+PD1Hi Tph和AtM B细胞,发现它们在TLS中呈正相关。在肿瘤和癌旁组织中,TLS区域AtM B细胞附近的CD4+PD1Hi Tph细胞密度和频率显著高于非TLS区域(图5J-K)。为了验证这一点,他们分选了LIHC浸润的PD1HiCD4+ Tph、Th和调节性T (Treg)细胞,并与健康供者的外周血总B细胞或分选的幼稚B细胞共培养(图5L)。结果表明,Tph细胞诱导AtM B细胞分化的效率高于Th和Treg细胞,IL-21R阻断显著减弱了Tph细胞的分化能力。
总之,这些数据表明肿瘤浸润的Tph细胞显著促进了AtM B细胞的分化。
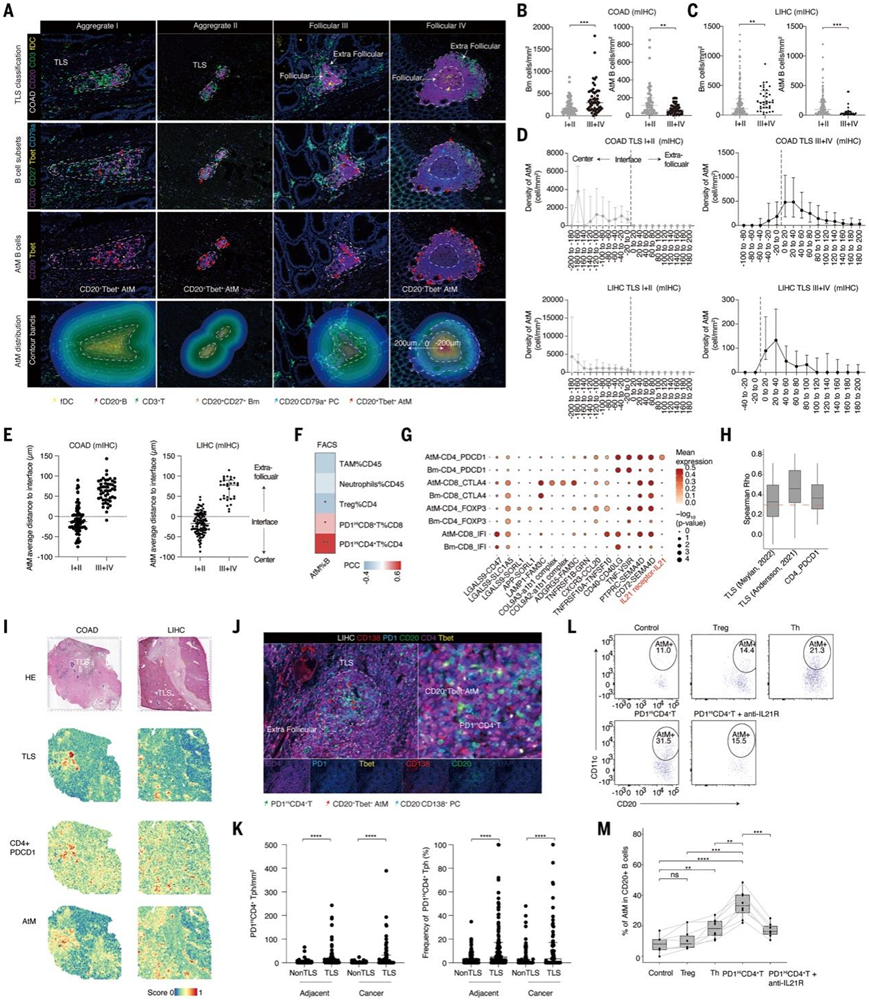
图5.AtM B 细胞聚集在未成熟的 TLS 中,并由 Tph 通过 IL-21–IL-21R 轴诱导。
(A)代表性 mIHC 染色。 (B-C) mIHC 显示COAD和 LIHC中未成熟和成熟 TLS 之间的 Bm 和 AtM B 细胞密度。 (D) COAD(上)和 LIHC(下)中未成熟和成熟 TLS 的 AtM B 细胞的密度。(E) COAD(左)和 LIHC 组织(右)中 AtM 到未成熟和成熟 TLS 之间界面的中位距离。虚线表示接口线。 ( F ) 通过流式细胞观察 LIHC 患者中肿瘤浸润的主要免疫亚群与 AtM B 细胞的相关性。(G) AtM B 细胞和 T 细胞之间的配体-受体相互作用上调。 (H-I)来自 9 种癌症类型的 81 个空间转录组数据集中AtM B 细胞特征与 TLS 或 PD1 Hi CD4 + Tph之间的空间共置相关性和代表性图像。(J) 代表性 mIHC 染色分析。 (K)(左)来自 LIHC TMA 的肿瘤 TLS 和非 TLS 区域以及邻近区域中 AtM B 细胞周围 20 μm 半径内PD1 Hi CD4 + Tph 细胞的浸润密度和(右)频率。 (L-M) 分选肿瘤浸润的 T reg、 Th 和 PD1Hi CD4+ Tph 细胞,并在存在或不存在同种型和抗 IL-21R 的情况下以 1:5 的比例与健康血 B 细胞共培养7天。
06
谷氨酰胺代谢建立了滤泡外 AtM B 细胞的表观遗传特性
他们使用 scMetabolism和代谢相关基因的无监督聚类计算了 Bm 和 AtM B 细胞的代谢通路评分(图 6A)。瘤浸润的 AtM B 细胞中谷氨酰胺、谷氨酸和鞘脂代谢上调,而 Bm 细胞中花生四烯酸代谢显著上调。这些通路中的核心基因,例如谷氨酰胺酶(GLS)、GLA和PTGES3,表现出相似的趋势。他们研究了谷氨酰胺和B细胞免疫表型之间的关系。通过基于质谱的非靶向代谢组学,发现与以GC为主的癌症(STAD和LC)相比,EF反应为主的癌症(LIHC、CESC和RCC)具有显著更高的谷氨酰胺。此外,在LIHC中,肿瘤中的谷氨酰胺水平显著高于邻近正常组织,而COAD和STAD这两种以GC为主的癌症显示出低于邻近正常组织的谷氨酰胺水平。
为了验证这一假设,他们从健康血液中收集了B细胞,并用R848(TLR7激动剂)、IFNγ和谷氨酰胺刺激它们。与IFNγ在自身免疫性疾病中的作用相似,谷氨酰胺与R848相比显著诱导AtM分化,而GLS抑制(CB839)显著减弱了AtM分化(图6B-C)。作为对照,Bm 细胞对 IFNγ 和谷氨酰胺刺激的反应显著减少,表明谷氨酰胺对 AtM 和 Bm 细胞的相反调节机制。他们监测了谷氨酰胺刺激下 B 细胞的耗氧率和三磷酸腺苷 (ATP) 产量,并观察到线粒体呼吸和糖酵解的整体减少(图 6D),这表明谷氨酰胺可能重塑 B 细胞的代谢特征,他们推测谷氨酰胺抑制 B 细胞的克隆扩增或正选择,从而使 B 细胞分化为 AtM B 细胞。然后,他们分析了 R848 和谷氨酰胺刺激后外周 B 细胞的细胞内代谢物,发现与单独 R848 刺激相比,谷氨酸、α-酮戊二酸 (α-KG) 水平增加,并且谷氨酰胺与谷氨酸的比率较高。CB839 处理抑制了这种趋势,表明 GLS 在 B 细胞谷氨酰胺分解中发挥着重要作用。经R848处理后,13c标记谷氨酰胺的代谢命运证实,谷氨酰胺由催化成谷氨酸(M5标记),并通过α-KG (M5标记)、琥珀酸盐(M4标记)、延胡索酸(M4标记)、丙酮酸盐(M3标记)和乳酸盐(M3标记)进入三羧酸(TCA)循环,这与报道的谷氨酰胺水解通路一致(图6E)。接下来,他们通过补充具有细胞渗透性的α-KG类似物二甲基-αKG (DMαKG)来研究α-KG是否也对AtM分化至关重要。事实上,当补充DMαKG时,gls抑制细胞的AtM分化恢复,与谷氨酰胺直接刺激相当。此外,R848直接添加DMαKG诱导的AtM分化水平相似,说明谷氨酰胺源性α-KG可直接调控AtM分化(图6F)。他们发现谷氨酰胺刺激导致H3K27三甲基化增加,而CB839对H3K27本身没有影响(图6C)。进一步的ATAC-seq和RNA-seq显示,谷氨酰胺处理的B细胞显示出AtM特征峰的激活(图6G),表明它们获得了滤泡外特征。通路富集分析再次证明EF相关的PI3K-AKT-mTORC1和外源代谢通路激活(图6H)。在谷氨酰胺刺激下,mTORC1通路的几个调节因子也增加,包括PIK3IP1和AKT1(图S12K)。在肿瘤浸润的AtM B细胞中,phospho-mTORC1及其下游靶点phospho-S6和phospho-AKT的水平比Bm和幼稚B细胞中更高,表明mTORC1信号通路可能参与谷氨酰胺调控(图6I-J)。雷帕霉素进一步抑制mTORC1通路可显著降低谷氨酰胺刺激下的AtM分化(图6K-L)。这些结果表明谷氨酰胺代谢建立了滤泡外AtM B细胞的表观遗传特性。
鉴于滤泡外AtM B细胞和T细胞在TLS内的空间共定位,他们探索了AtM B细胞对T细胞的潜在影响(图5A)。他们用谷氨酰胺诱导外周B细胞转化为AtM,并与外周CD3+ T细胞体外共培养。AtM B细胞可以降低CD4+和CD8+ T细胞的增殖(图6M),并损害T细胞产生IFNγ、肿瘤坏死因子-α (TNFα)和颗粒酶B的能力(图6N)。
最后,他们探讨了Bm和AtM B细胞在癌症中的预后价值。在四个独立的mIHC队列(COAD、STAD、LC和LIHC)中,Bm细胞与良好的预后相关,而AtM B细胞与较差的生存率相关,与EF或gc显性癌症无关(图6O)。此外,在已发表的接受抗pd1治疗的黑色素瘤和肺癌队列中,AtM B细胞的丰度与治疗耐药性显著相关,而Bm细胞与改善的反应和更长的生存期相关(图6P-Q)。总的来说,这些观察结果表明ef来源的B细胞与未成熟的TLS和耗竭的T细胞相关,导致某些癌症的免疫治疗抵抗和预后不良。

图6. 谷氨酰胺促进 AtM B 细胞分化以获得免疫调节功能。
(A) 不同组织中 Bm 和 AtM B 细胞的中值代谢通路评分(左)和平均代谢基因表达的热图(右)。点图的圆圈大小和颜色都代表缩放后的代谢评分(左)。热图的颜色代表平均代谢基因表达(右)。(B) 通过 FACS 检测 AtM(上)和 Bm(下)细胞的代表性流图。 (C) (左)通过FACS检测CD20 + B细胞中Bm和AtM的频率以及(右)Bm或AtM B细胞中三甲基组蛋白H3 (K27)的频率。 (D) 在添加寡霉素、FCCP 的情况下,在存在和不存在谷氨酰胺的情况下,用磷酸盐缓冲盐水 (PBS)(对照)或 R848 刺激 24 小时,健康血液 B 细胞的实时耗氧率 (OCR)和鱼藤酮+抗霉素 A (Rot/AA)。 (E) 用 R848 刺激 24 小时的健康血液 B 细胞中13C 标记的谷氨酰胺的代谢追踪分析。(F)通过FACS检测CD20+ B细胞中AtM的频率。 (G) 染色质可及性热图显示用 DPBS 或单独的 R848 或 R848 和谷氨酰胺刺激 4 天的健康血液 B 细胞。 (H)通路富集分析的热图。 (I-J) 代表性流程图和箱线图显示来自 LIHC 患者的肿瘤浸润的幼稚B细胞、Bm 和 AtM B 细胞中 mTOR 信号传导相关的磷酸化蛋白。(K) 显示来自 FMO和实验组的代表性流图。(L) 显示由 FACS 测定的CD20 + B 细胞中 AtM 的频率。 (M)通过流式细胞检测增殖的 CD4+和 CD8 + T 细胞的频率。 (N)通过流式细胞分析检测细胞毒性 CD4 +和 CD8 + T 细胞的频率以及CD4 + T 细胞中 T reg的频率。 (O)根据 COAD和 LIHC患者的CD20 + B 细胞中 Bm 和 AtM B 细胞的频率绘制的总体生存 Kaplan-Meier 图。 (P) 接受抗 PD1 治疗的 SKCM 患者的缓解率(左)和总生存率(右)。 (Q) 接受抗 PD1 治疗的 LC 患者的无进展生存的 Kaplan-Meier 图。
+ + + + + + + + + + +
结 论
本项研究发现了通过典型GC和替代EF通路形成 ASC 的两条独立发育通路,并证明了明显的癌症类型差异。结肠腺癌和肝癌是分别富集GC和EF通路的两种代表性癌症类型。以 EF 为主的癌症与免疫反应失调和较差的临床结果相关。然后,确定了动态代谢表观遗传信号网络,该网络参与微调肿瘤浸润 B 细胞分化并调控 EF 和 GC 通路之间的平衡。AtMB 细胞是 EF 衍生的 ASC 的主要祖细胞,表现出疲惫和旁观者表型,并且独立于 GC 通路而发育。AtM B 细胞位于未成熟 TLS 的中心,并在 TLS 成熟期间在空间上重新定位到外围。谷氨酰胺衍生的代谢物 α-酮戊二酸 (α-KG) 可以增加 AtM B 细胞相关转录因子T-bet和BATF的表达并促进其分化,同时激活mTORC1信号传导。因此,AtM B 细胞获得免疫调节功能,抑制抗肿瘤 T 细胞反应并营造免疫抑制微环境。
+ + + + +



 English
English


