文献解读|Cell Res(46.297): 垂体神经内分泌肿瘤主要组织类型的蛋白基因组学特征研究
✦ +
+
论文ID
原名:Integrated proteogenomic characterization across major histological types of pituitary neuroendocrine tumors
译名:垂体神经内分泌肿瘤主要组织学类型的整合蛋白基因组学特征
期刊:Cell Research
影响因子:46.297
发表时间:2022.10.28
DOI号:10.1038/s41422-022-00736-5
背 景
垂体神经内分泌肿瘤(PitNET)是最常见的颅内肿瘤之一,超过40%的PitNET在手术时具有侵袭性。世界卫生组织(WHO)在2017年的分类中,根据转录因子(TF)标志和激素表达的免疫组化结果将垂体瘤分为10个亚型(如下图)。然而,使用该分类系统选择治疗策略的指导十分有限。因此,需要进行更多的研究来改进当前的临床病理分类系统,并且积极探索垂体瘤的高级治疗策略,比如靶向治疗和免疫治疗。
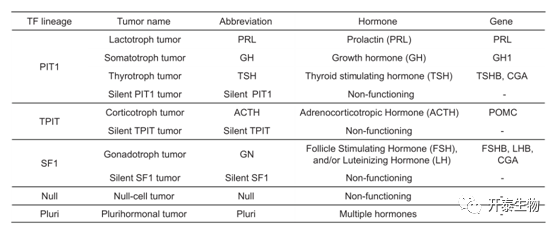
图1 PitNET临床病理分类(2017 WHO)
实验设计
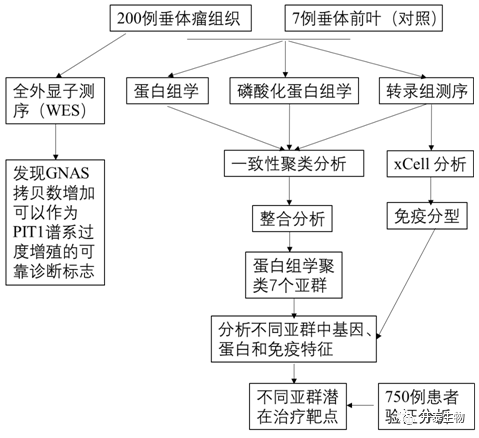
结 果
01

垂体瘤患者蛋白基因组景观概述
作者首先对收集患者组织和对照的垂体前叶临床病理特征,包括TF谱系、临床病理亚型、手术侵袭状态、患者性别、肿瘤直径和KNOSP分级进行了总结(图2a)。全外显子测序(WES)数据分析揭示了7333个突变基因,包括11092个非沉默点突变和419个插入或缺失(图2b)。随后作者又分别对蛋白组学、转录组学和磷酸蛋白组学的数据进行了主成分分析(PCA),结果表明PIT1谱系之间(GH、PRL、TSH、silent PIT1和多激素亚型)以及垂体前叶(APG)、ACTH、silent TPIT与其他类型的PitNET之间在蛋白质组学水平上的显著不同(图2c),而PIT1谱系在转录组学和磷酸蛋白质组学水平上显示出与APG组更高的相似性(图2d,e)。因此,这些结果提供了一个多组学景观,以提高对PitNETs分子机制的理解。
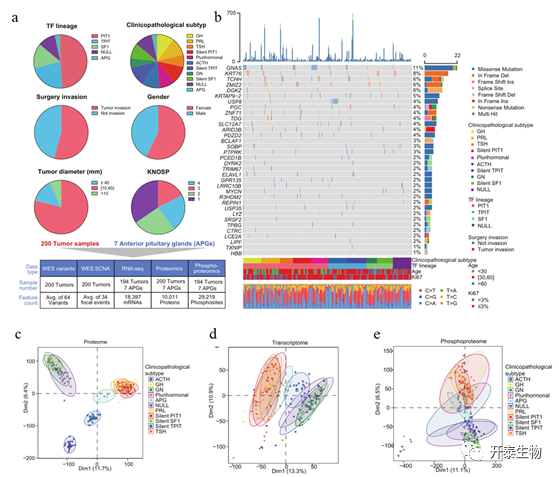
图2 PitNET蛋白基因组景观概述
02

GNAS突变和GNAS拷贝数增加对PIT1谱系PitNETs的影响
富含PIT1谱系的GNAS是最常见的突变基因,包含两个突变热点,R186C/G/L/H和Q212L(图3a)。GNAS拷贝数增加,对PIT1谱系具有特别强的影响(Spearman相关性)(图3b)。具有GNAS突变或GNAS拷贝数增加在PIT1谱系中显著富集(图3c)。因此,进一步将PIT1谱系分为三个亚组,包括野生型(WT)、GNAS拷贝数增加和GNAS突变体。与WT组相比,携带GNAS突变的样本显示GNAS蛋白水平降低,而GNAS拷贝数增加的患者在mRNA和蛋白质水平上显示GNAS增加(图3d)。进一步,作者比较了GNAS突变体和WT患者的差异表达蛋白,发现参与生长激素(GH)合成、分泌和作用途径(如GH1和GH2)的基因在mRNA、蛋白质和磷酸化水平上调(图3e,f)。另外,GSEA结果显示增殖相关的通路(比如细胞周期和DNA复制)在GNAS拷贝数增加的患者上调(图3h)。此外,与WT组相比,GNAS拷贝数增加组具有更高的多基因增殖评分和临床肿瘤体积(图3i)。在细胞周期相关分子中,PRKDC和CDK6是与GNAS拷贝数正相关的前两个蛋白质(图3j)。为了进一步确认GNAS拷贝数增加的影响,又进行了GNAS和CDK6的免疫组化(IHC)染色并计算得分。在PIT1谱系PitNETs和所有PitNETs中,GNAS得分高组中CDK6得分高的比例大于GNAS得分低组(图3k,l)。总之,这些结果说明了GNAS基因突变可能会导致激素分泌过多的不良事件。此外,GNAS拷贝数增加可以显著增强肿瘤细胞的增殖,靶向CDK6的抑制剂治疗可能对携带GNAS拷贝数目增加的PIT1谱系患者有效。

图3 GNAS突变和GNAS拷贝数增加对PIT1谱系PitNETs的影响
03

PitNETs的多组学聚类分类
作者对蛋白质组学数据聚类分析,将PitNETs分成七个亚群,包括GHenrich、EMTPRO、PRLenrich、TSH/silent PIT1enrich、ACTHenrich、silent TPITenrich和SF1/NULLenrich(图4a)。其中,SF1谱系和NULL PitNETs聚集在一起,形成SF1/NULLenrich集群,其显示代谢相关途径的上调,包括脂肪酸代谢和柠檬酸循环。此外,男性更普遍,平均年龄更高,肿瘤直径更大。ACTHenrich亚群富含USP8突变,ACTHenrich和silent TPITrich的女性比例极高(图4b)。为了进一步表征PitNETs的蛋白基因组分类,我们对PitNETs的十个临床病理亚型、三个TF谱系和NULL、五个转录组亚群、七个蛋白质组亚群和七个磷酸蛋白质组亚群进行了综合分析。结果表明,使用蛋白质组学数据鉴定的ACTHenrich、silent TPITrich和SF1/NULLrich亚群与使用转录组学和磷酸蛋白质组学的数据鉴定的亚群高度一致(图4c)。
04

蛋白基因组学鉴定以EMT为特征的侵袭性亚群
在蛋白质水平上,EMTPRO亚群中止血相关和EMT相关分子(包括GP1BB、FGB、MMP8、FN1和ITGB3)高度表达。EMTPRO亚群中与EMT、通过NFκB的TNFA信号传导和细胞因子-细胞因子受体相互作用相关的通路均上调(图4a),另外,EMTPRO显示出强大的入侵性,具有高水平的KNOSP和手术侵袭,以及较大肿瘤直径(图4b)。接下来使用ESTIMATE算法,EMTPRO在转录组和蛋白组的数据中均显示出较高的Stroml评分(图4d)。通过QuPath生物图像分析定量评估HE染色中具有基质形态的肿瘤细胞的比例,并确认EMTPRO亚群具有最高比例的基质表型细胞(图4e)。进一步通过肿瘤细胞中的上皮标记物(panCK)和间质标记物(FN1)的免疫荧光(IF)共染色,IF结果显示EMTPRO亚群中panCK和FN1共染色的区域的百分比显著高于其他亚群(图4f)。所有这些证据都支持EMTPRO亚群的特征是具有EMT状态的肿瘤细胞。
EMT诱导转录因子(EMT-TFs)被证实为EMT表型的关键驱动因素。作者比较了PIT1谱系中两个转录组亚群(EMTRNA and Hormone)之间的TF mRNA表达水平(图4g),证实了五个EMT-TFs在EMTRNA中显著上调,包括:SNAI1、SNAI2、ZEB2、TWIST1和TWIST2。此外,五种EMT-TFs mRNA的表达在EMTRNA和EMTPRO亚群中均显著正相关(图4h),与Hormone亚群相比,EMTRNA亚群中五种EMT-TFs的转录活性水平更高(图4i)。同样,EMT相关分子包括CDH2、VIM、CD44、FN1和ITGB1在EMTRNA亚群中上调,而CDH1、KRT8和KRT18则在转录组学和蛋白质组学数据集中下调(图4i)。另外,TWIST1和ZEB2的表达与其相应的肿瘤体积和侵袭性之间存在显著的正相关(图4j)。总之,PitNETs的整合蛋白基因组特征鉴定了一个之前未识别的、由EMT定义的高度侵袭性亚群(图4k)。
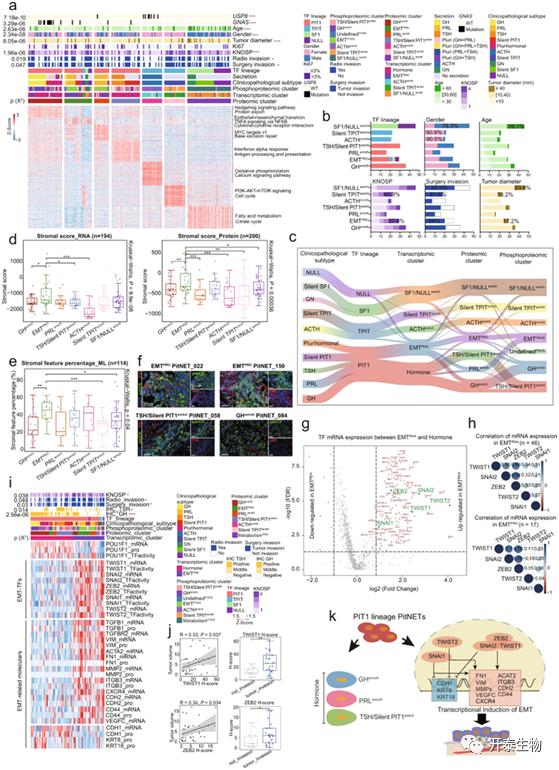
图4 蛋白基因组学鉴定以EMT为特征的侵袭性亚群
05

PitNETs中免疫浸润的特征
接下来,作者对转录组学数据使用xCell47分析推断肿瘤微环境中不同细胞类型的比例,聚类确定了具有不同免疫和基质特征的四组肿瘤:免疫耗竭、CD4+T细胞浸润、内皮细胞和CD8+T细胞浸润(图5a)。CD8+T细胞浸润簇包含ACTHenrich和silent TPIT亚群富集,其特征在于存在多种免疫细胞类型,包括中央记忆CD8+T和CD8+T(图5a)。在CD4+T细胞浸润亚群中,免疫抑制介质CTLA4上调,提示这些肿瘤可能对免疫检查点相关的治疗有反应(图5a,b)。免疫耗竭亚群由TSH/silent PIT1enrich和GHenrich蛋白质组亚群(主要是PIT1谱系)组成,其特征在于Treg细胞的较高分数和PDL1的上调(图5a,5c)。鉴于其在免疫抑制中的作用,作者进一步探讨了PDL1 mRNA表达与JAK1-STAT1-PDL1相关分子之间的相关性,包括PitNETs中的IFNGR1、EIF4E、JAK1和STAT1(图5d)。正如预期的,这些分子在mRNA、蛋白质和磷蛋白水平上显著正相关。此外, TCR信号相关基因,包括PTPN6、PLCG1和JUN,与PDL1 mRNA表达显著负相关(图5d)。在TSH/ silent PIT1enrich和GHenrich亚群(蛋白质组亚型)和免疫耗竭亚群(免疫亚型)中,PDL1表达显著较高,这与从多组学数据获得的结果一致(图5e)。有趣的是,另一个JAK-STAT轴JAK3-STAT6-FOS/JUN的表达与免疫评分高度相关(图5f)。据报道,STAT6可调节FOS和JUN,FOS和JUN可进一步调节下游趋化因子,如CCL2、CCL5、IL6和TGFB1,53,所有这些都在mRNA和蛋白质水平上与免疫评分显著正相关(图5f,g)。这些发现提示,EMTPRO亚群中趋化因子表达导致的免疫浸润增加可能受到JAK3-STAT6-FOS/JUN轴的调节。在多组学数据中,JAK1/STAT1在PIT1谱系肿瘤和所有Pitnet中均与JAK3/STAT6呈中度负相关(图5h)。
总之,这些数据显示了PIT1谱系中意外的双向调节,包括TSH/silent PIT1enrich和GHenrich亚群中可能对检查点(PDL1和PD1)抑制剂有反应的免疫抑制机制,以及EMTPRO亚群中可能被免疫疗法靶向的机制(图5i)。
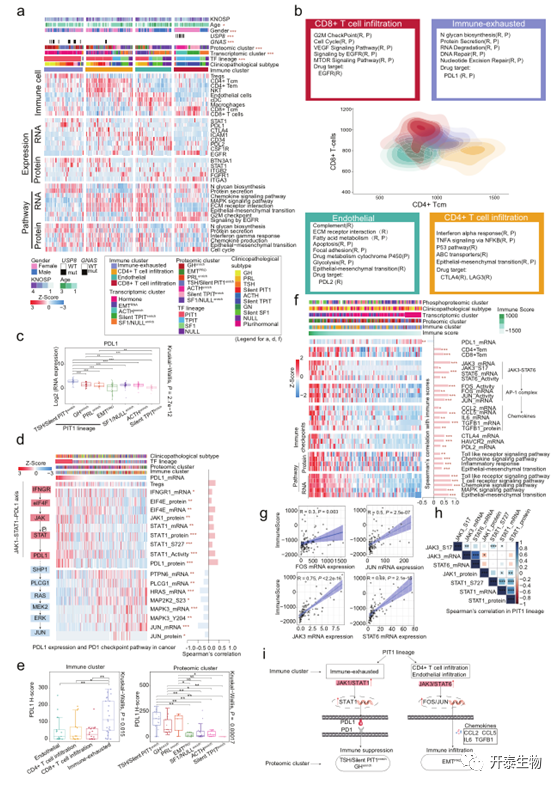
图5 PitNETs中免疫浸润特征分析
06

蛋白质组学数据揭示了TPIT谱系中EGFR激活的三种模式
EGFR与多种人类癌症相关,包括头颈部鳞状细胞癌和肺腺癌,已被提议作为ACTH PitNETs的治疗靶点。作者发现TPIT谱系中EGFR mRNA表达、蛋白质丰度和磷酸化修饰的水平高于其他肿瘤(图6a–c),随后对EGFR相关途径的分析确定了三组显示EGFR激活的不同机制,包括具有USP8突变的ACTH肿瘤(ACTH_USP8突变体)、没有USP8变异的ACTH瘤(ACTH_ USP8 WT)和沉默的TPIT肿瘤(图6b)。在ACTH_USP8突变体组中,USP8功能获得突变将EGFR从泛素化中拯救出来,导致EGFR活性增强,并进一步促进POMC生物合成(图6c,d)。在ACTH_ USP8 WT组中,EGFR配体(即AREG、TGFA、EGF、BTC、EPGN、HBEGF和NRG4)的平均mRNA表达显著高于其他组(图6e),与肽激素生物合成和血清ACTH水平呈正相关(图6f,g)。在silent TPIT肿瘤中,EGFR T693磷酸化、EGFR下游途径或成分(包括PI3K AKT mTOR、MAPK)和细胞周期途径表现出显著的富集(图6h-j),表明EGFR T693磷酸化可能导致这些途径的激活。此外,EGFR的IHC染色显示其在TPIT谱系中的表达高于非TPIT谱系,与ACTH肿瘤相比,在silent TPIT肿瘤中发现EGFR T693磷酸化的阳性染色率更高(图6k)。基于这些结果,作者总结了三种模式中每种模式的潜在治疗选择(图6l)。

图6 TPIT谱系中EGFR激活的三种模式
07

750名PitNETs独立队列中标记物的验证分析
作者将研究确定的七个蛋白质组亚群的代表性分子特征进行了总结(图7a)。为了评估本研究中观察到的结果是否适用其他队列,作者又在750个PitNETs的独立队列中进行了验证。高肿瘤直径组GNAS突变的比例显著高于低肿瘤直径组,并且高GNAS突变表明预后不良(图7b,c)。这些结果与在200名PitNETs的初始队列中获得的结果一致。对于在初始PitNET队列中确定的EMT-TFs(图4j),在750个PitNETs的验证队列中,ZEB2和TWIST1在侵入组中具有较高的表达(图7d)。此外,在750个PitNETs中,PDL1在TSH和silent PIT1亚型中显示出较高的表达(图7e),支持了在200 PitNET队列中免疫耗竭集群中发现PDL1过表达(图5c)。在750 PitNET验证队列中,与其他谱系相比,EGFR在TPIT谱系中独特地过表达,这也与200 PitNET队列的结果一致(图7g)。EGFR T693磷酸化的IHC染色证实,在TPIT谱系中,silent TPIT亚型中IHC阳性病例的比例(80例中的26例)明显高于ACTH(11例中的0例)(图7h)。此外,silent TPIT亚型中EGFR和EGFR T693磷酸化染色阳性的患者比例(18/80)明显高于其他谱系(1/670)(图7i)。
总之,在初始200个PitNET队列中确定的预后标志物和治疗靶点GNAS、ZEB2、TWIST1、PDL1、EGFR和EGFR T693磷酸化在750个PitNET队列的相应亚型中得到了验证。这些发现总结在PitNET树中,该树显示了一种更新的分子分类,其中患者被明确地分为七个亚群,用于潜在的治疗选择(图7j)。

图7 750名PitNETs独立队列中标记物的验证分析
+ + + + + + + + + + +
结 论
在本研究中,作者对200名PitNET患者进行了最大规模的整合基因组学、转录组学、蛋白质组学和磷酸蛋白质组学分析。GWAS数据表明,GNAS拷贝数增加可以作为PIT1谱系过度增殖的可靠诊断标志。基于蛋白质组学聚类分析确定了7个亚群,其中,鉴定并分析了高表达EMT标记物的肿瘤亚群为更具侵袭性。进一步分析了不同亚群的潜在治疗靶点,包括CDK6、TWIST1、EGFR和VEGFR2。免疫亚型分析确定了JAK1-STAT1-PDL1轴的变化与免疫耗竭之间的关联,以及JAK3-STAT6-FOS/JUN轴的变化与免疫浸润之间的关联。在750名PitNET患者的独立队列中,进一步证实了初始队列中确定的分子标记物和各种亚群的特征。本研究跨越传统组织学界限的蛋白基因组分析提高了目前对PitNET病理生理学的理解,并提出了新的治疗目标和策略。
+ + + + +



 English
English

