文献解读|Nat Commun(16.6):定量蛋白质组学定义了改良痘苗安卡拉感染期间的抗病毒防御和细胞死亡机制
✦ +
+
论文ID
原名:Quantitative proteomics defines mechanisms of antiviral defence and cell death during modified vaccinia Ankara infection
译名:定量蛋白质组学定义了改良痘苗安卡拉感染期间的抗病毒防御和细胞死亡机制
期刊:Nature Communications
影响因子:16.6
发表时间:2023.12.08
DOI号:10.1038/s41467-023-43299-8
背 景
猴痘病毒 (MPXV) 是猴痘疾病的病因,是中非和西非流行的人畜共患正痘病毒。MPXV 会引起类似天花的疾病,在免疫功能低下的个体、儿童和孕妇中会出现严重的疾病。
最新一代的天花疫苗源自改良的安卡拉痘苗 (MVA),其本身是由 VACV 株绒毛膜尿囊痘苗安卡拉 (CVA) 在鸡胚成纤维细胞中传代超过 570 次而衍生的。MVA 疫苗接种也已证明可以在人类中诱导 MPXV 中和抗体,并且在非人类灵长类动物模型中具有保护作用。由于目前没有进行系统的蛋白质组学研究,人们对 MVA 在细胞水平上的生物学效应知之甚少。
实验设计
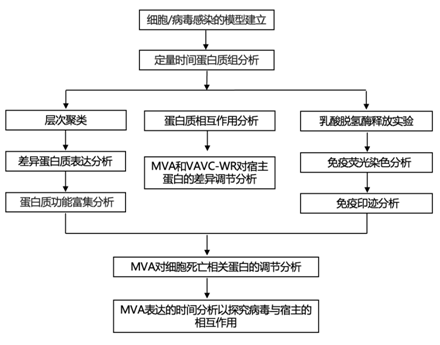
结 果
01
MVA 感染的定量时间分析
为了全面了解 MVA 感染过程中宿主和病毒蛋白的变化,研究者团队以 MVA 感染端粒酶逆转录酶 (TERT) 永生化原代人胎儿包皮成纤维细胞 (HFFF-TERT),感染复数 (MOI) 为5 生物复制品。HFFF-TERT 已确立为多种不同病毒感染的模型和 MOI 5 感染 > 96% 的细胞。应用 16 重 TMT 和三级质谱 (MS3) 与实时搜索 (RTS)量化整个感染过程中的蛋白质表达(图 1a)。在同一实验中,他们使用热灭活MVA (MVA- hi)或病毒DNA复制抑制剂胞嘧啶-arabinoside (AraC)进行了相同的分析,分别了解无基因表达的病毒颗粒或仅表达早期病毒基因的病毒颗粒的作用(图 1a)。
对 7545 种人类蛋白和 144 种病毒蛋白进行了定量,绘制了感染期间蛋白表达变化的整体视图。蛋白质的最大程度差异倍数发生在感染后期,大部分宿主蛋白质下调(图 1b)。
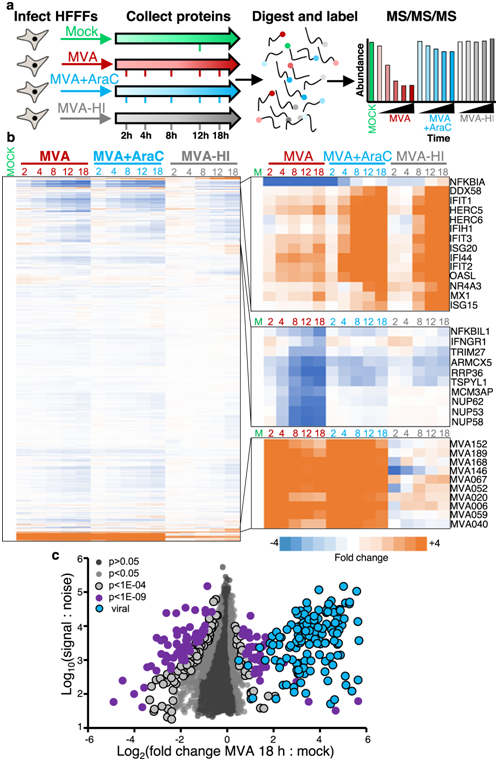
图1. MVA 感染的定量时间蛋白质组分析。
(a) 表示实验工作流程的示意图。(b) 在两个生物重复中定量的所有蛋白质的层次聚类。 (c) 感染 18 小时时定量的所有蛋白质的散点图。
02
MVA 调节内在、先天和适应性免疫的多种介质
感染 18 小时后,383 个人类蛋白质下调超过 2 倍,66 个人类蛋白质上调超过 2 倍。在 MVA 感染早期,多种细胞表面蛋白发生下调,包括多种 NK 和 T 细胞配体,这表明感染第一阶段的关键点可能是逃避细胞免疫(图2a-b)。上调的蛋白质包括炎症介质,例如环氧合酶 2 (PTGS2) 和乳转铁蛋白 (LTF)。为了区分在感染的不同阶段由病毒基因表达下调的高可信度宿主因子,他们应用了一系列过滤器,鉴定了在未修饰的 MVA、MVA+AraC 和 MVA-HI 存在下宿主蛋白表达的差异调节(图2c)。感染过程中后期表达的病毒蛋白精确调节核孔复合体(NPC)的多个成分。早期表达基因下调的蛋白质包括分泌性炎症介质,例如金属肽酶抑制因子2(TIMP2)和转化生长因子β−1(TGFB1) 以及抗病毒限制因子TRIM5。TRIM5 限制正痘病毒,并且是病毒蛋白 C6(由 MVA 28表达)蛋白酶体降解的靶标。
感染热灭活病毒提供了鉴定蛋白质的机会,这些蛋白质在感知病毒颗粒时上调,但其表达受到病毒基因的限制。其中鉴定出四种聚ADP核糖聚合酶(PARP)蛋白,包括锌指抗病毒蛋白(ZC3HAV1,ZAP),多种在免疫中起关键作用的蛋白,如病毒DNA传感器IFI16、干扰素调节因子TRIM26和干扰素刺激因子(IFIT2、ISG20和OASL)(图 2c)。
为了更好地理解在MVA感染的不同阶段蛋白质变化如何相互关联以及与更大的蛋白质组相关,他们将显示每个特征丰度特征的蛋白质组叠加到人类蛋白质-蛋白质相互作用的BioPlex网络上(图2d)。MVA感染后期下调的蛋白表现出强烈的自结合倾向,包括核孔成分和与核糖体生物发生相关的一系列核仁蛋白(例如SURF6、RBM28、RPL7L1、ZC3HAV1、CDK105)(图2d)。
为了评估 MVA 感染期间宿主蛋白质组变化的功能意义,他们通过 HFFF-TERT 的异位表达进行了小规模的功能获得筛选,纳入了一些在 MVA 感染期间下调的蛋白质(GLE1、NSA2、NUP54、NUP62、NUP88、RBM28),还检测了 IFN 刺激的蛋白质,其诱导受到感染的抑制,但不受到热灭活的病毒颗粒或病毒 DNA 复制所抑制(ISG20、OASL、ZNFX1)。在所选的9种蛋白中,只有ISG20显著改变了MVA-GFP感染(图2e)。

图2. MVA 调节内在、先天和适应性免疫的多种介质。
(a) 在MVA感染HFFF-TERT细胞期间,蛋白质在≥1个时间点下调>2倍的功能富集分析。(b)细胞表面相关途径的成分分析。(c)对受调节蛋白质组进行功能富集分析,以及富集途径的组成部分示例。(d) 蛋白质之间的相互作用图在 MVA 感染后减少,但在 MVA+AraC 和 MVA-HI 样品中保持不变。(e) 稳定表达上述蛋白的HFFF-TERT细胞系在MOI 5时由MVA-GFP感染。在指定时间,测量GFP的表达,并与感染的表达荧光素酶(Luc)的细胞进行比较。
03
MVA 和强毒 VACV 对宿主蛋白质组的差异调节
他们接下来表征了宿主调节的相似性和差异,将本研究的结果与对 VACV-WR 18的蛋白质组学分析结果进行了比较,VACV-WR是正痘病毒研究的参考病毒株。尽管至少 30% 的蛋白质受到两种病毒的共同调节,但仍存在许多关键差异(图 3a-b)。在MVA感染中显著下调但受到VACV-WR调节的蛋白在核孔复合体的相互作用组分和某些糖蛋白中富集。后者包括多种免疫调节因子,如调节免疫细胞之间细胞间通讯的信号素、转化生长因子TGFB1和TGFB2,以及内质网应激传感器EIF2AK3(也称为PERK)(图3a-c)。MVA,而不是VACV-WR,也诱导了NF-κB免疫信号传导的阴性(NFKBIA和NFKBIB,也分别称为IκBα和IκBβ)和阳性(BIRC2,也称为cIAP1)调节因子的下调(图3a)。IκB 将失活的NF-κB隔离在细胞质中,它们的蛋白酶体降解释放NF-κB成分积聚在细胞核中,并在细胞核中激活包括干扰素在内的免疫相关基因的表达。因此,NFKBIA 和 NFKBIB 的下调表明 MVA 期间 NF-κB 的激活。在感染MVA AraC而非MVA感染期间,NFKBIA重新合成也表明MVA阻断了I-κB降解或下游的NF-κB途径。另外,NFKBIA的重新合成可能表明MVA感染晚期表达的一个或多个蛋白导致NF-κB的降解,而在AraC存在下,这一降解发生阻断。在VACV-WR感染期间发生下调但受到MVA最低限度调节的蛋白在酪氨酸磷酸化和先天免疫相关因子中富集。前者包括受体酪氨酸激酶的Ephrin家族成员(EPHA4, EPHB2和EPHB3)和原癌基因FER,而后者包括多个干扰素刺激基因和MAP4K2, MAP4K2是丝裂原活化蛋白激酶的上游激活因子,是病原体感知下游免疫信号传导的关键调节因子(图3b-c)。
一般来说,HFFF-TERT 和在佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA)分化的THP-1巨噬细胞(以下称为THP-1)中的蛋白质变化之间存在良好的对应性,尽管每种细胞类型的变化幅度存在细微差异。70% 的蛋白质在 HFFF-TERT 或 THP-1 中下调超过 2 倍,在其他细胞类型中也下调至少 1.25 倍,而 18% 仅在 HFFF 中下调,12% 仅在 THP-1 中下调(图3d-e)。多种途径也通常受到调节(图3e)。不同细胞类型之间的调控差异包括HFFF-TERT中核孔复合体成员的下调,而在THP-1中没有,以及仅在THP-1中下调的转录调节因子早期生长反应1 (EGR1)是VACV的丝裂原活化蛋白激酶下游的宿主依赖性因子(图3e-f)。此外,在HFFF-TERT感染期间,胶原蛋白下调,而在THP-1(COL1A1, COL1A2, COL3A1, COL5A1和COL12A1)中,胶原蛋白上调(图3f)。MVA 感染的 THP-1 还表现出补体因子(C4A、C5、C7、CFH 和 CFI)和凝血因子[F2、F5、F10、抗凝血酶 III (SERPINC1) 和 β-纤维蛋白原(FGB)]丰度的整体增加,与 HFFF-TERT 不同,它们通常受到最低限度的调节。DNA 复制的阻断不会影响胶原蛋白和补体/凝血蛋白的上调,而热灭活的 MVA 无法像感染性 MVA 那样诱导这些因子。

图3. MVA 或 VACV-WR 感染人成纤维细胞期间,以及 HFFF 或 THP-1 细胞 MVA 感染期间差异蛋白变化。
(a) MVA 和 VACV-WR 感染 18 小时时定量的所有蛋白质的散点图。 (b) 蛋白质的功能富集分析。(c)(b)中确定的途径的示例成分。 (d) HFFF-TERT 或 THP-1 感染 12 小时时定量的所有蛋白质的散点图。(e) 蛋白质的功能富集分析。 (f) (e)中确定的途径的示例成分。
04
MVA 调节多种细胞死亡相关蛋白并激活巨噬细胞中的炎症小体
炎症小体是多聚蛋白复合物,可响应感染或细胞损伤刺激而组装并激活促炎性半胱天冬酶,尤其是半胱天冬酶-1。活性 caspase-1 可裂解 IL-1β 前体、IL-18 前体和 Gasdermin D (GSDMD)。为了确定 MVA 感染 THP-1 期间炎症小体是否发生激活,他们首先通过乳酸脱氢酶 (LDH) 释放测定来测量细胞死亡。MVA 感染 THP-1 会导致细胞死亡急剧增加,这种情况可以通过 caspase-1 抑制剂 (VX-765) 以及较小程度的泛 caspase 抑制剂 (zVAD-fmk) 的处理来逆转(图4a)。相反,坏死性凋亡介质 RIPK1、RIPK3 和 MLKL 的抑制剂在阻断 HFFF-TERT 坏死性凋亡的浓度下不会影响 MVA 诱导的细胞死亡(图 4a)。
接下来,他们试图量化感染的THP-1巨噬细胞中的炎性体组装,将这些巨噬细胞改造成表达caspase-1 caspase募集结构域(CARD)与EGFP融合(C1C-EGFP)。在VX-765存在的情况下,MVA感染后4和8小时,C1C-GFP在每个细胞中重新分布到单个斑点,以避免细胞焦亡(pyroptosis)(图4b-c)。他们还观察到MVA感染激活炎性体下游GSDMD的裂解。VX-765和zVAD-fmk阻止GSDMD裂解,表明其具有 caspase-1 依赖性(图4d-f)。
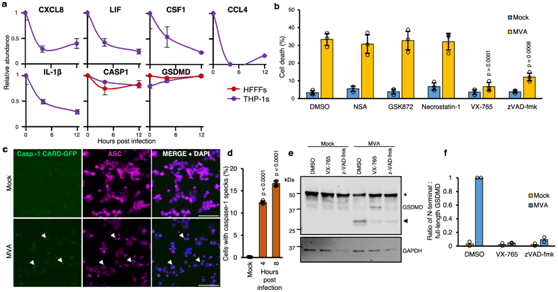
图4. MVA 感染诱导 THP-1 细胞焦亡。
(a) MVA 感染期间分泌蛋白和参与炎症小体途径的蛋白质的代表性时间曲线。 (b) 通过乳酸脱氢酶释放测定评估细胞死亡。 (c) 免疫荧光观察炎症小体组装(caspase-1/ASC 斑点形成)。 (d) 使用c中的 caspase-1 CARD-GFP 斑点对细胞进行定量。(e) 免疫印迹分析。(f) 切割的 N 末端片段(箭头)与来自(e)的全长 GSDMD(用星号表示)条带强度的比率。
05
MVA 蛋白表达的时间分析以了解病毒与宿主的相互作用
病毒蛋白表达的高清晰度时间分析可以促进病毒和细胞蛋白谱之间的直接关联,从而深入了解病毒与宿主蛋白的相互作用。他们分别量化了HFFF-TERT和THP-1中所有预测MVA蛋白。为了定义不同类别的蛋白表达,他们采用k-均值聚类,并纳入了经AraC处理的HFFF-TERT样本的数据。这表明,在两种测试的细胞系中,至少有四种不同的病毒蛋白表达的时间蛋白谱(图5a-b)。一些最早的TP1(时间谱1)和TP2类病毒蛋白在AraC存在的情况下表现出表达增加,这可能是由于缺乏复制后蛋白的负调控。相比之下,TP3类蛋白部分受到AraC抑制,TP4类蛋白的表达几乎完全抑制。TP1类蛋白包括MVA102 (VACV-WR D5)和MVA019 (VACV-WR C6)(图5a),MVA102 (VACV-WR D5)可在感染早期剥除病毒基因组。
为了将蛋白质功能与时间类别联系起来,他们将量化的MVA蛋白质与先前在研究中使用的功能和转录时间类别进行了注释。转录本和蛋白数据之间的比较是明显的:22/23的TP1蛋白由E1.1或E1.2类转录本编码,22/24的TP4蛋白由I或L转录本编码。TP2蛋白主要由E1.2转录本编码(图5c)。
不同转录组学和蛋白质组学研究之间的这种重叠强化了基于蛋白质的MVA基因表达时间分类的生物学相关性,并强调了正痘病毒基因表达的时间控制主要在转录水平上。带有“宿主相互作用”类别注释的蛋白主要在感染早期表达(TP1-2);“DNA复制”功能主要是TP2类,而结构蛋白或参与病毒粒子组装的蛋白主要与TP3和TP4类有关(图5d)

图5. MVA 蛋白表达的时间类别。
(a) 通过 k-均值聚类将病毒蛋白分为 4 类。随后蛋白质在每一类中按层次聚类。 (b) 每个类别的示例。(c) HFFF 中 MVA 病毒蛋白和 VACV 转录物类别的比较。(d) MVA 病毒蛋白的功能分类。
+ + + + + + + + + + +
结 论
本项研究进行了多重蛋白质组学分析,以量化人类成纤维细胞和巨噬细胞 MVA 感染过程中超过 9000 种细胞蛋白和约 80% 的病毒蛋白。MVA 将超过 690 种人类蛋白质下调超过 2 倍,揭示了宿主蛋白质组的重塑。病毒中间/晚期基因表达对于先天免疫的 MVA 拮抗作用是必要的,而干扰素效应子(如 ISG20)的抑制会增强病毒基因表达。巨噬细胞感染特有的蛋白质组变化表明炎症反应的调节,包括炎症小体的激活。因此,本项研究提供了 MVA 对人类蛋白质组影响的整体视图,这些发现对于设计未来几代疫苗至关重要。
+ + + + +



 English
English


