文献解读|Nat Cancer(23.5):多发性骨髓瘤的蛋白质组学图谱揭示了疾病生物学和治疗机会
✦ +
+
论文ID
原名:The proteogenomic landscape of multiple myeloma reveals insights into disease biology and therapeutic opportunities
译名:多发性骨髓瘤的蛋白质组学图谱揭示了疾病生物学和治疗机会
期刊:Nature Cancer
影响因子:23.5
发表时间:2024.06.28
DOI号:10.1038/s43018-024-00784-3
背 景
多发性骨髓瘤 (MM) 是第二大最常见的血液系统恶性肿瘤,其特征是骨髓中单克隆浆细胞扩增。患者患有骨病变、肾功能不全、高钙血症和骨髓衰竭等症状。MM 目前仍然无法治愈,因此迫切需要更好的风险分层以及新的治疗方法。
实验设计
结 果
01
MM 的蛋白质组学概况
为了表征未经治疗的有症状的 MM 的蛋白质组学景观,研究团队分析了从 114 例 NDMM 患者中分离的浆细胞(图1a)。通过荧光原位杂交 (FISH) 评估的原发性和继发性染色体变异的频率。对大多数样本进行了转录组分析(RNA-seq)和全基因组 DNA 测序,分别评估基因表达和拷贝数变异 (CNA),这与 FISH 检测到的基因变异基本一致(图1b)。他们总共鉴定了超过 10000 种蛋白质和 50000 种磷酸肽,并定量了 8336 种蛋白质和 25131 种磷酸肽(图1c)。鉴定了关键的浆细胞标志物,包括转录因子 IRF4、表面蛋白 CD38、TNFRSF17(BCMA)和 SDC1(CD138)以及易位蛋白 NSD2、FGFR3 和 CCND1(图1c)。RNA 与蛋白质的相关性为中等,Pearson 相关系数中位数为 0.29(图1d),受易位影响的蛋白质以及关键的细胞表面蛋白和转录因子显示出高于平均水平的相关性(图1d)。单样本基因集富集分析 (ssGSEA)显示了单个信号通路的富集和与剪接、蛋白酶体降解和氧化磷酸化相关的基因的负富集(图1e),这些数据意味着 MM 中存在广泛的转录后调控。
他们通过差异表达分析确定了常见基因变异对(磷酸化)蛋白质的影响。大多数易位,HRD、+1q 和 del(13q),对顺式和反式蛋白质的表达水平有显著影响,t(14;16)、del(1p) 或 del(17q) 的调节较少(图1f)。遗传亚型中最重要的蛋白质和磷酸化肽是IgH易位蛋白和(受到CNA影响)染色体上的蛋白质(图1g)。

图1. 新诊断的 MM 的蛋白质组学图谱。
(a) 蛋白质组学研究概述。(b) CNV 热图,按主要遗传亚组排序。(c) 通过基于 TMT 的质谱法检测到的蛋白质和磷酸肽按中位强度排序。(d) mRNA-蛋白质水平 Pearson 相关性。(e) KEGG 通路分析。(f) 每个细胞遗传亚群中差异调节的蛋白质(左)和磷酸肽(右)。(g) 热图显示 MM 样本中每个遗传亚群中五种最显著的蛋白质(左)和磷酸肽(右)。
02
基因改变影响顺式和反式蛋白质水平
在 t(11;14) MM中,细胞周期调节因子高度失调,包括CCND1 的高表达、CDK4 蛋白水平和 RB1 磷酸化的增加,同时 CDK6 蛋白水平降低(图2a-b)。在非 t(11;14) MM中,高 RB1 磷酸化反而与 CDK6 蛋白表达、高水平 CCND2 和 CCND3 RNA 和磷蛋白相关 (图2b)。他们发现 102 种凋亡相关蛋白在 t(11;14) 骨髓瘤中失调,包括凋亡抑制因子 BIRC2 和 BCL2L1 (BCL-XL) 的下调以及促凋亡蛋白(如 TRADD 和 FADD)的上调(图2a)。在所有 t(4;14) 患者中,NSD2 在 RNA、蛋白质和磷蛋白水平上均选择性强烈上调(图2c,d)。相反,FGFR3 表达并不均匀,仅在 12/19 (63%) t(4;14) 样本中检测到(图2d)。磷酸化蛋白质组学数据的 SsGSEA 显示,在 FGFR3 蛋白升高的样本中,FGFR3 信号通路上调,与 t(4;14) 状态无关(图2e)。FGFR3 蛋白表达与对 FGFR3 的依赖性高度相关,而 NSD2 敲除 (KO) 对 MM 细胞系中的生存没有影响(图2f)。因此,FGFR抑制剂erdafitinib对t(4;14)阳性/FGFR3高水平细胞系OPM2具有极好的抑制作用,但对FGFR3阴性细胞无效(图2g)。在t(4;14)样本中,反式蛋白中上调最多的蛋白是去泛素化酶泛素C末端水解酶L1 (UCHL1)(图2c)。UCHL1 已证明对 MM 和其他 B 细胞恶性肿瘤至关重要,并且与侵袭性疾病有关。

图2. 原发性易位 t(11;14) 和 t(4;14) 的(磷酸化)蛋白质组学谱。
(a) 整体蛋白质水平。(b) 热图显示了 RB1、CDK4、CDK6、CCND1、CCND2 和 CCND3 在 RNA 和蛋白质水平以及 RB1 磷酸肽上的标准化表达。(c) 整体蛋白质水平。(d) FGFR3 和 NSD2 的蛋白质、磷蛋白和 RNA 表达水平 。(e) MM 样本中的 FGFR3 蛋白水平与 Reactome 基因集“磷酸化蛋白质组学数据中活化 FGFR3 的下游信号传导”的 ssGSEA 标准化富集分数。(f) FGFR3 和 NSD2 RNA 表达以及 CRISPR–Cas9 KO 筛选数据。(g) MM 细胞系的细胞活力。
03
E2 泛素连接酶 UBE2Q1 是 MM 中具有 1q 扩增的候选癌蛋白
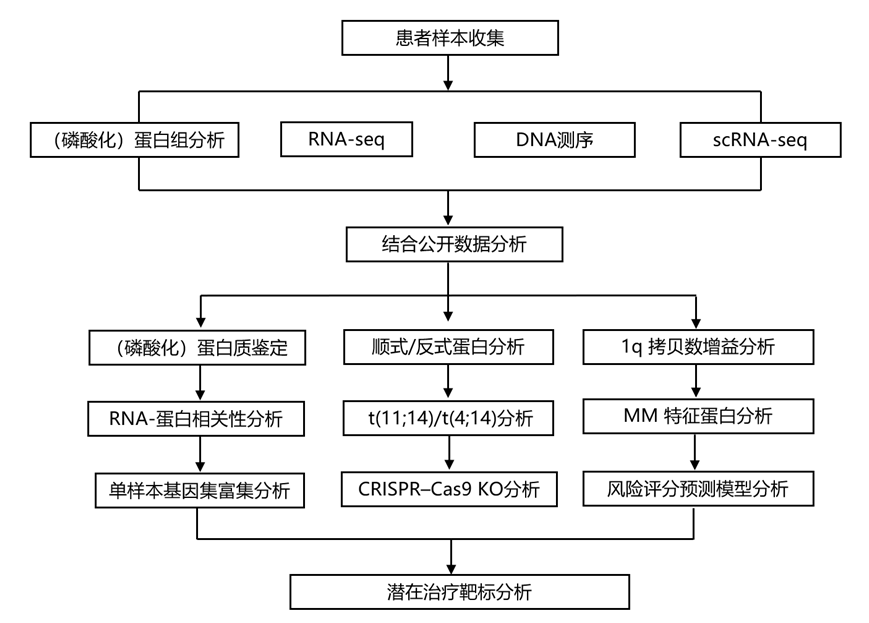
1 号染色体长臂的增益(+1q)是 MM 中已确定的高风险标志,并且与之前的研究一致,本研究队列中的 1q 拷贝数与较短的总生存期 (OS) 相关。大部分上调蛋白受到顺式调控(1q),包括许多潜在致癌驱动因素的蛋白,如ANP32E、BCL9和MCL1(图3a)。他们观察到1q状态与临床试验阶段药物靶点MCL1蛋白水平仅部分相关(图3b)。参与蛋白酶体降解、蛋白质稳态和蛋白质折叠途径的几种蛋白质在具有 1q增益的 MM 中上调,包括顺式调节的蛋白质,例如 E2 连接酶 UBE2Q1(图3c)和 E3 连接酶 DCAF8,以及反式调节的蛋白质,例如含伴侣蛋白的 TCP-1 复合物成员和 E2 连接酶 UBE2G2 和 UBE2H。虽然1q基因从拷贝数(CN)到RNA和蛋白质的相关性普遍较高,但许多基因在一定程度上不受CNA影响(图3d)。E2 连接酶 UBE2Q1 是唯一与不良 OS 和无进展生存期 (PFS) 显著相关的 1q 蛋白(图3e)。鉴于 UBE2Q1 在泛素化介导的蛋白质降解中的作用,他们评估了 UBE2Q1 过表达在两种 MM 细胞系中的影响(图3f)。在 UBE2Q1 过表达的 LP1 细胞中,观察到蛋白质的失调,这些蛋白质也与原发性 MM 中的 UBE2Q1 水平表达相关,并且在具有 1q 增益的原发性骨髓瘤患者中也存在差异表达(图3g-h)。这些数据表明,由于DNA扩增而失调的UBE2Q1会调节其他蛋白质的蛋白质水平,并提示UBE2Q1在MM发病机制中发挥作用。
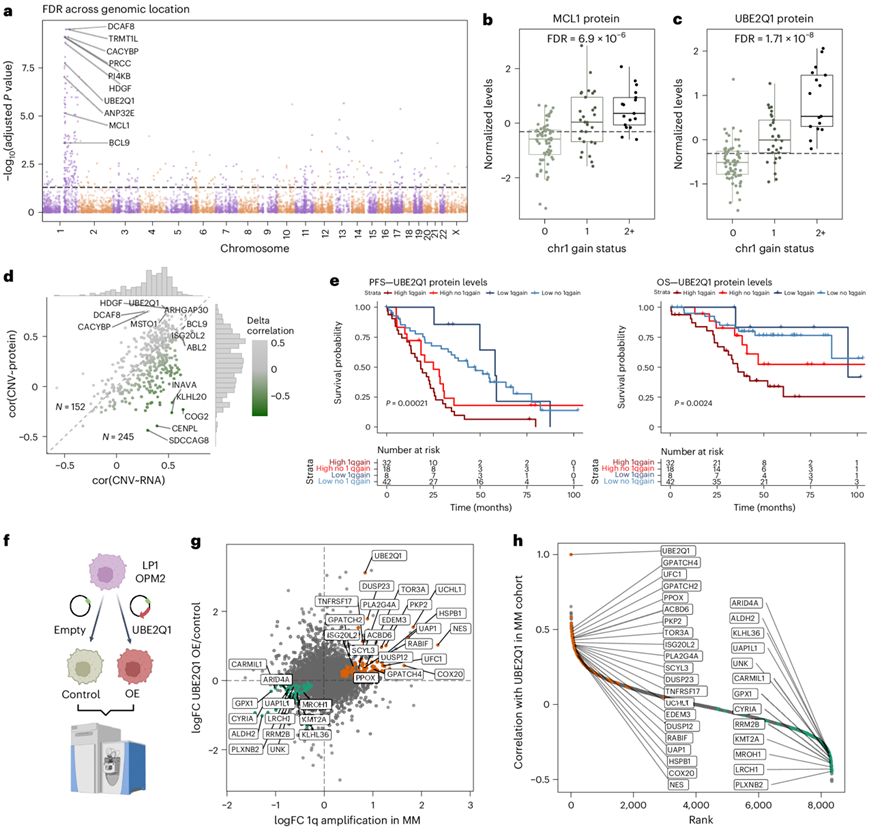
图3. 鉴定 UBE2Q1 为具有 1q 染色体增益/扩增的 MM 侵袭性表型的候选蛋白。
(a) 将具有 1q 拷贝数增益的 MM 样本的整体蛋白质水平与所有其他样本 进行了比较。(b) 按 1q 增益状态分组的 MM 患者的 MCL1 蛋白水平。(c) 按 1q 增益状态分组的 MM 患者的 UBE2Q1 蛋白水平。(d) Pearson相关系数分析。(e)生存分析。(f) UBE2Q1在LP1和OPM2细胞系中过表达。(g) LP1细胞和1q增益的MM患者中调节的蛋白与骨髓瘤队列中UBE2Q1蛋白水平相关。(h) 蛋白质水平的相关性分析。
04
MGUS 和 PCL 中的蛋白质特征
MM 由意义不明的单克隆免疫球蛋白病(MGUS)发展而来,恶性肿瘤前状态 MGUS 的特征是骨髓中单克隆浆细胞少于 10%,且无症状。患者可处于这种状态超过 10 年,无需治疗。对七例 MGUS 病例的蛋白质组学分析显示,与 NDMM 仅有少量差异,20 种蛋白质和 509 种磷酸肽失调(图4a)。在差异表达蛋白质中,组蛋白甲基转移酶 KMT2D 是 B 细胞恶性肿瘤中已知的肿瘤抑制因子,在 MGUS 中丰度更高(图4a)。
浆细胞白血病 (PCL)是一种高度侵袭性的髓外骨髓瘤,预后不良,由于浆细胞脱离骨髓微环境而进入血液。尽管基因相似,但主成分分析 (PCA)和统计分析表明,PCL 和 MM 的(磷酸化)蛋白质组存在显著差异(图 4b-c)。ssGSEA 分析显示,从 MGUS 到 MM 再到 PCL,增殖和 MYC 靶标特征逐渐富集(图4d)。PCL 中上调最多的蛋白质是富含半胱氨酸的蛋白 1 (CRIP1) 和 CRIP2,后者是一种在急性髓系白血病中也高表达的蛋白质。PCL 中进一步上调的蛋白质包括 AHNAK、TAGLN2 和 LMNA,它们与实体癌的转移和侵袭性疾病有关,PCL 样本显示单克隆抗体靶标 CD38 的水平较低 (图4c)。
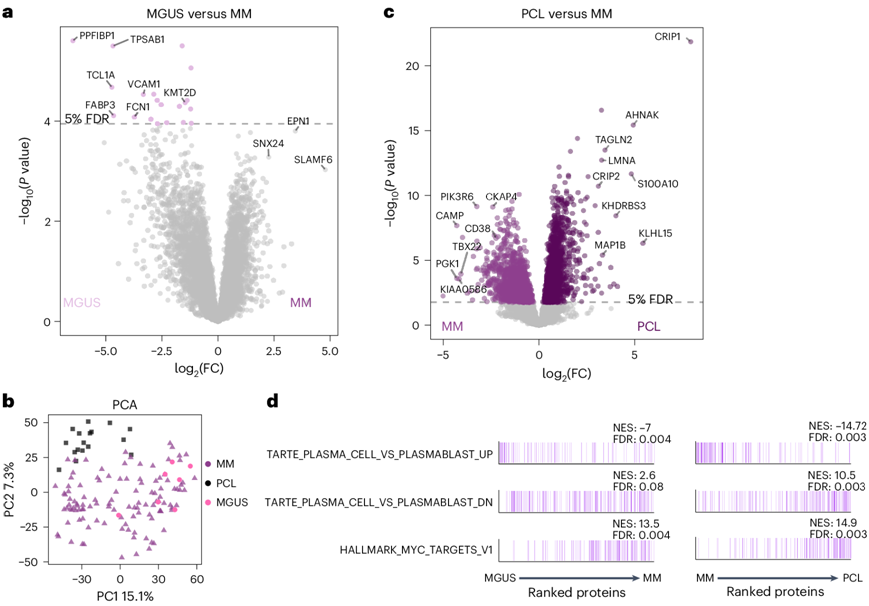
图4. MGUS 和 PCL 的蛋白质组谱。
(a) 整体蛋白质水平分析。(b) MM、MGUS 和 PCL 样本的整体蛋白质组数据的 PCA。(c) MM 样本与 PCL 中的整体蛋白质水平进行比较。(d) 该图显示按等级排序的蛋白质。
05
基于蛋白质组学的结果预测
他们应用引导方法和模型优化(图5a),定义了一个蛋白质风险评分模型,其中包含八种具有不同权重的蛋白质的蛋白质水平信息,包括 1q 蛋白质 UBE2Q1。蛋白质风险评分高的患者的中位 PFS 为 12.5 个月,而中位评分的患者为 30.0 个月,低评分的患者为 87.4 个月,这转化为中位 OS 分别为 29.6、86.3 和 108.1 个月(图5b)。蛋白质风险评分的预后价值在 CD138 富集和非富集样本中保持一致(图5c)。令人惊讶的是,蛋白质风险评分随着疾病侵袭性从MGUS到新诊断的多发性骨髓瘤 (NDMM)和 PCL(中位数评分 0.97)逐渐增加(图5d-e)。
图5. 蛋白质组风险评分预测 NDMM 的结果。
(a) 临床试验中接受以来那度胺为基础的强化治疗的 NDMM 患者的蛋白质组风险评分的生成工作流程。(b) 生存分析。(c) PFS 和 OS 的多变量 Cox 回归分析。(d) 健康供体、癌前 MGUS、MM 和 PCL 患者的样本中蛋白质高风险评分中所含蛋白质的表达。(e) 根据健康浆细胞、MGUS、MM 和 PCL 样本的蛋白质组数据计算的蛋白质风险评分值。
06
鉴定MM 中的特征蛋白质
他们进一步鉴定 MM 细胞特有的蛋白质,并与从健康供体骨髓中分离的造血干细胞和祖细胞 (CD34 +)、B 细胞 (CD19 +) 和浆细胞 (CD138 +) 进行比较(图6a)。关键造血谱系标志物表现符合预期,B 细胞中 PAX5 水平较高,干细胞/祖细胞中 CD34 水平较高,CD138 +浆细胞中 IRF4 水平较高(图6b)。将 MM 细胞与三个健康群体逐一比较,发现与 CD34 +、CD19 +和 CD138 +健康细胞相比,MM 中分别有 1475、1350 和 1187 个显著变化的蛋白质(图6c)。在 MM 中持续上调的蛋白质包括核糖体蛋白和热休克蛋白。几种浆细胞分化标志物包括 PRDM1、CD56(NCAM1)和 BCMA(TNFRSF17)在 MM 细胞中表达较高,而 CD138(SDC1)和 CD38 没有观察到重大差异。他们将三次比较中显著上调的蛋白质与在骨髓瘤细胞中选择性鉴定的蛋白质(402 种蛋白质)相结合(图6c),并使用遗传依赖性数据(depmap.org)(图6d)进行综合分析,这产生了31个候选靶蛋白的列表,其中包括已知的MM生存因子(survival factors),如转录因子IRF4和PRDM1以及激酶PIM2和PIK3CA(图6e)。为了进一步评估蛋白质在 MM 中的作用,他们在 MM.1S 细胞系中进行了CRISPR 激活筛选(图6f)。驱动 MM 细胞生长的关键基因是 POU2AF1 和 IRS1,其蛋白质表达量高,对 MM 至关重要(图6g-h)。POU2AF1编码OCA-B 转录辅激活因子,是一种 B 细胞分化因子,对生发中心形成和几种 B 细胞肿瘤(包括淋巴瘤和 MM)至关重要。IRS1 是胰岛素生长因子 1 受体 (IGF1R) 的下游信号蛋白,当 IGF1 与 IGF1R 结合时,MM 细胞中会发生高度磷酸化。
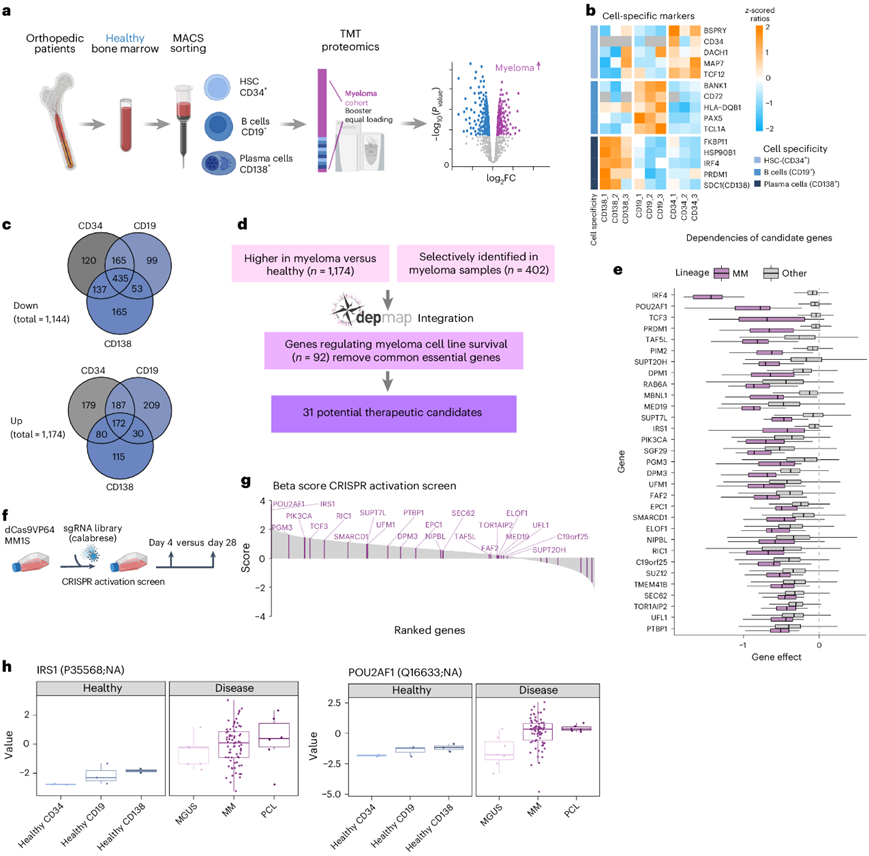
图6. 综合蛋白质组学和基因筛选揭示了 MM 细胞生长的驱动因素。
(a)实验流程。(b) 健康样本中细胞谱系特异性标志物的蛋白质水平。(c) 维恩图显示与健康样本相比,MM 样本中上调和下调蛋白质的重叠。(d) 数据分析工作流程,以从骨髓瘤上调或特异性表达的蛋白质中识别潜在的治疗候选物。(e) 显示了骨髓瘤和其他细胞系中潜在治疗靶点的基因效应。(f) CRISPR–Cas9 激活筛选的工作流程。(g) 按 beta 值排序的基因对增殖的影响。(h) 健康和恶性细胞群中 IRS1 和 POU2AF1 的蛋白质水平。
07
MM 细胞上的表面蛋白鉴定
为了识别其他 MM 细胞表面蛋白,他们将健康和恶性浆细胞蛋白组数据与癌症表面蛋白质组数据相结合(图7a)。虽然 TNFRSF17(BCMA)对骨髓瘤样本具有高度特异性,但其他免疫治疗靶标如 CD38、CD138(SDC1)和 SLAMF7 在 MM 中的表达(与健康浆细胞相比)较低。此外,他们检测到了几种在 MM 细胞中表达水平较高的蛋白质,包括 Fc 受体样 2 和 5(FCRL2 和FCRL5)、受体酪氨酸激酶样孤儿受体 2 (ROR2)、信号淋巴细胞活化分子家族成员 1 (SLAMF1) 和溶酶体相关膜蛋白 3 (LAMP3)(图7b)。在本项研究的数据集中,所有蛋白都显示出良好的RNA-蛋白相关性,在单细胞转录组分析(scRNA-seq)数据中对这些靶点的评估进一步证实了它们在恶性浆细胞中的选择性和高表达(图7c)。对原发患者和健康供体的骨髓进行流式细胞分析,证实了 11 名患者中的 7 名 MM 细胞表面存在 FCRL2 表达,并且其在健康血浆和 B 细胞以及其他造血细胞上分别显示中度和低表达(图7d-e)。
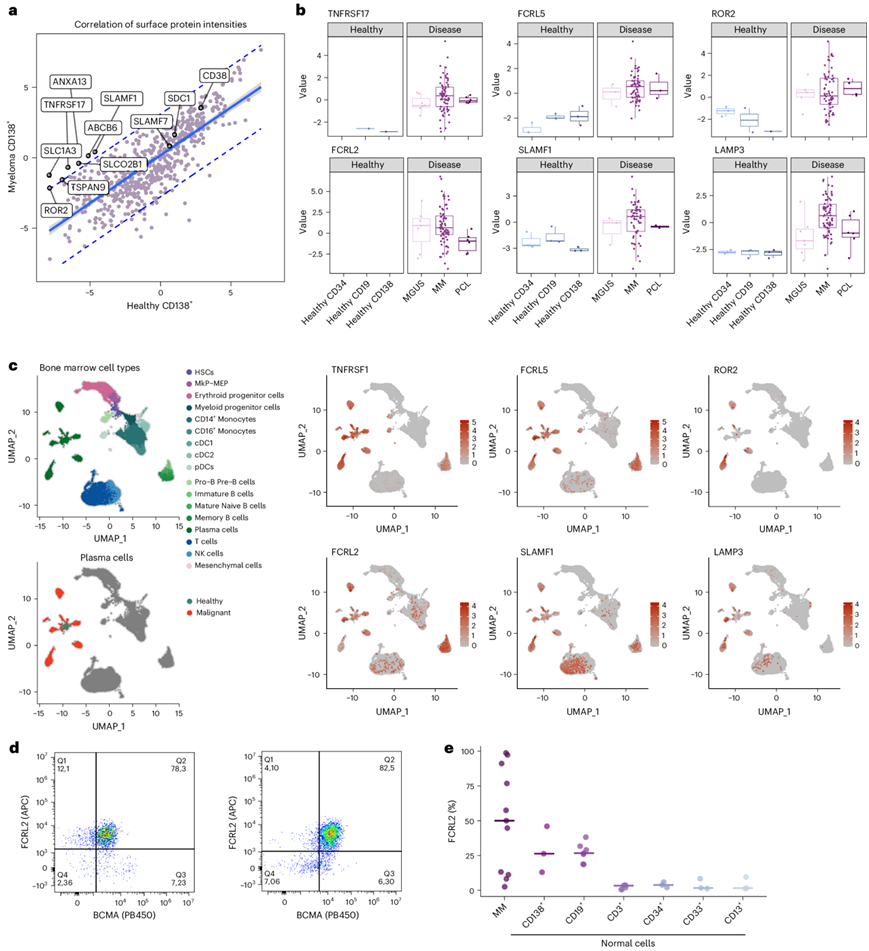
图7. MM 细胞上的表面蛋白鉴定。
(a) MM 和健康骨髓样本中表面蛋白的中值标准化原始强度的相关性。(b) 健康造血细胞和恶性浆细胞中选定的表面蛋白的蛋白质水平。(c)UMAP可视化。(d) MM 样本中BCMA(TNFRSF17)(x轴)和 FCRL2(y轴)表达的 FACS 分析。(e) MM 细胞中 FCRL2 阳性细胞的百分比,以及其他正常血液细胞群中表达极少或无表达的百分比。
+ + + + + + + + + + +
结 论
本项研究对138 例原发性患者来源的浆细胞恶性肿瘤进行了多组学分析,与健康浆细胞相比,恶性浆细胞的(磷酸化)蛋白质组高度失调。本研究发现了一种与侵袭性疾病相关的预后蛋白质特征,与 MM 中已确定的风险因素无关。结合功能遗传学和scRNA-seq数据,揭示了浆细胞恶性肿瘤中一般和遗传亚型特异性失调的蛋白质和通路,其中包括(免疫)治疗的潜在靶点。
+ + + + +



 English
English


