文献解读|Sci Transl Med(17.1):大脑、脑脊液和血浆的蛋白质组学可识别区分散发性和遗传性阿尔茨海默病的分子特征
✦ +
+
论文ID
原名:Proteomics of brain, CSF, and plasma identifies molecular signatures for distinguishing sporadic and genetic Alzheimer’s disease
译名:大脑、脑脊液和血浆的蛋白质组学可识别区分散发性和遗传性阿尔茨海默病的分子特征
期刊:Science Translational Medicine
影响因子:17.1
发表时间:2023.07.05
DOI号:10.1126/scitranslmed.abq5923
背 景
阿尔茨海默病 (AD) 是导致痴呆症的最常见原因,会降低患者和护理人员的生活质量。AD 的特点是大脑中含有 β 淀粉样蛋白 (Aβ) 的斑块和 tau 神经原纤维缠结,导致神经元丢失、神经炎症和记忆力下降。AD 的蛋白质组学研究有助于确定 AD 途径,但通常侧重于单一组织和散发的 AD 病例。对遗传定义的 AD 亚型(包括TREM2和 ADAD 病例中具有 AD 风险变异的个体)进行蛋白质组学分析,对于充分了解这种异质性疾病的生物学以及识别 AD 亚型特异性分子标记和治疗靶点非常重要。
实验设计

结 果
01
散发性 AD 的蛋白质组学特征
为了确定与大脑、脑脊液和血浆中散发性 AD 相关的蛋白质组变化,研究团队使用 SomaLogic 开发的多重单链 DNA 适体测定法对 1305 种蛋白质进行了定量,对 290 名神经病理学确诊的 AD 患者和 25 名无脑部病理的认知正常个体的尸检脑组织中剩余的 1092 个蛋白质进行了差异丰度分析。他们还对来自 176 名 AD 患者和 494 名健康对照者的脑脊液样本中的 713 种蛋白质以及来自 105 名 AD 患者和 254 名健康对照者的血浆样本中的 931 种蛋白质进行了差异丰度分析(图1)。
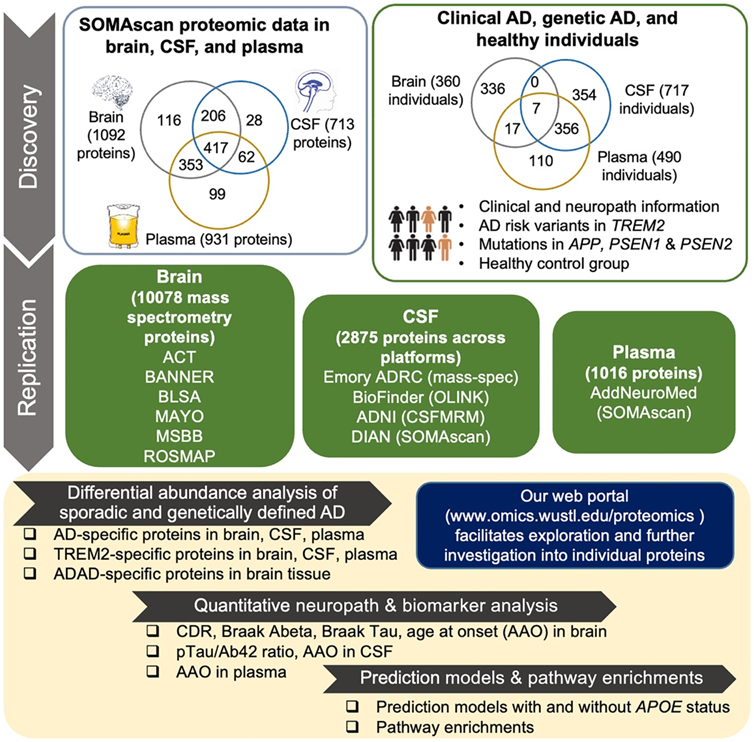
图1. 实验设计。
在大脑中,12 种蛋白质显示出与 AD 状态显著相关(图 2A)。所有这些蛋白还与其他AD相关特征显著相关,包括发病年龄和AD神经病理特征[如Braak评分和死亡时的临床痴呆评分(CDR)]。为了检查脑、脑脊液和血浆的一致性,他们检测了这些蛋白质是否也与脑脊液和血浆中的AD风险或发病有关。在12种与AD状态相关的脑蛋白中,只有6种同时存在于脑脊液(CSF)和血浆样本中。其中,5个蛋白[sparc相关模块钙结合蛋白1 (SMOC1),肝细胞生长因子(HGF),卵泡抑素样蛋白1 (FSTL1),泛素结合酶E2 (UBC9)和神经上皮细胞转化1 (NET1)]在脑脊液和血浆中与AD状态或发病年龄相关。
为了在发现队列中复制他们的发现,他们下载了来自成人思想变化(ACT)、班纳太阳健康研究所(Banner)、巴尔的摩衰老纵向研究(BLSA)、梅奥诊所(Mayo)、西奈山脑库(MSBB)和宗教秩序研究和记忆与衰老项目(ROSMAP)的质谱数据。他们整合了这些质谱数据集,包括来自415名AD患者和194名对照(称为MassSpec Joint)的10078种蛋白质,随后对AD状态进行了差异丰度分析。在这些数据集中的9种蛋白质中,8种复制方向一致[中期因子(Midkine)、SMOC1、嗜铬粒蛋白a (CgA)、HGF、neurexin-1-β (NRX1B)、UBC9、NET1和血清淀粉样蛋白p成分(SAP)](图2D)。
在脑脊液中,117种蛋白与临床AD状态显著相关(图2B)。在这117种蛋白质中,78种也在脑和血浆中发现,27种蛋白质[包括细胞外信号调节激酶1 (ERK-1)和富含亮氨酸重复序列激酶2 (LRRK2)]在脑组织、CSF和血浆中得到验证。在所纳入的外部数据集中,40个蛋白质[包括14-3-3、钙调神经磷酸酶、SMOC1、GFAP、分泌磷蛋白1 (SPP1)和过氧化物还原酶1 (PRDX1)]复制方向一致(富集14 ~ 34倍)(图2D)。
在血浆中,经过多重测试校正后,有 26 种蛋白质与散发性 AD 状态相关(图 2C)。在与 AD 状态相关的 26 种血浆蛋白中,有 16 种在大脑和脑脊液中发现,7 种蛋白[包括 ERK-1、细胞粘附相关、癌基因调节 (CDON) 和 SHC 适配器蛋白 1 (SHC1)] 复制方向一致。
使用蛋白质标记物的预测模型对于早期诊断和监测疾病进展至关重要。他们分别基于在脑、脑脊液和血浆中检测到的8、40和9种蛋白质创建了预测模型,并将性别和年龄作为协变量在外部数据集中进行了复制。基于8种脑蛋白的预测模型在区分AD病例和认知正常个体方面具有很高的准确性:发现的曲线下面积(AUC)为0.84,独立的MassSpec Joint数据为0.99(图2E-H)。基于脑脊液中检测到的40种蛋白质的预测模型在发现时的AUC为0.89,在Emory-ADRC质谱复制研究中为0.90(图2F-I)。对血浆使用相同的方法,基于这9种蛋白的预测模型在发现和AddNeuroMed复制数据中的AUC均为0.79(图2G-J)。
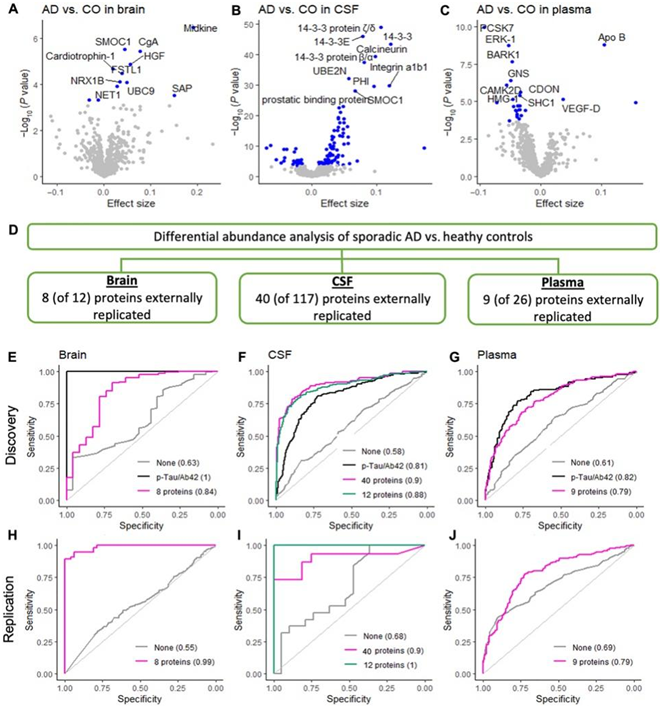
图2. 散发性 AD 和外部复制的蛋白质组学分析。
(A-C)火山图显示了差异丰度。(D)总结显示鉴定和外部复制的脑、脑脊液和血浆蛋白的数量。(E-J)受试者工作特征(ROC)曲线显示了外部复制蛋白(脑中8个,脑脊液中40个,血浆中9个)在区分AD患者和健康对照(CO)方面的表现。
02
基于脑、CSF和血浆蛋白的TREM2风险变异携带者的蛋白质组学特征
已经发现TREM2中几种罕见的编码变异,它们使AD的风险增加了近两倍。因此,他们旨在鉴定TREM2中携带AD风险变异个体的脑组织、CSF和血浆中的蛋白质组学特征。鉴于不同TREM2变异的发生频率较低,将其合并为一组TREM2风险变异携带者。他们分别生成了21、47和131名TREM2变异携带者的脑、CSF和血浆蛋白质组学数据,并将他们的蛋白质丰度与认知正常个体和不具有TREM2变异的散发性AD患者的蛋白质丰度进行了比较(图3A-F)。
在大脑中,与认知正常个体相比,TREM2风险变异携带者在多重测试校正阈值下改变了9种蛋白质(包括α-突触核蛋白)(图3A)。此外,与其他散发性AD相比,TREM2风险变异携带者中有23种蛋白(包括LRRK2)发生了改变(图3D)。五种蛋白[谷丙转氨酶(ALT)、热休克蛋白70 (HSP70)、HSP70蛋白8、垂体腺苷酸环化酶激活多肽27 (PACAP-27)和蛋白酶体亚基α -1 (PSA1)]普遍存在,表明它们在所有三组(TREM2变异携带者、健康对照组和其他散发性AD病例)中具有不同的蛋白丰度。正如他们所证明的,本项研究的研究设计是一种可行的替代方法,可以识别在外部数据集中复制的蛋白质,利用这些数据来识别那些在脑组织、脑脊液和血浆中复制的蛋白质。在大脑中发现的27种TREM2相关蛋白(结合9和23种蛋白- 5种常见蛋白)中,11种仅在脑脊液中复制,6种仅在血浆中复制,5种[ALT、α-突触核蛋白、粒细胞抑制因子(MIS)、LRRK2和血小板活化因子乙酰水解酶(PAFAH) β亚基]在两种液体中都有复制(图3G)。在脑脊液中,与健康对照相比,TREM2变异携带者中有31种蛋白发生了改变(图3B),与其他散发性AD病例相比,TREM2变异携带者中有10种蛋白发生了改变(图3E)。三种蛋白(核苷二磷酸激酶A、生长抑素-28和凝血酶)是常见的。在这38种蛋白中,20种在脑中复制,4种在血浆中复制,7种在脑组织和血浆中复制[14-3-3E, 14-3-3蛋白ζ/δ、生长抑素-28、SMOC1、泛素、醌氧化还原酶样1 (QORL1)和钙调神经磷酸酶] (图3G)。
在血浆中,他们共鉴定出69种蛋白质:与健康对照相比,TREM2变异携带者中65种蛋白质发生了改变(图3C);与其他散发性AD相比,TREM2变异携带者中有7个蛋白发生改变(图3F)和3个蛋白重叠[富含表皮生长因子样结构域1 (CREL1)、Cripto和枯草杆菌蛋白转化酶/kexin 7型(PCSK7)的半胱氨酸](图3F)。在这69种蛋白质中,24种蛋白质存在于大脑中,9种蛋白质在脑脊液中复制,21种蛋白质在血浆中复制[包括骨蛋白多糖II, pappalysin 1 (PAPP-A), ERK-1和血管细胞粘附分子1 (VCAM-1)](图3G),代表了122倍的富集。
他们还建立了预测模型,可以在散发性AD病例和脑脊液和血浆对照中区分TREM2变异携带者和非携带者。在脑脊液中,基于脑组织、脑脊液和血浆中复制的7种蛋白质的预测模型提供了0.79的AUC,用于区分TREM2变异携带者和认知正常个体(图3H)。同样的模型显示,将TREM2变体携带者与其他散发性AD病例区分开来的AUC为0.84(图3J)。虽然脑脊液p-tau/ Aβ42比值是区分AD病例和对照组的一个很好的生物标志物,但之前没有研究报道过脑脊液p-tau/ Aβ42比值如何预测TREM2变异携带者。在这项研究中,TREM2变异携带者与认知正常个体相比,CSF p-tau/ Aβ42的AUC为0.74,TREM2变异携带者与其他ad的AUC为0.53。他们基于7种蛋白质的TREM2相关预测模型的AUC值均显著高于基于CSF p-tau/ Aβ42比率的模型(图3H)。在血浆中,他们基于21种蛋白在脑组织、脑脊液和血浆中复制的预测模型提供了0.93的AUC来区分TREM2变异携带者和健康个体(图3I)。预测性能显著高于基于CSF p-tau/ Aβ42比值的模型。同样,在区分TREM2风险变异携带者与其他AD病例时,基于相同21种蛋白的预测模型提供了0.90的AUC(图3K),这明显高于CSF p-tau/ Aβ42比值的AUC。由于蛋白质的数量很大,他们进行了逐步的模型选择,发现了9个蛋白质的子集,它们在区分TREM2变异携带者与认知正常个体和其他散发性AD病例方面的auc分别为0.89和0.88(图3I-K)。
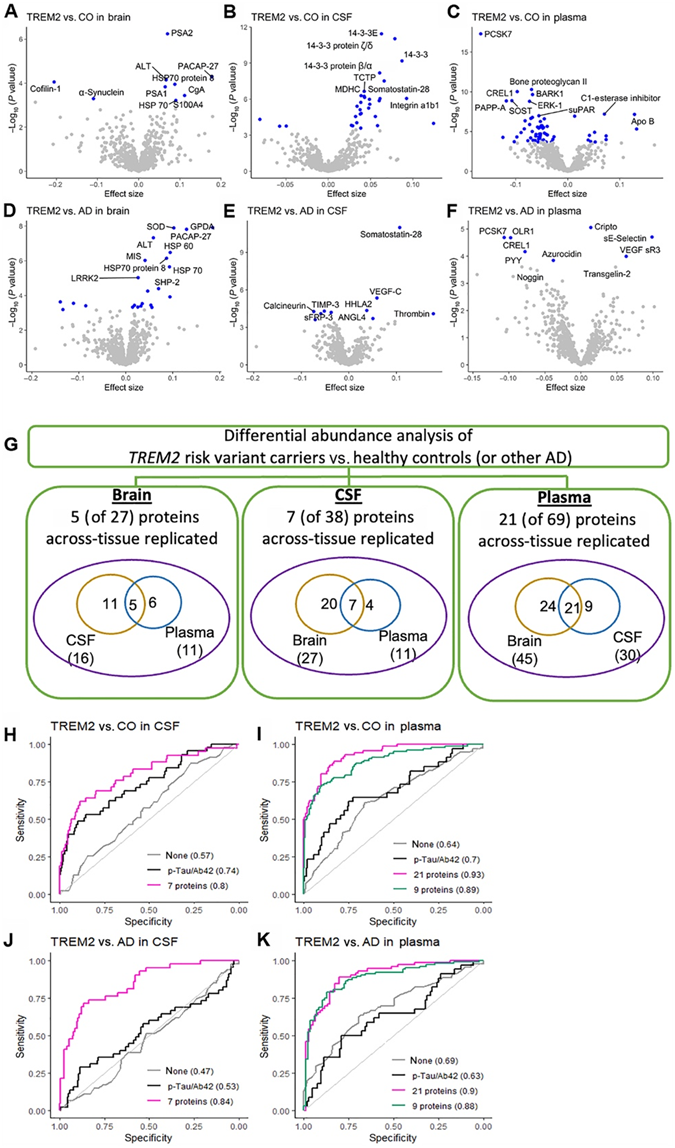
图3. TREM2变异携带者状态和脑组织、脑脊液和血浆复制的蛋白质组学分析。
(A-C) 火山图显示了TREM2变异携带者和健康对照 (CO) 之间差异丰度。(D-F) 火山图显示脑部和 CSF 中针对差异丰度TREM2变异携带者和不带任何TREM2变异的散发性 AD 病例测试的所有蛋白质的表达。尽管此处标记了排名前 10 的蛋白质。(G) 总结显示三种组织中已识别的跨组织复制蛋白质。(H-K) 组织特异性 ROC 曲线显示基于跨组织复制的蛋白质的预测模型的性能。
03
常染色体显性 AD (ADAD)的蛋白质组学特征
为了鉴定与 ADAD 状态相关的蛋白质,他们从 DIAN 和 Knight ADRC 研究中招募的 24 名携带致病性 ADAD 变异体的个体(19 名携带PSEN1个体、1 名携带PSEN2个体、4 名携带APP变异体)的顶叶皮质生成了蛋白质组数据。与在多重测试校正阈值下没有大脑病理的认知正常个体相比,他们发现 ADAD 突变携带者中有 109 种蛋白质发生了改变(图 4A)。由于 ADAD 病例比认知正常对照组年轻得多,因此该模型未纳入年龄变量,以避免共线性导致模型预测不准确。然而,这可能会导致假阳性,因为一些重要的蛋白质可能与年龄有关,而不是与 ADAD 状态有关。为了解决这个问题,他们在对照组中鉴定了 98 个与年龄相关的蛋白质,具有显著性(图4B)。
为了验证其余 92 个蛋白是否也与 CSF 中的 ADAD 状态相关,他们分析了 DIAN 研究中 289 个 ADAD 突变携带者和 184 个非携带者的 CSF 蛋白。在大脑中鉴定的 92 种蛋白质中,14个在脑脊液中因ADAD状态改变,且改变方向一致(图 4C)。接下来,他们利用这14种蛋白质来创建区分ADAD突变携带者和非携带者的潜在预测模型。使用大脑中这14种蛋白质的预测模型提供了1的AUC,将ADAD病例与健康对照完全分开(图 4D)。在脑脊液数据中,同样的14种蛋白质比仅考虑性别的模型提供了更高的预测性能(图 4E)。
如前所述,他们在脑组织中鉴定了12种与散发性AD状态相关的蛋白质(图2A)。他们还试图确定散发性AD状态改变的蛋白质是否在ADAD患者中表现出类似的改变。与健康个体相比,与散发性AD脑相关的大多数蛋白质在AD个体中表现出更强的改变。与散发性AD状态相关的蛋白质在阿尔茨海默病脑样本中平均高出36%(图4F)。例如,SMOC1不仅与散发性AD状态有显著关联,而且与更大程度的ADAD也有显著关联(图4G)。同样,与AD相比,其他蛋白质,包括SAP、HGF、CgA和NET1在ADAD中的失调程度更严重(图4H-K)。如前所述,在脑脊液和血浆中,SMOC1也与散发性AD状态有关,这表明它可以用来建立一个新的AD预测模型。
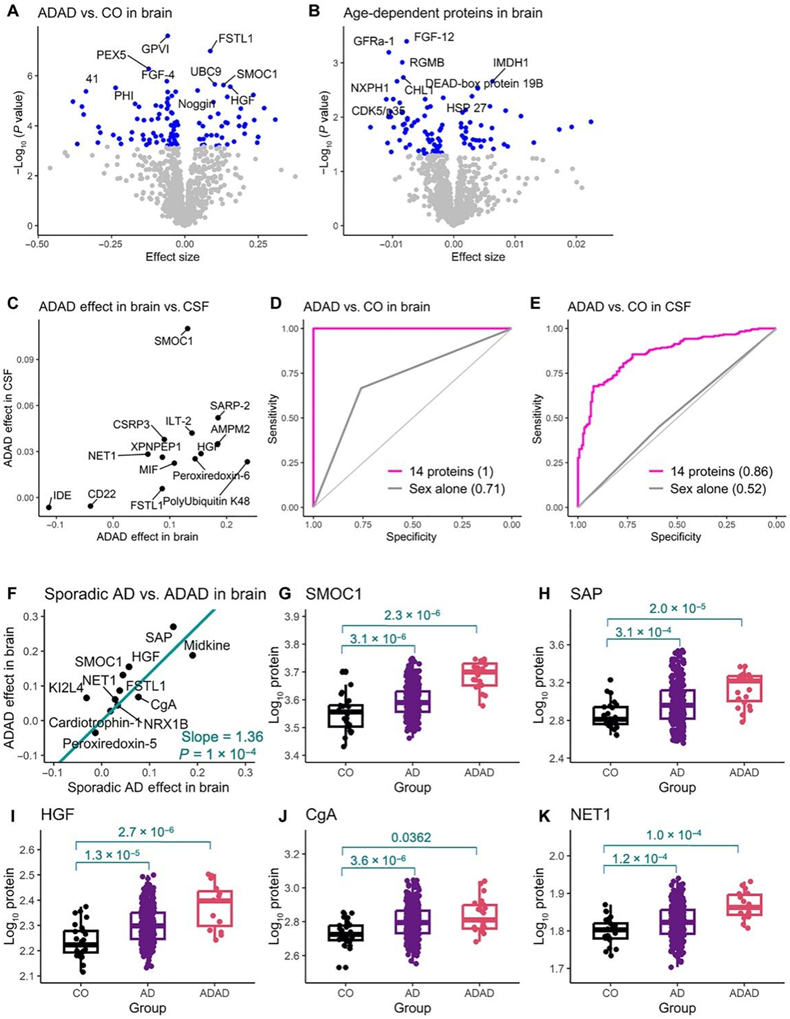
图4. ADAD 状态的蛋白质组学分析。
(A) 火山图显示ADAD 患者和健康对照 (CO) 个体之间大脑中蛋白质丰度(x轴)及显著性(y轴)。(B) 火山图显示大脑中蛋白质丰度分析(x轴)与依赖于年龄的统计显著性(y轴)的关系。( C到E ) CSF 中复制的 14 种蛋白质的散点图及其在大脑和 CSF中的预测模型。(F) 与散发性 AD 状态相关的 12 种蛋白质的散点图。(G-K) 选定的五种蛋白质(SMOC1、SAP、HGF、CgA 和 NET1)的箱线图。
04
AD蛋白质的功能途径分析
最后,他们使用 Enrichr 检测了本项研究中确定的蛋白质的功能途径。正如预期的那样,鉴定出的 AD 途径蛋白富集,包括 Apo E ( APOE )、钙调神经磷酸酶 [蛋白磷酸酶 3 调节亚基 B、α ( PPP3R1 ) 和蛋白磷酸酶 3、催化亚基 ( PPP3CA )] 和 ERK-1 [丝裂原激活蛋白激酶 3 ( MAPK3 )](图5A-B)。除了 AD 途径外,在散发性 AD 和TREM2变异携带者中发现的改变的蛋白质在帕金森病 (PD) 途径中富集。在PD途径的蛋白中,α-突触核蛋白(SNCA)在散发性AD和TREM2携带者中与对照组相比都发生了改变。同样,LRRK2在散发性AD和TREM2携带者中发生改变。他们还发现散发性AD和TREM2携带者中鉴定的蛋白在先天免疫系统途径中富集。特别是,散发性AD的蛋白质富集于中性粒细胞介导的免疫途径。该途径中的蛋白包括骨桥蛋白(SPP1)和整合素a1b1 (ITGB1)等。
散发性AD最富集的途径是程序性细胞死亡和细胞凋亡的内在途径,其中包括几种14-3-3蛋白(YWHAE和YWHAZ)。这表明与 AD 发病机制相关的一些细胞死亡是由细胞凋亡调节的,而不是由于坏死、嵌入、铁死亡或溶酶体依赖性细胞死亡所致。包括成纤维细胞生长因子信号途径和表皮生长因子(EGF)受体信号途径,也是散发性AD的主要途径之一。trem2特异性蛋白富集最强烈的途径是胆囊收缩素(CCK)受体信号。该途径包括ITGB1、PPP3CA、YWHAB和MAPK3。CCK是一种在大脑包括海马中高度表达的饱腹感激素。研究表明,在ADNI队列中,CSF CCK与记忆评分、较高的CSF tau和p-tau值有关。由ADAD特异性蛋白富集的途径也揭示了涉及该AD亚型相关的生物学过程。显著上调的途径包括蛋白水解、细胞过程负调控、B细胞增殖调控和肽基酪氨酸磷酸化调控。它们包括胰岛素降解酶(IDE)和巨噬细胞迁移抑制因子(MIF),巨噬细胞迁移抑制因子是一种参与先天免疫反应的促炎细胞因子。IDE参与胰岛素的细胞分解,并参与神经元和小胶质细胞自然分泌的Aβ蛋白的降解和清除。这些蛋白也富集于细胞因子介导的信号途径,表明炎症也在ADAD中发挥作用。
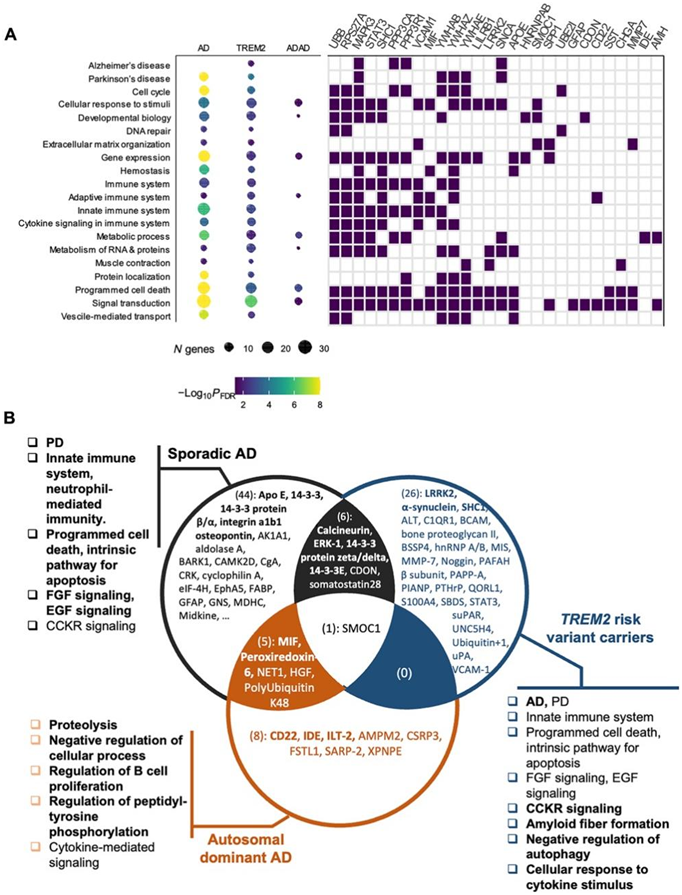
图5. 散发性和基因定义的 AD 的途径富集。
(A)(左)点图显示了散发性 AD 患者、TREM2携带者和 ADAD 患者共有的几种途径。点的大小对应于已识别基因的数量。点的颜色对应于 FDR 校正的显著性。(右)平铺图显示属于特定途径的差异表达基因。(B) 维恩图显示了三组 AD 中已识别蛋白质的重叠:散发性 AD 的 56 个外部复制蛋白质、 TREM2的 33 个跨组织复制蛋白质以及 ADAD 的 DIAN CSF 数据中复制的 14 个蛋白质。
+ + + + + + + + + + +
结 论
本项研究提出了一项蛋白质组学研究,分析了散发性 AD 患者、TREM2风险变异携带者、ADAD患者和健康个体的脑组织、脑脊液 (CSF) 和血浆中的 1305 种蛋白质,确定了散发性 AD 患者中 8 个大脑蛋白、40 个脑脊液蛋白和 9 个血浆蛋白发生了改变,并且在几个外部数据集中复制了这些发现。本项研究发现了一种蛋白质组学特征,可以将TREM2变异携带者与散发性 AD 患者和健康个体区分开来。ADAD 患者中与散发性 AD 相关的蛋白质也发生了改变,但影响更大。与 ADAD 相关的脑源性蛋白质也在其他脑脊液样本中得到复制。富集分析强调了几个途径,包括与 AD(钙调神经磷酸酶和 Apo E)、帕金森病(α-突触核蛋白和 LRRK2)和先天免疫反应(SHC1、ERK-1 和 SPP1)有关的途径。本项研究结果表明,脑组织、脑脊液和血浆的组合蛋白质组学可用于识别散发性和基因定义的 AD 标记物。
+ + + + +



 English
English


