文献解读|Cancer Discov(28.2):ONC201 在 H3K27M 突变型弥漫性中线胶质瘤中的临床疗效是由综合代谢和表观遗传途径的破坏驱动的
✦ +
+
论文ID
原名:Clinical Efficacy of ONC201 in H3K27M-Mutant Diffuse Midline Gliomas Is Driven by Disruption of Integrated Metabolic and Epigenetic Pathways
译名:ONC201 在 H3K27M 突变型弥漫性中线胶质瘤中的临床疗效是由综合代谢和表观遗传途径的破坏驱动的
期刊:Cancer Discovery
影响因子:28.2
发表时间:2023.11.01
DOI号:10.1158/2159-8290.CD-23-0131
背 景
弥漫性中线胶质瘤 (DMG) 中的组蛋白突变 H3K27M(包括 H3.3 和 H3.1/H3.2)与侵袭性临床行为和 11 至 15 个月的中位总生存期 (OS) 相关。正在研究的小分子 ONC201 是一种多巴胺受体 D2 (DRD2) 拮抗剂,通过激活综合应激反应 (ISR) 以及灭活 AKT 和 ERK,显示出治疗浓度下的脑渗透性和针对神经胶质瘤和其他实体瘤的临床前活性,但背后的机制仍不清楚。
实验设计
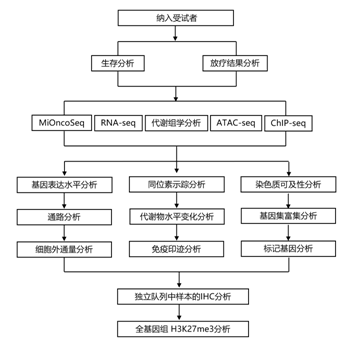
结 果
01
试验设计和患者特征
研究者团队报告了最近完成的2项临床研究(NCT03416530和NCT03134131)中ONC201在H3K27M-DMG中的临床结果。在ONC201-014 (NCT03416530)中纳入了30 名患者,在ONC201-018 (NCT03134131)纳入了41 名患者。使用 ONC201 治疗的非复发性 H3K27M-DMG 患者的中位总生存期 (OS)为诊断后 21.7 个月。尽管两项试验之间的 OS 似乎不同,但它们之间的中位 OS 没有统计学差异,ONC201-014 中OS为 21.7 个月,ONC201-018 中OS为 13.9 个月(图 1A)。接受 ONC201 治疗的非复发性 DMG 患者的中位无进展生存期 (PFS)为从治疗开始起 7.3 个月。试验之间的中位 PFS 没有统计学差异,ONC201-014中的PFS为 9.4 个月,ONC201-018中为 4.8 个月(图 1B)。ONC201-014 和 ONC201-018 中接受 ONC201 治疗的复发性肿瘤患者的中位 OS 为 9.3 个月,因为 ONC201-014 中复发性肿瘤患者数量较少(图1C)。ONC201-014/018中接受ONC201治疗的复发性DMG患者的中位PFS为3.4个月(图1D)。
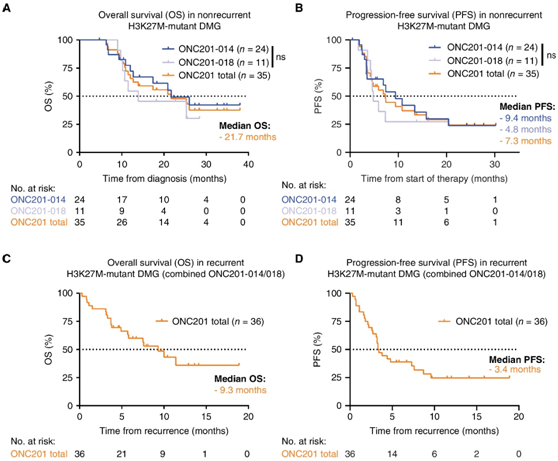
图1. 使用 ONC201 治疗的 H3K27M-DMG 试验患者的生存结果。
(A-D) Kaplan-Meier 曲线分析。
他们使用 ONC201 治疗的患者根据高级别神经胶质瘤 (HGG) 的神经肿瘤学反应评估 (RANO) 标准进行放射学分析。在ONC201-014试验中,患者的最佳反应表现为6例(31.6%)部分缓解(PR), 7例(36.8%)疾病稳定(SD), 6例(31.6%)疾病进展(PD)(图2a)。治疗期间到PR的中位时间为复发后8个月,放射学反应的中位持续时间为14个月(图2B)。ONC201-018的患者表现为9例(40.9%)PR、8例(36.4%)SD和5例(22.7%)PD(图2C)。服用ONC201-018的患者中位缓解持续时间为8个月,达到PR的中位时间为7.6个月(图2D)。
接下来,他们对ONC201-014中的非复发患者进行了脑灌注成像分析。相对脑血容量(nrCBV)与OS、nrCBV与PFS呈显著负相关(图2E-F)。
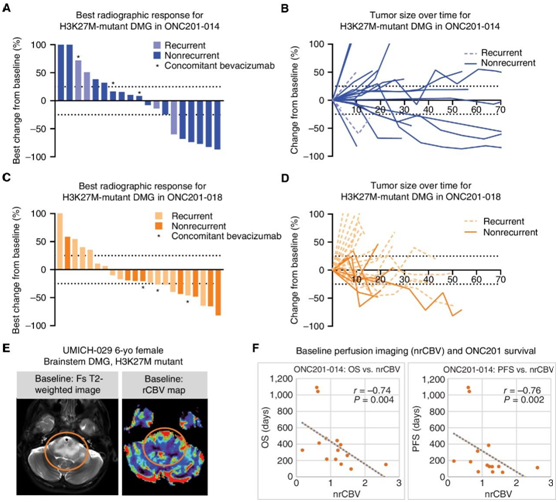
图2. 使用 ONC201 治疗的 H3K27M-DMG 试验患者的放射线评估。
(A-B)瀑布图和蜘蛛图代表来自ONC201-014的H3K27M-DMG患者对ONC201的放射反应。(C-D)瀑布和蜘蛛图表示来自ONC201-018的H3K27M-DMG患者对ONC201的放射学反应。(E)来自 UMICH-029 的代表性动态磁敏感对比灌注 MRI 图像。(F) ONC201-014 的 H3K27M-DMG 中标准化相对脑血量(X轴)与 OS(左)或 PFS(右)之间的相关性。
02
使用 ONC201 治疗的 H3K27M-DMG 患者的放射基因组分析
为了探索对 ONC201 表现出放射学反应的 H3K27M-DMG 患者的分子属性,他们分析了单机构队列 (UMich),其中进行了基线肿瘤 DNA/ mRNA测序 (MiOncoSeq)(图3A)。与线粒体代谢相关的基因和基因组上调,包括类固醇生物合成、氧化磷酸化和三羧酸循环(TCA),与临床放射学反应呈正相关(图3B)。丙酮酸脱氢酶 B (PDHB)、琥珀酸脱氢酶 B (SDHB)、富马酸水合酶 (FH) 和 ATP 柠檬酸裂解酶 (ACLY) 属于 TCA 循环相关基因,与 ONC201 治疗患者更好的放射反应相关(图3C)。相反,T细胞受体信号通路和Wnt通路相关基因,包括GLI3、WNT10B和APC,与较差的放射反应相关(图3C)。
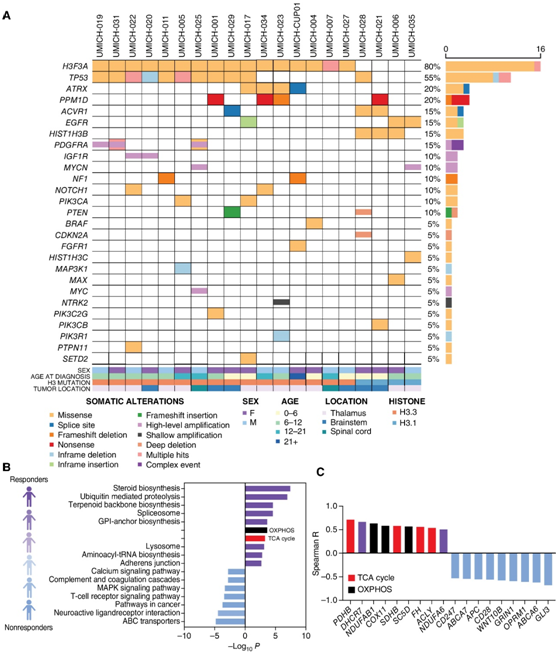
图3. 使用 ONC201 治疗的 H3K27M-DMG 试验患者的分子属性。
(A)使用 ONC201 治疗的UMich 队列(非复发性 H3K27M-DMG)中的体细胞驱动基因改变,获得了基线 DNA/mRNA测序数据。(B)在非复发性 H3K27M-DMG 中进行个体基因表达水平 (RNA) 和最佳肿瘤反应之间的相关性。(C)代表显著的 TCA 循环相关(红色)、OXPHOS(黑色)和其他具有正相关(紫色)或负相关(浅蓝色)的基因。
03
ONC201 放射反应与代谢酶的表达相关
他们对用 ONC201(5 μmol/L)与载体处理的 H3.3K27M DIPG007 细胞进行了转录组分析(RNA-seq)和代谢组学分析(图4A-B)。综合分析显示 TCA 循环、糖酵解和丙酮酸代谢是最下调的途径。同时,与糖酵解和TCA循环代谢相关的关键因子发生下调,包括葡萄糖转运蛋白(SLC1A3)、己糖激酶2 (HK2)、丙酮酸脱氢酶复合物(PDC) -PDHB、二氢脂酰胺乙酰转移酶(DLAT)、二氢脂酰胺脱氢酶(DLD) -氧戊二酸脱氢酶(OGDH)、SDHB和ACLY(图4C)。h3.3 k27m突变DMG细胞显示糖酵解和糖酵解能力均降低(图4D)。
此外,细胞外通量分析还降低了线粒体功能的多个参数,包括基础呼吸、最大呼吸、质子泄漏、ATP产生和备用呼吸能力(图4E)。OGDH将α-酮戊二酸(α-KG)代谢为琥珀酸盐,与OGDH降低一致,onc201处理的细胞与载体处理的细胞的快照代谢物分析显示α-KG水平升高(图4F)。与丙酮酸脱氢酶表达减少一致,乳酸水平上调。同时,其他 TCA 循环相关代谢物(包括琥珀酸)的减少,以及 SDHB 下游代谢物(包括苹果酸和天冬氨酸)的减少(图4F-H)。相反,谷氨酰胺代谢上调,谷氨酰胺和下游谷氨酸水平增加(图4F-H)。在三个独立的 H3.3K27M 细胞系中,OGDH、ACLY、PDHB、DLD、DLAT 和 SDHB 的蛋白水平降低,但 HK2 的蛋白水平没有降低(图 4G)。然而,FH 与 ONC201 治疗患者更好的放射学反应相关(图 3C),但在 ONC201体外治疗后没有变化(图 4G),这表明了一种可能性:即在患者组织中观察到的一些 ONC201 驱动的代谢变化(但在 H3K27M 肿瘤细胞系中未观察到)可能代表肿瘤微环境细胞的变化。
为了确定与临床数据的相关性,他们通过将 ONC201 处理与载体处理的 DIPG007 细胞的 RNA-seq数据与最佳放射反应分析的基因表达重叠进行了无偏分析(图4I)。该分析将PDHB、ACLY和SDHB确定为与放射反应呈正相关的基因,并且在体外ONC201 处理的细胞中同时下调(图 4I)。这些结果确定了参与线粒体 TCA 循环代谢的基因作为 H3K27M 突变 DMG 患者对 ONC201 放射学反应的可能预测因子。
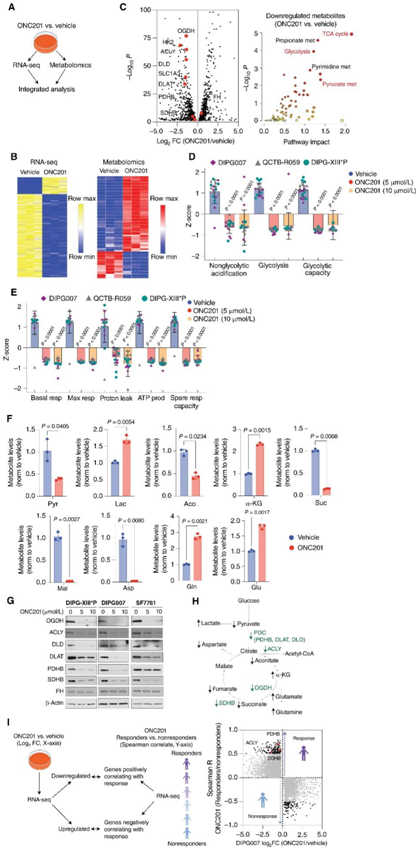
图4. ONC201 放射反应与代谢酶的表达有关。
(A)H3.3K27M DIPG007 细胞用载体或 5 μmol/L ONC201 处理 48 小时,然后进行 RNA-seq 和代谢组学分析。(B)热图显示 ONC201 与载体处理后 RNA-seq(左)和代谢物(右)的上调和下调基因。(C)下调基因的综合结果表示为火山图和途径影响分析图。(D)H3.3K27M-DMG 细胞中糖酵解应激测试的 Seahorse 数据。(E) H3.3K27M-DMG 细胞氧化磷酸化应激测试的 Seahorse 数据。(E) H3.3K27M-DMG 细胞氧化磷酸化应激测试的 Seahorse 数据。(G)免疫印迹分析。(H) 糖酵解和 TCA 循环代谢的示意图。(I)将A中 ONC201 或载体处理的 DIPG007 细胞中的 RNA-seq 数据。
04
ONC201 破坏综合代谢和表观遗传途径
H3K27M 突变以与异柠檬酸脱氢酶突变 (IDH1m) 神经胶质瘤相反的方式驱动整合的代谢和表观遗传途径。IDH1m 神经胶质瘤将 α-KG 转化为 2-羟基戊二酸 (2HG)。2HG 可以抑制组蛋白赖氨酸去甲基化酶的 Jumonji C 结构域 (JmjC) 家族,以增加组蛋白赖氨酸甲基化,包括 H3K27me3。H3K27M 和 IDH1m 是相互排斥的,相反,H3K27M 细胞利用 α-KG 来维持低 H3K27me3。ONC201处理的H3K27M细胞中的高α-KG水平(图4F)使他们假设ONC201处理可能导致异常的整合代谢和表观遗传途径。
于是,他们用[13C6]标记的葡萄糖或[13C5]标记的谷氨酰胺对H3.3K27M DIPG007细胞进行代谢追踪研究(图5A)。在onc201处理的细胞中,谷氨酰胺代谢升高,谷氨酰胺衍生的α-KG增加(图5B)。相比之下,ONC201处理降低了葡萄糖来源的α-KG。他们观察到谷氨酰胺衍生的α-KG在onc201处理的细胞中代谢为2HG(图5B)。在三个独立的H3.3K27M细胞系(DIPGXIII*P、DIPG007和SF7761)中,ONC201显示增加了2HG的产量(图5 c)。
接下来,他们评估了是否可以检测到接受 ONC201 治疗的 H3K27M-DMG 患者脑脊液样本中 2HG 水平的变化。对来自 ONC201-014 的 ONC201 治疗患者的连续 CSF 样本进行了无偏代谢组学分析。相比于无反应患者,在onc201治疗的有反应患者中,2HG和谷氨酸都显示出增加的趋势(图 5D)。一名患者在接受ONC201治疗时肿瘤体积下降超过50%,与治疗开始时相比,脑脊液2HG升高(图5E)。相比之下,在ONC201治疗未表现出放射学反应,也未观察到类似的2HG升高(图5F)。
正如所预期的,D-2HG水平在IDH1m R132H TB096细胞中较高,但在经或未经ONC201处理的H3.3K27M细胞中可忽略不计(图5G)。相反,与载体处理的H3.3K27M细胞相比,ONC201处理的L-2HG水平显著增加,并且在IDH1m R132H TB096细胞中未检测到(图5H)。
2HG 的 L-和 D-对映体都是 α-KG 依赖性双加氧酶(包括组蛋白去甲基酶)的有效抑制剂(图 5I)。然而,L-2HG 表现出比 D-2HG 更大的效力。H3K27M 突变肿瘤的定义是 H3K27me3 水平整体降低。有趣的是,ONC201处理后导致多种H3.3/3.1K27M细胞系中H3K27me3水平呈剂量依赖性增加(图5J),同时,H3K36me3 水平也发生增加(图5J)。遗传和药理学抑制乳酸脱氢酶A(LDHA)消除了ONC201介导的H3K27me3增加(图5K-L)。L-2HG 和 D-2HG 具有特定的脱氢酶(分别为 L-2HGDH 和 D-2HGDH),可将每种亚型转化回 α-KG。L-2HGDH的过表达逆转了SF7761和DIPG007细胞中ONC201介导的H3K27me3增加(图5M-N)。
这些结果证明 ONC201 诱导 H3K27M-DMG 细胞中产生更有效的 2HG L-对映体,从而导致 H3K27me3 增加。
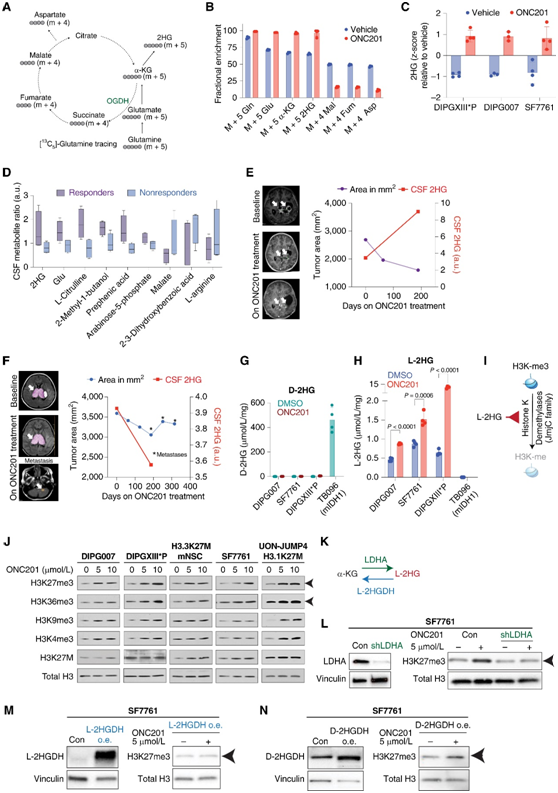
图5.ONC201 破坏整合的代谢和表观遗传途径。
(A)[13C5 ]-谷氨酰胺追踪到 TCA 循环的示意图,表明每种代谢物的预测质量同位素。(B)条形图显示用载体(蓝色)或 5 μmol/L ONC201(红色)处理 48 小时的 H3.3K27M DIPG-007 细胞中各种代谢物。(C)条形图显示用载体(蓝色)或 5 μmol/L ONC201 处理的 H3.3K27M DIPGXIII*P、DIPG-007 和 SF7761 细胞中 2HG 水平(Y轴、Z 分数,通过 LC-MS 测量)(红色)48 小时。(D)箱线图,显示来自 ONC201 治疗的 H3K27M-DMG 患者的 CSF 样本中的代谢物测量值。(E)响应者患者 UMICH-006 的肿瘤面积(左Y轴,紫线)和 CSF 2HG 水平(右Y轴,红线)。(F)无反应患者 UMICH-022 的肿瘤面积和 CSF 2HG 水平。(G-H)对映体特异性质谱分析。(I)卡通图显示 L-2HG 抑制 Jumonji C (JmjC) 结构域组蛋白赖氨酸去甲基化酶,导致组蛋白甲基化增加。(J-N)免疫印迹分析。
05
ONC201 降低与细胞周期和神经胶质细胞分化相关的基因的染色质可及性
接下来,他们进行了转座酶可及染色质测序 (ATAC-seq)、H3K27ac 染色质免疫沉淀测序 (ChIP-seq),注意到启动子和增强子的染色质可及性均降低(图6A-B),并且与载体处理的H3K27M DIPG007细胞相比,ONC201导致1161个染色质可及性降低的基因下调。基因集富集分析 (GSEA) 显示与细胞周期和神经元发育相关的途径下调(图6C),H3K27ac 主要在增强子处减少(图 6D-E)。与对照组相比,ONC201 处理导致1602 个基因下调,这些基因对应于主要与 GSEA 细胞周期调节相关的途径的下调(图 6F)。染色质可及性降低和H3K27ac富集的下调基因包括GFAP、Nestin和编码Soronin蛋白的CDCA5,该蛋白在细胞分裂过程中调节姐妹染色单体的内聚(图6G-H)。
H3K27M 肿瘤具有异常的富含 H3K27ac 的超级增强子。与载体处理的细胞相比,ONC201 处理的细胞中的 H3K27M 特异性 H3K27ac 标记的超级增强子整体减少(图6I),这也与ONC201处理下超增强子相关基因(包括GFAP、OLIG2、DAXX、SMARCD2和KDM2A)的表达降低相对应(图6J)。他们将下调的h3k27ac标记基因与公开的人类H3K27M-DMG样本的单细胞RNA-seq数据相比较,发现其主要与循环肿瘤细胞相对应(图6K)。
这些结果表明,在h3k27m突变的DMG细胞中,ONC201在表观遗传上下调了与神经胶质分化和细胞周期相关的基因。
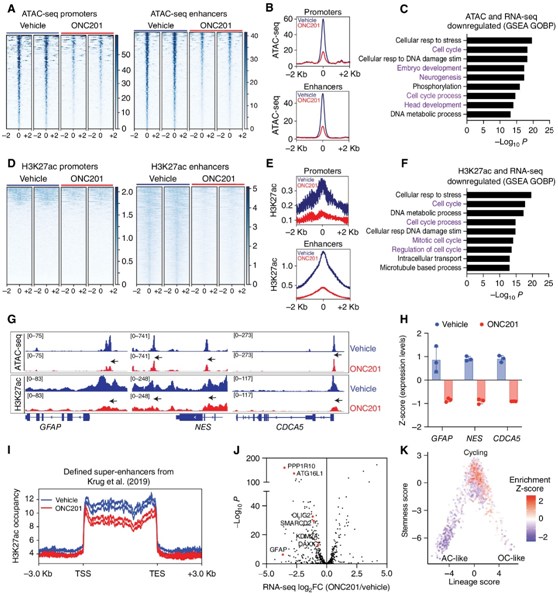
图6. ONC201 降低了与细胞周期和神经胶质细胞分化相关的基因的染色质可及性。
(a-B) 热图显示用载体或ONC201处理的H3.3K27M DIPG007细胞启动子和增强子的染色质可及性(ATAC-seq)。(c) 启动子和增强子染色质可及性(ATAC-seq)降低基因的GSEA。 (d-E) 热图显示了DIPG007细胞在用载体或ONC201 (5 μmol/L ONC201)处理48小时后启动子和增强子上的基因组H3K27ac。(F) 启动子和增强子上H3K27ac富集减少的基因的GSEA。(g) 在GFAP、NES和CDCA5上,onc201处理(红色)或载体处理(蓝色)的细胞中具有代表性的ATAC-seq和H3K27ac ChIP-seq轨迹。(h) GFAP、NES和CDCA5在onc201处理(红色)或载体处理(蓝色)细胞中的表达。(i) 在onc201处理(红色)和载体处理(蓝色)的H3.3K27M DIPG007细胞中分析H3K27M肿瘤中富集h3k27ac的超增强子。(j)RNA-seq基因表达的火山图显示ONC201处理与载体处理的细胞中h3k27ac标记的超增强子减少的基因。(K) 在公开的单细胞RNA-seq数据上预测的下调h3k27ac标记基因。
06
ONC201 治疗可增加 H3K27M-DMG 患者肿瘤中的基因组 H3K27me3
在两个独立的非重叠队列中,与未处理的H3K27M-DMG肿瘤样本相比,ONC201处理的H3K27M肿瘤细胞中H3K27me3水平整体增加(图7A-D)。此外,组合免疫组化(IHC)证实H3K27M阳性肿瘤细胞中H3K27me3增加(图7E)。与两名未接受治疗的患者相比,两名接受onc201治疗的h3k27m-dmg患者的H3K27me3总体基因组范围更高(图7f-L),并且在治疗时间较长的患者中最高(UMICH-012)。尽管存在这种差异,但在onc201治疗组与未治疗组患者中,H3K27me3显著升高的基因主要与包括神经元分化在内的形态发生/分化相关途径相关(图7J)。他们还确定了onc201治疗组与未治疗组h3k27m - dmg中H3K27me3的基因组再分布,注意到基因组H3K27me3启动子、外显子、内含子和3'UTR区域增加(图7G)。相比之下,基因组H3K27me3在基因间区域减少(图7G),这表明ONC201将H3K27me3从基因间区域重新分配到基因区域(图7G)。
这些数据表明,通过 IHC 和基因组检测,ONC201 治疗会增加 H3K27M-DMG 患者中 H3K27M 肿瘤细胞的 H3K27me3 水平(图7K)。
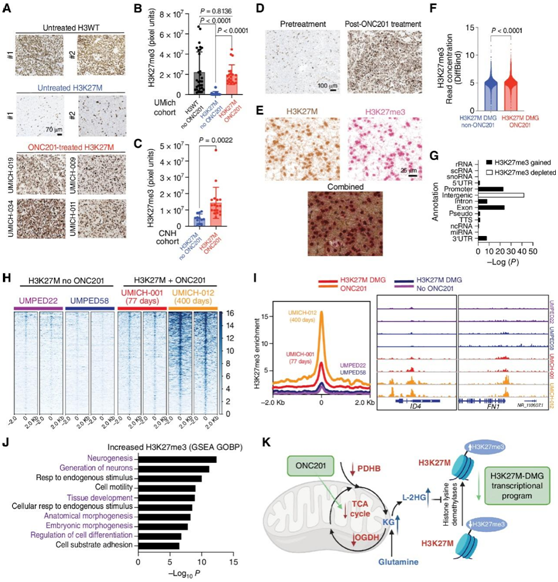
图7. ONC201 治疗可增加 H3K27M-DMG 患者肿瘤中的基因组 H3K27me3。
(a) 来自未经处理的 H3WT、未经处理的 H3K27M-DMG 和 ONC201 处理的 H3K27M-DMG 患者肿瘤样本的 H3K27me3 染色的代表性图像。 (b) 未经 ONC201 处理的 H3WT(黑色)、未经 ONC201 处理的 H3K27M(蓝色)中 H3K27me3 的定量。(c) H3K27me3表达的定量。 (d) 来自UMich队列的H3K27M-DMG肿瘤样本的代表性图像。(e) 来自UMich队列的onc201治疗的H3K27M- dmg肿瘤样本的代表性图像,用H3K27M(棕色)和H3K27me3(红色)的联合免疫组化染色。(f) H3K27M-DMG肿瘤样本的ChIP-seq中全基因组的H3K27me3。 (g) H3K27me3基因组在H3K27M-DMGs肿瘤样本中的比较。(h) 热图显示H3K27me3在H3K27M-DMG肿瘤样本中的基因组水平。(i) 左图为onc201处理和非onc201处理的H3K27me3基因组的总体峰值代表。右,每个肿瘤样本中具有代表性的H3K27me3基因ID4和FN1轨道。(j)onc201治疗组与未治疗组患者中H3K27me3显著升高基因的GSEA。(K) ONC201对h3k27m - dmg代谢和表观遗传信号影响的总体机制示意图。
+ + + + + + + + + + +
结 论
本项研究评估了两项已完成的多中心临床研究中接受治疗的患者的临床结果、肿瘤测序和组织/脑脊液 (CSF) 相关样本。初次放疗后、复发前接受 ONC201 治疗的患者的中位总生存期为 21.7 个月,而复发后接受 ONC201 治疗的患者的中位总生存期为 9.3 个月。放射反应与基线肿瘤测序中关键三羧酸循环相关基因的表达增加相关。ONC201 治疗增加了培养的 H3K27M-DMG 细胞和患者脑脊液样本中的 2-羟基戊二酸水平。这与体外和人类肿瘤中抑制性 H3K27me3 的增加相对应,并伴有细胞周期调节和神经胶质分化基因的表观遗传下调。总体而言,ONC201 通过破坏整合的代谢和表观遗传途径并逆转特有的 H3K27me3 减少,在 H3K27M-DMG 中发挥功效。
+ + + + +



 English
English


