文献解读|iScience(5.8):综合系统生物学表征了鼠寨卡病毒小头畸形中免疫介导的神经发育变化
✦ +
+
论文ID
原名:Integrative systems biology characterizes immune-mediated neurodevelopmental changes in murine Zika virus microcephaly
译名:综合系统生物学表征了鼠寨卡病毒小头畸形中免疫介导的神经发育变化
期刊:iScience
影响因子:5.8
发表时间:2023.05.18
DOI号:10.1016/j.isci.2023.106909
背 景
2015-2016年寨卡病毒(ZIKV)在美洲流行的急性危机导致了一系列先天性寨卡病毒感染导致的中枢神经系统发育异常,统称为先天性寨卡综合征。感染病毒的儿童表现为严重的发育迟缓、癫痫发作、视力/听力异常以及与小头畸形、颅内钙化、脑回异常和脑室扩大等脑部结构异常相关的关节挛缩。尽管已做了大量的研究,先天性ZIKV感染的神经发病机制仍不完全清楚。
实验设计
结 果
01
免疫活性 ZIKV 小头畸形小鼠模型的蛋白质组学和基因表达分析
研究者团队对从已建立的免疫活性先天性 ZIKV 感染小鼠模型中收集的胚胎大脑进行了基于定量质谱的蛋白质组学和 RNA转录组分析(图1 A)。对怀孕的野生型 CD-1 小鼠在胚胎第 10.5 天 (E10.5) 进行胎盘内注射 ZIKV 或注射磷酸盐缓冲盐水 (PBS) 作为对照(Mock) (图1 A)。与E16.5时的对照组相比,实验中使用的ZIKV注射胚胎显示出更小的大脑和降低9.6%的脑壁厚度(图1B-D)。将定量蛋白质组学工作流程应用于E14.5的胚胎大脑,以捕捉导致小头畸形的分子事件的早期阶段。实现了大脑发育蛋白质组的全面覆盖,从而鉴定了>8000个蛋白质,并准确定量了亚细胞区室中>6800个蛋白质(图1A)。他们检测到 ZIKV 多蛋白的总序列覆盖率 > 40%,肽映射到所有 ZIKV 编码结构和非结构病毒蛋白,信号肽 2K 除外,不包含胰蛋白酶可裂解位点(图1E)。与对照组的大脑相比,ZIKV感染的大脑中的ZIKV丰度在多蛋白丰度(7倍变化)和病毒RNA拷贝数方面显著增加(图1F)。
有趣的是,尽管注射了相同滴度的病毒,但每个胚胎的 ZIKV 多蛋白表达均表现出差异,这反映了 ZIKV 在注射胚胎内的活跃繁殖(图1F)。
他们利用每个感染大脑中ZIKV多蛋白丰度的光谱来研究宿主蛋白对病毒载量的剂量反应。宿主细胞周期进展蛋白和病毒多蛋白蛋白丰度呈负相关。鉴定了与细胞周期相关的宿主蛋白,如细胞周期蛋白依赖性激酶1(CDK1)和CDK2、染色体组织和DNA复制、DNA复制复合物的组成部分,包括复制起源复合物(ORC)、迷你染色体维持(MCM)复合物、Condensin复合物、组蛋白乙酰化(HAT)复合物,以及与ZIKV多蛋白丰度呈负相关的后期促进复合体/环体(APC/C)(图1G-H)。
免疫组织化学 (IHC) 染色结果显示,E16.5 感染 ZIKV 的胚胎皮质板中神经元数量减少。即TBR1、CTIP2 和 SATB2 阳性的神经元减少了 25%(图1I-J)。
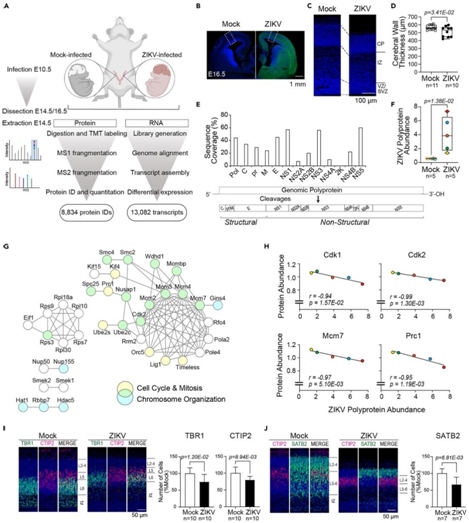
图1. 胚胎 ZIKV 感染再现了人类小头畸形,并显示了细胞周期相关蛋白的病毒载量依赖性失调。
(A) 对照 (PBS) 或ZIKV感染大脑的多重蛋白质组分析和 RNA 转录组分析 (RNA-seq) 工作流程。(B) 在 E10.5时ZIKV 感染后,在 E16.5 处对大脑进行免疫组织化学 (IHC) 染色。(C) E16.5 处初级体感区域的 IHC 染色。(D) E16.5 时脑壁的总厚度。(E)蛋白质组学鉴定的ZIKV多蛋白和潜在加工多蛋白的结构和非结构蛋白组成序列。(F) E14.5 时ZIKV 感染大脑中 ZIKV 多蛋白的平均标准化丰度。(G) 与 ZIKV 多蛋白丰度具有强负相关性的蛋白质相互作用网络。(H) 所选细胞周期相关蛋白、细胞周期蛋白依赖性激酶 1 (Cdk1)、Cdk2、微型染色体维持复合物组分 7 (Mcm7) 和细胞分裂蛋白调节器 1 (Prc1) 的总归一化蛋白丰度。(I-J) IHC染色分析。
02
ZIKV 感染激活干扰素诱导的先天免疫和抗原呈递通路
定量蛋白质组学分析在 E14.5 时鉴定出胚胎大脑中 84 个显著上调和 16 个显著下调的蛋白质(图 2A)。基因本体生物学过程 (GOBP) 分析显示,富集最多的通路是参与免疫应答的通路,如固有免疫应答、抗原处理和呈递以及对细胞因子的应答(图2B)。此外,蛋白质组学数据集中还显示了肿瘤坏死因子产生的正向调节和细胞凋亡信号通路的正向调节。层次聚类分析证明了 ZIKV 胚胎中丰度显著增加的蛋白质子集(图2C),该子集中的蛋白质与先天免疫反应以及抗原加工和呈递有关。
他们对蛋白质进行了差异分析,发现信号转导子和转录激活子1(STAT1)、骨髓基质细胞抗原2(BST2)和干扰素 (IFN) 刺激基因15 (ISG15) 是最显著上调的蛋白质,表明ZIKV诱导的IFN诱导的Janus激酶(JAK)-STAT通路的激活(图2C-D)。他们进一步检测到免疫蛋白酶体复合物亚基(PSMB8、9、10,亮橙色和PSME1、2,橙色)、MHC-I肽负载复合物(TAP1、TAP2、TAPBP、B2M,黄色)、MHC-I蛋白(H2-D1、H2-K1,亮粉色)以及T细胞和B细胞信号蛋白(FCER1G、LCP1和NFATC4,浅粉色)的丰度升高。
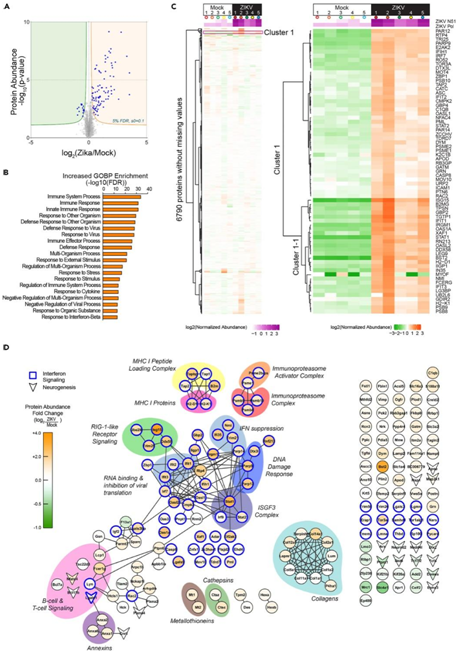
图2. 蛋白质组学数据显示ZIKV感染大脑中干扰素诱导的免疫通路和抗原呈递通路的激活。
(A) 基于中值标准化蛋白质丰度值,ZIKV感染与对照的 E14.5 脑组织(中蛋白质表达倍数变化 (log2(ZIKV/Mock)) 的火山图。(B) GOBP分析。(C) 6790 个蛋白质的层次聚类。(D) 蛋白质的相互作用网络丰度显著变化。
03
ZIKV感染后会上调JAK/STAT通路下游细胞因子
RNA-Seq 数据揭示了 ZIKV 感染后在 E14.5 转录水平上的差异(491 个上调和 69 个下调)(图3A)。丰度升高的转录本包括那些参与 IFN 诱导的 JAK/STAT 信号通路的转录本,例如STAT1、STAT2、IFN 调节因子 1 (IRF1)和C 型蛋白酪氨酸磷酸酶受体 (Ptprc,编码 CD45)(图3B)。此外,他们检测到由JAK/STAT通路激活诱导的细胞因子的升高,包括C-C基序趋化因子配体 (CCL)2/5/9、C-X-C基序趋化因子配体(CXCL)9、克隆刺激因子(CSF)1、分泌型磷蛋白(SPP)1和肿瘤坏死因子超家族成员(TNFSF)10(图3C)。他们还检测到参与抗原呈递通路的转录本丰度增加,如免疫蛋白酶体PSMB 8/9/10、MHC Ia(H2-D1和H2-K1)和MHCIb(图3D),表明抗原通过MHC-1递呈。此外,他们发现同种异体移植物炎症因子1(IBA1)和跨膜蛋白119 (TMEM119) 丰度升高(图3E),这表明巨噬细胞/小胶质细胞的募集。进一步进行qPCR分析,证实ISG15和OAS1g mRNA表达水平升高(图3F)
6218 个转录本-蛋白质对的 RNA 水平和蛋白质水平动态比较证明了本项研究的数据集中转录本和蛋白质丰度的对应关系(图 3G-H)。这些转录本-蛋白质对显示出 RNA 和蛋白质的高度对应性。表达水平增加(图3H),大多数转录本-蛋白质对都涉及免疫反应。
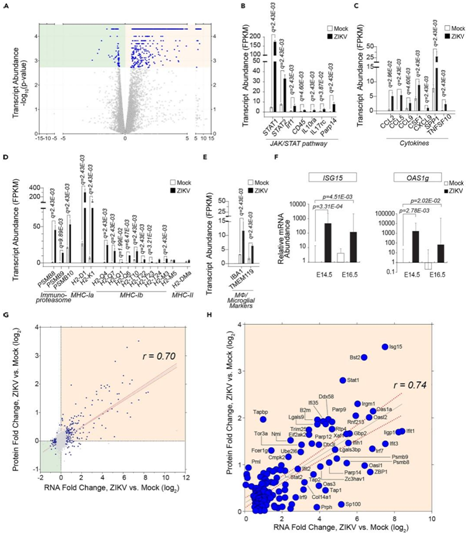
图3. RNA 测序数据捕获胚胎脑中干扰素诱导的细胞因子产生和巨噬细胞/小胶质细胞浸润。
(A) ZIKV 与模拟感染的 E14.5 脑组织中转录本表达的火山图。(B) 基于 RNA-Seq 分析的 Janus 激酶/信号转导子和转录激活子 (JAK/STAT) 通路中分子的平均相对转录丰度 (FPKM)。(C) FPKM 值中显示的细胞因子的定量。(D) FPKM 值中显示的免疫蛋白酶体以及 MHC-I 和 MHC-II 分子的定量。(E) 巨噬细胞/小胶质细胞标记物的 FPKM 值。(F) 干扰素 (IFN) 刺激基因 15 (ISG15) 和 2'-5' 寡腺苷酸合成酶 1G (OAS1g) 的 qPCR 分析。(G) 6218 个转录本-蛋白质对的蛋白质和 RNA 水平上感染诱导的倍数变化的相关性。(H) ZIKV 感染后转录本-蛋白质对丰度增加。
04
ZIKV 感染抑制细胞周期进程并下调神经发育信号级联
接下来,他们分析了 30 个转录本-蛋白质对,这些转录本-蛋白质对显示出丰度持续下降,至少在转录组或蛋白质组数据集中发生了显著的变化。在这些转录蛋白对中,有10对在人类中引起孟德尔遗传后的神经发育疾病,这些疾病的表型与先天性寨卡综合征重叠(图4A)。
另外 7 个下调的转录本-蛋白对在发育中的大脑中具有关键功能(图 4 A),包括远端少同源框 2 (DLX2)、E1A -结合蛋白 P400 (EP400)、驱动蛋白家族成员 26A (KIF26A)、Plexin A4 (PLXNA4)、蛋白酪氨酸磷酸酶受体 Z1 型 (PTPRZ1)、癫痫相关 6 同源物 (SEZ6) 和 T 淋巴瘤侵袭和转移诱导蛋白2 (TIAM2)。
为了研究这些神经发育调节因子的下调是否会导致其调节通路的预期下游效应,他们根据先前对E14.5小鼠皮层EOMES/TBR2和NEUROD2结合染色质的全基因组ChIPseq分析,检测了ZIKV感染后丰度改变的转录本。在 ZIKV 感染的大脑中,丰度下降的转录本中有 18% 是 响应EOMES/TBR2 反应的,而在整个转录组只有 3% 的转录本丰度下降(图4B)。同样,丰度下降的转录本中有 40% 是响应 NEUROD2 反应的,而整个转录组中这一比例为 7%(图 4 C)。为了表征 NEUROD2-EOMES/TBR2 信号级联的下游后果,他们建立了一个 NEUROD2 和 EOMES/TBR2 响应基因的网络,这些基因在转录本表达中受到干扰,并确定了其他下调转录本之间的连接性。在丰度下调的转录本中,EOMES/TBR2 在度数(节点上发生的链接数量,在本例中为神经发育基因)和接近中心性(节点之间的平均最短路径)方面都是得分最高的网络节点,其次是 SATB2、TCF4、Basic-Helix-Loop-Helix 家族成员 E22 (BHLHE22)、TBR1 和 CTIP2(图 4 D),强调 EOMES/TBR2 作为与胚胎大脑发育相关的关键 ZIKV-扰动分子。
与转录物和蛋白质水平结果一致,组织学证实E14.5和E16.5脑壁室下区(SVZ)的EOMES/TBR2阳性细胞数量减少,E16.5心室区 (VZ) 的性别决定区Y-Box 2 (SOX2) 阳性细胞数量下降(图 4E-F)。此外,与E16.5时对照组的大脑相比,ZIKV感染的大脑中磷酸组蛋白H3 (PHH3) 阳性和抗原Ki67阳性细胞的数量分别减少了32.3%和20.7%(图4G-H)。
此外,在本研究中蛋白质组学数据集中, ZIKV感染的大脑中细胞周期蛋白依赖性激酶抑制剂1B (p27Kip1)的丰度增加了7.9%(图4I)。这些发现表明 ZIKV 感染抑制 NPC 细胞周期进展和增殖。此外,STAT1 蛋白表达水平与 SOX2和 EOMES/TBR2呈负相关(图4 J),表明ZIKV感染后JAK/STAT通路激活与NEUROD2-EOMES/TBR2信号级联抑制之间存在相关性。
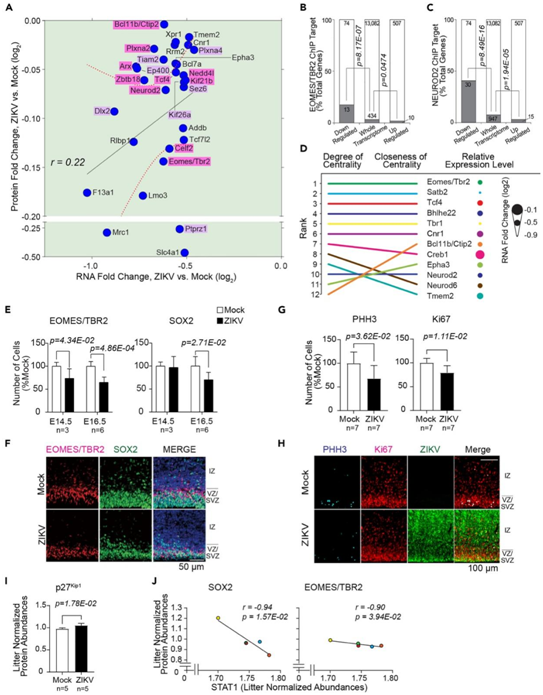
图4. ZIKV诱导关键神经发育蛋白下调。
(A) ZIKV 感染后丰度减少的转录本-蛋白质对。(B) 相对于整个转录组数据集中存在的 EOMES/TBR2 ChIP 靶标,Eomesodermin/T-box 脑蛋白 2 (EOMES/TBR2) ChIP 靶标在 ZIKV 响应转录组的下调和上调子集中富集。(C) 相对于整个转录组数据集中存在的 NEUROD2 ChIP 靶标,神经元分化 2 (NEUROD2) ChIP 靶标在 ZIKV 响应转录组的下调和上调子集中富集。(D) NEUROD2/TBR2 信号网络中互连节点的中心性和相对 RNA 表达水平的程度和接近度。(E) E14.5 和 E16.5 时 EOMES/TBR2 阳性和性别决定区 Y-Box 2 (SOX2) 阳性细胞的定量。(F)对照或 ZIKV 感染的胚胎脑的 VZ/SVZ 和 IZ、EOMES/TBR2(红色)、SOX2(绿色)和 Hoechst(细胞核,蓝色)的IHC 染色。(G) E16.5时磷酸化H3 (PHH3)阳性和Ki67阳性细胞的定量。(H) 对照或 ZIKV 感染的 E16.5 大脑的 IZ 和 VZ/SVZ 的 IHC 染色。(I) E14.5 处细胞周期蛋白依赖性激酶抑制剂 1B (p27 Kip1) 蛋白的归一化丰度。(J) 神经发育基因的归一化丰度与 STAT1 丰度的相关性。
+ + + + + + + + + + +
结 论
本项研究利用综合系统生物学、蛋白质组学和转录组分析(RNA-seq),探究了具有免疫功能的野生型先天性 ZIKV 感染小鼠模型的胚胎脑组织。ZIKV 诱导了强烈的免疫反应,同时下调了关键的神经发育基因程序。 ZIKV 多蛋白丰度与宿主细胞周期诱导蛋白之间存在负相关。他们进一步发现了基因/蛋白质的下调,其中许多基因/蛋白质已知导致人类小头畸形,包括脱中胚层蛋白/T-box 脑蛋白 2 (EOMES/TBR2) 和NEUROD2。神经祖细胞和有丝分裂后神经元中不同分子通路的干扰可能导致先天性 ZIKV 感染的复杂脑表型。总之,这项关于蛋白质和转录水平动态的研究通过对发育中大脑中胎儿免疫反应的表征,增强了对 ZIKV 免疫病理学的理解。
+ + + + +



 English
English


