文献解读|Cell Rep Med(14.3):滤泡性淋巴瘤 B 细胞表现出异质性转录状态并伴有相关的体细胞改变和肿瘤微环境
✦ +
+
论文ID
原名:Follicular lymphoma B cells exhibit heterogeneous transcriptional states with associated somatic alterations and tumor microenvironments
译名:滤泡性淋巴瘤 B 细胞表现出异质性转录状态并伴有相关的体细胞改变和肿瘤微环境
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.02.23
DOI号:10.1016/j.xcrm.2024.101443
背 景
滤泡性淋巴瘤(FL)是一种起源于生发中心(GC)的惰性非霍奇金淋巴瘤,具有显著的生物学和临床异质性,目前对FL的异质性缺乏全面的了解。
实验设计
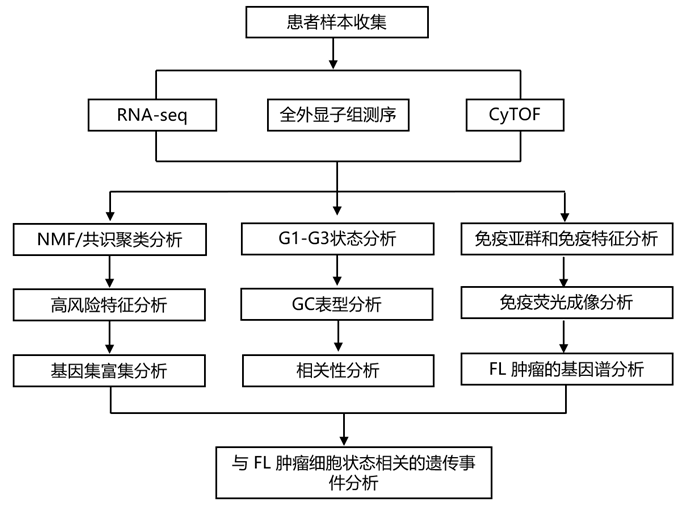
结 果
01
滤泡性淋巴瘤B细胞转录状态分析
为了识别 FL 肿瘤中独特的 B 细胞转录状态,研究者团队对来自 FL 肿瘤和良性淋巴结的分离 B 细胞进行了转录组分析(RNA-seq)、全外显子测序(WES)(图1A)。他们实施非负矩阵分解(NMF)和共识聚类来定义患者之间稳定细胞状态的理想数量。根据迭代 NMF 运行的共识聚类选择标准将 3 个 FL B 细胞组 (G1–G3) 确定为最稳定(图1B)。为了确定聚类是否由肿瘤活检部位或临床特征(组织学分级、分期、FLIPI)驱动,他们寻找每个特征与单个聚类的关联,发现与组织学分级和FLIPI评分显著相关(图1C)。
他们使用匹配的bulk RNA-seq样本,根据免疫应答-1 (IR-1)、IR-2和23基因高危特征对样本进行评分(图1D)。鉴于每个基因组内存在较大的组内变异性,G1-G3 并未表现出与这些特征的关系。然而,与 G1 的有利结果非常相似,与不良结果呈正相关的 23-基因高风险特征与 G2 相比,G1 的趋势较低。

图1. FL B细胞转录组分析。
(A) 用于数据生成的样本示意图。(B) 200 NMF 在 FL 和良性 B 细胞基因表达上运行的共识聚类图结果。(C) 诊断临床属性与每个 B 细胞 NMF 组之间的比例关联。(D) 来自匹配批量、未分选肿瘤 RNA-seq 样本的 23 基因高风险特征和 IR-1/IR-2 特征的 B 细胞组特征评分。
02
FL B 细胞状态表现出独特的生物活性
他们研究了每个组的转录状态,每个样本的最高表达状态类似于共识聚类中对其分组的分配。为了确定基因对每个状态的贡献的等级顺序,他们根据特征权重与每个系数的正负关系对其进行评分,并发现许多对FL和B细胞生物学重要的基因与这3种状态中的每一种都强相关(图2 A)。G1包括炎症和B细胞运动呈正相关的基因(如白细胞介素-6 [IL-6]、 IFNGR1、S1PR1、APRIL、TACI),而B细胞转录调节因子(如MEF2B、EZH2)呈负相关。G2与参与DNA复制增殖和维持的基因(如MKI67、POLQ、RAD51、CCNB2)有很强的正相关。最后,将G3定义为典型的胃癌B细胞标记物(如CD38、EP300、MME [CD10])的高表达以及IRF4和BHLHE40的低表达,这两种标记物都抑制胃癌B细胞的表型转化。
基因集富集分析(GSEA)对各状态的基因贡献排序显示,3种状态之间存在352个显著的通路关联。在最重要的基因集中,出现了围绕炎症、生长/增殖和表观遗传重编程的显著样本间异质性模式(图2B)。G1状态最富集的程序与1型干扰素(IFN)信号、IL-6信号、MYD88/NF-κB(核因子κB)和抑制的细胞周期相关。G2状态主要是增殖信号、代谢重编程、B细胞受体(BCR)信号和对应激或损伤的反应。除MYD88/NF-κB和炎症负富集外,G3状态下与表观遗传重编程、代谢重编程和细胞粘附相关的程序呈正富集。
许多富集的基因集突出了每种状态下的协调功能,这些功能由1或2个突出每种状态下活性的基因集总结而成。他们观察到G1状态下IL-6、Janus激酶、信号转导和转录激活因子(STAT)信号的显著正富集和G2M细胞周期检查点的负富集,这突出了该状态的炎症抗增殖性质(图2C)。G2状态在哺乳动物雷帕霉素靶复合物1 (mTORC1)基因集和BCR复合物信号中都呈正富集,这两个基因集都能够激活和维持这种状态的增殖和成中心性质,以及G2状态下的许多其他富集基因集。最后,G3状态在染色质修饰方面呈正富集,总结了富集的众多相关表观遗传基因集,在抗原加工和提呈方面呈负富集。
B细胞在发育过程中经历多种表型和形态变化,所有这些变化都受少数主要转录调控因子的调控,如B细胞淋巴瘤6 (BCL6)、干扰素调节因子4 (IRF4)和PAX5等。接下来,他们使用VIPER检测了G1-G3状态下B细胞主调节因子的活性,以筛选出非冗余和重要的调节因子(图2D)。G1状态下,IFN刺激基因因子3复合体(IRF9、STAT1和STAT2)的所有3种蛋白的活性都显著增强,这些蛋白响应IFN-β信号。负责IFN-β产生的转录因子IRF7也显著富集,进一步表明1型IFN信号通路处于G1状态。这种状态也增加了KLF9的活性,已知KLF9抑制细胞周期进程;这与叉头盒蛋白M1 (FOXM1)和拓扑异构酶IIα (TOP2A)活性显著降低以及G2M基因组显著负富集一致(图2C)。细胞生长和增殖的正向调节因子(FOXM1、TOP2A、HMGA1、MYB)以及DNA损伤反应(蛋白激酶、DNA活化、催化亚基[PRKDC]、HMGB1)的G2状态显著富集。此外,G2状态富集了ILF2 (NFAT),它已由PRKDC进一步激活,两者都是BCR激活的下游。同样,G2状态在GC反应的调节因子FOXO1、CREB结合蛋白(CREBBP)和SPEN中表现出活性降低。G3状态下,参与维持核受体共抑制因子(NCOR)/SMRT(视黄酸和甲状腺激素受体转录抑制活性的沉默介质:BCL6、MEF2B、ZBTB5、ZBTB20、MLL、SPEN)的蛋白活性显著增加。总之,这些结果表明与炎症、免疫反应、细胞增殖、代谢重编程和染色质修饰相关的转录活性定义了 FL 肿瘤之间在 B 细胞水平上的转录异质性。
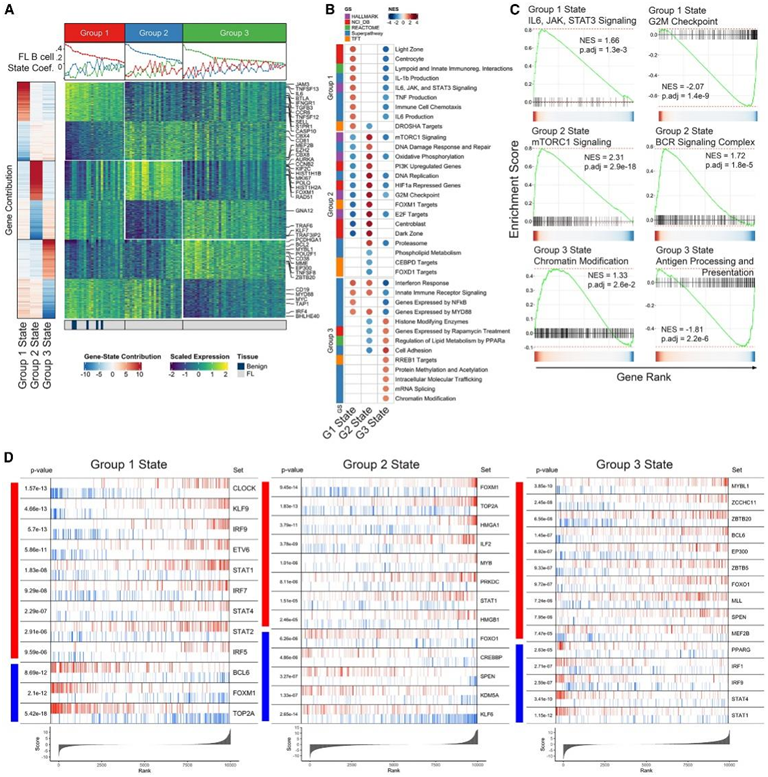
图2. 不同的FL B细胞基因表达状态突出了独特的生物活性。
(A)每个组状态的基因贡献分数。(中)组特征定义基因的相对基因表达热图。所选的感兴趣基因在右侧突出显示。(上)NMF H 矩阵中每个因子/状态的单独样本状态系数值。(B) 为每个组状态选择的重要基因集的归一化富集分数 (NES)。(C) 组状态 1(上)、2(中)和 3(下)的重要基因集的 GSEA 图。(D) 组态的 VIPER 调节器活性富集图。
03
GC 程序部分保留在 FL B 细胞组中
G1 和 G2 状态的最高正富集基因组包括中心细胞、中心母细胞、亮区和暗区。13种状态按照发育顺序排列,从暗区(DZ.a-DZ.c)、中间表型(INT.a-INT.e)、亮区(LZ. a和LZ.b)、到GC后的表型(前体记忆细胞[M]:preM;浆母细胞:PBL.a和PBL.b),每个样本在13种GC状态中至少有1种为显著阳性(图3A)。13个基因集分别独立检测,大多数样本(87.6%)在1个以上基因集上得分显著,通常来自相邻表型(即DZ.a和DZ.b)或相反表型(即DZ.c和preM)的阳性和阴性分数。基因表达模式也与每个样本中得分最高的基因集一致,突出了B细胞样本的异质性(图3B)。
每个GC基因集与FL B细胞组之间的关联的超几何检测显示,所有3组之间都有很强的相关性(图3C)。G1与GC后表型(preM和PBL.b)以及2种中间表型(INT. a和INT. d)有很强的相关性。INT.d和preM是发育连续表型,表明该FL亚群中的B细胞正在退出或已经退出GC反应。G2 与许多增殖表型 DZ.a、LZ.b 和 PBL.a 具有显著相关性,但与其余 DZ 表型的相关性较弱(图 3 C)。相反,G3 样本仅在 INT.e 表型中呈正富集,与 INT.d 和 preM 具有非常强的负相关性(图 3 C)。基于FL B细胞转录谱和在每组中确定的相关GC程序,他们分别将G1称为炎症记忆样(INFM)、G2为增殖暗区样(PDZ)、 G3为染色质修饰中间体(CMI)。
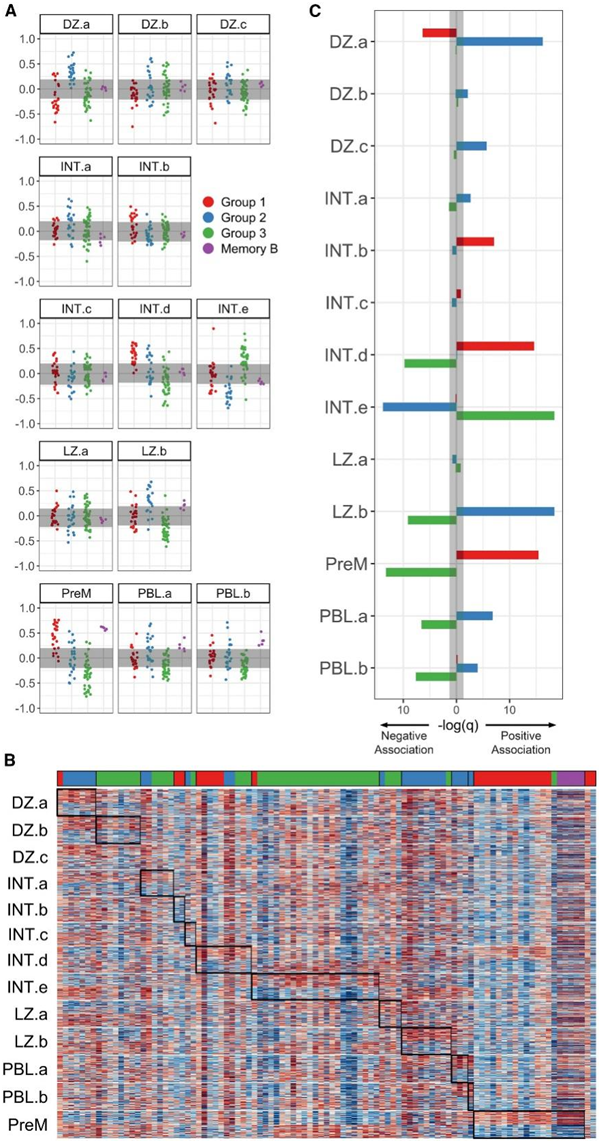
图3. FL B 细胞程序与独立 GC 表型相关。
(A) 每个样本的 GC B 细胞聚类基因集的预测分数。(B) FL B 细胞样本的标准化 RNA-seq 值热图。(C) 通过 B 细胞组分配的超几何测试进行 GC B 细胞聚类富集分析。
04
FL B细胞状态与特异性肿瘤免疫和基质相互作用相关
FL肿瘤在免疫细胞富集的肿瘤微环境(TME)中发展,每个患者肿瘤细胞的独特分子特征可能有助于逃避免疫监视或促进提供连续生长信号的环境。为了分析TME并鉴定FL样本中的免疫细胞亚群,他们使用了来自图1、2和3中匹配淋巴结样本的细胞悬液的细胞CyTOF数据,并使用表型算法进行聚类,鉴定了20个独特的细胞群(图4A),分为已知的主要和次要免疫亚群,包括T滤泡辅助(Tfh)细胞的4个亚群(图4B)。总体而言,所有样本的非B免疫细胞含量从2%到84%不等,在INFM中检测到的免疫细胞平均百分比最高(40%),在CMI中检测到的免疫细胞平均百分比最低(21%)(图4C)。此外,CMI和INFM状态之间的负相关关系与免疫含量显著相关,无论分组如何,这表明CMI和INFM B细胞状态与整体TME呈相反关系(图4D)。
为了确定INFM、PDZ和CMI与其免疫细胞含量之间的显著关系,他们首先使用相关矩阵将FL TME组织成细胞群落,当与层次聚类配对时,将丰度耦合的群体分组(图4E)。接下来,为了确定细胞丰度与3种B细胞状态之间的关系,他们对每种归一化B细胞状态的表达能力进行建模,以预测每个样品中细胞丰度的百分比。INFM 和 CMI 状态与可能的抗肿瘤和前效应细胞群落呈负相关(图 4 E)。
值得注意的是,INFM状态与促炎细胞类型,炎症单核细胞来源的树突状细胞(mDC), CD4 Th1效应记忆T细胞(Tem)和CD8 Tem有很强的正相关,这些细胞都能够分泌1型干扰素和肿瘤坏死因子α (TNF-α)。PDZ组中非b细胞含量的变化表明,与PDZ状态相关的细胞类型很少;PDZ与CD14+mDC和CD57hi“GC”Tfh细胞呈正相关,与ICOShi Tfh细胞呈正相关。此外,CMI状态与一半的细胞类型有显著的负相关,包括大多数含有T细胞的细胞群落。
为了确定基质细胞TME,他们使用匹配的冰冻切片的RNA-seq和预测的分组,对FL中的3种基质细胞(血管周细胞[DN]、滤泡树突细胞[FDC]和滤泡网状细胞[FRC])的表达特征的相对丰度进行评分。与免疫微环境类似,预测基质组成的最大差异在INFM和CMI之间。与CMI组相比,INFM组和PDZ组FDC和FRC的特征均显著升高(图4F)。此外,与CMI相比,INFM对DN间质细胞(称为周细胞)具有显著更高的特征。
他们对3组中每组的代表性肿瘤切片进行免疫荧光成像分析,CD21染色显示在INFM和PDZ中有明显的大滤泡,CD20染色显示B细胞与FDC密切相关(图4G)。相反,CMI样本的滤泡更小,边缘更软,CD20模式显示B细胞位置没有固有的结构组织。为了支持增殖特征,与INFM和CMI相比,PDZ样品还含有大量主要定位于滤泡的Ki-67细胞,INFM和CMI分别具有少量的Ki-67+ 和无定位。与图4E相似,INFM样品有丰富的CD8+ T细胞染色,主要定位于滤泡中的B细胞。与INFM样品相比,PDZ样品在B细胞隔离的滤泡中增强了CD4的表达,这支持了PDZ和Tfh细胞之间的关联。
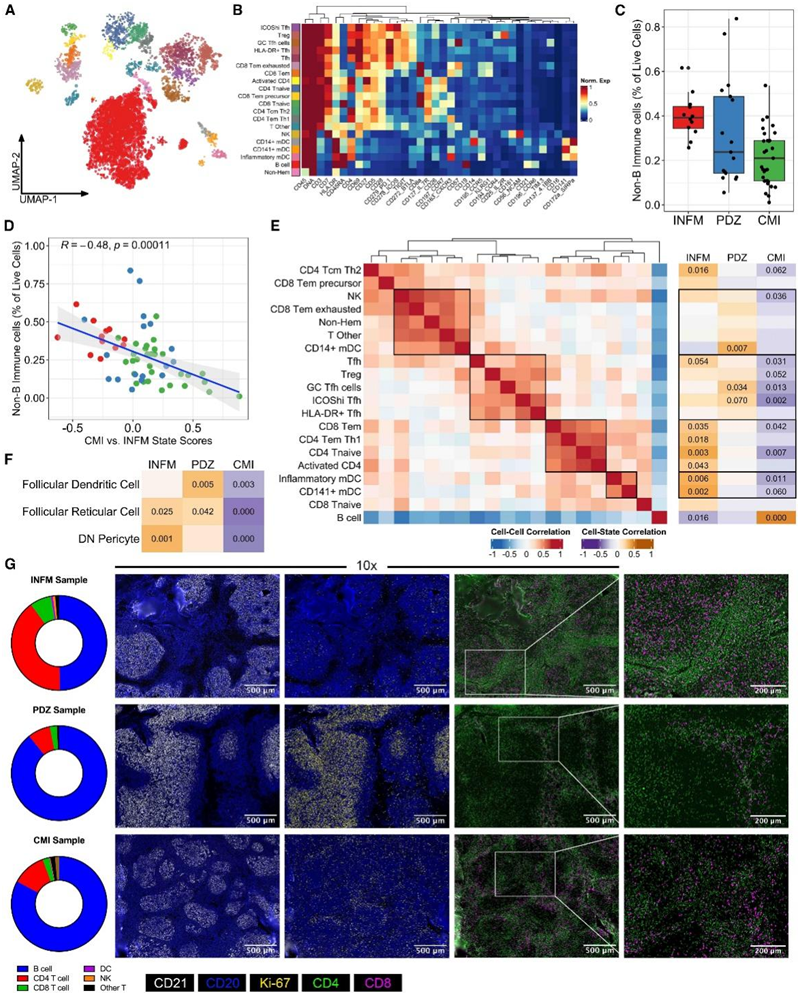
图4. FL B 细胞状态塑造其局部免疫特征。
(A) 来自单独分析的 FL 患者 CyTOF 样本的免疫元聚类的均匀流形近似和投影(UMAP)。(B) (A) 中提到的每个已识别聚类中平均表面蛋白表达的热图。(C) 免疫内容箱线图,以每个样本中活细胞按 B 细胞群的百分比表示。(D) CMI 与 INFM 状态系数差异与非 B 免疫细胞百分比(活细胞的百分比)之间的相关图。(E)(左)所有样本中细胞聚类丰度之间的相关矩阵热图。来自 Pearson 相关的单元格值。相关距离的树状图。(右)细胞丰度与样本 B 细胞群状态之间的 Pearson 相关性热图。(F) 使用已发表的 GC 基质基因集的 SingScore 和 B 细胞组状态的单样本基因集评分之间的 Spearman 相关性热图。(G)多重免疫荧光分析。
05
FL肿瘤的遗传谱
他们在整个基因组中发现了4个显著的拷贝数增加峰和7个显著的拷贝丢失峰(图5A)。这些区域包括REL、MYC和BCL2的增加,以及TNFAIP3、TNFRSF14和FAS的减少。此外,他们利用之前发表的BayesNMF模型得出了这些样本的突变特征情况,该模型揭示了这些样本中的3个突变特征(图5B)。Sig1是衰老的标志,在CpG基序上具有丰富的非聚集性C>T突变,并且与COSMIC标志1和患者年龄有很强的相关性。Sig3与许多DNA损伤反应特征一致,构成了大多数聚类状突变,其最丰富的取代类似于RCY基序中已知的激活诱导胞苷脱氨酶(AID) C>T/G突变(图5B)。
为了识别新的和先前描述的驱动基因,他们使用了openCRAVAT突变影响评分算法ChASM和VEST(图5C)。总的来说,他们确定了158个反复突变的蛋白,这些蛋白显示在肿瘤图中(图5C)。最常见的改变基因(>20%)是KMT2D、BCL2、TNFRSF14、CREBBP和MEF2B,所有这些基因的突变频率都与COSMIC数据库中报道的FL相似。
为了确定每个突变基因和拷贝数变异(CNV)的早期和晚期事件的频率,他们使用ABSOLUTE检测每个变异的估计癌细胞比例(CCF),并进一步将它们分为克隆(CCF≥0.85)和亚克隆(图5D)。大多数CNV主要是克隆基因,这些基因在克隆事件平均接近50%的队列中更频繁地发生突变,KMT2D除外。综上所述,这些数据强调了CNV作为重要遗传事件的重要性,并扩大了FL中已知复发性体细胞改变和早期遗传事件的广度。

图5. FL 体细胞变化景观。
(A) 对 WES 识别的 CNV 进行 GISTIC 2.0 分析。(B) 突变特征三核苷酸单碱基取代谱。(C) FL 患者个体突变和 CNV 事件的 Oncoplot。(D)克隆与亚克隆事件的比率。
06
遗传事件与FL肿瘤细胞状态有关
他们下一步研究了每个状态之间遗传特征的富集,当研究INFM、PDZ和CMI的总体肿瘤突变负荷(TMB)时,发现INFM组有低于PDZ和CMI组的趋势(图6A)。由于Sig3突变特征与已知的AID基序大致相似,并且异常AID活性是导致B细胞恶性肿瘤的DNA错配的主要促成因素,因此他们接下来定量分析了FL B细胞状态类别与Sig3突变特征暴露之间的关联(图6B)。与TMB相似,从INFM到CMI, Sig3信号暴露呈上升趋势,与INFM相比,CMI的暴露增加接近标准显著性阈值。
在PDZ状态下,几种基因变异在 PDZ 状态中显著正向富集,如免疫调节基因(HLA-B和β2M),6q14.2-23.3的拷贝数丢失。最后,CMI状态对染色质修饰蛋白如CREBBP和KMT2D的改变、BCL2突变、10q23.31-24.1拷贝数缺失和2p16.1拷贝数增加(包括REL)呈正富集。
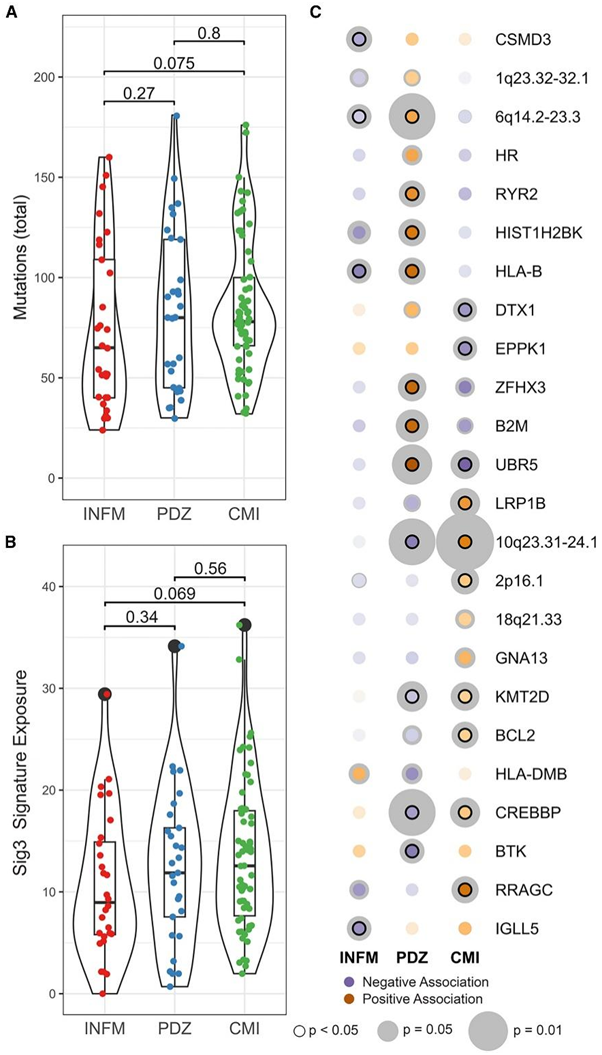
图6. 体细胞改变与B细胞状态有关。
(A) B 细胞组 TMB 的箱线图和小提琴图。(B) B 细胞组的 Sig3 突变特征暴露的箱线图和小提琴图。(C) 使用样本 B 细胞状态值和基因型谱之间的广义线性模型进行 B 细胞状态热图和突变相互关联分析。
+ + + + + + + + + + +
结 论
本项研究对从 87 个 FL 活检中分选的 B 细胞进行了RNA-seq,结合机器学习方法,确定了 3 种转录状态,分为炎症、增殖和染色质修饰状态。当与全外显子组测序和免疫分析相结合时,发现每种状态都与染色质修饰因子突变、 TNFAIP3拷贝数改变和Tfh细胞相互作用的组合相关,更重要的是,主要与富含活化T的微环境有关。总而言之,这些数据定义了一大群患者的 FL B 细胞转录状态,有助于了解肿瘤细胞水平的 FL 异质性,并为指导治疗干预提供理论依据。
+ + + + +



 English
English


