文献解读|Nat Commun(14.3):门静脉栓塞后人类再生肝脏的细胞图谱
✦ +
+
论文ID
原名:Cell atlas of the regenerating human liver after portal vein embolization
译名:门静脉栓塞后人类再生肝脏的细胞图谱
期刊:Nature Communications
影响因子:14.3
发表时间:2024.07.11
DOI号:10.1038/s41467-024-49236-7
背 景
人类肝脏在受伤或部分切除后能够自我修复和扩大。肝脏再生包括肥大(细胞大小增加)和增生(细胞数量增加),以补偿丢失的组织质量。门静脉栓塞术 (PVE) 是一种用于避免肝切除术患者出现肝功能不全的技术,它将血流重新引导至特定的肝段,从而产生肥大的再生部分,在功能上补偿将要手术切除的萎缩栓塞部分,但其潜在的分子机制尚不明确。
实验设计
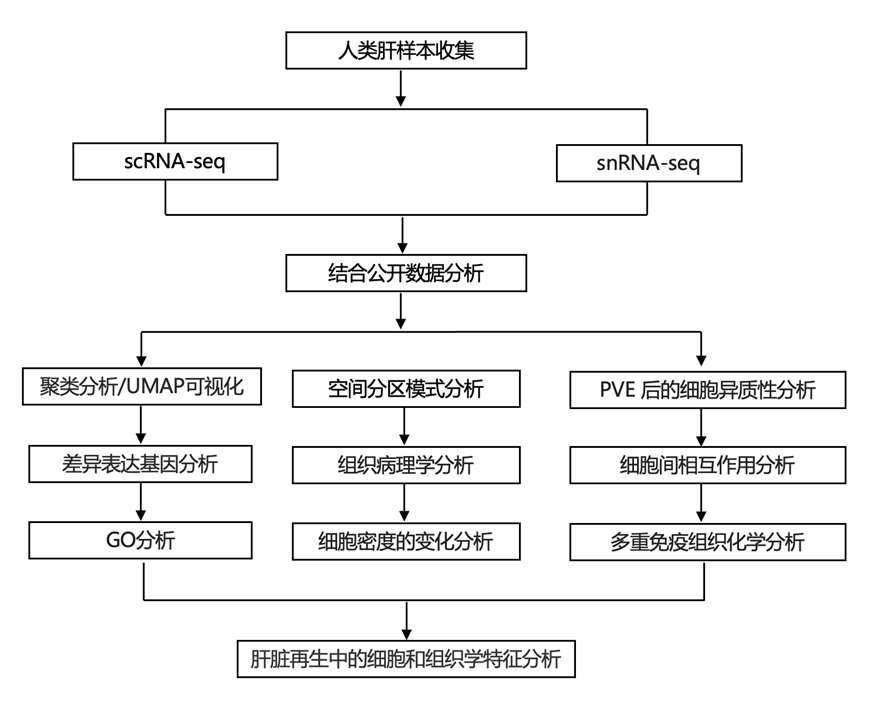
结 果
01
识别新鲜和冷冻肝脏样本中的细胞类型
研究团队收集了患者(因良性肝病而接受肝切除)的肝脏样本,并进行了单细胞转录组分析(scRNA-seq)和单细胞核转录组分析(snRNA-seq)(图1a)。聚类显示新鲜(fresh)和冷冻(frozen)组织中都有 5 个主要细胞群,包括肝细胞、胆管细胞(胆管上皮细胞)、内皮细胞、间充质细胞和免疫细胞(图 1b)。虽然在冷冻样本中的每个细胞群检测到的基因数量较少,但可以持续检测到细胞类型标记基因,并且新鲜和冷冻组织之间的差异表达基因(DEG)呈强相关性(图1c-e)。
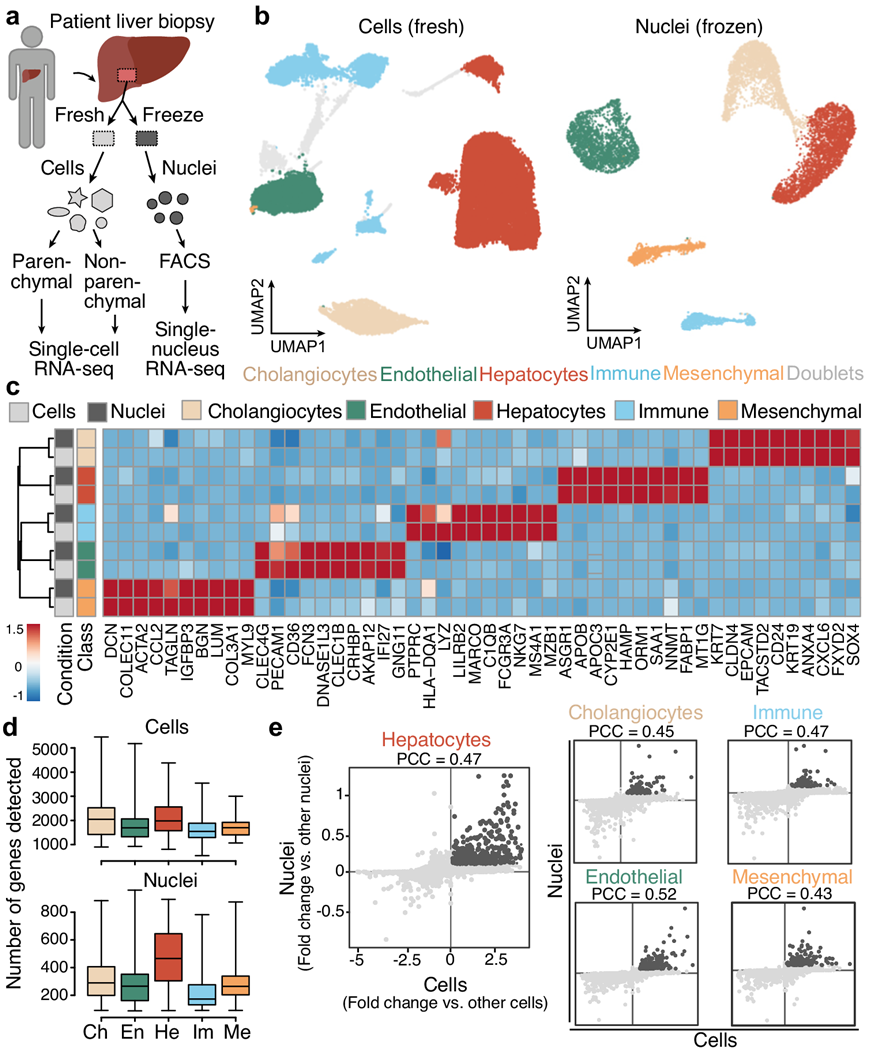
图1.成人健康肝脏标本中的主要细胞群。
(a) scRNA-seq 和snRNA-seq实验示意图。(b) UMAP 可视化。(c) 每种主要细胞类型的标记基因的表达。(d) 主要细胞类型中每个细胞和细胞核检测到的基因数量。(e) 显示了新鲜和冷冻样本中每种主要细胞类型的标记基因检测比较。
02
PVE 后人类肝脏转录图谱
为了研究特定于再生人类肝脏的细胞过程,他们从 6 名接受PVE的患者身上获得了新鲜切除的肝组织样本。在 PVE 期间,通向肝脏患病部位的门静脉分支发生阻断或用金属线圈栓塞,肝脏残余部分接收增加的门静脉血流,随着时间的推移逐渐扩大(图 2a-b)。在切除当天,他们从同一捐赠者那里收到了两个组织样本,将其称为再生样本和栓塞样本。他们分离了实质和非实质细胞部分,并对每个部分进行 scRNA-seq。在合并的数据集中,他们确定肝细胞、内皮细胞 (EC)、胆管细胞、免疫细胞和间充质细胞是主要细胞类型(图 2c-d),从PVE后恢复的比例相似 (图 2e)。他们将 PVE 后的基因表达水平与健康肝组织中的对应水平进行了比较。除肝细胞外,所有细胞类型中的 DEG在再和栓塞后都发生更频繁地上调(图 2f)。
在肝切除术后,肝细胞是最先进入再生程序的细胞类型,随后是调控组织重塑(包括肝血管和胆管的重建)的细胞类型。在胆管细胞(图2g)、内皮细胞(图2h)、肝细胞(图2i)和免疫细胞(图2j)中的差异表达基因分析显示,与健康样本相比,再生和栓塞组织中均存在上调基因,并具有每种状态特有的特征。DEG分析揭示了 PVE 后样本中多种表达程序的富集(图 2k-n)。在再生样本和栓塞样本中,胆管细胞中的“细胞形态发生”和 EC 中的“血管发育”显著富集。栓塞组织显示肝小叶实质内有大量各种未定义的血管生成事件。再生组织显示门管区具有更多胆管,并且小叶实质内包含胆道和血管细胞的位置,分别表明门管区重塑和新形成的门管结构作为门管区的前体。EC 和肝细胞还显示出先天免疫和炎症通路的上调(图 2l-m),这些通路在启动再生过程中起着关键作用。
在再生和栓塞组织的肝细胞中,上调的转录本中也有一些已知具有区域特异性表达的基因(HAMP、CRP、IGFBP2、SAA1、SAA2)(图 2i),可能表明分区中的基因表达发生了改变。

图2. 门静脉栓塞(PVE)后人肝细胞的转录景观。
(a) 示意图显示了 scRNA-seq 实验的门静脉栓塞 (PVE) 程序和组织采样。 (b) 分别显示 PVE 前(左)和 PVE 后 (中) 肝脏的计算机断层扫描 (CT) 扫描以及 3D 组织重建(右)。(c-d)UMAP可视化。(e) 每个供体的主要细胞类型比例。(f) 每种主要细胞类型的健康与再生或栓塞样本之间差异表达基因的数量。(g-j) 与健康样本相比,PVE 后胆管细胞、内皮细胞、肝细胞和免疫细胞的基因表达变化。(k-n) GO分析。
03
门管周围样肝细胞在 PVE 后肝脏中占主导地位
他们探索了 PVE 后肝细胞中的基因表达是否显示出与健康组织相似的分区(图 3a-b),PVE 后肝细胞的 UMAP 可视化揭示了与健康肝细胞相似的特征梯度(图 3c)。根据肝小叶分区对健康细胞进行排序,在三种情况下都由已知分区标记的表达谱验证(图 3d)。在两种PVE样本中,与健康状态有所不同的基因涉及到细胞呼吸(例如再生过程中的NDUFA3、SOD2;栓塞中的CP、MT-ND6)和脂质代谢(例如再生过程中的APOA5;栓塞中的APOC3、APOC2)。在再生的肝细胞中,他们还观察到与毒性反应相关的基因(CYP2A6、GSTO1、MT2A、CYB5A和ASS1)。这些数据表明,在PVE手术后,代谢稳态可能受到了破坏或处于变化之中。
具有中心周围表达特征的细胞减少,而具有中间区域和门管周围样特征的细胞相应富集(图 3e)。为了了解这些基因表达变化是否反映了小叶空间组织的改变,他们通过免疫荧光和 H/E 染色检测了已知肝细胞分区标记物在各个肝小叶中的存在(图 3f-g)。在 PVE 后肝小叶边界不太清晰,组织结构更加混乱,标记物仍然与其已知的门管/中心位置大致相关(图 3d)。在PVE样本中,中心标志物CYP3A4在中叶区和中央静脉之间的表达较弱。与此同时,门静脉标记物SAA1/2在再生肝样本中显著减少,而HAL(门静脉标记物)的表达则限制在门区周围的区域。他们还定量了沿中心到门静脉轴的细胞密度,发现健康肝组织中细胞分布均匀,而PVE样本的小叶显示出细胞密度的变化(图3g)。在再生小叶的中央区域细胞密度增加,而在栓塞肝样本中,中央区细胞密度急剧减少。这些结果表明,虽然与肝细胞分区相关的主要转录组和蛋白质特征得以维持,但 PVE 后人类肝脏的特征是肝细胞代谢和小叶结构的改变,特别是栓塞组织中中心周围肝细胞的密度降低。
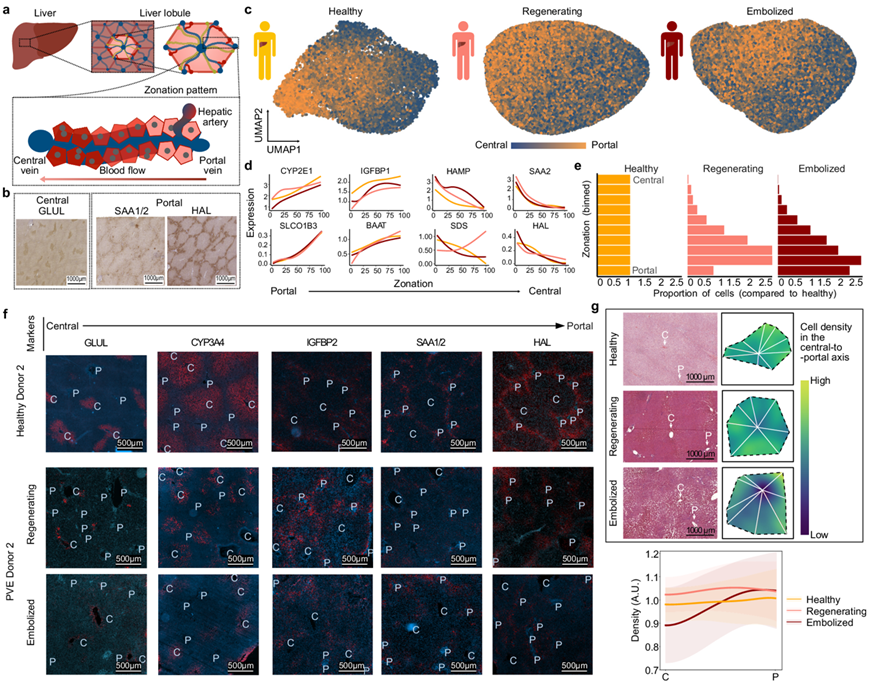
图3. 再生和栓塞组织肝细胞中的空间分区模式发生改变。
(a) 示意图说明肝小叶的结构。(b) 健康组织肝细胞内中央和门脉区域特异性蛋白表达的 3,3'-二氨基联苯胺 (DAB) 染色。(c) 健康(右)、再生(中)和栓塞(左)组织肝细胞内分区的基因表达特征。(d)代表性分区标记基因的表达模式。(e) 直方图显示分区中肝细胞的比例。(f) 肝组织各种肝细胞分区标记的免疫荧光染色分析。(g) H&E染色和细胞平均密度分析。
04
PVE 后内皮细胞状态分区改变
接着,他们检测了PVE后肝内内皮细胞(LSEC)的分区(图4a),在结合健康和PVE后数据集中对肝内血管内皮细胞亚群的注释显示出9个分子上独特的LSEC亚群(图4b)以及非LSEC内皮细胞、淋巴内皮细胞和处于细胞周期G2M/S期的内皮细胞聚类(图4c-d)。根据标记基因的表达,他们将 LSEC 亚群分为门静脉周围(MGP、AQP1、IGFBP7、CLEC14A)、中心周围(CLEC1B、CLEC4G、CLEC4M和FRZB )、中心区域(门静脉周围/中心周围标记物)、有孔(PLVAP、RBP7)、重塑(CTGF、IGFBP3、ANGPT2)、干扰素(CXCL10、IFI44L、ISG15、IFIT3)。他们还确定了三个表达线粒体和应激相关基因的亚群,这些基因可能与组织加工有关,或者与肝再生过程中内皮细胞中增加的剪切应力的关系有关。
他们观察到中心周围LSEC群体的丰度有差异,再生组织中有更多的周期细胞和高线粒体含量的细胞,而栓塞组织中有干扰素和ANGPT2+重塑细胞的富集(图4e)。与健康对照的伪轨迹一致表明,再生肝的LSEC中心区域向中心周围表达模式转变,而来自栓塞样本的LSEC略微倾向于门静脉周围表达模式(图4f)。重塑、高干扰素和应激相关 LSEC 主要位于中心周围,而有孔 LSEC 主要位于门静脉周围(图 4g)。有孔细胞与瘢痕相关 (SA) 内皮细胞具有强匹配特征,并具有强促纤维蛋白原特征,突出了 PVE 后肝脏门静脉血管附近出现的潜在纤维化特征。
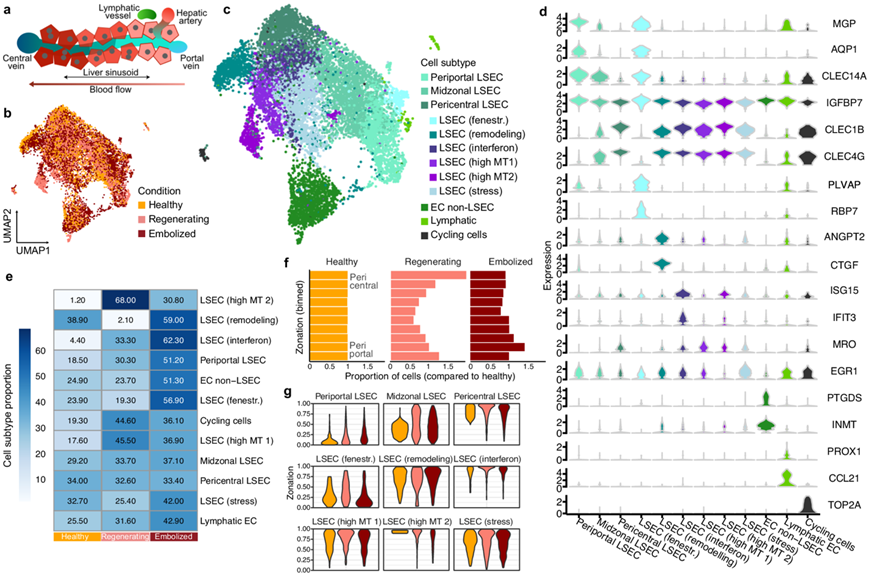
图4. PVE 后肝内皮细胞异质性和推断的区域化。
(a) 示意图说明了肝小叶内沿门脉中心轴的内皮细胞多样性。(b-c) UMAP可视化。(d) 小提琴图显示内皮细胞亚群标准化标记基因表达的分布。(e)每种内皮细胞亚群的比例。(f) 直方图显示LSEC(门脉周围、中间区域和中心周围 LSEC)分区的比较。(g) 显示了健康、再生和栓塞后每个 LSEC 亚群沿分区轨迹的分布。
05
免疫细胞和间充质细胞对 PVE 反应的调节
他们在健康和 PVE 肝脏组织中鉴定了 24 个细胞聚类,属于髓系和淋巴系(图5a-c),具有可通过已知标记物识别的明确细胞类型。再生组织中 NK 细胞增加(图 5d),栓塞组织中浆细胞样树突状细胞 (pDC) 增加(图 5d)。在髓系区室中,他们观察到 PVE 后组织中库普弗细胞比例下降,同时其他单核细胞/巨噬细胞群增加(图 5d),例如表达IGSF21(一种具有促炎作用的基因)的单核细胞/巨噬细胞群;以及 TREM2+ 单核细胞,后者之前已确定为瘢痕相关巨噬细胞亚型。他们从一个独立的肝硬化数据集获得了基因表达特征,这两种基因表达特征都与更促纤维蛋白原的TREM2+特征(SAMac(2))匹配。
然后,他们通过分析了PVE 后组织中细胞间相互作用的变化,研究了不同细胞群如何共同协调肝组织的修复和再生。大多数预测的相互作用涉及巨噬细胞、内皮细胞或间充质细胞(图5f),这些细胞群显示出最多的非同型细胞相互作用,并且 PVE 后肝脏中相互作用数量增加最多,尤其是在再生切片中。大多数细胞类型在再生组织中显示出细胞间相互作用数量的增加,在 pDC、分裂 EC 和周围 LSEC 中看到的数量最多。奇怪的是,与健康样本相比,PVE 后肝细胞的相互作用略有减少。
为了揭示整体相互作用网络的变化,他们将属于配体-受体对的基因汇总到基于相关性的共表达网络中(图 5g)。这突出了特征性的间充质相互作用,尽管检测到的细胞数量很少,但这种细胞类型仍处于肝细胞间相互作用的中心。间充质细胞与 LSEC 一起构成了 PVE 后的主要通讯轴。大多数相互作用,涉及细胞外基质(ECM)成分-胶原蛋白(collagen),纤维连接蛋白(FN1),腱糖蛋白(TNC)和玻连蛋白(VTN),它们在PVE后样本中高表达(图5h)。所有小叶区域的肝细胞都在产生FN1和VTN,而间充质细胞表达COL12A1、COL5A3以及TNC。通过免疫组织化学证实,COL12A1和FN1在门静脉周围普遍存在(图 5i)。在整个成像切片中,两种 ECM 蛋白在再生和栓塞样本中更高(图 5j)。各种类型的内皮细胞与这些基质蛋白以及其他与细胞迁移和血管生成相关的受体(EPHA3、NOTCH1)相互作用,表明间充质细胞和肝细胞(通过ECM调节)在改善再生肝血管化中的作用。
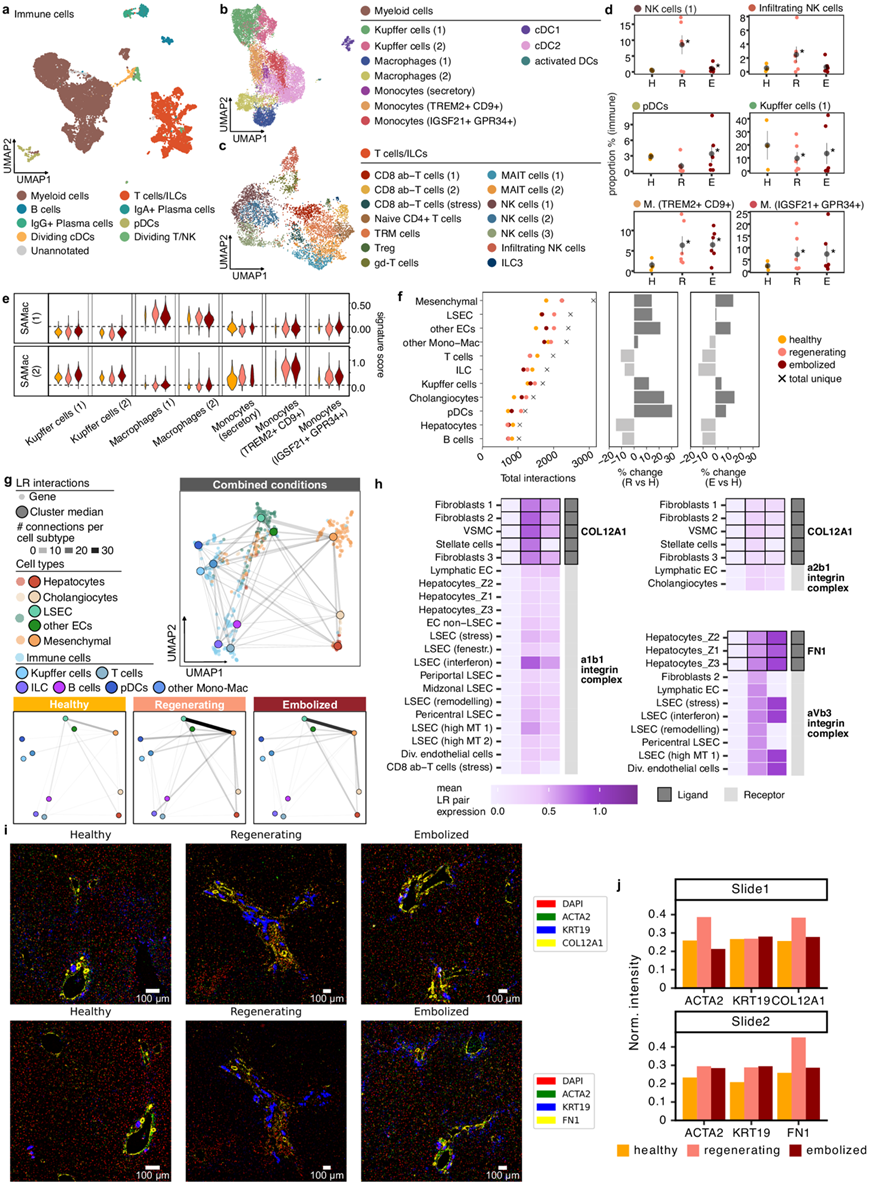
图5. 细胞间信号图揭示成纤维细胞和免疫细胞对 PVE 的反应协调。
(a-c)UMAP可视化。 (d) 选定的免疫细胞群的比例变化。(e) 每种情况下髓系细胞群中的疤痕相关巨噬细胞 (SAMac) 特征评分。(f) 细胞间相互作用分析。(g) UMAP图显示特定的配体-受体相互作用网络。(h) 热图显示在健康、再生和栓塞后涉及 ECM 蛋白的选定配体-受体对的平均表达。(i) 免疫组织化学染色分析。(j) 三种蛋白质的总荧光强度分析。
06
PVE 后肝小叶的多重免疫荧光分析
接下来,它们对健康、再生和栓塞的人体肝组织的大面积(平均面积 = 0.25 mm 2)切片进行多重免疫荧光成像(4I)分析(图6a),该方法覆盖了厘米到微米的尺度(图 6b),能够对从单个细胞到肝小叶和血管中模式的蛋白质染色和组织学特征进行分析(图 6c)。结合对组织结构(例如门管三联体和中央血管)的观察,抗体组分辨出了肝细胞分区、窦状隙、基质、免疫细胞位置、胆管和血管区域(图 6d)。
对 PVE 后样本的分析发现了几种蛋白质和形态学特征,以与健康组织相似的分辨率来表征再生和栓塞组织(图 6d-f),他们建立了一个计算流程来区分血管区域和这些区域内的细胞核(图 6g),肝细胞和 LSEC 中的门管周围和中心周围标志物用于区分门管和中心血管,通过对各种样本的形态学分析进行验证(图 6i)。每个血管的标准化表达显示,在 PVE 后,间充质细胞标志物 ACTA2 增加(图 6g)。通过标志蛋白和其他细胞核物理特征的聚集来识别主要的细胞类型——肝细胞、LSEC、免疫细胞和血管基质细胞(图 6h)。他们观察到血管周围细胞类型的差异分布(图 6i),PVE 样本中的基质细胞显著增加(图 6j),尤其是在门静脉周围。这些结果突出了 PVE 诱导的肝小叶重塑,并验证免疫内皮间质相互作用是再生组织结构变化的基础。
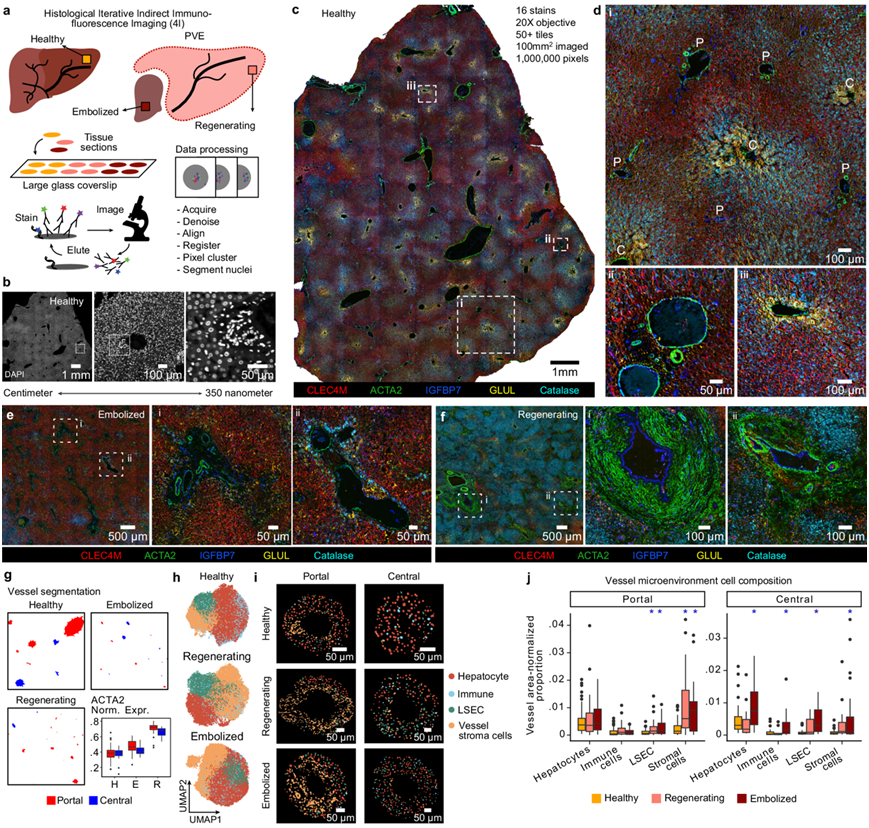
图6. 多重免疫组织化学揭示 PVE 后患者组织切片中血管周围微环境的改变。
(a) 实验示意图。(b) 健康肝组织的 DAPI 染色,说明了跨长度尺度的图像分辨率。 (c-f)多重染色分析。(g) 来自肝脏 4I数据的门管和中央血管检测结果。(h) UMAP可视化。(i)代表性门管和中央血管,分割的细胞核按细胞类型着色。(j)门管和中央血管微环境中每个血管面积的细胞核比例。
+ + + + + + + + + + +
结 论
本项研究对健康、患者来源的肝脏样本进行单细胞和单核转录组学分析,以探索再生肝脏的细胞状态,与门静脉栓塞后肝脏的发育过程、细胞粘附和炎症相关的基因发生上调,门静脉-中心肝细胞分区破坏以及内皮细胞和免疫细胞的细胞亚型组成改变。谱系间相互作用分析揭示了间充质细胞是免疫细胞和内皮细胞之间相互作用的关键细胞,并强调了ECM蛋白在肝脏再生中的重要性。此外,他们建立了组织级迭代间接免疫荧光成像,用于对血管周围微环境进行高维空间分析,揭示了再生肝小叶组织结构的变化。
+ + + + +



 English
English


