文献解读|Nat Genet(31.7):绘制人类和小鼠肺纤维化的空间解析转录组图
✦ +
+
论文ID
原名:Mapping spatially resolved transcriptomes in human and mouse pulmonary fibrosis
译名:绘制人类和小鼠肺纤维化的空间解析转录组图
期刊:Nature Genetics
影响因子:31.7
发表时间:2024.07.01
DOI号:10.1038/s41588-024-01819-2
背 景
特发性肺纤维化 (IPF) 是一种慢性肺部疾病,其特征是肺部逐渐形成不可逆的瘢痕。治疗方案有限,由于对疾病发病机制的了解不够全面,以及现有临床前模型的可转化性限制,新疗法的开发受到阻碍。
实验设计
结 果
01
健康和特发性肺纤维化 (IPF) 人类肺的空间转录组学
研究团队收集了四名 IPF 患者(IPF 1-4)和四名无已知肺部疾病的受试者[健康对照 (HC) 1-4]的肺切除样本进行空间转录组分析和单细胞转录组分析(scRNA-seq)。在每位 IPF 患者中,选择三个组织块(“B1”、“B2”和“B3”),反映同一供体内纤维化损伤程度的增加(图1a),而在HC中,选择“B0”组织块(图1a)。
他们平均分析了每个组织切片约 4000 个点(每个点代表覆盖该点的组织中细胞混合物的转录组),平均每个点捕获 >1500 个独特基因(图1c)。IPF 和 HC 样本之间的差异表达分析 (DEA) 确定了 1469 个差异表达基因 (DEG)(图1d),包括与成纤维细胞相关的基因(FNDC1、COL10A1和THY1)以及基质金属蛋白酶和参与 IPF 相关信号通路的基因(SFRP2、WNT10A和TGFBI)。
他们使用非负矩阵分解 (NMF)对数据进行反卷积分析,鉴定了30个“因子”,揭示了不同细胞类型和结构的特征,包括混合支气管上皮细胞类型(因子1:F1)、平滑肌细胞(F10)以及浆细胞和B细胞(F6)(图1e)。通过与IPF衍生的scRNA-seq数据集(称为“Habermann”)整合,进一步推断出细胞类型密度的空间分布。结果揭示了一个独特的群体(F1 和 F21),它们与有纤毛的气道细胞类型相关,包括基底细胞、棒状细胞、纤毛细胞和MUC5B+细胞(图1f)。其他因子与肺泡区室相关(图1g),包括肺泡巨噬细胞(与 F5 空间重叠)、肺泡 1 型 (AT1) 细胞(与 F12 和带注释的肺泡组织空间重叠)和 AT2 细胞。另一组因子对应于免疫细胞和基质成分,包括淋巴细胞、内皮细胞和成纤维细胞(与 F4 和标记为纤维或重塑组织的区域空间重叠)。有几个因子尚不明确,可能代表了更复杂的细胞混合物、未注释的细胞类型和/或未表征的细胞状态。这包括 HC 和 IPF 肺泡区中的 F16(图1f),以前列腺素信号基因和 AT1、AT2 和成纤维细胞标志物为主。
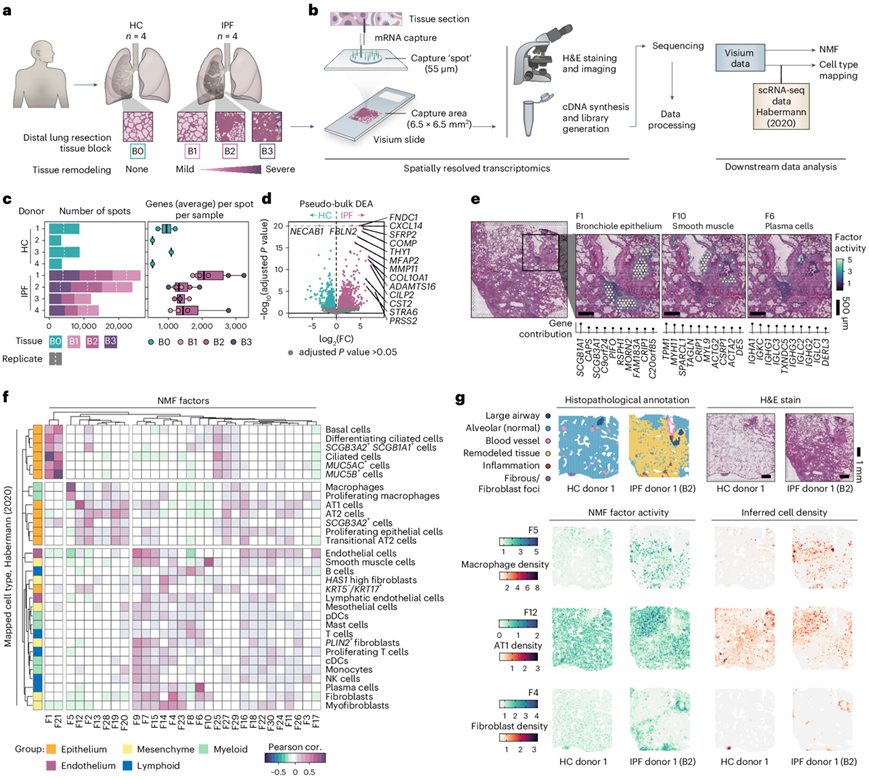
图1. 人类肺纤维化的空间转录组学分析。
(a) 对来自 HC和 IPF 患者的远端肺切除样本的组织切片进行切片和分析。(b) 空间转录组学分析实验流程和后续数据处理步骤的示意图。 (c) 总结数据描述,包括每个样本的 Visium 捕获点的数量以及每个点和样本检测到的独特基因的平均数量。(d) 比较每个供体的汇总 HC 和 IPF Visium 数据,以基于来自整个组织切片的数据识别条件之间的显著DEG。(e) 选定 NMF 因子的空间分布图,对应于细支气管上皮(F1)、平滑肌(F10)和浆细胞(F6)的组织学和/或转录谱。(f) 使用 公开的scRNA-seq 数据集,在所有样本的所有点中,绘制 NMF 因子活性和推断的细胞类型密度的 Pearson 相关 (cor.) 热图。(g) 基于 H&E 染色的 Visium 切片,对每个 HC 和 IPF 组织块的切片进行的组织病理学注释。
02
因子活性揭示通路和细胞相互作用
进一步检查样本中的因子分布,发现有 11 个因子在 IPF 中比 HC 中更为普遍(图2a)。这些因子与重要的 IPF 细胞形态和过程有关,包括 ECM 相关通路,以及纤维化重叠区域(F4 和 F14)或 IPF“蜂窝状”形成区域(F5 和 F21)(图2b)。F5 显示树突状细胞和巨噬细胞的标志物,而 F21 呈现出表达MUC5B的气道上皮特征。F21 谱可能反映了先前确定的MUC5B +、BPIFB1 +和SCGB3A1 + IPF 相关细胞群。MUC5B 表达先前定位于蜂窝状囊肿,并且MUC5B多态性与 IPF 风险有关。F9 是 IPF 肺中特有的,其特征是与氧化应激、炎症、ECM 重塑和血管变化相关的基因。此外,它在纤维化密度较低的 IPF 样本中尤其存在(“B1”),表明参与了早期纤维化过程。
在 ECM/纤维化相关因子中,F4 和 F14 在 IPF 组织中都特别活跃,可能反映了病理重塑(图2c)。除了胶原蛋白和纤维化相关基因之外,F14 特征还包括角蛋白,例如KRT7和KRT8(图2d)。F14 活性与推断的KRT5−/ KRT17+ AbBa 细胞、肌成纤维细胞和最近描述的HAS1 -hi 成纤维细胞亚型的细胞类型密度相关,尤其是在 IPF 样本中(图2e)。肺样本(IPF 供体 2)显示 F14 活性与KRT5− / KRT17 + AbBa 细胞类型之间的相关性不太明显。这种偏差可能源于供体在研究样本的细胞组成方面的异质性,或患者之间疾病表现的更普遍差异(图2e)。F14阳性斑点与相关细胞类型相吻合,并显示F14活性与成纤维细胞灶(FF)在空间上保持一致(图2f),这是活跃组织重塑的组织学特征。
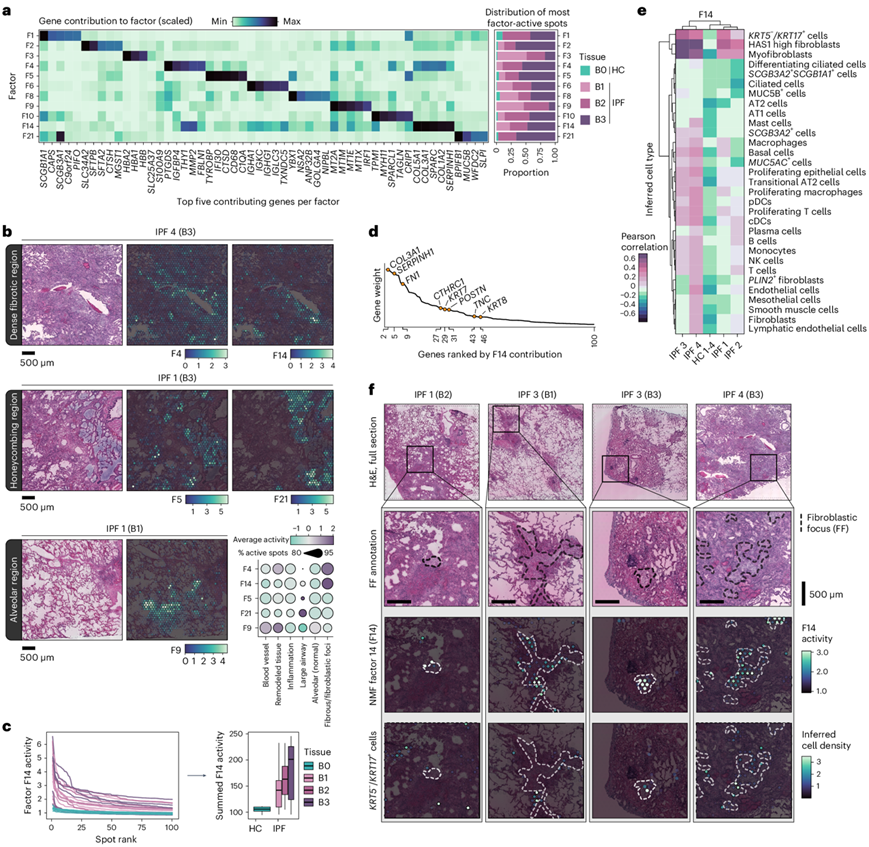
图2. NMF 揭示的疾病相关特征。
(a) NMF 识别了 IPF 组织中过度表达的特征。(b) IPF 肺切片中选定的 NMF 因子的空间表示,展示了在所有 IPF 样本中观察到的不同定位模式。(c) 基于 F14 活性的每个样本排序前 100 个点的活性概况。(d) 基于基因权重(贡献)对 F14 的前 100 个基因进行排序,重点关注角蛋白、胶原蛋白和其他纤维化相关基因。 (e) F14 活性与空间点内推断的细胞类型密度之间的相关热图,F14 和细胞类型的潜在共定位分析。(f) FF 注释、F14 活性的可视化,以及所有 IPF 供体肺中选定样本和区域中推断的KRT5−/ KRT17+细胞的分布。
03
IPF 中 AbBa 生态位的特征
为了更好地理解 F14 中的细胞类型异质性,他们分离了其最活跃的点(表示为 F14 hi),并确定了五个不同的亚聚类,F14 hi C0–C4(图3a)。C0 的基因对应于KRT5−/ KRT17+AbBa 细胞类型的标记物(例如PRSS2和KRT7),缺乏基底细胞标记物KRT5。其余四个 F14hi聚类表达对应于成纤维细胞和肌成纤维细胞(C1 和 C2)、巨噬细胞(C3)以及基底和分泌性气道上皮细胞(C4)的基因。根据标记基因谱,C1 和 C2 似乎代表具有不同作用的纤维化群体。C1 显示基质沉积和疤痕形成特征,而 C2 具有指示应激反应(金属硫蛋白)、免疫调节(CCL2和FCN3)和血管相互作用(ENG和THBD)的标志物,可能反映了 IPF 肺纤维化微环境中成纤维细胞表型的多样性。C0点常与FF边缘共定位(图3b)。F14 hi C0 AbBa 生态位周围的 AT2 细胞和过渡 AT2 细胞的丰度高于较远的区域(图3c)。
他们观察到基质重塑和纤维化相关基因(例如MMP11、POSTN和COL1A2)在C0中随着与 F14 距离的增加而下降(图3d),表明 AbBa 细胞周围的纤维化活动增加。相反,与肺泡功能和免疫反应相关的基因(例如SFTPA2、SFTPC和SLPI)在 C0 内的表达低于其周围环境。一组免疫球蛋白相关基因(例如IGLC1、IGKC和PIGR)在 AbBa 细胞密集区域附近表达,但在 AbBa 微环境中不表达,这意味着存在差异免疫反应或可能将某些免疫元素排除在 AbBa 微环境之外。
对 F14hi C0 点附近区域 (n.b.) 的分析确定了包含肺泡上皮细胞(n.b.聚类 0)、成纤维细胞/肌成纤维细胞 (n.b.聚类1)、肺泡巨噬细胞(n.b.聚类2)和浆细胞(n.b.聚类 3) 的亚聚类(图3e)。上游调节因子和通路富集分析预测 F14hi C0 和n.b.聚类 1 中已知与纤维化有关的分子(包括 TGF-β1、TGF-β2、MRTFB、TEAD1-4 和 ISG15)的上游激活(图3f)。转化生长因子β (TGF-β)(由TGF-β1、TGF-β2和TGF-β3编码)在IPF中起重要作用,并参与ADI细胞的形成和抑制向AT1细胞的分化。ISG15是p53的调节因子,与年龄相关的信号通路有关。IPF、糖蛋白VI (GP6)和伤口愈合信号通路的富集,以及与细胞运动和迁移相关的通路,进一步支持活跃的纤维化结节。
配体-靶相互作用的预测分析确定了F14hiC0微环境中进一步的细胞-细胞通信,包括TGFB1、IL1B和SFRP2(图3g)。SFRP2(一种WNT信号调节因子)的表达明显起源于邻近的成纤维细胞聚类,表明(肌)成纤维细胞、肺泡上皮细胞和AbBa细胞之间潜在的自分泌和旁分泌WNT信号。预测的配体载脂蛋白E(由APOE编码)在巨噬细胞聚类中高表达,提示邻近巨噬细胞群具有单核细胞来源和M2样特征。通过分析F14hiC0区域距离内所有注释的APOE受体的表达,他们确定了APOE和其几个受体之间的反向表达模式(图3h)。磷脂酰肌醇蛋白聚糖 1(由GPC1编码)、LDL 受体相关蛋白 1 (LRP1) 和多配体蛋白聚糖 1 (SDC1) 在 F14hi C0 区域内和附近表达更高。
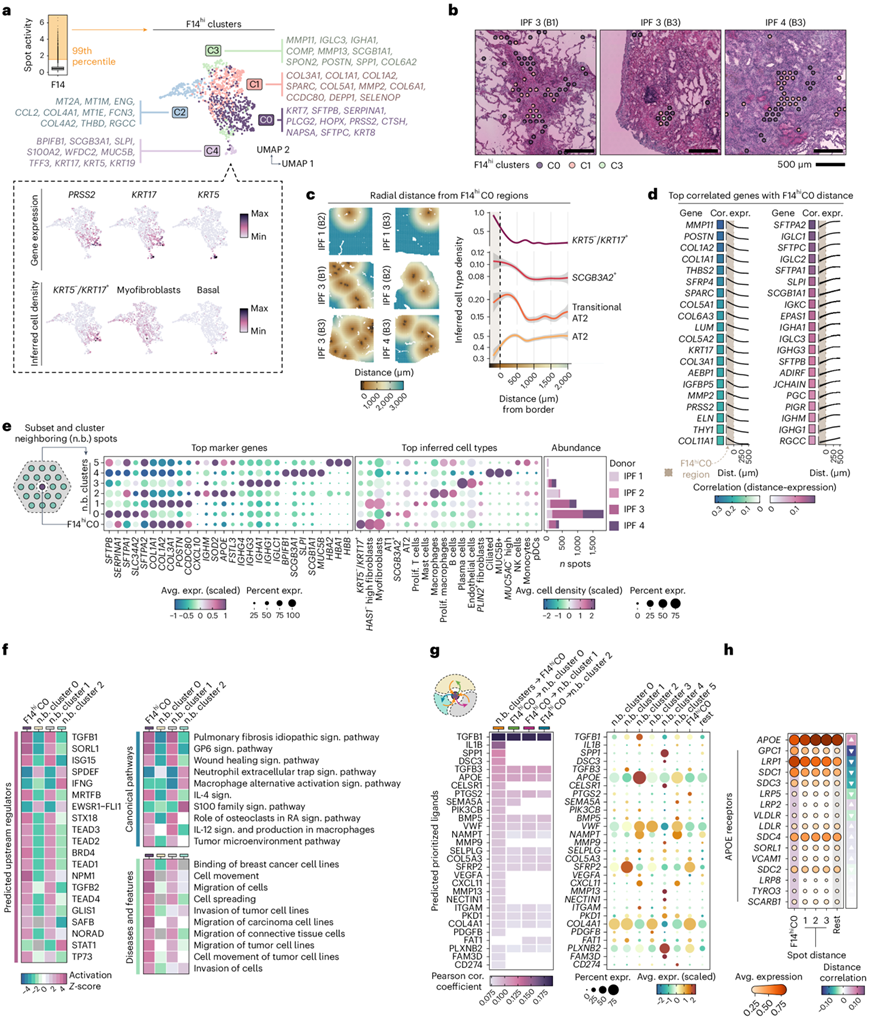
图3. AbBa 生态位的细胞和分子反卷积。
(a) UMAP 空间可视化,列出了顶级基因标记以及 AbBa 细胞标记PRSS2和KRT17以及基底细胞标记KRT5的表达。(b) 代表性 IPF 组织切片中 FF 内F14 hi聚类的空间位置。(c) 根据F14 hi C0 边界推断的细胞类型密度,具有径向距离。(d) 前 20 个基因的 Pearson 相关性 (cor.) 和基因表达 (expr.) 分析。(e) 将相邻的 F14 hi C0 点 (~200 µm)聚类为 6 个聚类(聚类0-5),其中标记基因的平均表达 (avg. expr.) 和选定的平均推断细胞类型密度在点图中突出显示。(f) 富集分析 (IPA)。(g)细胞间通讯分析显示。(h) APOE 及其受体在 F14hi C0 和径向距离上的平均表达。
04
小鼠肺纤维化模型中的空间转录组学
博来霉素(BLM)诱导的小鼠模型是肺纤维化最成熟的临床前模型。为了加深对该模型对人类 IPF 的转化预测能力的理解,他们从单剂量 BLM 或盐水(载体)给药后第 7 天 (d7) 和第 21 天 (d21) 收集的小鼠肺样本中生成了空间转录组(SRT) 数据(图4a)。选择这些时间点是因为包含了急性炎症和早期纤维化阶段 (d7),以及已确定的纤维化阶段 (d21)。
与小鼠模型中的对照样本相比,他们在注释的纤维化区域中确定了 DEG,并分析了它们与人类 IPF 中的 DEG 的重叠(图4b)。小鼠和人类之间有许多 DEG 重叠(IPF 和 d7 BLM 纤维化区域之间有 178 个,IPF 和 d21 BLM 之间有 93 个)。在后者中,大多数参与 ECM 组织(COL17A1)、炎症信号传导(CX3CL1)和细胞凋亡调控和细胞粘附(S100A14和FAIM2)。虽然这些基因可能在两种情况下的纤维化中发挥作用,但反向表达模式表明在人类 IPF 和小鼠 BLM 模型中的作用不同。
使用在 BLM 小鼠模型(称为“Strunz”)中生成的肺 scRNA-seq 数据集进行细胞类型反卷积。细胞类型密度的空间可视化显示了与相关组织区域的准确映射,其中在健康肺泡组织中推断出肺泡上皮细胞(图4c)。在 BLM 组和载体组之间观察到明显的细胞类型密度差异,包括分辨(M2 极化)巨噬细胞和Krt8 + ADI 细胞(图4d)。AT2 细胞丰度在第 7 天减少,但在第 21 天恢复,证实急性炎症得到消退。
共定位分析揭示了斑点内细胞类型的动态空间区室化,捕捉了纤维形成的时空动态并表明肺组织在 BLM 损伤后发生重塑(图4e)。在对照肺中,他们确定了由支气管上皮(A)和肺泡(B)组织组成的两个区室,勾勒出未受伤的肺结构。在 d7 BLM 处理的肺中,突出的细胞密度由支气管上皮(C)、肺泡上皮和肺泡毛细血管内皮(D)以及以成纤维细胞和肌成纤维细胞为标志的重塑肺泡组织(E)组成。在 d21 时,隔室的细胞组成发生了改变,因此除了支气管上皮 (F) 和纤维化、重塑的肺泡组织 (H) 外,他们还观察到以肺泡上皮巨噬细胞和Krt8 + ADI 细胞 (G) 为特征的隔室,显示出再生肺泡组织的轮廓。空间映射结果证实,隔室 F 与支气管结构一致,H 与纤维化/重塑组织相吻合,而 G 存在于纤维化区域的边缘并延伸到完整组织中(图4f)。因子活性和细胞类型丰度共定位分析在很大程度上反映了 d21 BLM 区室化(图4g)。他们将小鼠mmNMFd21因子与人类IPF NMF分析(hsNMF)中识别出的因子进行了比较(图4h),主要基因在人类和小鼠因子之间的整体重叠较弱。然而,与特定形态特征相关的因子,如平滑肌细胞、血管和纤毛气道上皮细胞,显示出更明显的重叠,突显了正常肺结构中的保守特征。值得注意的是,包含人类KRT5−/KRT17+ AbBa细胞(hsNMF-F14)和小鼠Krt8+ ADI细胞(mmNMFd21-F14)转录特征的因子重叠有限。
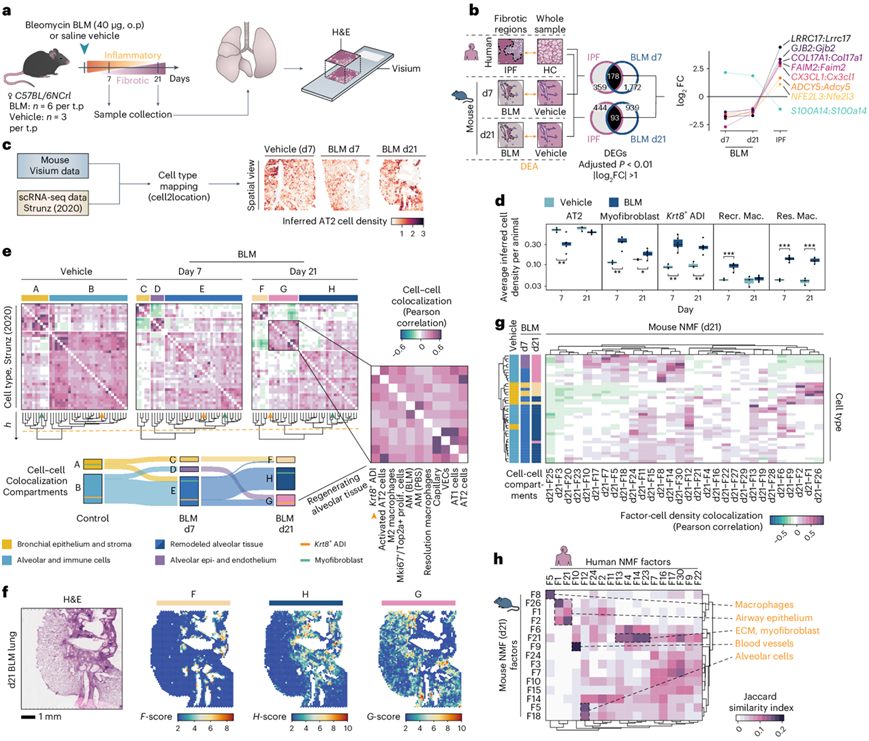
图4. 小鼠和人类肺纤维化的比较空间分析。
(a) 小鼠BLM肺损伤模型的研究设计。(b) 人类IPF和BLM治疗小鼠与对照组的纤维化区域的DEA,其中d7或d21时人类IPF和小鼠BLM独有和共同的DEG的维恩图,并突出显示具有逆表达模式的基因。(c) 整合公开数据集以推断斑点细胞类型密度。(d) 每只动物的平均细胞类型丰度。(e) 细胞-细胞相关热图显示不同条件和时间点的细胞共定位区室,桑基图说明了从载体到 BLM d7 再到 BLM d21 区室内细胞类型的变化。(f) 根据 BLM d21 肺切片的细胞类型密度计算的区室评分(F-H)。(g) 所有斑点中 BLM d21 NMF 因子活性和细胞类型密度的相关性分析。(h)使用前 100 个因子驱动基因对人类和小鼠 d21 NMF 分析进行比较。
05
人类 IPF 和小鼠 BLM 模型中的对比反应
他们分析了人类 IPF 样本中的KRT5− / KRT17+ AbBa 细胞 (hsNMF-F14) 和小鼠 BLM 样本中的Krt8+ ADI 细胞 (mmNMFd21-F14)的空间相关性。hsNMF-F14 活性主要与成纤维细胞 (HAS1 -hi)、肌成纤维细胞和KRT5−/KRT17+ AbBa 细胞相关。而mmNMFd21-F14 活性主要与Krt8+ ADI 细胞和 AT2 细胞相关,但与肌成纤维细胞的相关性较弱。此外,与 hsNMF-F14(图5a)不同,mmNMFd21-F14 与 AT1 细胞表现出相关性(尽管相关性较弱) ,这与人类 AbBa 生态位中不同的纤维形成环境一致。
为了进一步比较 AbBa(IPF)和 ADI(BLM)生态位,他们细化了 mmNMFd21 -F14 并确定了四个亚聚类(mmNMFd21 -F14 hi C0–3),其中聚类 0(mmNMFd21 -F14hi C0)与Krt8+ ADI 细胞表现出最强的关联(图5b)。
他们检测到 hsNMF-F14 hi C0 和 mmNMFd21 -F14hi C0 之间共有标记,包括几种胶原蛋白和 ECM 相关基因(例如COL1A1、FN1、TNC和CTHRC1)、上皮细胞标记(CDH1)以及人类 AbBa 细胞(KRT17)和小鼠 ADI 细胞(KRT8)的标记(图5c),这表明 AbBa 和 ADI 区域之间存在共同的特征。
为了更好地理解异常的纤维化生态位驱动因子,他们对 hsNMF-F14hi C0 和 mmNMFd21 -F14hi C0 进行了上游调节因子分析(图5d)。两组均预测了TGFB1、TP53和SMAD3的激活,表明了保守的TGF-β相关机制和细胞衰老。hsNMF-F14hi C0特异性调节因子包括抗纤维化生长因子BMP7、APOE受体SORL1和Notch信号通路的组成部分GLIS1。mmNMFd21-F14hi C0显示氧化应激和炎症调节因子包括HIF1A、IL4、YAP1和NFE2L2 (NRF2)的激活。他们在人体样本中发现载脂蛋白信号对hsNMF-F14hi C0具有激活作用(图3f-h),与此相反,在小鼠样本中,mmNMFd21-F14hi C0预计会抑制APOE及其受体LDLR。
接下来,他们检测了 mmNMF d21 -F14 hi聚类的组织学背景,并分析了它们与纤维化的关系(图5e)。mmNMF d21 -F14 hi C0 聚类位于纤维化区域内,通常靠近健康组织和纤维化组织之间的交界处,与 IPF 样本中 FF 和 hsNMF-F14 hi C0 的空间关系相当,表明处于过渡状态。通过评估与 mmNMFd21 -F14 hi C0 生态位边界径向距离相关的细胞类型密度,他们发现靠近生态位的 AT2、活化 AT2 和 AT1 细胞密度较高(图5f),突出了人类 AbBa 生态位周围没有 AT1 细胞。
在 BLM 小鼠数据中,肺泡上皮细胞类型/状态的空间轨迹分析(图5g)显示从 AT2 细胞经活化的 AT2 和 ADI 细胞到 AT1 细胞的单一路径。相反,在 IPF 肺中,轨迹从 AT2 细胞通过过渡 AT2 细胞分支,并分化为KRT5 − / KRT17 + AbBa 或 AT1 细胞。轨迹的空间可视化进一步说明了这些细胞类型在 BLM 损伤小鼠肺中的连续共定位以及 IPF 中过渡 AT2-AbBa 和 AT2-AT1 微环境的空间分离(图5h)。

图5. 纤维化生态位和细胞动力学的转化分析。
(a) hsNMF-F14 hi和 mmNMF-F14 hi因子活性与公开数据集中前 15 种相关细胞类型的相关性。(b) mmNMFd21 -F14hi亚聚类中的细胞密度分布。(c) hsNMF-F14 hi C0 和 mmNMFd21 -F14 hi C0 标记基因表达(expr.)的热图。(d) 调节因子的比较网络图。(e) 组织切片内 hsNMF-F14 hi C0 和 mmNMF d21 -F14 hi C0 点的空间映射,说明了与纤维化区域的关系。(f) mmNMF d21 -F14 hi C0周围细胞密度的径向分布线图。(g) 推断密度较高的 AT2、活化 AT2、Krt8+ ADI 和 AT1 细胞(小鼠)或 AT2、过渡型 AT2、KT5/KRT17 +和 AT1 细胞(人类)点的空间轨迹。(h) 空间共定位分析。
06
肺纤维化中的免疫细胞动力学
IPF和BLM损伤肺的一个共同组织学特征是纤维化组织内存在密集的免疫细胞浸润(图6a)。免疫密集区域内的基因表达(图6b)和细胞类型组成(图6c)揭示了 IPF 和 BLM 肺之间的显著差异。在 BLM 模型中, Cd74和Coro1a等基因的富集表明存在抗原呈递细胞和淋巴细胞。总体而言,BLM 区域显示出相对平衡的 B、T 和树突状细胞混合,而人类 IPF 样本则相反,其中CXCL13的明显表达表明免疫反应以 B 细胞为主导。
然后,他们描绘了人类 IPF 和 BLM 小鼠模型的纤维化生态位中不同的细胞轨迹和分子机制(图6d)。他们重点介绍了 IPF 肺中肺泡细胞再生的停滞与 BLM 模型中的主动修复,以及不同的信号分子,例如 TGF-β、APOE、YAP1 和 TEAD,以及免疫细胞存在的差异。
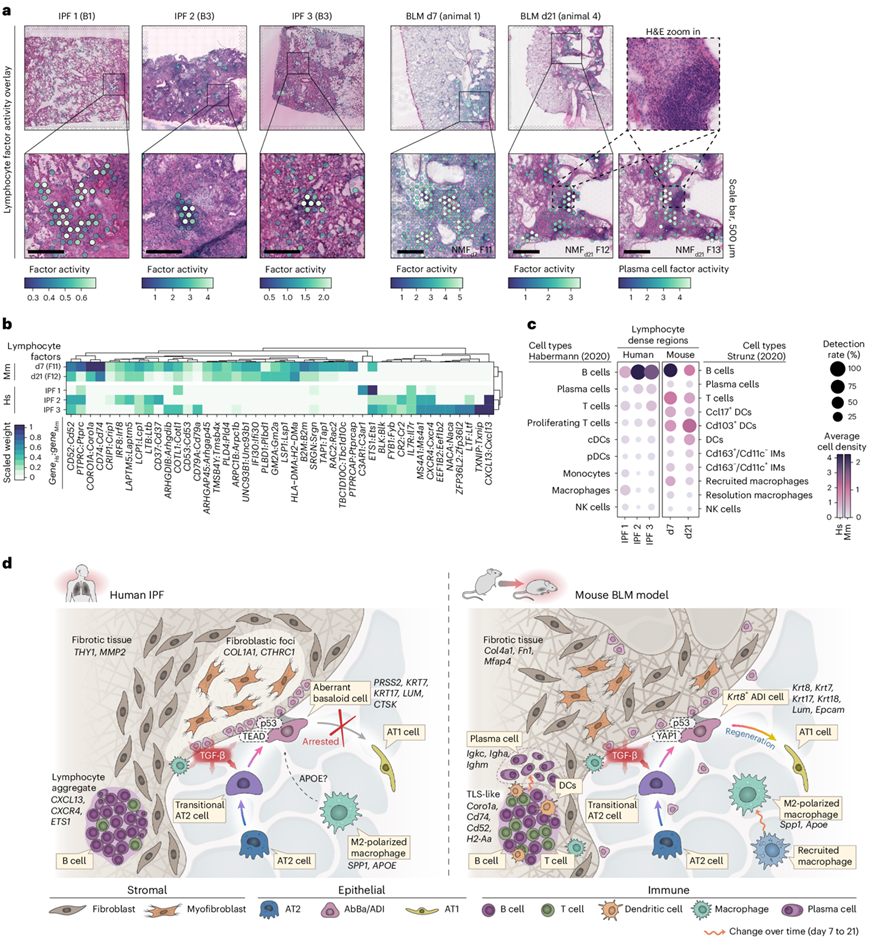
图6. IPF 和 BLM 小鼠模型中的免疫细胞特征和纤维化生态位的比较概览。
(a) 在选定的人类和小鼠样本中,NMF 因子与密集的淋巴细胞或免疫细胞聚集体重叠的空间可视化。(b) 热图显示整个条件下贡献最大的因子基因。(c) 绘制细胞类型密度的点图。(d) 人类 IPF 肺和小鼠 BLM 损伤肺中纤维化生态位的示意图,说明了纤维化肺内所提出的细胞相互作用。
+ + + + + + + + + + +
结 论
本项研究生成了人类 IPF和BLM诱导的小鼠肺纤维化的空间转录组图谱,在 IPF 肺中发现了不同的纤维化微环境,其特征是微环境中的异常肺泡上皮细胞,该微环境由转化生长因子 β 信号传导以调节因子(例如 TP53 和 APOE)主导。本项研究还发现 IPF 纤维化微环境中肺泡再生停滞与急性纤维化小鼠肺中的主动组织修复之间存在明显差异。本项研究对 IPF 转录前景提供了深入的见解,并提出肺泡再生是 IPF 的一种潜在的治疗策略。
+ + + + +



 English
English


