文献解读|Cancer Cell(50.3):单细胞图谱鉴定 MSI +细胞是胰腺癌不同亚型的共同起源
✦ +
+
论文ID
原名:Single-cell mapping identifies MSI+ cells as a common origin for diverse subtypes of pancreatic cancer
译名:单细胞图谱鉴定 MSI +细胞是胰腺癌不同亚型的共同起源
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.09.25
DOI号:10.1016/j.ccell.2023.09.008
背 景
胰腺癌在所有主要癌症中死亡率最高,5年生存率最低。胰腺导管腺癌(PDAC)是一种侵袭性和常见的外分泌癌,包括胰腺腺鳞癌(ASCP)(这是PDAC的一种侵袭性亚型,临床预后最差)、腺泡细胞癌(ACC)(占所有儿童胰腺癌的15% ,对化疗只有中等反应)以及高度侵袭性的间变性肿瘤,其特征是未分化状态。
因此,识别癌症产生的细胞对于了解肿瘤进化的分子基础至关重要。
实验设计
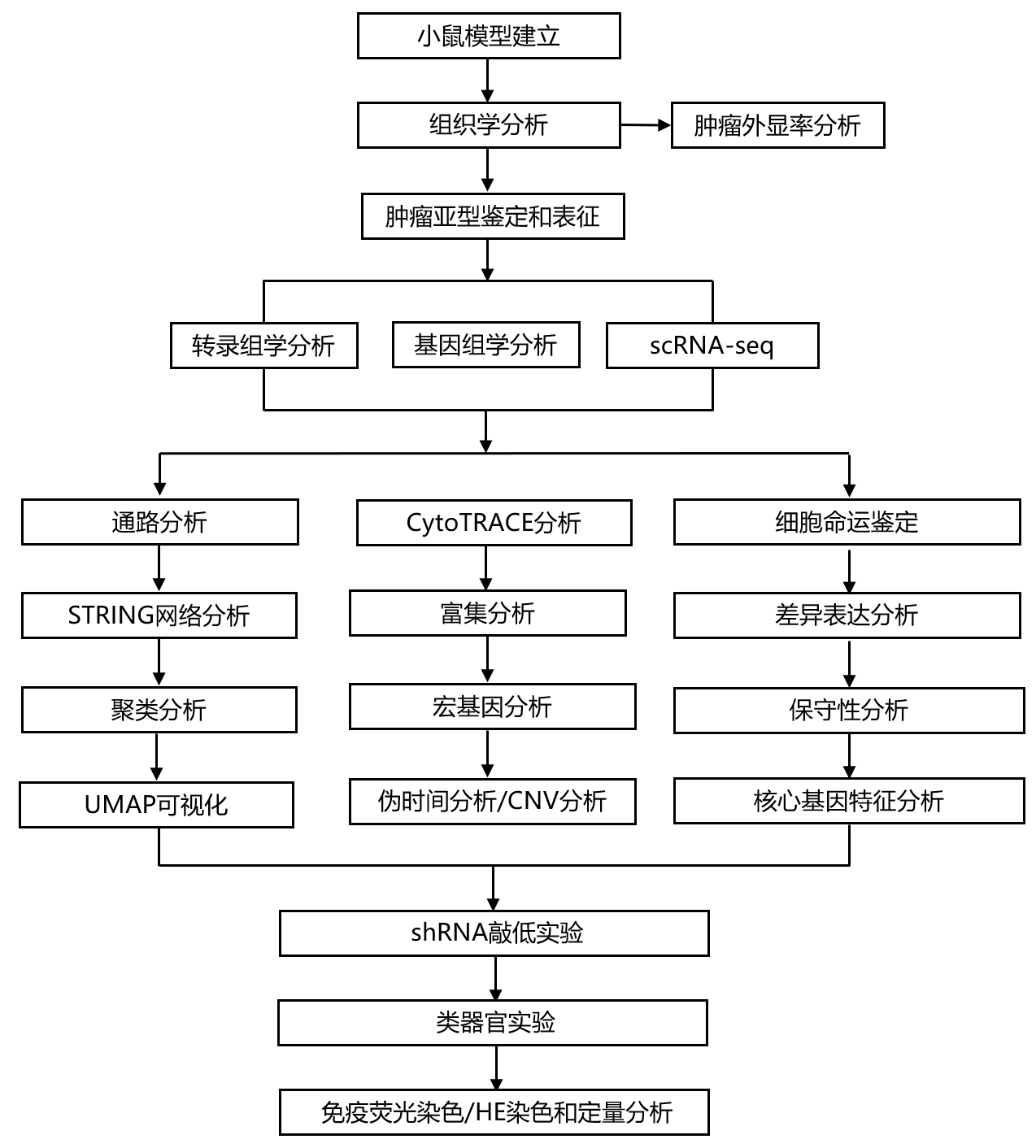
结 果
01
MSI2的表达标志着不同组织中癌症的起源细胞
为了了解Musashi-2 (MSI2+)干细胞/祖细胞的肿瘤启动潜能,研究者团队建立了MSI2 -CreERT2敲入小鼠(Msi2CreERT2/+)模型,其中将CreERT2整合到MSI2位点的“ATG”密码子中(图1A-B)。为了评估该模型的保真度,他们分析了内源性MSI2在组织中的表达。MSI2被在心室下区SRY盒转录因子2 (SOX2+)细胞(图1C)、肺支气管肺泡连接处的俱乐部细胞(图1D)和肾脏calbindin+细胞(图1E)的干细胞/祖细胞富集群体中表达。胰腺导管上皮细胞中也表达Msi2(图1F)。他们将MSI2 -CreERT2小鼠与R26R-LSL-tdTomato报告基因小鼠模型杂交,以比较Cre活性与Msi2表达。在tamoxifen(他莫昔芬)驱动的Cre激活后,TdTomato表达与Msi2表达强烈一致(图1g-j),证实了该敲入模型的保真度和特异性。
为了确定正常的MSI2+细胞是否可以作为癌症的起源,他们将MSI2 -CreERT2小鼠与CAG-LSLMycT58A小鼠模型(图1K)杂交,以靶向Msi+细胞的关键致癌基因MYC。他莫昔芬处理的Msi2-CreERT2 /CAG-LSL-MycT58A小鼠(此处简称Msi2-Myc)发生了一系列癌症,包括脉络膜丛癌(图1L)、小细胞肺癌(图1M)、胃癌(图1N)和胰腺癌(图1O)。肿瘤外显率在不同组织间存在差异,在所分析的小鼠中,80%为肺肿瘤,68%为胃肿瘤,52%为脑肿瘤,45%为胰腺肿瘤(图1P)。
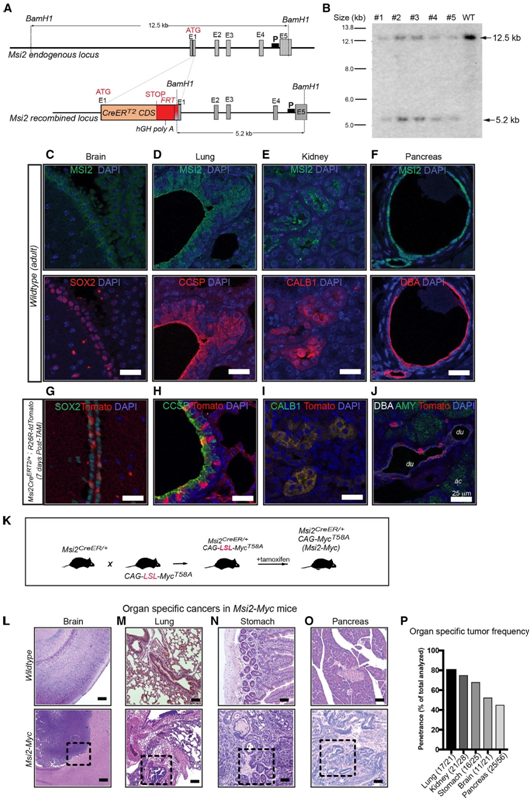
图1. MSI2的表达标志着多种组织中癌症的起源细胞。
(A)具有CreERT2编码序列(CDS)的野生型和重组Msi2等位基因克隆到Msi2的ATG位点示意图。(B)与野生型(WT)相比,杂合子的目标等位基因小鼠组织的Southern blot。(C-F)脑组织 (SOX2, C)、肺(CCSP, D)、肾脏(CALB1, E) 和胰腺 (DBA, F)中MSI2(绿色,上)和组织特异性标志物(红色,下)的表达。(G-J) tdTomato的表达分析。(K) Msi2-Myc小鼠模型的建立方案。(L-O)野生型正常组织(上)和Msi2-Myc小鼠肿瘤组织(下)的组织学分析。脑(L),肺(M),胃(N)和胰腺(O)。(P) Msi2-Myc模型的肿瘤外显率。
02
多种胰腺癌亚型的模型
使用组织学和典型标记确定肿瘤亚型:PDAC的细胞角蛋白19和淀粉酶缺失(AMY-)(图2A),鳞状特征肿瘤的细胞角蛋白5/14(图2B),鳞状肿瘤内鳞状分化的细胞角蛋白p63(图2C);ACC淀粉酶(图2D);间变性肿瘤的分化标志物缺失(图2E)。虽然一些Msi2-Myc小鼠仅具有一种亚型,但其他小鼠呈现两种或更多亚型(图2F)。总体而言,在分析的小鼠中,发现了64% 为SF(CK5和CK14)或frank ASCP (p63+)的导管肿瘤,72% 为ACC, 8% 为间变性肿瘤(图2G)。上皮肿瘤细胞的转录组分析(RNA-seq)显示,ACC和ASCP亚型具有彼此不同的转录组景观和起源细胞(图2H),其中ASCP肿瘤与Kras/p53驱动(KPC)肿瘤的关系更密切,这与它们的导管性质一致。此外,ASCP肿瘤显示更高的鳞状标记物如Krt5、Krt6a和Trp63和富集(DN) Trp63转录本(图2I-J)。
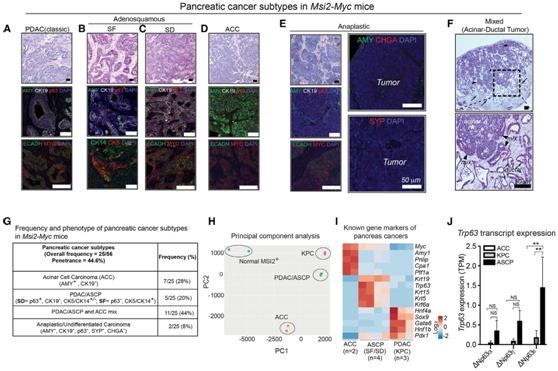
图2. MSI2细胞中MYC的靶向表达驱动MSI2+ MYC小鼠多种胰腺癌亚型的发展。
(A-E)使用谱系特异性标志物确定肿瘤亚型。(F)腺泡-导管混合性肿瘤组织学分析。(G)Msi2-Myc小鼠肿瘤亚型的总体频率和表型。(H) MSI2+胰腺细胞、ACC和PDAC/ASCP肿瘤细胞的主成分分析。(I) Msi2-Myc ACC和ASCP的分类标记热图。(J)柱状图显示△Np63 (Trp63)变异在ACC、ASCP和PDAC (KPC)胰腺肿瘤中的表达。
为了确定Msi2-Myc模型胰腺肿瘤与人类疾病之间的一致性,他们比较了转录组学和基因组特征。人类和小鼠ACC肿瘤的转录组学比较揭示了富集和缺失通路的保守性(图3A)。在人类ACC中通常缺失的基因,也在小鼠ACC中发生缺失(图3B)。虽然小鼠和人类ACC肿瘤之间有许多不受调控的通路,但在小鼠和人类ACC中,富集和缺失的基因在基因水平上的保守性较低(图3C)。基因组水平分析显示,小鼠和人类ACC中扩增基因在自噬、氨基酸代谢、氧化磷酸化和凋亡相关程序中具有特异性(图3D-E)。小鼠和人ASCP肿瘤的转录组图显示富集通路的保守性(图3F-G),以及与胰腺癌进展相关的基因集(图3H)。在基因组水平上,小鼠和人类ASCP肿瘤显示出与Ras/Notch信号、MAP激酶信号和凋亡等关键程序调控相关的扩增基因的保守性(图3I-J)。

图3. 转录组学和基因组学的改变在Msi2-Myc肿瘤和相应的人类癌症中是保守的。
(A)患者和Msi2-Myc模型中ACC肿瘤的保守基因集。(B)正常胰腺GSEA相对于ACC肿瘤显示KEGG通路在人和小鼠ACC肿瘤中缺失。热图显示了在人类ACC中突变/缺失而在小鼠ACC中抑制的基因。(C)人和小鼠ACC肿瘤中富集的基因热图。(D)人类和小鼠ACC肿瘤中预测的扩增基因组区域内的保守扩增基因。(E)STRING网络分析显示,人类和小鼠ACC肿瘤中的通路发生了改变。(F)人ASCP患者与Msi2-Myc小鼠之间的保守基因集。(G)正常胰腺与ASCP肿瘤的GSEA比较;KEGG通路在人和小鼠ASCP中富集。(H) GSEA显示胰腺癌中富集的代谢通路。(I)人类和小鼠ASCP肿瘤中预测的扩增基因组区域内的保守扩增基因。(J)对共享扩增基因的STRING网络分析显示在人类和小鼠ASCP肿瘤中改变的通路。
03
胰腺癌亚型细胞起源和癌前状态的单细胞图谱
接下来,他们使用单细胞转录组分析(scRNA-seq)来追踪MSI2+细胞的分子轨迹(图4A)。MSI2+导管细胞分为三个聚类(D1-D3)(图4B)。为了定义这些聚类的层次结构,他们使用了CytoTRACE分析(可以通过跟踪转录多样性来预测单细胞群体中最不成熟的细胞),预测D1/D2为最未分化的群体(暗红色),D3为分化程度较高的群体(绿色)(图4C)。与此一致的是,D1和D2聚类中富集了干细胞和重编程基因,如Prom1、Sox4和Gata6(图4D)以及Oct4、Tead2和Notch。而D3分化程度更高,大多数干细胞基因表达水平较低,而纤毛细胞分化所需的转录因子Foxj1表达水平升高(图4E)。
为了确定MYC如何启动转化,他们分析了MYC诱导后细胞的转录组多样性,对表达myc的上皮细胞进行分类和分析。有趣的是,这些癌前细胞以大量未分化细胞为主(图4F),表达导管和腺泡特征,并以Hmmr(透明质酸介导的运动受体)的表达为标志(图4F)。组织学上,这些癌前细胞通常表现为未分化的细胞团斑块或“肿瘤”,其中一些病变具有异常的导管形态(图4G)。细胞周期和染色质修饰基因(Hmgb2和Top2a)以及大量致癌程序(Aldh1a1、Ran、Ube2c和Klf2)相对于正常胰腺在这些癌前病变中富集(图4H)。胚胎干细胞和细胞周期特征也在这些细胞中富集(图4)。宏基因分析显示,D1和D2的基因特征在癌前细胞中最富集(图4J),这表明未分化的D1/D2导管细胞可能对myc驱动的转化最敏感。

图4. 未成熟的MSI2+细胞是MYC转化的靶标。
(A)表达致癌Myc的胰腺细胞scRNA-seq。(B) UMAP图显示正常胰腺表达msi2的聚类。(C)由CytoTRACE分析生成的UMAP图预测正常胰腺导管细胞聚类的分化状态。(D)在表达msi2的胰腺细胞聚类中显著的干细胞相关基因的表达。(E)热图显示胰腺中每个msi2表达聚类中富集的前10个基因。(F) UMAP图显示,通过CytoTRACE预测的大多数未分化群体(上),通过Hmmr mRNA表达(下)在Msi2-Myc小鼠5周后的癌前细胞中鉴定(下)。(G) Msi2-Myc小鼠在他莫昔芬后5周的癌前病变的代表性图像。(H)癌基因和干细胞相关特征基因表达富集。(I) GSEA图显示未分化的癌前细胞中干细胞和细胞周期基因的富集。(J)宏基因分析。
04
胰腺癌亚型的发育轨迹
为了了解不同肿瘤亚型从这一共同的癌前细胞池中分化的基础,他们分析了来自Msi2-Myc小鼠的终末期腺泡和腺鳞状肿瘤细胞。scRNA-seq结果显示,腺泡肿瘤是由脂肪酶(Cel)和b-连环蛋白(Ctnnb1)鉴定的(图5A),并且拥有一个由CytoTRACE预测的分化程度较低的独特群体。通过CytoTRACE和差异表达分析发现,Hmgb2和Top2a分别是低分化群体中相关程度最高和富集程度最高的基因。此外,分化程度较低的细胞群拥有最少的拷贝数变异(CNV),这种基因组变化通常在肿瘤进化过程中积累,并能驱动肿瘤进展(图5B)。他们使用Monocle构建了一条从预测的前体群体到已建立的ACC细胞的单一轨迹(图5C)。
为了了解导管/鳞状谱系肿瘤是否从不同的起源进化并沿着不同的路径相对于ACC,他们分析了三个独立的肿瘤,一个具有鳞状特征的PDAC,即PDAC/ASCP(SF)(图5D-5F),一个具有p63+鳞状分化,即ASCP(SD)(图5G-5I),一个具有更经典的PDAC特征。分叉导管/鳞状肿瘤和p63+ ASCP肿瘤中最不成熟的聚类与ACC中最不成熟的聚类相似:均表达Hmgb2/Top2a(图5E-H),且CNV最少。随着分化的增加,CNV逐渐积累,突出了肿瘤的基因组进化如何与其向分化谱系的表观遗传控制进展平行的显著一致性(图5E-H)。在分叉的肿瘤中,PDAC和ASCP都起源于Top2a/Hmgb2+群体(图5E-F),但在分支点分化,要么进行PDAC命运(终点为Sox9、Agr2和Tff2),要么转向鳞状命运(终点为Krt5、Krt6a、Krt15和Krt7)(图5F)。
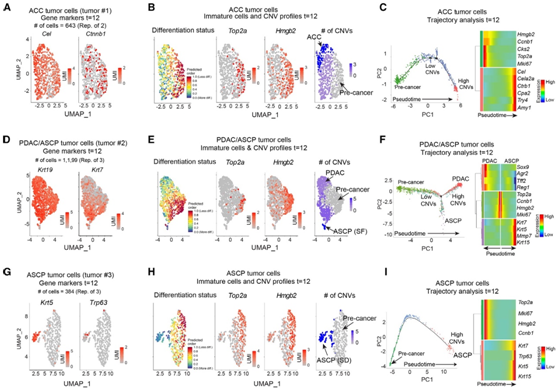
图5. 追踪不同胰腺癌亚型的进化。
(A) UMAP图显示典型ACC肿瘤中常见分类标记的表达。(B) UMAP图显示分化状态,未分化细胞(左,红色)与Hmg2b和Top2a表达高度一致(中)。CNV的上升(紫色,右)与ACC分化的增加平行。(C)显示ACC伪时间进展的轨迹图。(D) UMAP图显示典型PDAC/ASCP(SF)肿瘤中常见分类标记的表达。(E) UMAP图显示分化状态,未分化细胞(左,红色)与Hmg2b和Top2a表达高度一致(中)。CNV的上升(右)与终末期PDAC/ASCP(SF)肿瘤分化的增加平行。(F) PDAC/ASCP(SF)肿瘤轨迹图(左);ASCP(SF)进展过程中基因表达谱变化的热图(右)。(G)代表性的UMAP图,显示了代表性ASCP中常见分类标记的表达。(H) UMAP图显示分化状态,未分化细胞(左)与Hmg2b和Top2a表达高度一致(中)。CNV的增加(右)与ASCP分化的增加相一致。(I) ASCP(SD)肿瘤轨迹图(左);ASCP进展过程中基因表达谱变化的热图(右)。
05
Msi2-Myc小鼠的混合胰腺癌亚型起源于一个共同的癌前细胞池
接下来,他们将重组细胞池原位移植到受体(NSG)小鼠的胰腺中(图6A)。移植后,所有的受体小鼠都出现了肿瘤。对来自终末期肿瘤的分选癌细胞进行scRNA-seq,发现基于谱系特异性基因分类的腺泡和导管亚型具有显著的异质性(图6B-C),表明这些细胞可以重现原发肿瘤的混合性质(图5A-5I)。此外,未分化祖细胞在这些混合肿瘤中持续存在(图6C),反映了在原发原位肿瘤中发现的未分化细胞。这些结果证明多种亚型的胰腺癌可以从Msi2-Myc小鼠中(作为常见肿瘤前体的)共同癌前细胞池中产生(图6D)。与这一观察结果一致的是,从同一只小鼠中分离出的ACC、PDAC和ASCP的基因组分析具有相同的CNV,表明这两种谱系起源于一个共同的肿瘤前体,后来发生分化(图6E)。整合来自所有样本和所有肿瘤亚型的所有scRNA-seq数据进一步发现细胞群的转录重叠(图6F)。
在t = 5时发现的细胞群也在ACC和ASCP肿瘤中发现。在所有t = 5和t = 12个样本中发现癌前或常见肿瘤前体群体具有共同的转录组基因特征,包括Hmgb2和Top2a的富集表达(图6G)。
ACC和ASCP肿瘤细胞表现出不同的保守CNV模式(图6H-I)。许多通过外显子组-序列分证实了CNV可能在肿瘤生长过程中驱动亚型特异性。尽管谱系特异性CNV已经开始出现在癌前病变中(图6J),与不同细胞池中的谱系特异性转录程序一致(图6K-L),但他们发现谱系特异性CNV发生在命运特异性基因表达之后,这表明最终决定亚型的转录变化可能是由表观遗传机制启动的(图6J)。

图6. Msi2-Myc小鼠的多种胰腺癌癌症亚型来源于一个共同的未分化癌前细胞池。
(A)表达致癌MYC的胰腺细胞scRNA-seq图。(B)细胞(ACC标记物)和Krt19(导管标记物)的表达表明混合谱系胰腺癌的特征。(C)差异表达分析,通过分类来突出已鉴定细胞群体的基因特征。(D)三系肿瘤伪时间进展轨迹图,显示ACC、PDAC和ASCP肿瘤细胞。(E)多谱系胰腺肿瘤的推断CNV分析显示,在两个独立样本中,不同命运 (ACC/ASCP) 之间有共同的CNV标记,表明有共同的起源。(F) scRNA-seq数据的整合显示了共享的不成熟细胞群(称为癌前细胞)。(G)癌前细胞(常见肿瘤前体)核心基因随时间的特征。(H)高度保守和不保守的小鼠ACC肿瘤。(I)高度保守和不保守的独立小鼠ASCP/鳞状肿瘤。(J) UMAP图显示有代表性的早期癌前病变中出现不同的CNV印迹。(K)在胰腺肿瘤亚型、ACC和ASCP中观察到富集的基因标记。(L) 癌前病变的UMAP图显示ACC和PDAC/ASCP的早期转录分化。
06
基因组和表观遗传变化对ACC和ASCP特化的差异贡献
为了检测在导管谱系中富集的转录程序是否能在功能上赋予导管命运,他们重点研究了RAS信号,发现RAS信号在导管命运细胞中发生放大和转录上调(图7A-B)。此外,他们还发现Msi2-Myc模型中MYC的表达足以激活ASCP肿瘤发展后期的Kras突变信号(图7C)。于是,他们将Msi2-CreERT2/CAG-LSL-MycT58A小鼠与KrasLSL-G12D/+小鼠杂交以产生Msi2-Myc/Kras小鼠(图7D)。与MYC在MSI2+细胞中诱导时发生的ACC和ASCP肿瘤相反,在这些细胞中包含致癌基因kras驱动了具有鳞状特征且具有侵袭性的PDAC(图7E-G),这表明RAS信号的激活足以将命运从ACC转移到导管/鳞状谱系,并强调了本项研究中计算模型的保真度和预测能力。
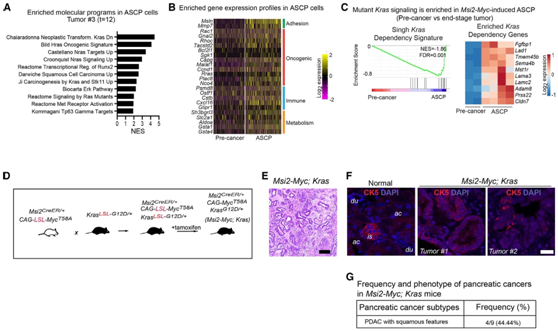
图7. 在Msi2-Myc模型中,RAS信号足以将胰腺癌的命运转向导管和腺鳞谱系。
(A) GSEA显示分化的小鼠ASCP肿瘤细胞中最高富集的通路。(B)癌前细胞进展到终末期ASCP时基因表达变化的热图。(C) GSEA显示Kras和Kras相关基因在Msi2-Myc ASCP肿瘤中上调。(D) Msi2-Myc小鼠模型的建立。(E)代表性图像显示广泛的导管肿瘤。(F) 2个独立胰腺导管肿瘤的鳞状肿瘤细胞图像。(G) Msi2-Myc中肿瘤亚型的频率和表型。
07
胰腺腺鳞癌依赖性的鉴定
为了测试鳞状肿瘤在晚期的潜在依赖性,他们选择了在终末期ASCP肿瘤和/或早期癌前病变(Hmmr和Atf3)中富集的基因(图8A)。其中,shrna介导的Ifne、Atf3、Hmmr和Sprr3的敲低持续地降低了源自Msi2-Myc鳞状肿瘤的两种独立癌细胞系的类器官形成潜力(图8B),突出了这些基因在鳞状肿瘤细胞持续维持中的重要性。在这些基因中,Hmmr的高表达与许多癌症类型的不良预后相关。
Hmmr在小鼠和人类正常胰腺中检测不到或含量较低,但在小鼠和患者源性癌前病变中,Hmmr显著上调并定位于细胞膜中(图8C-D)。shrna介导的小鼠癌前细胞中Hmmr的敲低显著减少了体外类器官的形成(图8E),这表明Hmmr在肿瘤发生的早期阶段是一种潜在的依赖性。
在晚期,Hmmr抑制原代小鼠ASCP细胞使类器官生长减少50%以上(图8F)。临床注释的胰腺癌组织微阵列免疫染色(图8G)显示,HMMR在原发性患者样本和导管和鳞状谱系的患者来源细胞系中均高表达。考虑到其表达,他们在人胰腺癌细胞系中敲除HMMR,发现其在体外显著抑制大多数人胰腺癌细胞的生长(图8H),其中对腺鳞状细胞系FG和KLM-1的影响最大。HMMR的敲低也使原位移植细胞系的生长在体内降低了2倍以上(图8I),肿瘤细胞的侵袭性显著降低,这表明肿瘤细胞附近存在未受损伤的正常组织(图8I)。
最后,他们在患者来源的异种移植物(PDX)肿瘤中敲除HMMR,将PDX肿瘤分离并在体外用gfp标记的慢病毒shRNAin感染,然后重新移植到NSG小鼠皮下(图8J)。虽然每个PDX样本在t =0时等效转导(图8K),但在晚期的shHMMR肿瘤中,GFP+ EpCAM+肿瘤细胞的相对频率减少了5- 20倍(图8K),这表明HMMR在体内是小鼠和人类腺鳞癌的一个关键功能的依赖。

图8. 胰腺腺鳞癌的依赖性鉴定。
(A)与ACC和KPC PDAC相比,Msi2-Myc ASCP中富集基因的热图。(B) shRNA介导的特定基因抑制对小鼠ASCP细胞类器官生长的影响。(C) Msi2-Myc小鼠典型癌前病变中HMMR表达增加。(D)代表性图像(左)和MFI(右)显示HMMR在人胰腺肿瘤前组织阵列(PanIN)中的表达增加。(E) 左:shHmmr对Msi2-Myc癌前类器官的影响。右:shControl和shHmmr细胞中Hmmr的相对表达量。(F) shHmmr对小鼠ASCP类器官生长的影响。(G)代表性图像和点阵图显示HMMR在人胰腺癌组织阵列中表达的MFI。(H) shHmmr对人ASCP球形成的影响。(I)左:shHMMR在体内对FG细胞的影响,右:代表性染色显示原位移植shControl(上)和shHMMR(下)转导的FG细胞的终末期肿瘤。(J)患者来源的异种移植(PDX)肿瘤细胞体内HMMR敲除示意图。(K) shHMMR对PDX生长的影响。(L)胰腺癌亚型在Msi2-Myc肿瘤模型中的起始和进化模型
+ + + + + + + + + + +
结 论
为了确定干细胞/祖细胞是否可以作为细胞来源,他们创建了一只Msi2- CreERT2敲入小鼠。当与CAG-LSL-MycT58A小鼠杂交时,Msi2-CreERT2小鼠发生多种胰腺癌亚型:导管癌、腺泡癌、腺鳞癌和罕见间变性肿瘤。将单细胞基因组学与发育状态和谱系轨迹的计算分析相结合,本项研究证明MYC优先触发最不成熟的MSI2+胰腺细胞转化为多谱系癌前细胞。这些癌前细胞随后通过激活不同的转录程序和大规模的基因组变化分化形成胰腺癌亚型,而Ras等特定信号的强制表达可以改变亚型定向。这项研究表明,多种胰腺癌亚型可以从一个共同的MSI2+细胞池中产生,并提供了一个强大的模型来理解和控制形成胰腺癌不同命运的程序。
+ + + + +



 English
English


