文献解读|Nat Commun(16.6):蛋白质组学特征鉴定软组织肉瘤的临床相关亚组
✦ +
+
论文ID
原名:Proteomic characterization identifies clinically relevant subgroups of soft tissue sarcoma
译名:蛋白质组学特征鉴定软组织肉瘤的临床相关亚组
期刊:Nature Communications
影响因子:16.6
发表时间:2024.02.15
DOI号:10.1038/s41467-024-45306-y
背 景
软组织肉瘤 (STS) 是一种罕见的实体癌,起源于间叶组织,包括肌肉、脂肪、骨骼和纤维组织,约占成人恶性肿瘤的 1%。STS 最常见的亚型包括脂肪肉瘤 (LPS)、平滑肌肉瘤 (LMS) 和未分化多形性肉瘤 (UPS) 。同时,一些组织学亚型,如血管肉瘤(AS)和恶性周围神经鞘瘤(MPNST)相对罕见。需要基于整体分子图谱的进一步分析,以从分子方面区分组织学亚型的关系,并反映其多样化的肿瘤生物学。
实验设计
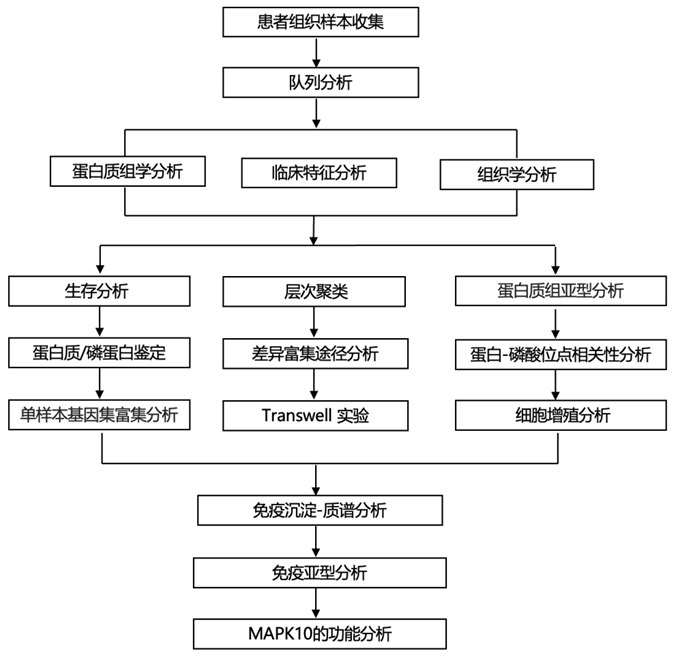
结 果
01
STS 队列的临床和分子特征
本项研究建立了一个包含 12 种肉瘤亚型的 272 名中国 STS 患者队列,包括高分化脂肪肉瘤 (WDLPS)、粘液样脂肪肉瘤 (MLPS)、去分化脂肪肉瘤 (DDLPS)、血管肉瘤 (AS)、未分化肉瘤 (UPS)、粘液纤维肉瘤 (MFS)、其他成纤维细胞/肌纤维母细胞肿瘤(otherFS)、平滑肌肉瘤(LMS)、横纹肌肉瘤(RMS)、恶性周围神经鞘瘤(MPNST)、滑膜肉瘤(SS)和上皮样肉瘤(ES)。为了系统地描绘 STS 的蛋白质组图谱,研究团队从 272 名诊断为 STS 的中国患者中收集了福尔马林固定石蜡包埋 (FFPE) 组织(图 1A-B)。他们共收集了 91 个匹配的肿瘤邻近组织 (NAT),计算出的肿瘤纯度范围为 70% 至 98%(图1D-E)。生存分析表明,大多数STS组织学亚型不能通过总生存率 (OS)或无病生存(DFS)来区分(图1C)。他们还收集患者的临床资料,包括性别、诊断年龄、组织学亚型、FNCLCC分级、生存时间等(图S1B)。
他们共鉴定出10118个蛋白和37842个磷酸化位点,平均每个样品鉴定出5593个蛋白和6483个磷酸化位点(图S1E-G)。其中丝氨酸(S) 28034个(74.1%),苏氨酸(T) 8762个(23.2%),酪氨酸(Y) 1046个(2.7%)(图S1H)。主成分分析(PCA)表明,不存在与时间相关的批次效应(图S1I)。对照样本的相关性为0.83 ~ 0.95,中位变异系数(CV)为0.14(图S1A-C,图S1J-K)。
为了进一步揭示STS组织学亚型之间分子特征的差异,他们基于蛋白质组数据对癌症标志进行了单样本基因集富集分析(ssGSEA)。结果表明,TGFβ信号通路在AS中比其他组织学亚型最富集。脂肪代谢相关通路,包括脂肪生成和脂肪酸代谢,主要富集在 WDLPS 和 MLPS 中,而 DDLPS 则富集 PI3K-Akt-mTOR 信号通路(图 1D)。他们还评估了已报道的诊断标志物在不同亚型中的表达,包括CDK4 (WDLP的标志物)、CDKN2A (DDLPS的标志物)、S100B (MPNST的标志物)、TLE1 (SS的标志物)、DES(LMS的标志物)等(图1E)。与以往报道一致,CDK4和CDKN2A在DDLPS和WDLPS中呈现相反的分布趋势:CDK4在DDLPS中相对较高,CDKN2A在WDLPS中相对较高(图1E)。
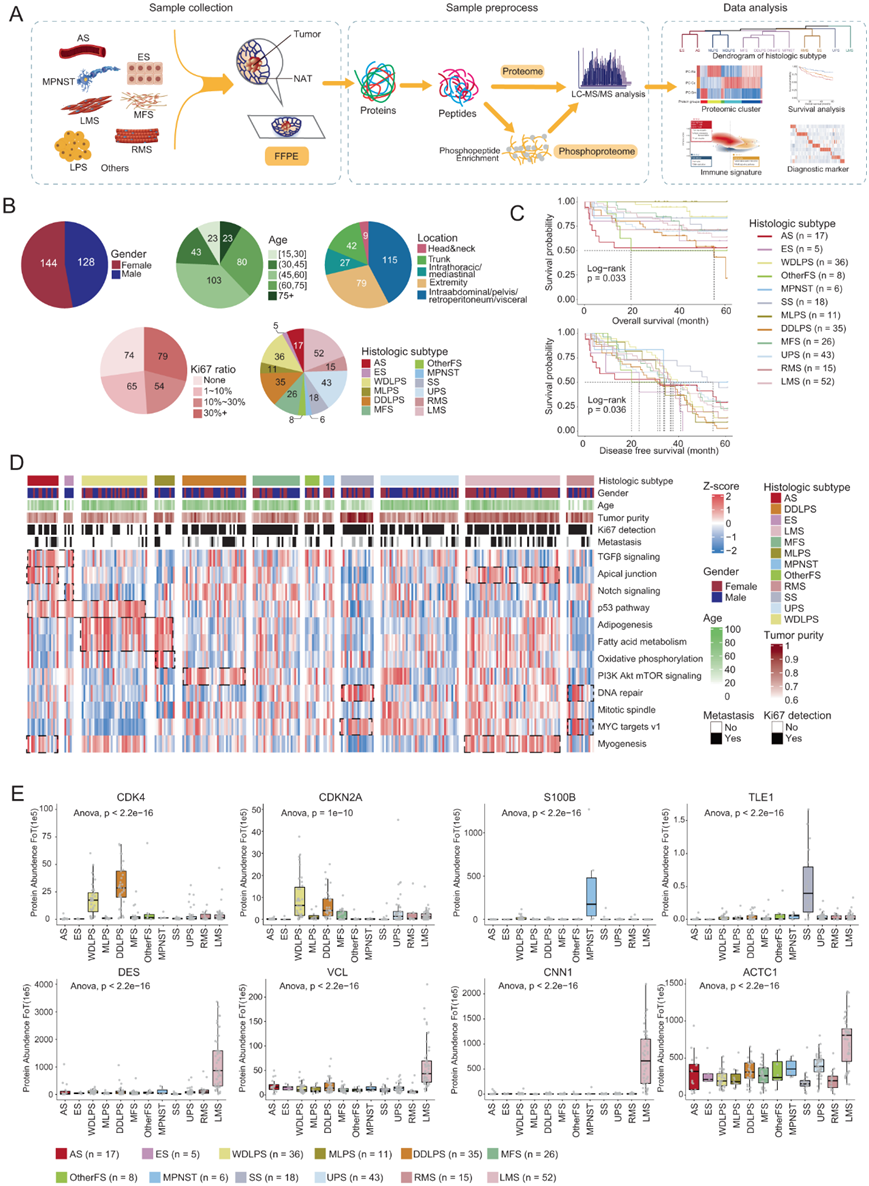
图1. 软组织肉瘤群体的蛋白质组学景观。
(A) 实验设计的示意图,包括样品收集、样品预处理、LC-MS/MS 分析和数据分析。(B) 饼图显示了 STS 队列的临床特征,包括性别、年龄、肿瘤位置、KI67 比率和 STS 组织学亚型。(C) Kaplan-Meier 曲线。(D) STS 组织学亚型中富集的癌症标志的热图。(E) 箱线图显示了本项研究队列中 12 种组织学亚型中特定 STS 组织学亚型的已知标记物的蛋白质丰度。
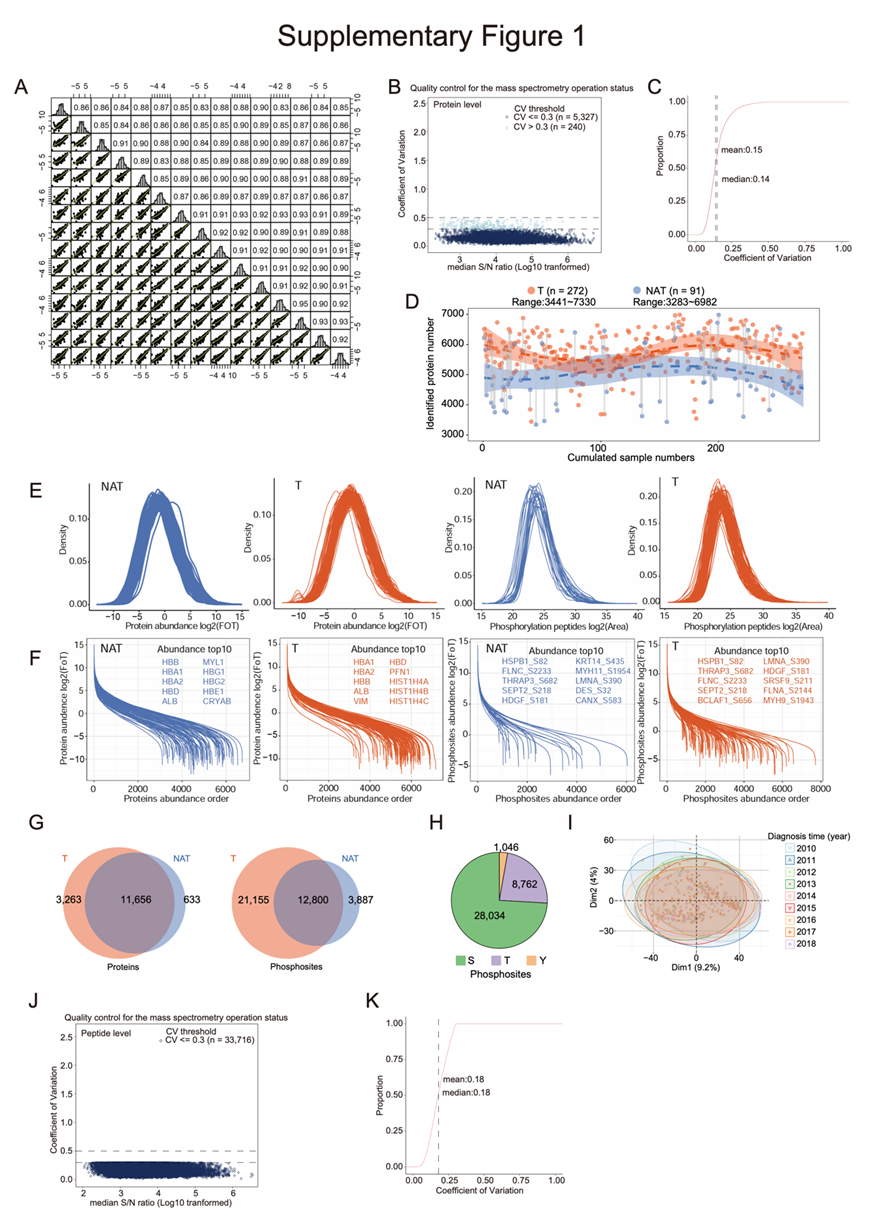
图S1.蛋白质组学和磷蛋白质组学数据分析。
(A) 利用HEK293T细胞胰蛋白酶消化法进行纵向质谱质量控制。使用散点图和Spearman相关系数来评估无标记量化的稳健性。相同样品的重复实验之间的Spearman相关系数和不同样品的散点图比较。(B) 散点图显示了所有HEK293标准样品蛋白水平的变异系数(CV)和信噪比(S/N)。(C) 累积分布曲线。 (D) 蛋白质的两两比较用灰色直线表示。(E) 密度图显示肿瘤(橙色)和NAT(蓝色)中蛋白质和磷蛋白丰度的分布。(F) 散点图显示肿瘤(橙色)和NAT(蓝色)中的蛋白质和磷蛋白丰度动态。(G) 维恩图显示了肿瘤和NAT中已识别的蛋白质和磷位点。(H) 饼状图显示三种磷酸化氨基酸残基:丝氨酸、苏氨酸和酪氨酸在所有已识别的磷酸基中的比例。(I)主成分分析。(J) 散点图显示了所有HEK293标准品多肽水平的CV和S/N比值。 (K) 累积分布曲线。
02
无监督层次聚类揭示了不同组织学肉瘤的共同和独特特征
组织学聚类是STS诊断的金标准,但亚型之间的分子相似性和多样性仍不清楚。为了进一步研究 STS 组织学亚型的内在共同特征,他们对 12 种 STS 组织学亚型采用层次聚类,根据轮廓系数和临床相关性选择了 6 个聚类(HC1 ~ HC6)(图 2 A-C)。HC1含有AS和ES;HC2包括MLPS和WDLPS;HC3由MFS、DDLPS、otherFS和MPNST组成;HC4含有RMS和SS;HC5是UPS并且HC6是LMS(图 2A)。这些层次聚类的生存分析显示,属于 HC1(AS 和 ES)的患者在所有集群中的 OS 最低。同时,属于HC2(MLPS和WDLPS)的患者具有明显更长的OS(图 2B)。
为了探索每个层次聚类的分子特征,他们基于蛋白质组数据进行了 ssGSEA(图 2C)。ssGSEA的统计结果表明,包括TGFβ信号传导、整合素通路、上皮细胞迁移和肌动蛋白细胞骨架重组在内的通路主要富集在HC1中(图 2C)。GSVA分析显示,通过Rab通路的升高富集,可以将DDLPS (HC3)与WDLPS和MLPS (HC2)区分开来(图2C)。
为了研究与生存结果相关的聚类特异性蛋白,他们重点研究了在HC1或HC2(具有最差和最佳OS的层次聚类)中高度表达的蛋白。SHC1、PTK2、ITGB2的高表达与预后不良显著相关(图2D)。
在这些与OS相关的蛋白中,SHC1的风险比最高,提示SHC1可能在生存结果中起重要作用。据报道,SHC1作为一种接头蛋白,可通过生长因子信号转导和级联(包括TGFβ信号转导)发生募集和激活。激活后,SHC1可以调节多种生物过程,包括细胞生长和增殖、细胞迁移和血管生成。SHC1的蛋白丰度和TGFβ信号通路富集评分之间呈显著正相关,这表明在肉瘤中SHC1和TGFβ信号通路之间存在关联(图2E)。然后,他们研究了参与TGFβ信号传导的蛋白的表达,发现在TGFβ家族中,TGFβ3与SHC1呈统计学上的正相关,表明TGFβ3和SHC1之间的潜在关联,暗示它们可能协同影响下游信号通路(图2E)。
他们构建了SHC1过表达载体并将其转染到ASM细胞系(SHC1-OE-ASM)中。同时,他们还利用shRNA敲低ASM中的SHC1(SHC1-KD-ASM)。RT-PCR分析证实SHC1-OE-ASM中SHC1的表达显著升高,而SHC1-KD-ASM中SHC1的表达显著降低。然后,他们用TGFB3处理SHC1-OE-ASM和OE-Ctrl-ASM(转染空载体作为对照)并评估肿瘤细胞迁移率。结果,用TGFB3处理的SHC1-OE-ASM显示出显著升高的肿瘤细胞迁移率,而OE-Ctrl-ASM在用TGFB3处理后显示出肿瘤细胞迁移率没有显著变化(图 2F)。这些结果证实了 TGFB3 在激活 SHC1 介导的肿瘤细胞迁移中的作用。
已发表的研究表明,SHC1 参与多种生物过程,并可能通过磷酸化调节下游途径。为此,他们研究了富含HC1并参与SHC1相关途径的磷蛋白和相应的磷酸位点(图 2G)。在与SHC1丰度具有显著正相关的7个磷酸位点中,ADD2 Ser2与SHC1具有最高的相关性(图 2G)。在已报道的调节ADD2磷酸化的激酶中,PTK2是与SHC1相关性最显著且在HC1聚类中表达较高的激酶(图2H)。为了进一步研究PTK2在影响细胞迁移中的作用,他们用PTK2抑制剂处理SHC1-OE-ASM和OE-Ctrl-ASM细胞株,并通过transwell实验评估细胞迁移。因此,抑制PTK2可以显著降低SHC1过表达引起的细胞迁移率(图2I)。此外,在SHC1-KD-ASM中过表达PTK2可显著增加细胞迁移,而这种迁移可通过敲除SHC1而发生抑制(图2 J)。这些结果表明PTK2参与了SHC1驱动的细胞迁移。他们进一步对SHC1-OE-ASM进行了PTK2抑制剂处理和未处理的磷酸化蛋白质组学分析。结果表明,参与肌动蛋白细胞骨架重组和上皮细胞迁移的ADD2 Ser2、FGD4 Ser702和EPB41 Ser542等蛋白的磷酸化在PTK2抑制剂处理后的SHC1-OE-ASM中显著升高,而在SHC1-OE-ASM中显著降低(图2K)。这些结果证实了PTK2在磷酸化ADD2的Ser2位点和提高肌动蛋白细胞骨架重组途径中的作用。
为了检测 SHC1 靶向 HC1(AS 和 ES)的临床相关性,他们收集了 6 种不同的肉瘤细胞系,包括 2 种 AS 细胞系(ISO-HAS 和 ASM)、2 种 ES 细胞系(VA-ES-BJ 和 SU- CCS-1)和 2 个 WDLPS 细胞系(93T449 和 SW-872)。所有六种细胞系均经过培养并用不同程度的氨基甲酰胆碱(SHC1 抑制剂)处理。然后测量氨基甲酰胆碱对细胞活力的影响。与 WDLPS 细胞系相比,AS 和 ES 细胞系对 IC50值较低的 SHC1 抑制剂更敏感(图 2L),证明SHC1对AS和ES细胞活力有更有效的影响。总之,SHC1由TGFB3激活后,可以募集PTK来磷酸化ADD2 Ser2和其他参与肌动蛋白细胞骨架重组和上皮细胞迁移的磷酸位点,并且这与不良预后相关(图 2M)。
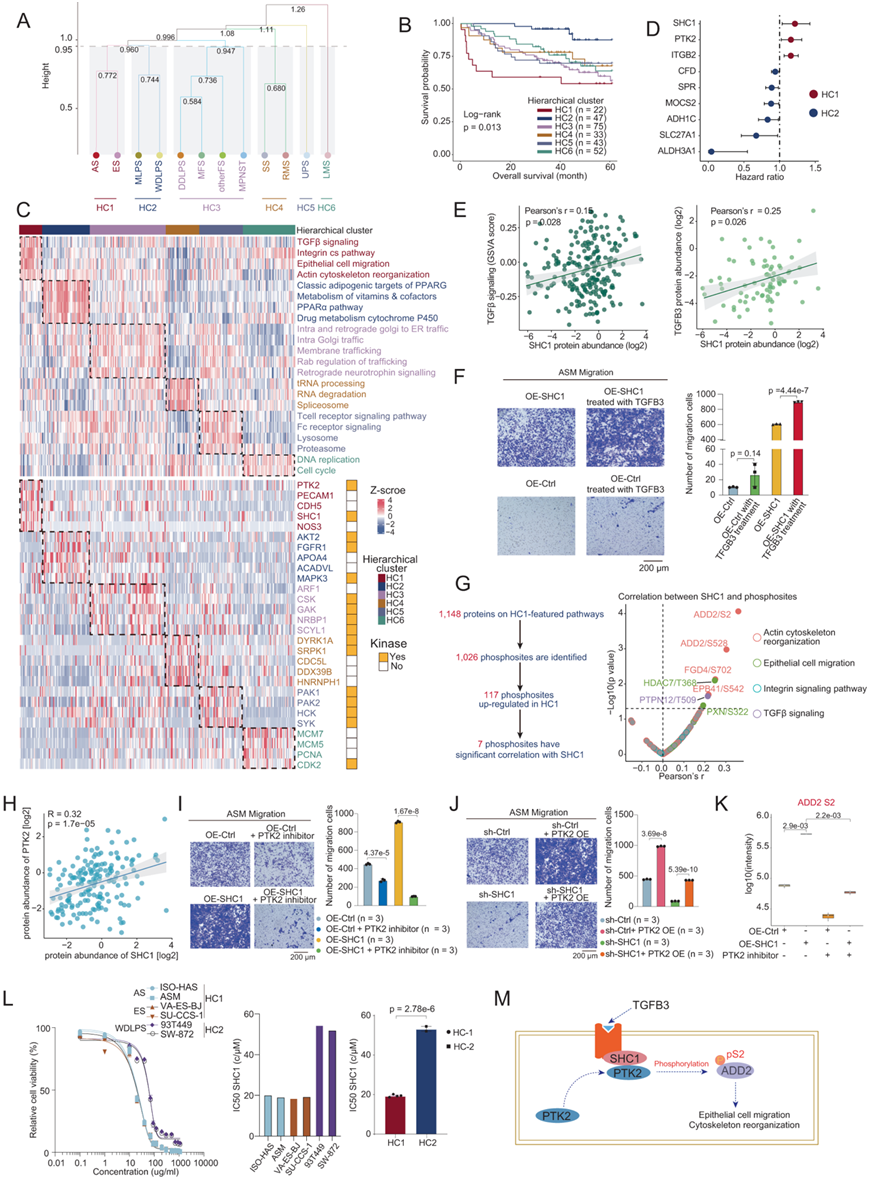
图2. STS 组织学亚型的层次聚类。
(A) 层次聚类 (HC) 的树状图。(B) 按 HC 分层的肿瘤患者 OS 的 Kaplan-Meier 曲线。(C) 热图显示了不同 HC 中差异富集的途径(上图)和关键蛋白质(下图)。(D) 森林图显示了 HC1 和 HC2 中与预后相关的蛋白质。(E) 散点图描述了 SHC1 丰度与 TGFβ 信号传导 GSVA 评分或 TGFB3 丰度之间的相关性。 (F) 通过 Transwell 实验证实了 TGFB3 对 ASM 细胞迁移的影响。 (G) 流程图和火山图显示磷酸位点在 HC1 中均上调且与 SHC 显著相关。(H) 散点图显示 PTK2 和 SHC1 蛋白表达量呈正相关。(I-J) Transwell 实验和条形图显示了不同处理下 ASM 细胞的迁移细胞计数。 (K) 箱线图表示不同处理下 ADD2 S2 的磷酸化强度。(L) 剂量反应曲线和IC50值呈现了6种细胞系对SHC1抑制剂的不同反应效果。 (M) SHC1依赖性细胞迁移的机制的示意图。
03
蛋白质组学亚型揭示了 STS 组织学亚型内的异质性
除了基于蛋白质组数据的层次聚类揭示了 STS 组织学亚型之间的关系之外,他们还进一步进行了基于蛋白质组数据的亚型分析。
基于 272 个肿瘤样本的整体蛋白质组学数据的共识聚类确定了具有不同临床结果、增殖评分、基质评分和通路富集的三个聚类(PC-Ra、PC-Cc 和 PC-Sm)(图3A)。值得注意的是,蛋白质组聚类在OS中存在显著差异,其中PC-Ra和PC-Cc的预后比PC-Sm差(图3C)。为了探索蛋白质组学特征和信号通路在蛋白质组聚类间的多样性,他们利用基于2757个蛋白质组学聚类间差异表达的共识聚类,发现了6个蛋白质组集,说明了3个蛋白质组学聚类间不同的蛋白质表达模型(图3A)。PC-Ra的特征是富集了RAS-MAPK级联和血管生成,具有低等级的氧化还原过程。PC-Cc的特点是高表达参与细胞周期相关途径的蛋白质,包括mRNA加工、DNA修复、细胞群增殖和染色体组织。一致地,PC-Cc具有最高的细胞周期评分(图3A)。
为了评估本项研究的蛋白质组聚类与组织学亚型的交叉点,他们使用这两个分类器比较了 272 名 STS 患者的亚型分配。有趣的是,LMS 组织学亚型 (HC6) 在三个蛋白质组聚类中正交分布,这意味着该亚型并不局限于独特的蛋白质组特征(图 3 A-B)。通过进一步的蛋白质组聚类和患者临床特征的综合分析,他们发现PC-Ra患者在术后5年内的转移率高于PC-Cc和PC-Sm(图3D)。在组织学上,PC-Ra包含所有6个层次聚类,然后他们根据HC对PC-Ra进行划分,并评估这3个转移相关通路的ssGSEA富集评分。因此,HC1 (As和ES)与其他HC的区别在于HC1中血管生成的富集程度最高,而RAS-MAPK级联通路的富集程度最低(图3E)。因此,他们假设PC-Ra和HC1 (PC-Ra-HC1)患者的转移可能主要由血管生成驱动,PC-Ra和其他HC (PC-Ra- ohc)患者的转移可能主要由RAS-MAPK信号通路驱动。同样,他们针对参与PC-Ra这些特征通路的蛋白,从PC-Ra- hc1与PC-Ra- oHC、转移与非转移两个方面分析它们的不同表达倾向,探索与转移相关的关键蛋白(图3F)。他们发现PC-Ra-HC1转移样本中SHC1和MAPK10富集(图3F)。免疫组织化学(IHC)也证实了SHC1和MAPK10分别在PC-Ra-HC1和PC-Ra-oHC中高表达(图3G)。为了验证SHC1对PC-Ra-HC1转移的促进作用,他们构建了SHC1过表达的ISOHAS细胞系(ISOHAS-SHC1-OE)。因此,transwell实验显示ISOHAS-SHC1-OE细胞株的迁移能力增强(图3H)。
然后,他们结合不同表达和蛋白-磷酸化位点相关性分析,发现磷酸化位点可能是SHC1或MAPK10磷酸化信号转导的下游参与者(图3I)。值得注意的是,CTNNB1 Ser552与SHC1呈正相关,CTNNB1 Ser675与MAPK10呈正相关(图3I)。
为了确定与SHC1、CTNNB1 Ser552位点磷酸化和肿瘤转移相关的潜在激酶,他们参考了公共数据库并进行了进一步的相关性分析。因此,在公开报道的CTNNB1激酶中,CSNK1G1与SHC1和CTNNB1的Ser552位点磷酸化均呈显著正相关(图3J-K)。为了进一步研究CSNK1G1在影响肿瘤转移中的作用,他们用CSNK1G1抑制剂处理了SHC1-OE-ISOHAS和Ctrl-OE-ISOHAS细胞系,然后用transwell实验评估细胞迁移,抑制CSNK1G1可以显著降低SHC1增加的细胞迁移率(图3L-M)。
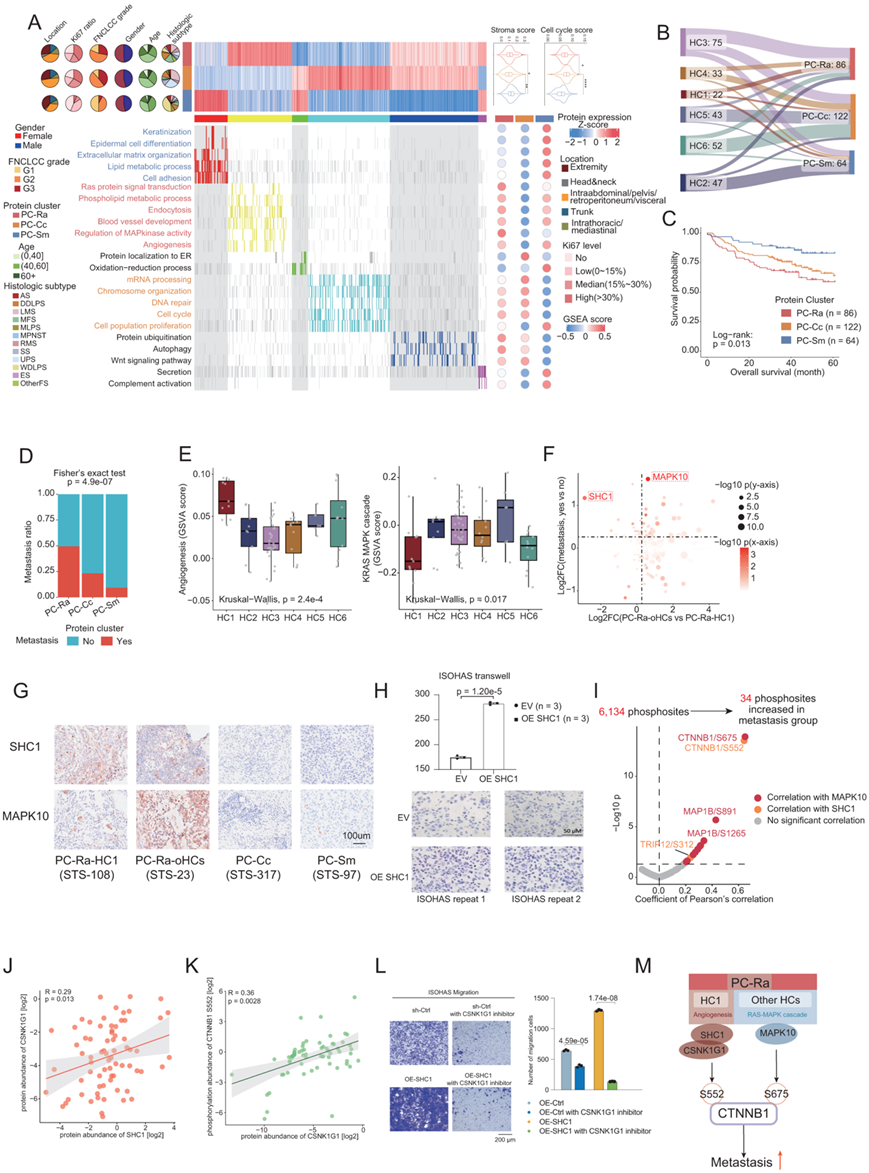
图3. STS 的蛋白质组聚类。
(A) 热图呈现 3 个蛋白质组聚类 (PC)、6 个蛋白质组以及蛋白质组中的富集通路。(B) 桑基图说明了层次聚类和蛋白质组聚类之间的关系。 (C) 蛋白质组亚型 OS 的 Kaplan-Meier 曲线。(D) 条形图表示蛋白质组聚类的转移率。(E) 箱线图表示层次聚类之间血管生成和 KRAS-MAPK 级联的 GSVA 评分。(F) 散点图展示了四组中不同表达模型的蛋白:转移组、非转移组、PC-Ra-oHC和PC-Ra-HC1。(G) SHC1 和 MAPK10 的 IHC 图像。(H) Transwell实验证实SHC1对ISOHAS细胞系的细胞迁移有促进作用。(I) 火山图显示了转移组中富集的磷酸位点,并与 SHC1 或 MAPK10 相关。 (J) CSNK1G1 和 SHC1 之间的丰度相关性。 (K) CSNK1G1 丰度与 CTNNB1 Ser552 磷酸化水平之间的相关性。(L) 通过transwell实验证实了SHC1-CSNK1G1轴对ISOHAS迁移的影响。(M) 与 PC-Ra 转移相关的两种不同机制的示意图。
04
APEX1 促进 PC-Cc 细胞增殖
尽管PC-Cc和PC-Ra均与不良预后相关,但PC-Cc显示细胞周期途径的富集度升高(图 3A)。为了进一步探讨预后与细胞周期相关蛋白的关系,他们对细胞周期相关蛋白进行了Cox比例风险模型分析,发现APEX1与预后的相关性最显著(图4A)。APEX1 是碱基切除修复(BER)途径的关键酶,其功能是修复由氧化剂或烷化剂引起的 DNA 损伤。APEX1 在多种癌症的进展中发挥着关键作用,包括胃癌、结肠癌和肝细胞癌。为了进一步探讨 APEX1 是否通过细胞增殖促进不良预后,他们进行了相关性分析,发现 APEX1 丰度与 PC-Cc 细胞增殖评分之间呈正相关(图4B)。APEX1在KI67比率较高的组中显示出较高的丰度,证实了APEX1丰度与细胞增殖的正相关性(图 4B)。
此外,为了验证APEX1对PC-Cc细胞增殖的促进作用,他们利用两种LMS细胞系(RKN和SK-UT-1B)产生了APEX1过表达细胞系(RKN-APEX1和SK-UT-1B-APEX1),因为LMS是PC-Cc的主要组织学亚型之一。结果表明,过表达APEX1后,两种细胞系均表现出较高的细胞增殖率,证明APEX1对体外细胞增殖的促进作用(图4C)。在此基础上,他们进一步探索了在细胞周期通路中可能与APEX1协同作用的蛋白,发现BANF1、RUVBL1、NPM1等蛋白与APEX1呈正相关(图4D)。
为了验证APEX1和NPM1在PC-Cc中的相互作用,他们收集了不同APEX1表达水平的PC-Cc患者的PDC,利用APEX1抗体(抗APEX1)进行免疫沉淀-质谱(IP-MS)实验(图4G)。结果,高APEX1与对照组的比较鉴定出48种特异性与APEX1相互作用的蛋白。其中,与对照组相比,高APEX1组NPM1表达最高,证实了APEX1和NPM1在PC-Cc中存在密切的相互作用(图4E-F)。与APEX1一致,他们也在蛋白水平上证明了NPM1与PC-Cc细胞增殖之间的正相关,在公共独立队列中在mRNA水平上证明了NPM1与细胞增殖之间的正相关(图4E-G)。生存分析进一步发现,NPM1和APEX1均高表达的患者预后较差(图4H)。NPM1作为一种磷酸化蛋白,在细胞周期的不同阶段由多种激酶磷酸化,调节其亚细胞定位和功能。他们假设NPM1的磷酸化可能有助于其与APEX1的相互作用。最后,他们评估了NPM1 Ser125丰度与APEX1的相关性最高(图4I)。此外,他们通过激酶-底物相关性分析进一步探索了NPM1 Ser125的上游激酶,发现NPM1 Ser125与RIOK1呈显著正相关,提示NPM1 Ser125可能是RIOK1的底物。
他们还构建了RIOK1过表达的RKN细胞系(RIOK1-OE-RKN)和RIOK1敲低的RKN细胞系(RIOK1-KD-RKN)来验证RIOK1在促进细胞增殖和磷酸化NPM1 Ser125中的作用。CCK8细胞增殖实验显示,RIOK1-OE-RKN显著提高细胞增殖率,RIOK1-KD-RKN显著降低细胞增殖率(图4K)。RIOK1抑制剂还可以显著降低RIOK1-OE-RKN的增殖(图4K)。这些结果证实了 RIOK1 对促进肉瘤肿瘤细胞增殖的影响。然后,他们对不同处理的 RKN 肉瘤细胞系进行了比较蛋白质组和磷酸化蛋白质组分析。结果,除了APEX1之外,参与DNA碱基切除修复的蛋白质包括XRCC1、XRCC4、POLB以及细胞增殖指数KI67在RIOK1-OE-RKN中表现出升高的表达(图4L)。与高RIOK1 PDC的结果一致,NPM1 Ser125在RIOK1-OE-RKN中显著增加,验证了RIOK1和NPM1 Ser125的相关性(图 4L)。
为了进一步研究NPM1磷酸化对细胞增殖及其与APEX1相互作用的影响,他们构建了突变型NPM1 Ser125质粒(NPM1 S125A),并将其转染至RIOK1-KD-RKN细胞(NPM1 S125A -OE-RIOK1- KD-RKN)。将野生型 NPM1 质粒也转染至 RIOK1-KD-RKN 细胞(NPM1-OE-RIOK1-KD-RKN)作为对照。与RIOK1-KD-RKN相比,NPM1-OE-RIOK1-KD-RKN显示出升高的细胞增殖率,而NPM1 S125A -OE-RIOK1-KD-RKN的细胞增殖率没有显示出显著升高(图 4M)。一致地,还观察到细胞增殖指数KI67仅在NPM1-OE-RIOK1-KD-RKN中升高(图 4N)。同时,比较蛋白质组学和磷酸化蛋白质组学数据证实了NPM1-OE-RIOK1-KD-RKN细胞中APEX1表达增加以及NPM1 Ser125磷酸化增加(图 4N)。这些结果表明敲低 RIOK1 导致的细胞增殖率下降只能通过野生型 NPM1 过表达来挽救,这进一步强调了 NPM1 Ser125 磷酸化在药物依赖于 RIOK 的肿瘤细胞增殖调节中的作用。
这些结果说明了RIOK1通过磷酸化NPM1影响肉瘤肿瘤细胞增殖的潜在机制,NPM1随后与APEX1相互作用,从而促进肿瘤细胞增殖(图 4O)。
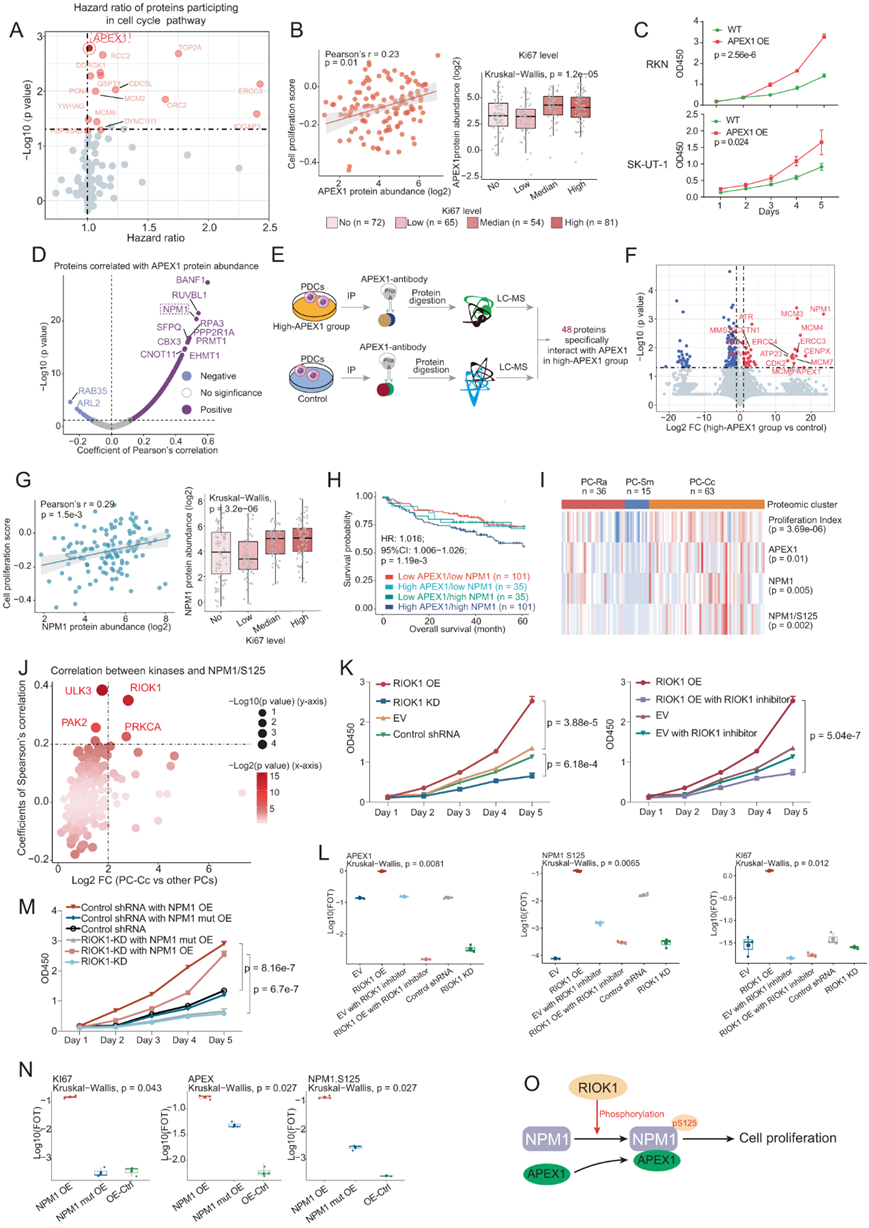
图4. PC-Cc 的特征蛋白和驱动通路。
(A) 火山图说明了 PC-Cc 中也富含的与预后相关的蛋白质。(B) 散点图说明了 APEX1 丰度与细胞增殖之间的相关性。箱线图显示了 APEX1 和 Ki67 水平之间的相关性。(C) SHC1 过表达后 RKN 和 SK-UT-1B 细胞系的增殖增加。 (D) 火山图说明了与 APEX1 显著相关的蛋白质。(E) 流程图显示了从具有不同 APEX1 表达的患者中分离出的原发性患者来源癌细胞 (PDC) 的 IP-MS 步骤。(F) 火山图显示高-APEX1 PDC 组中蛋白质上调。(G) NPM1 丰度和细胞增殖之间的相关性。(H) Kaplan-Meier 曲线说明了 APEX1 和 NPM1 对患者总生存时间的相互作用影响。(I) 热图展示了 PC-Cc 中 APEX1、NPM1 和 NPM1 Ser125 的富集情况。(J) 散点图说明了与 NPM1 Ser125 相关并在 PC-Cc 中富集的激酶。(K) RIOK1 促进 RKN 细胞系的增殖率。(L) 箱线图揭示了 RKN 细胞系中 RIOK1 对 APEX1、Ki67 和 NPM1 Ser125 的影响。(M) RIOK1 促进的 RKN 细胞系的增殖率与 NPM1 Ser125 相关。(N) 箱线图揭示了 RKN 细胞系中 NPM1 Ser125 突变对 APEX1、Ki67 和 NPM1 Ser125 的影响。(O) RIOK1、APEX1和NPM1促进细胞增殖的综合机制的示意图。
05
软组织肉瘤的免疫浸润以及MAPK10对肿瘤免疫浸润的影响
他们基于xCell74算法进行了细胞型反卷积分析来推断STS TME。基于推断细胞类型比例的共识聚类定义了具有不同免疫和基质特征的三种免疫亚型:IM-S-1(基质富集)、IM-S-2(免疫缺陷)、IM -S-3(免疫富集)(图5A,图5C)。生存分析表明免疫亚型的 OS 存在显著差异,这表明不同类型的免疫细胞浸润可能导致不同的预后结果(图 5B)。基质富集亚型(IM-S-1)主要包含PC-Sm样本(图5D),基质评分最高,并以多种类型的基质细胞为特征,如角质形成细胞、脂肪细胞和系膜细胞(图5A)。与PC-Sm的特点一致,该亚型也具有富集的补体和凝血级联以及PPAR信号通路(图5A)。免疫缺陷亚型(IM-S-2),主要含有PC-Cc和LMS,免疫评分最低。一致地,这种亚型富含参与细胞周期的蛋白质,如PCNA、CDK2、MCM4和MCM6。免疫富集亚型(IM-S-3)的特点是免疫评分最高,存在CD8 T细胞、CD4 T细胞、巨噬细胞等,免疫逃避标志物CD274 (PD-L1)、CD80的表达增加(图5A,图5F)。SsGSEA分析显示免疫相关通路,包括Toll样受体信号通路、T细胞受体信号通路和RIG样受体信号通路也在该亚型中富集(图5A)。有趣的是,IM-S-3中的样本比其他两种免疫亚型的转移率明显更高(图5E)。
先前的研究表明,免疫逃避可以促进许多癌症的远距离转移,例如结肠癌和乳腺癌。为了进一步探讨 IM-S-3 中较高的转移率是否与 CD80 和 CD274 的表达升高相关,他们比较了 IM-S-3 中有转移和无转移的样本之间 CD274 和 CD80 的表达水平,发现它们都具有转移组中的表达水平增加,这证实了 CD80/CD274 与 IM-S-3 中转移之间的关联(图 5G)。
值得注意的是,PC-Ra的样本也具有高转移率的特点(图 3D,5D)。基于PC-Ra与IM-S-3的交集,他们发现同时属于PC-Ra和IM-S-3(PC-Ra-IM3)的患者具有最高的转移率(56%),且CD274/CD80丰度高于PC-Ra-nIM3(患者属于PC-Ra,但不属于IM-S-3)和IM3-nPC-Ra(患者属于IM-S-3,但不属于PC-Ra)(图5H-J)。由于已经证明PC-Ra中的转移依赖于通过磷酸化Ser552或Ser675来激活CTNNB1(图 3L),因此他们随后分析了三组CTNNB1 Ser552和Ser675的表达:PC-Ra-IM3、PC-Ra- nIM3 和 IM3-nPC-Ra,发现 PC-Ra-IM3 中 CTNNB1 Ser675 高表达,但 CTNNB1 Ser552 没有发生高表达(图 5K)。
接下来,他们评估了CD274/CD80与CTNNB1 Ser675磷酸化之间的关联,并观察到CTNNB1 Ser675的丰度与CD274或CD80的表达之间的显著相关性(图 5L)。以往的研究报道CTNNB1可以诱导CD274的转录表达,这意味着CTNNB1 Ser675的磷酸化可能激活CTNNB1以诱导CD274的转录。此外,与PC-Ra中CTNNB1 Ser675和MAPK10的相关性一致,他们还观察到PC-Ra-IM3中MAPK10的表达增加,并且MAPK10和CD274/CD80之间呈显著正相关(图5 M-N) 。这些结果证明了MAPK10可能通过磷酸化CTNNB1 Ser675激活CTNNB1,诱导CD274的转录表达,从而导致PC-Ra-IM3患者转移的高风险。
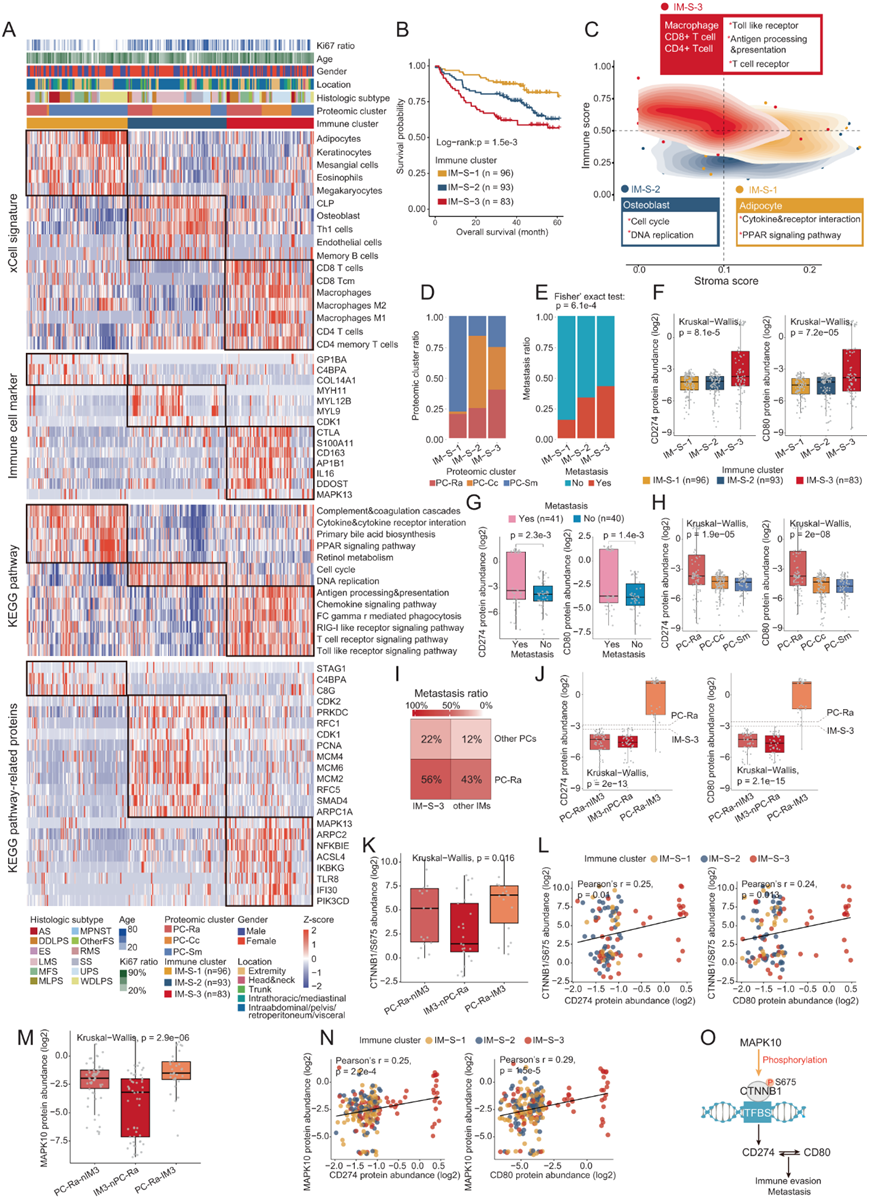
图5. STS 的免疫亚型。
(A) 热图展示了三个免疫聚类之间富集的细胞类型组成、蛋白质和途径。 (B) Kaplan-Meier 曲线说明了三个免疫聚类的不同 OS。(C) 基于基质和免疫评分的不同免疫聚类的密度等值线图。 (D) 条形图表示每个免疫聚类中蛋白质组聚类的比例。(E) 条形图表示每个免疫聚类中有转移和没有转移的患者的比例。(F) 箱线图显示不同免疫聚类中 CD274 和 CD80 的丰度。(G) 箱线图显示有和没有 IM-S-3 转移的患者中 CD274 和 CD80 的丰度。(H) 箱线图显示不同蛋白质组聚类中 CD274 和 CD80 的丰度。(I) 热图显示了不同蛋白质组和免疫聚类的转移率。(J) Boxplot 显示三组中的 CD274 和 CD80 丰度:PC-Ra-nIM3、IM3-nPC-Ra和 PC-Ra-IM3 。(K) Boxplot 显示了三组 CTNNB1 Ser675 的磷酸位点丰度:PC-Ra-nIM3、IM3-nPC-Ra和 PC-Ra-IM3。(L) 散点图显示了 CTNNB1 pSer675 和 CD274 或 CD80 丰度之间的相关性。(M) 箱线图显示 PC-Ra-nIM3、IM3-nPC-Ra和 PC-Ra-IM3中 log2 转换的 MAPK10 蛋白丰度 。(N) 散点图显示了 MAPK10 和 CD274/CD80 之间的相关性。(O) 示意图显示MAPK10磷酸化CTNNB1 Ser675以调节CD274,从而促进转移的机制。
为了进一步从不同方面阐明STS亚群之间的关系,他们对STS的12个组织学亚型、6个层次聚类、3个蛋白质组聚类和3个免疫聚类进行了综合分析(图6A)。PC-Cc主要富集3个层次聚类(HC4、HC5、HC6)和5个组织学亚型(RMS、SS、UPS、LMS、DDLPS)。而这些组织学亚型,几乎所有分布在PC-Cc中的患者都表现出更高的增殖评分、更高的APEX1丰度和更高的NPM1丰度(图6B),这表明尽管不同的组织学亚型,但在蛋白质组学水平上仍然可以观察到一致的分子特征。此外,结合免疫聚集,他们发现Pc-Cc和IM-S-2之间有高度的重叠,暗示肿瘤对肿瘤微环境(TME)的潜在影响。有趣的是,免疫聚类主要将PC-Ra分为两个具有不同TME特征的免疫聚类:PC-Ra-IM1和PC-Ra-IM3。
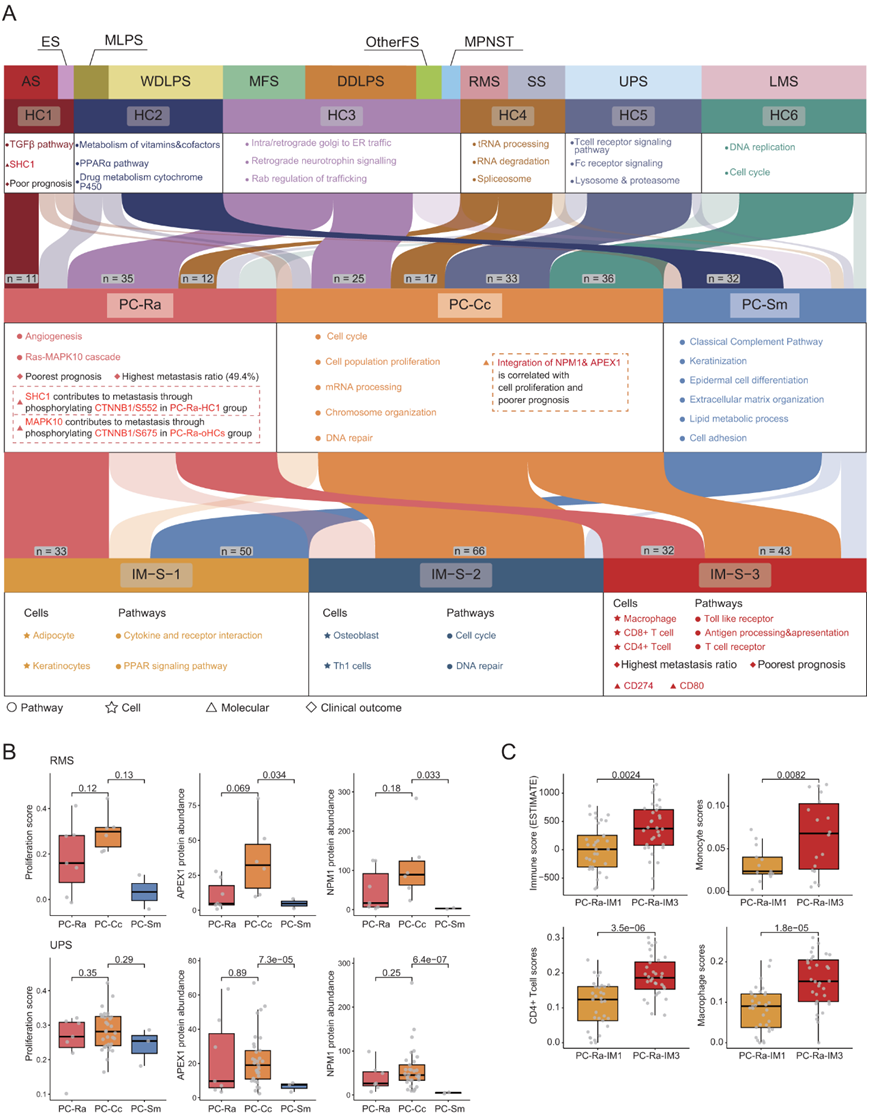
图6. 基于蛋白质组聚类的分子特征总结。
(A) 图解总结展示了不同级别亚型的特征途径和主要分子发现,包括组织学亚型、层次聚类、无偏的共识蛋白质组聚类和免疫聚类。(B) 箱线图分别在 RMS(上)和 UPS(下)中显示不同蛋白质聚类的增殖评分和 APEX1/NPM1 蛋白质丰度。 (C) 箱线图显示 PC-Ra-IM1和 PC-Ra-IM3中单核细胞/CD4 + T 细胞/巨噬细胞的免疫评分和特征评分 。
+ + + + + + + + + + +
结 论
本项研究描绘了代表 12 个主要亚型的 272 个软组织肉瘤的蛋白质组图谱。层次聚类发现血管肉瘤和上皮肉瘤之间蛋白质组学特征相似,AS和ES中SHC1表达升高与不良预后相关。此外,蛋白质组聚类将软组织肉瘤患者分为 3 个具有不同驱动途径和临床结果的蛋白质组聚类。在具有高细胞增殖率的蛋白质组聚类中,APEX1和NPM1能够促进细胞增殖并驱动癌细胞的进展。基于免疫特征的分类定义了具有独特肿瘤微环境的三种免疫亚型。进一步的分析说明了免疫逃避标记物(PD-L1 和 CD80)与软组织肉瘤中肿瘤转移之间的潜在关联。总体而言,该分析揭示了肉瘤类型特异性的蛋白质变化,提供了有关软组织肉瘤关系的见解。
+ + + + +



 English
English


