文献解读|Nat Commun(16.6):肠道菌群在炎症性抑郁症中的免疫调节作用
✦ +
+
论文ID
原名:Immunoregulatory role of the gut microbiota in inflammatory depression
译名:肠道菌群在炎症性抑郁症中的免疫调节作用
期刊:Nature Communications
影响因子:16.6
发表时间:2024.04.08
DOI号:10.1038/s41467-024-47273-w
背 景
重度抑郁症 (MDD) 仍然难以预防和治疗,主要是因为该疾病的特征高度异质性且涉及多因素过程。越来越多的证据表明炎症在 MDD 的病因和病理生理学中起着重要作用。这种类型的抑郁症与促炎细胞因子增加有关,例如白细胞介素 6 (IL-6)、肿瘤坏死因子 α (TNF-α)、C 反应蛋白 (CRP) 以及其他一些因素,这些炎症因子可能有助于区分炎症性和非炎症性抑郁症。研究表明,肠道紊乱的微生物群,可能是导致神经退行性疾病的主要炎症来源。肠道微生物群可直接调节免疫系统,并有助于维持和破坏免疫耐受性。肠道菌群紊乱可能是低度炎症的根源。目前,肠道菌群的特征及其在这种抑郁症亚型中的免疫调节作用仍不明确。
实验设计
结 果
01
MDD 患者与 HC 之间的肠道菌群组成
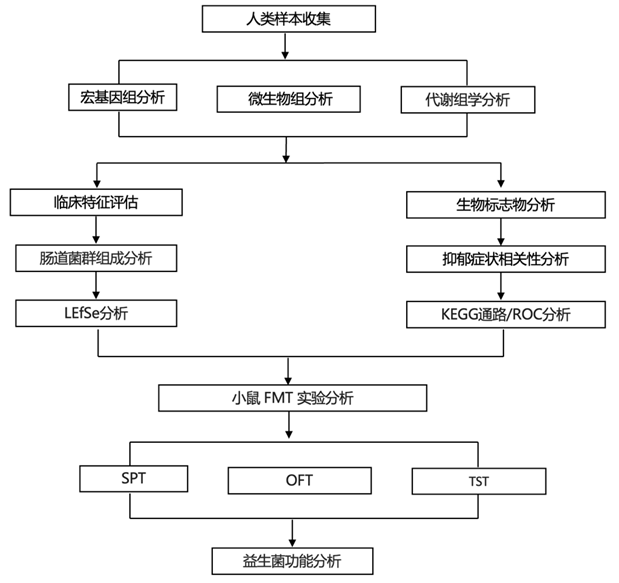
研究者团队首先对 MDD 患者和健康对照者 (HC) 进行人体研究。MDD 患者与 HC 患者的年龄、性别和体质指数 (BMI) 相似。该队列中的患者没有其他躯体疾病,并且不超重。MDD 患者的受教育年限明显少于 HC。MDD 组的汉密尔顿抑郁量表 (HAMD-17) 和汉密尔顿焦虑量表 (HAMA) 总分高于 HC 组。他们发现 MDD 组的 hs-CRP 水平高于 HC 组;然而,IL-1β、IL-6、IL-10 和 TNF-α 浓度在两组之间没有显著差异。MDD 组的丙酸和丁酸水平明显低于 HC,但两组间的乙酸、异丁酸、戊酸和己酸水平相当。
Alpha 多样性分析表明,MDD 患者的 Chao 指数、Faith 系统发育多样性 (PD) 和观察到的物种数量高于 HC(图 1A)。Beta 多样性分析表明,组间差异大于组内差异(图 1B)。使用线性判别分析效应大小 (LEfSe) 检验来探讨 MDD 患者与 HC 之间的微生物组差异。在科水平上,小单孢菌科和红螺菌科的相对丰度在 MDD 患者中显著较高,而梭菌科、消化链球菌科、巴斯德氏菌科和Turicibacteraceae的丰度显著高于HC组。在属水平上,Adlercreutzia的相对丰度在MDD患者中明显较高;然而,Clostridium、梭菌、罗斯氏菌、嗜血杆菌、SMB53和Turicibacter的丰度在HC中明显较高(图 1C)。
相关性分析显示,梭菌、罗斯氏菌、嗜血杆菌、SMB53和Turicibacter的相对丰度与丙酸和丁酸呈正相关,与 hs-CRP 和 HAMD-17 总分呈负相关。hs-CRP 水平也与 HAMD-17 总分和 HAM-A 呈正相关(图 1D)。热图显示,一些参与炎症激活的细胞因子蛋白,如 TNF-R1、TNF-R2、巨噬细胞集落刺激因子 (MCSF) 和 IL-12,均过度表达。然而,与 HC 相比,生长激素 (GH)、成纤维细胞生长因子 4 (FGF-4)、转化生长因子 1β (TGF-1β) 和内分泌腺源性血管内皮生长因子 (EG-VEGF) 均参与肠粘膜修复,但在 MDD 患者中表达不足(图 1E)。
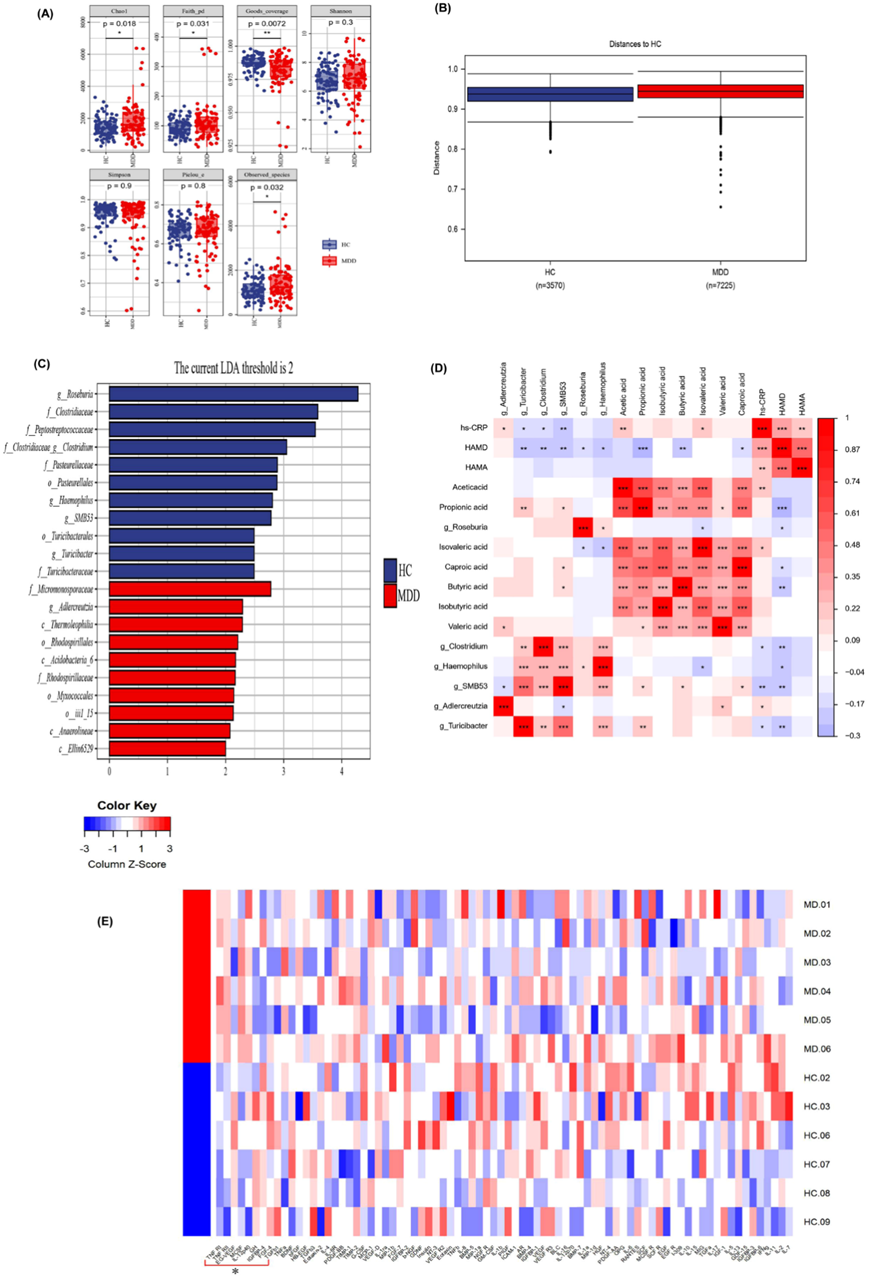
图1. MDD 患者的肠道微生物组成、短链脂肪酸 (SCFA) 和炎症指标。
(a) Alpha 多样性分析。 (b) Beta多样性分析。(c) 线性判别分析(LDA)效应大小(LEfSe)表明,在科水平上,小单孢菌科和红螺菌科的相对丰度在MDD患者中显著较高。(d) 对不同属的肠道细菌、短链脂肪酸(SCFA)、hs-CRP与抑郁和焦虑严重程度进行相关性分析。(e) 肠黏膜不同细胞因子分析。
为了进一步阐明炎症途径并量化肠道通透性标志物,他们进行了酶联免疫吸附试验 (ELISA)分析。MDD 组的 TLR-4、NF-κB 和 NLRP3 水平升高(图 2A)。Claudin-1、ZO-1 和 Occludin 等通透性生物标志物的水平降低(图 2B)。相关性分析显示, Clostridium相对丰度与MCSF、hs-CRP水平呈负相关,炎症因子与通透性生物标志物(Claudin-1、ZO-1、Occludin)及SCFA(乙酸、丙酸、丁酸)呈负相关,与HAMD-17总分呈正相关;丁酸水平与Occludin呈正相关,与TLR-4、NF-κB、NLRP3、TNFR2、HAMD-17呈负相关;Claudin-1与GH、EG-VEGF等肠黏膜修复标志物呈正相关(图 2C)。
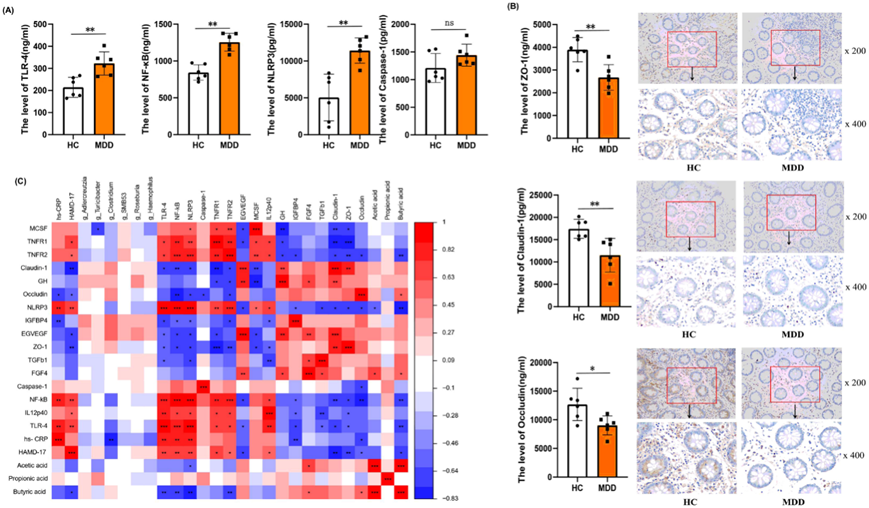
图2. MDD和 HC肠粘膜炎症因子和通透性生物标志物的差异 。
(a) 使用ELISA法测定相关标志物。 (b)免疫组化分析。(c)相关性分析。
02
肠道菌群在炎症抑郁症中的作用
为明确炎症抑郁症肠道菌群特点,对三组患者进行了LEfSe分析。与非炎症抑郁症和HC相比,促炎性细菌,如拟杆菌科和拟杆菌属的相对丰度明显较高。同时发现,炎症抑郁症患者中能产生SCFA的抗炎细菌,如拟杆菌的相对丰度较低(图 3A)。为了在属水平上确定炎症抑郁症患者与HC之间、炎症抑郁症与非炎症抑郁症之间的生物标志物,将所有不同属合并构建了受试者工作特征(ROC)曲线。ROC曲线分析显示,AUC分别为81.73%和79.16%(图 3B)。
为了进一步在种水平上识别特异性菌群,指导炎症抑郁症的治疗,他们对20例炎症抑郁症患者和20例随机选择的HC的粪便样本进行了宏基因组测序分析。LEfSe分析显示,43个物种的相对丰度在炎症抑郁症组中显著降低,9个细菌物种在炎症抑郁症组中富集(图 3C)。为了建立炎症抑郁症的精准诊断模型,结合所有不同物种构建了ROC曲线,发现AUC为100%(图 3D)。
利用KEGG直系同源(KO)数据库对两组之间的功能基因序列进行分析,发现K00244(延胡索酸还原酶A)在炎症抑郁组中表达显著降低。将K00244注释到KEGG通路图谱中,发现这些样本中丁酸代谢(map00650)异常。相关性分析发现,K00244丰度与HAMD-17评分呈显著负相关,与丁酸水平呈正相关(图3E)。炎症抑郁症中一些减少的物种(Clostridium_butyricum、Clostridium_sp.CAG_343、Clostridium_sp.CAG_417、Faecalibacterium_sp. AF27-11BH和Eubacterium_sp.AF36-5BH)与 hs-CRP、SCFAs、K00244 和抑郁症状相关。此外, Mogibacterium diversum水平与 hs-CRP 和抑郁症状呈正相关(图 3F)。
与非炎症抑郁组相比,炎症组炎症因子TLR-4、NF-κB、NLRP3、Caspase-1、TNF-RI、TNF-RII、MCSF含量均增加,且炎症抑郁组肠黏膜生物标志物ZO-1及Occludin通透性降低,但仅NF-κB、TNF-RII、Occludin三者间差异有统计学意义(图3G)。
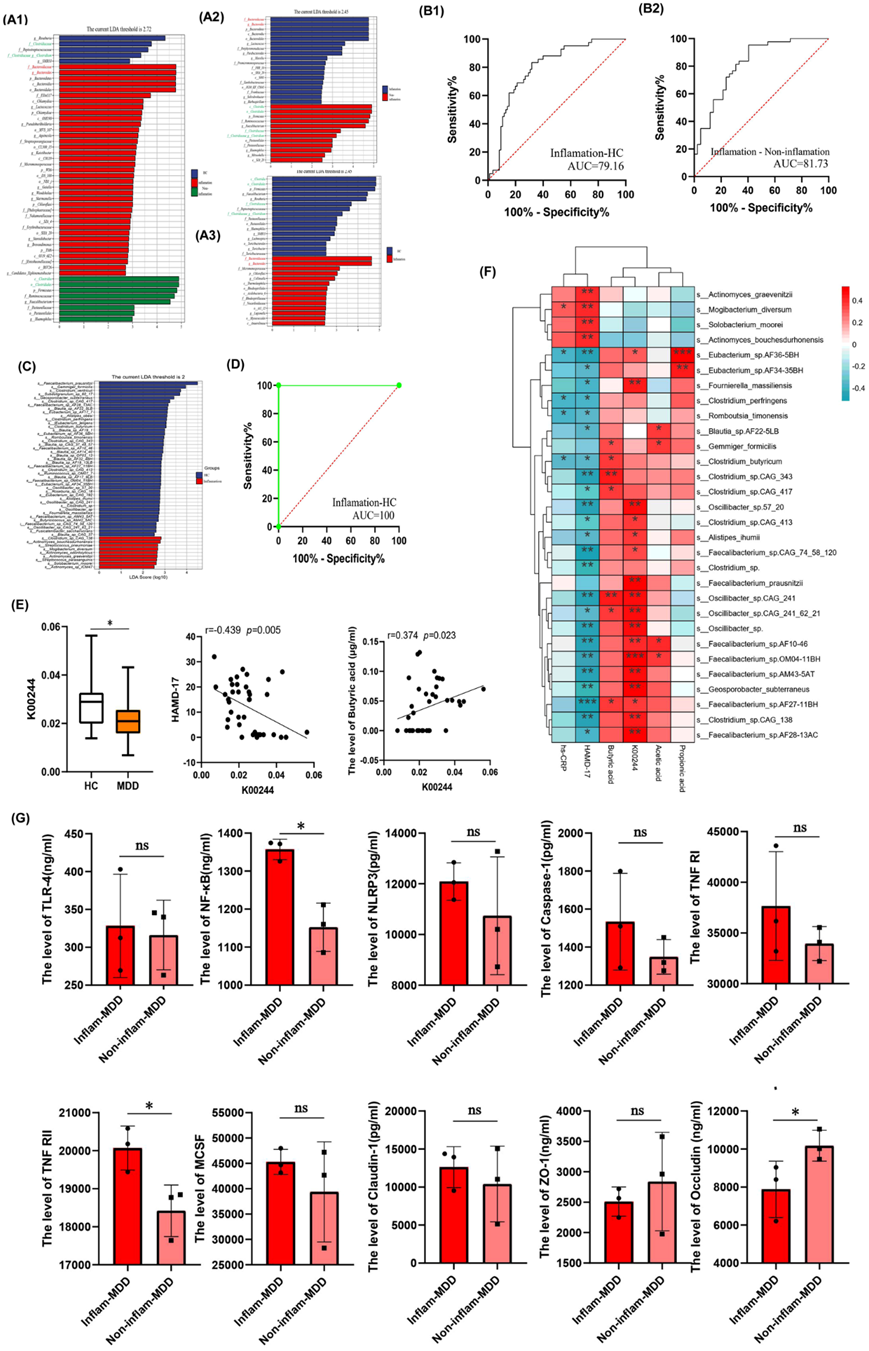
图3. 炎症抑郁症的肠道菌群特征、肠粘膜炎症因子和通透性生物标志物。
(a) 为明确炎症抑郁症肠道菌群特点,对三组进行LEfSe分析。(b) 为确定在属水平上区分炎症抑郁症与HC、炎症抑郁症与非炎症抑郁症的生物标志物,将各属合并制作受试者工作特征(ROC)曲线,ROC分析显示AUC分别为81.73%和79.16%。 (c) 对肠道菌群进行宏基因组测序分析。(d) 结合所有不同物种制作了ROC曲线。(e) K00244的表达在炎症抑郁症组中显著降低。(f) 相关性分析。(g) 炎症抑郁症患者肠黏膜炎症因子及通透性生物标志物分析。
03
炎症抑郁症患者的肠道微生物组移植可在受体小鼠中诱发抑郁样行为
为了确定抑郁相关的行为表型是否与肠道菌群紊乱有关,他们进行了粪便菌群移植 (FMT)实验(图 4A)。FMT 后,高炎症组小鼠在蔗糖偏好测试 (SPT) 中消耗的蔗糖较少,表明小鼠表现出更多的快感缺乏样行为。在旷场测试 (OFT) 中,与低炎症组、HC 组和空白组相比,高炎症组小鼠活动减少,焦虑增加。同样,与 HC 组和空白组 相比,高炎症组在悬尾测试 (TST) 中的不动持续时间增加 ,表明抑郁样行为增加。高炎症组小鼠体重明显低于低炎症组、HC组和空白组,且高炎症组小鼠体重变化小于其他组(图 4B-C)。总体而言,这些行为测试表明,移植了炎症抑郁症患者微生物群的小鼠体重更轻、体重变化较小、活动减少、焦虑增加和抑郁样行为。
Alpha多样性分析显示,高炎症组的Simpson指数低于低炎症组、HC组和空白组(图 4D)。Beta多样性分析显示,经Jaccard相异度计算,高炎症组与其他组之间的细菌群落组成存在明显差异(图 4D)。LEfSe分析用于分析四组之间的菌群差异,结果显示,高炎症组的Bacteroidaceae和Bacteroides相对丰度显著较高,而HC组的Clostridiales和Clostridia相对丰度显著较高(图 4D)。
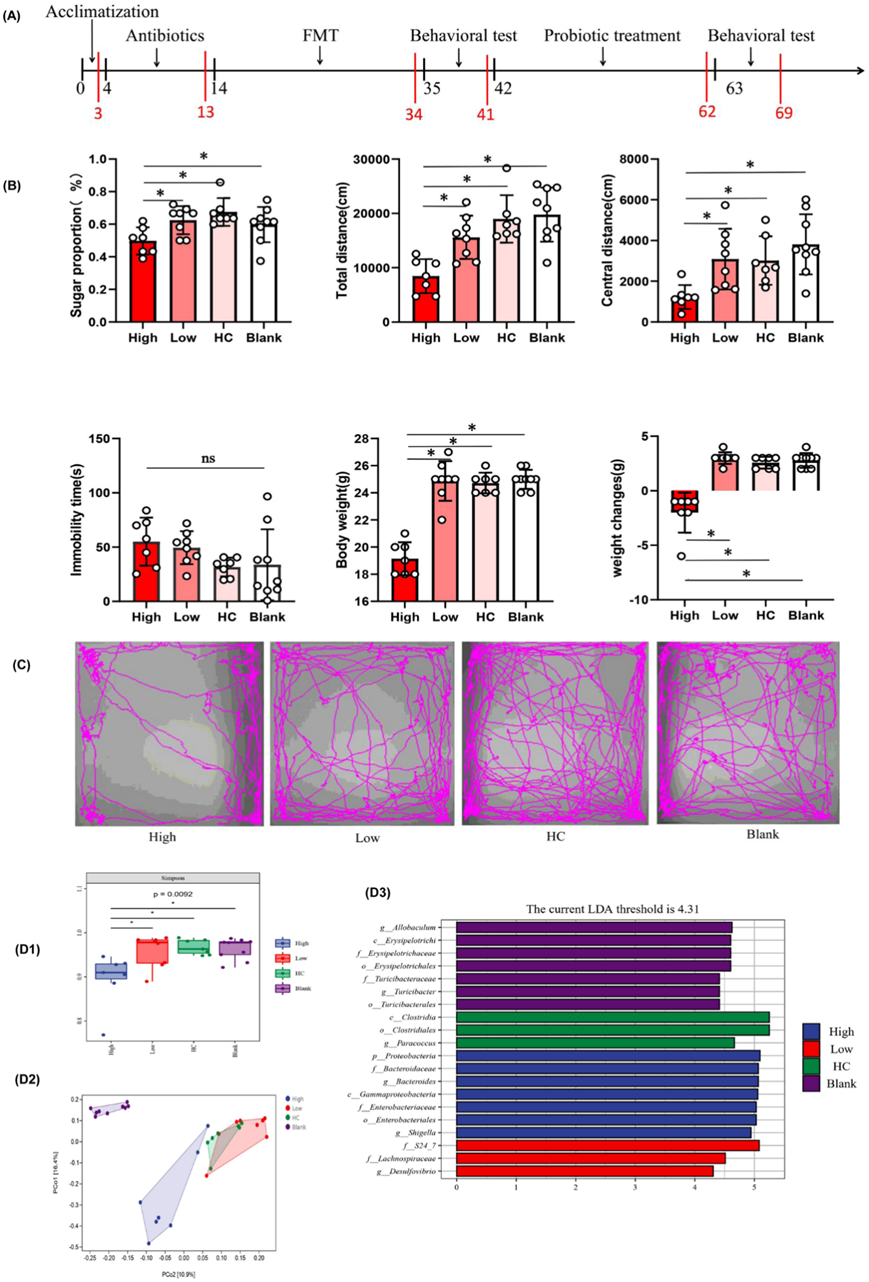
图4. 炎症抑郁症小鼠模型的行为特征和肠道菌群组成。
(A)小鼠治疗和行为测试示意图。 (b) 肠道菌群悬浮液比较。(c) OFT中小鼠的运动轨迹。 (d1-3) Alpha 多样性分析、Beta 多样性分析、LEfSe 分析。
04
高炎症组肠黏膜炎症因子及通透性升高
菌群紊乱可影响免疫和炎症途径,导致免疫激活和肠黏膜炎症,进一步破坏肠道屏障。因此,他们通过 qPCR 研究肠道菌群在炎症中的影响,并通过免疫组织化学研究肠黏膜通透性。与低炎症组、HC 组和空白组相比,高炎症组肠黏膜中 TLR -4 和 NLRP3 等炎症因子的表达增加(图5A )。此外,他们发现高炎症组通透性生物标志物(例如 Claudin-1 和 ZO-1)的数量和面积密度降低(图5B)。高度炎症组的Occludin密度呈降低趋势,但高度与低度炎症组之间差异无统计学意义。此外,他们用免疫荧光法评估了海马内小胶质细胞的数量和形态,发现高炎症组iba-1和小胶质细胞分支的面积密度增加(图 5D)。
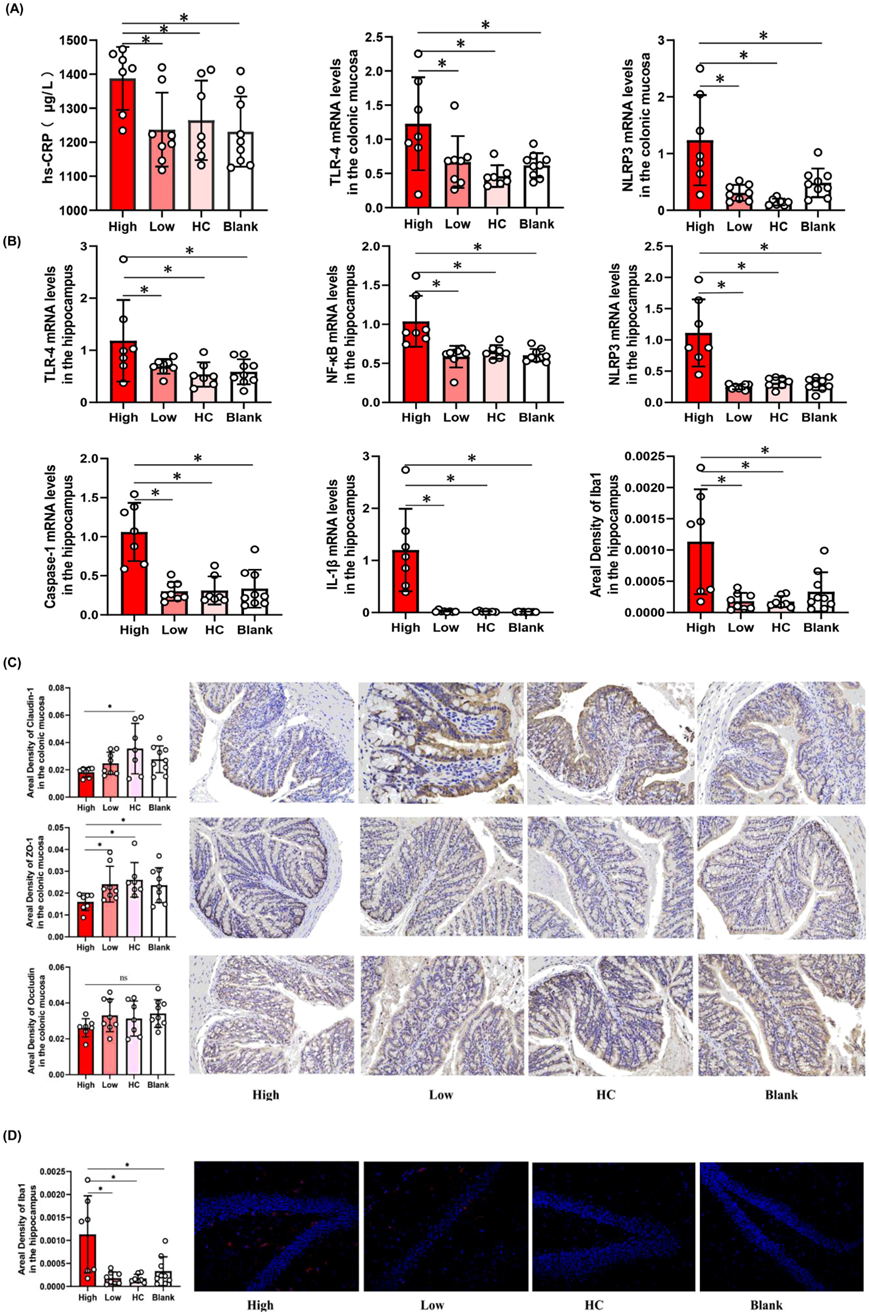
图5. 高炎症组的炎症因子升高。
(a) 高炎性组肠黏膜TLR-4、NLRP3表达及血清hs-CRP浓度较低炎性组、HC组、空白组升高。(b) 高炎症组脑组织 TLR-4、NF-κB、NLRP3、Caspase-1表达及 Iba1密度 升高。 (c) ELISA 和免疫组化分析。(d) 高炎症组海马小胶质细胞数量和分支增多。
05
益生菌丁酸梭菌(CB) 对小鼠炎症抑郁症模型的影响
总体而言,他们发现在高炎症小鼠中促炎细菌的丰度增加,而抗炎细菌的丰度降低。为了进一步研究高炎症小鼠肠道菌群与抑郁症状之间的关系,他们给高炎症小鼠补充了产丁酸的抗炎细菌(CB),通过 alpha 多样性分析发现 CB 组的 Simpson 指数增加(图 6A)。还通过 beta 多样性分析发现,高炎症组和 CB 组的细菌群落组成存在明显差异(图 6B)。此外,LEfSe 分析显示 CB 组中梭菌的丰度增加,拟杆菌的丰度降低(图 6C)。
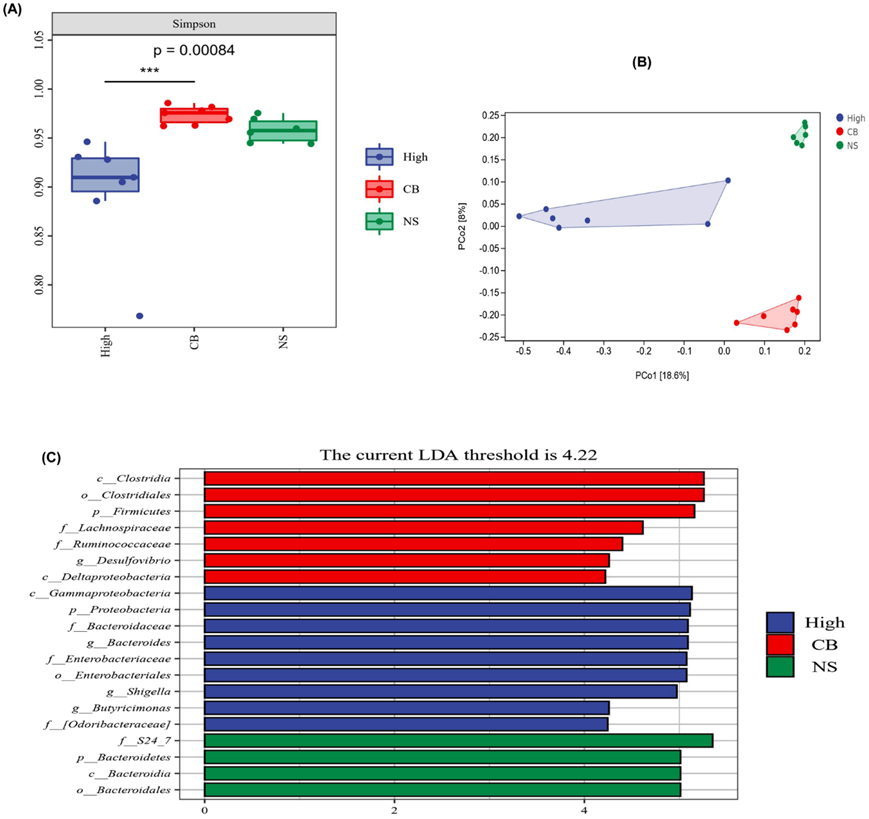
图6. 益生菌(CB)对炎症抑郁症小鼠模型肠道菌群的影响。
(a) Alpha 多样性分析。(b) Beta多样性分析。(c) LEfSe 分析。
与高炎症组相比,CB组肠黏膜炎症因子TLR-4、NLRP3表达降低,血清hs-CRP浓度降低(图 7A),脑组织TLR-4、NF-κB、NLRP3、Caspase-1、IL-1β表达降低(图 7C)。他们发现CB组通透性生物标志物Claudin-1、ZO-1升高,而Occludin呈升高趋势,但差异均无统计学意义(图 7B)。CB组海马内小胶质细胞数量和分支减少(图 7D)。
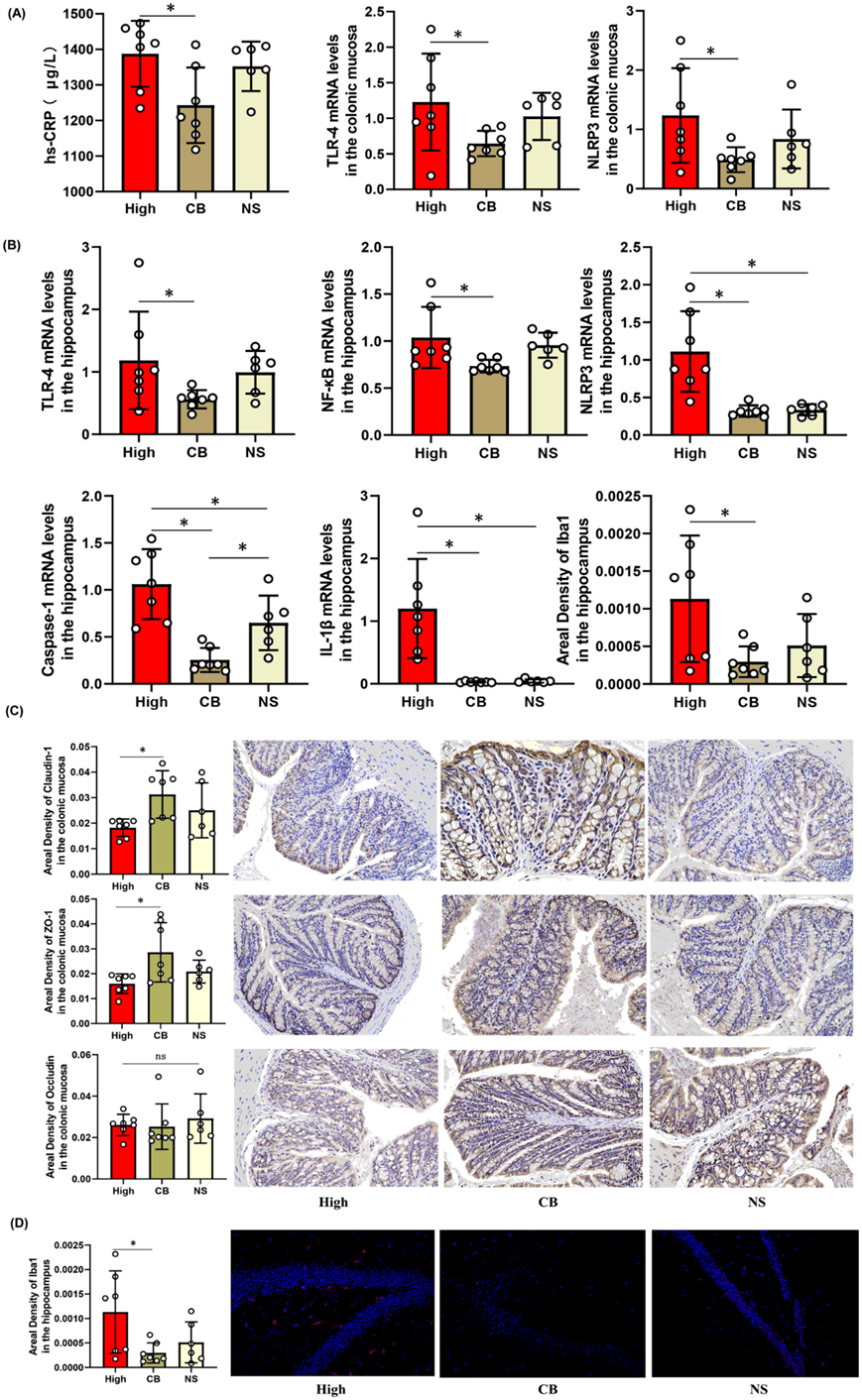
图7. 益生菌(CB)对炎症抑郁症小鼠模型炎症因子的影响。
(a) CB 降低了 肠黏膜中TLR-4、NLRP3的表达以及血清中 hs-CRP 的浓度。 (b) CB降低了脑中 TLR-4、NF-κB、NLRP3和 Caspase-1的表达。 (c) ELISA 和免疫组化分析。(d) CB 组海马小胶质细胞的面密度、数量和分支减少。
此外,使用行为测试评估抑郁样行为。在 SPF 中,CB 组小鼠消耗的蔗糖比高炎症组或生理盐水 (NS) 组更多。在 OFT 中,CB 组小鼠活动增加(总行进距离更长)且焦虑减少(在远离墙壁的暴露中心区域行进更多)。同样,CB 组小鼠在 TST 中的不动持续时间减少。小鼠体重显著增加,并且 CB 组体重变化更大(图 8A-B)。
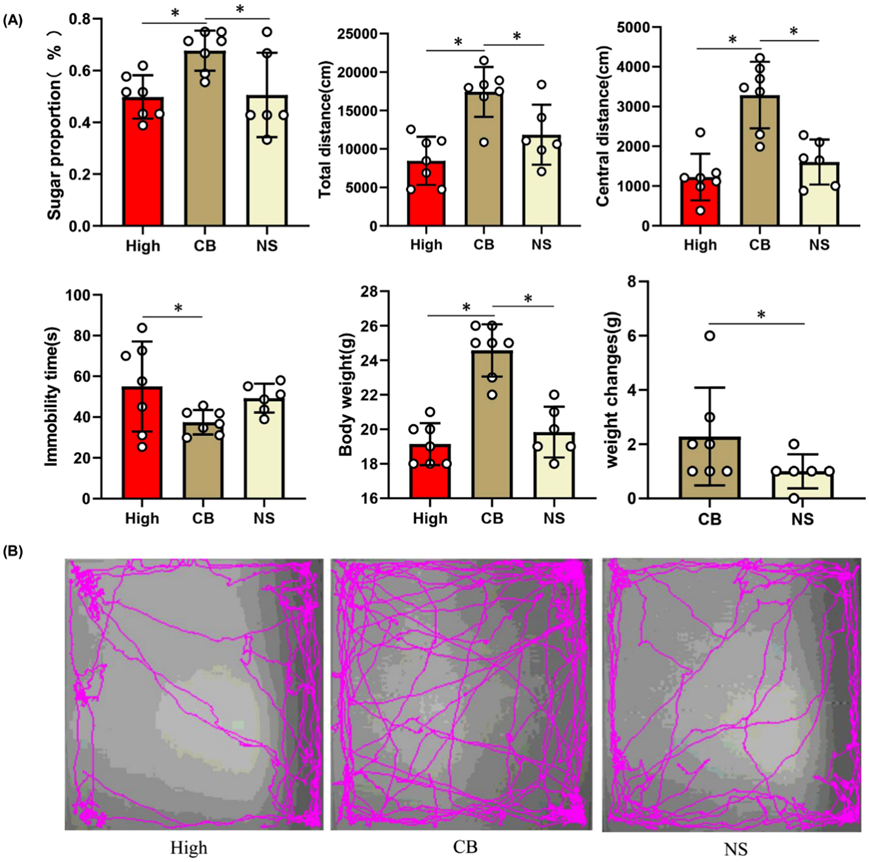
图8. 益生菌(CB)对炎症抑郁症小鼠模型抑郁样行为的影响。
(a) CB 组小鼠在 SPT 中消耗的蔗糖比高炎症组和 NS 组小鼠多。(b) OFT中小鼠的运动轨迹。
+ + + + + + + + + + +
结 论
本项研究发现炎症抑郁症患者的肠道菌群表现出较高的拟杆菌属和较低的梭菌属,并且丁酸代谢异常的产 SCFA 菌种有所增加。FMT 后,炎症抑郁组的肠道菌群在出现抑郁和焦虑样行为的受体小鼠中显示外周和中枢炎症因子增加以及肠粘膜通透性增加。丁酸梭菌给药可使肠道微生物群正常化,减少炎症因子,并在炎症性抑郁症小鼠模型中表现出抗抑郁样作用。这些发现表明,源自肠道微生物群的炎症过程可能与炎症性抑郁症的神经炎症有关。
+ + + + +



 English
English


