文献解读|Nat Commun(17.694):单细胞RNA测序揭示化疗对人胰腺癌及其肿瘤微环境的影响
+ 论文ID 原名:Single-cell RNA sequencing reveals theeffects of chemotherapy on humanpancreatic adenocarcinoma and itstumor microenvironment 译名:单细胞RNA测序揭示化疗对人胰腺癌及其肿瘤微环境的影响 期刊:Nature Communications 影响因子:17.694 发表时间:2023.2.13 DOI号:10.1038/s41467-023-36296-4
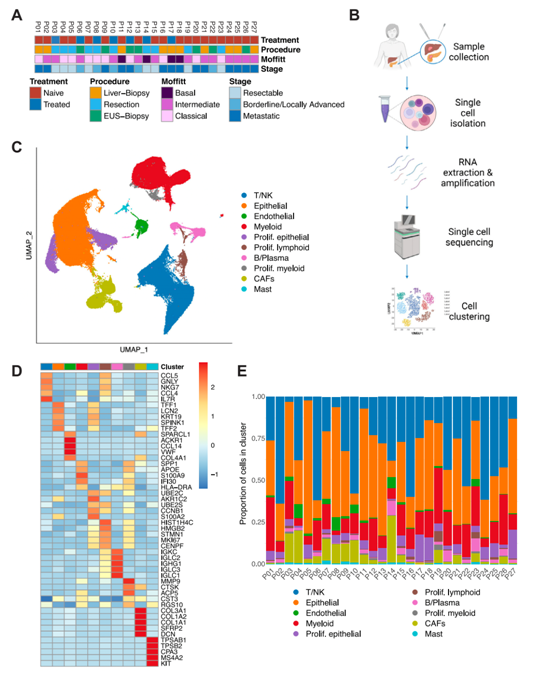
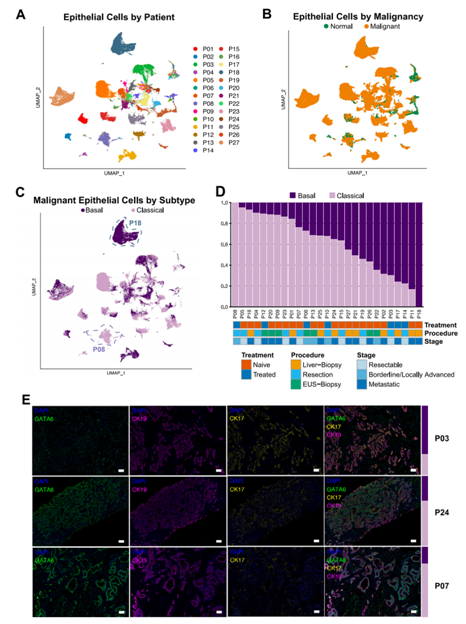
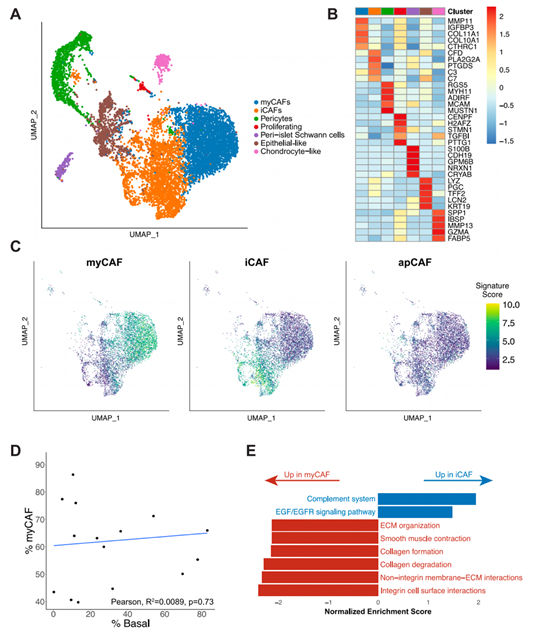
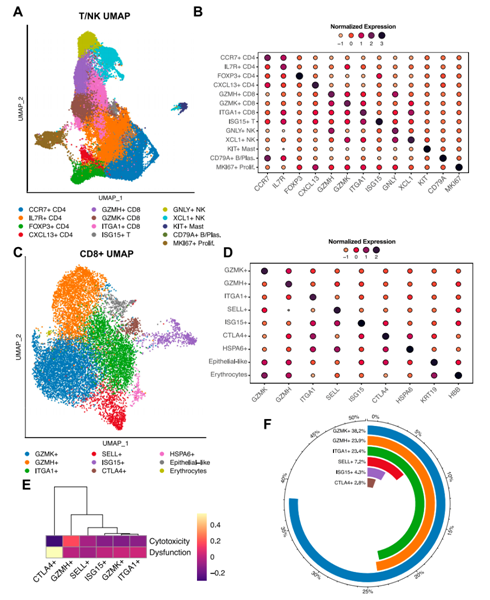
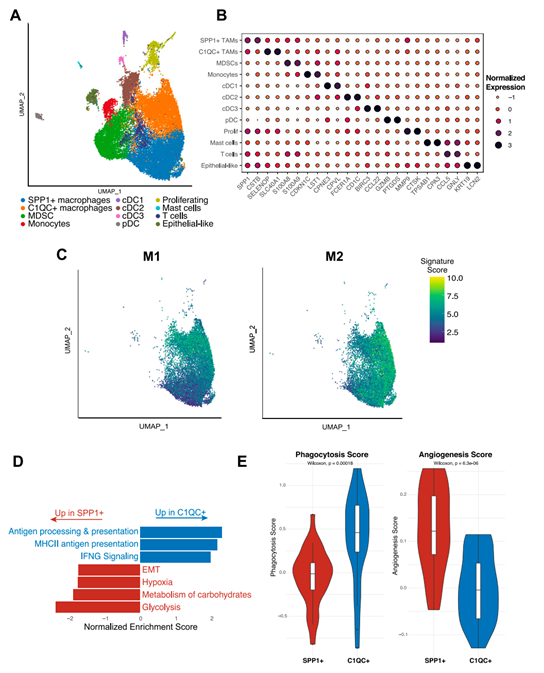
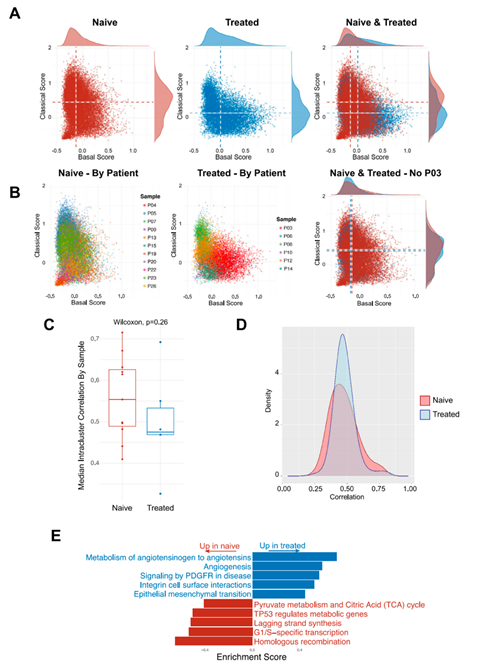
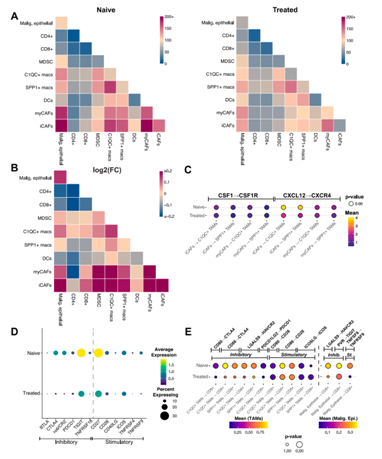
背 景 胰腺导管腺癌(PDAC)中的肿瘤微环境(TME)是一个驱动肿瘤进展的复杂系统,但缺乏对PDAC TME及其在治疗中作用的单细胞信息。本想研究对化疗前或化疗后新鲜收集的人PDAC样本进行单细胞RNA测序。研究发现了基底样和经典癌细胞亚型的异质性混合,以及不同的与癌症相关的成纤维细胞和巨噬细胞亚群。值得关注的是,经典的和基底样癌细胞对化疗有相似的转录反应,并且在处理的样本中没有表现出向碱基样转录程序的转变。作者观察到处理样本中配体-受体的相互作用,特别是CD8+T细胞上的TIGIT与其在癌细胞上的受体之间的相互作用,并确认TIGIT是CD8+T细胞的主要抑制检查点分子。该项研究结果表明,化疗对PDAC TME有深远的影响,并可能促进免疫治疗的抵抗。 实验设计 结 果 01 单细胞分析揭示了PDAC的转录景观 该研究的PDAC标本是通过手术切除原发胰腺病变,或通过内窥镜/介入放射学引导下原发胰腺病变或肝转移瘤 (图1A)获得的。在27例患者中,7例在组织采集前接受了化疗,而20例患者在标本采集时尚未接受治疗(图1A)。作者将取回的肿瘤标本制成了单细胞悬液,并对它们进行了测序(图1B)。在对原始测序数据进行标准处理和质量过滤后,总共保留了139,446个细胞用于分析。通过统一形式的无监督、基于图形的聚类和可视化显示了使用规范标记和基因表达谱注释的十个不同的细胞簇(图1C,D)。三个主要的簇鉴定为上皮细胞、T/ NK细胞和髓系细胞。作者还进一步鉴定了CAF、内皮细胞、B/浆细胞和少量肥大细胞。并在肝活检中发现增殖性癌细胞数量增加(图1E)。 图1 单细胞分析揭示了PDAC的转录组景观 02 上皮区室显示肿瘤异质性恶性亚型组成 由于一些上皮细胞聚集在顶体样本中,作者进一步评估了总上皮区室中恶性细胞的比例(图2A)。在进行了拷贝数变异(CNV)分析后,作者发现绝大多数上皮细胞表现出几种CNV事件,表明其为恶性肿瘤,并将其与正常上皮细胞区分开来(图2B)。除一个样本外,所有样本均由不同比例的基础细胞和经典癌细胞的混合物组成(图2C,D)。作者使用IHC验证了Moffitt转录亚型。具有更高百分比的基础或经典转录亚型的代表性样本分别对CK17或GATA6呈强阳性(图2E),而具有更均匀的两种亚型混合物的样本显示GATA6和CK17的表达分散、更均匀(图2E)。 通过差异基因表达对基础细胞和经典细胞的进一步分析,典型的基础基因和经典基因在各自的亚型中上调。通路富集分析显示,基底细胞中与迁移和侵袭相关的EMT、血管生成和细胞外基质(ECM)相互作用特征富集,而经典细胞富集代谢通路,尤其是脂质代谢通路。这些结果强调了PDAC中恶性上皮细胞的异质性,并表明单标记分析可能不足以准确识别患者肿瘤中的癌症细胞亚型。 图2 上皮区室显示肿瘤异质性恶性亚型组成 03 PDAC肿瘤微环境中CAF景观的绘制 接下来,作者分析了PDAC TME的间充质区室。间充质细胞隐逸揭示了七个不同的簇(图3A)。两个主要簇由肌成纤维细胞CAF(myCAF)和炎性CAF(iCAF)组成(图3A,B)。作者并没有发现强的抗原呈递CAF(apCAF)特征(图3C)。其他集群鉴定为粗糙细胞和施旺细胞,而单个样本提供了软骨细胞样细胞集群。此外,作者还检测到一小部分细胞表达上皮标志物(图3A,B)。 myCAF与iCAF的比值在不同样本间存在差异,而这两个亚群相对于Moffitt亚型分布的比例没有显著差异(图3D)。在myCAF中,SDC131,一个与CAF介导的乳腺癌细胞迁移调控相关的基因表达上调,而在iCAF中CCL1932高度表达,这与肺癌中CAF的细胞毒性T细胞募集有关。此外,iCAFs显示参与复合物级联和EGF信号传导的基因富集,而myCAFs显示ECM组织和平滑肌牵引富集,支持了CAF异质性和TME中CAFs的不同功能特征(图3E)。 图3 绘制PDAC肿瘤微环境中的CAF景观 04 PDAC肿瘤微环境中T/NK景观的绘制 为了更好地表征肿瘤浸润性淋巴细胞,作者分析了T/NK群体,并鉴定了13个不同的簇(图4A)。CD4+T细胞簇分为四个不同的亚型(图4B),CD8+T细胞聚集成三个主要亚群。NK细胞分离为高表达细胞毒性基因的GNLY+簇和具有较低细胞毒性基因表达和较高先前与组织驻留NK细胞连接的基因表达的XCL1+簇。较小的簇鉴定为肥大细胞和浆细胞(图4A,B)。 由于该研究最初的T/NK聚类没有识别出不同的严格T细胞亚群,于是作者改进了CD8+T细胞聚类的分辨率(图4C),识别出具有高水平耗尽标记物(CTLA4、HAVCR2、LAG3、TIGIT)的所有CTLA4+CD8+T细胞聚类。作者还发现了上皮样簇、红细胞样簇和HSPA6+簇;后者主要来源于一名患者,没有显示出其他明显的CD8+亚群特征(图4C,D)。 为了进一步评估CD8+T细胞亚群的耗竭,作者对每个亚群进行了功能障碍和细胞毒性评分。不出所料,GZMH+CD8+T细胞的细胞毒性得分最高,CTLA4+CD8+T淋巴细胞的耗竭得分最高(图4E),亚组之间的耗竭状态相似(图4E)。耗竭的CD8+T细胞仅占所有CD8+T淋巴细胞的2.8%(图4F)。 图4 绘制PDAC肿瘤微环境中T/NK的景观 05 C1QC+和SPP1+ TAMs在髓系细胞内由两个不同的亚群组成 髓细胞是较大TME的重要组成部分,作者确定了12个不同的髓细胞簇(图5A)。代表大多数髓细胞的TAMs聚集成SPP1+和C1QC+亚群(图5A,B)。作者还鉴定了髓源性升压细胞(MDSCs)、单核细胞和树突状细胞(DC),它们进一步聚集成常规DC1-3(cDC1-3)和浆细胞样DCs(pDCs)(图5A,B)。 尽管C1QC+TAMs显示出比SPP1+TAMs更高的M1特征表达,SPP1+和C1QC+亚群均显示出强M2特征表达,因此无法根据M1/M2分类进行明确区分(图5C)。一般来说,SPP1+TAM富含EMT、碳水化合物代谢和缺氧相关基因,而C1QC+TAM则富含IFN信号和抗原提呈(图5D)。与基因集富集分析(GSEA)结果和最近的结肠癌研究一致,SPP1+TAM富含血管生成相关基因,C1QC+TAM富集吞噬功能(图5E)。 图5 C1QC+和SPP1+TAM在髓细胞室中包括两个不同的亚群 06 化疗诱导的癌细胞转录变化与亚型无关 为了分析化疗对PDAC TME的影响,作者重点研究了治疗前和治疗后收集的原发性胰腺肿瘤标本。最终的结果表明,在最常见的差异表达基因中,TFF3是经典亚型标志的一部分,其在婴儿样本中显著高于处理过的样本。总体而言,经处理的样品没有显示出向更基底样表达模式的转变(图6A),尽管经处理的样本P03明显比任何其他样本都更基底(图6B)。除了Moffitt标志基因之外,作者还通过计算每对癌细胞之间的相关性来测量样本表达谱的异质性。根据这一指标,无论是每个样本(图6C)还是每个细胞(图6D),治疗样本和初始样本在肿瘤内异质性方面都没有差异。 为了确定细胞状态,作者使用GSEA检查每个样本中癌症细胞的常见基因表达模式。这里,与原始样本相比,来自治疗样本的癌症细胞富含与血管生成和EMT相关的通路,这些通路可促进肿瘤复发和进展(图6E)。 图6 化疗诱导癌细胞的转录变化,不依赖于亚型 07 化疗减少PDAC中抑制性检查点分子的表达以及配体-受体相互作用 作者应用CellPhoneDB来推断原始样本和处理样本中恶性上皮细胞、TAM和CAF亚群、CD8+和CD4+T细胞、MDSCs和DC之间的潜在配体-受体相互作用(LRI)(图7A),在数据集中发现,化疗治疗组的细胞-细胞相互作用普遍减少(图7B)。由于已知CAFs会募集和极化巨噬细胞,作者检查了CAFs和TAMs41之间的募集相关配体-受体相互作用。在这项分析中,只有两种配体-受体相互作用的证据。CXCL12-CXCR4是原始样本中最强的潜在配体-受体相互作用,在数据集和验证数据集中,随着治疗的进行,其显著减弱(图7C)。 由于检查点抑制药物尚未在PDAC临床试验中显示出益处,作者进一步评估了CD8+T细胞中与治疗相关的检查点分子表达。我们发现TIGIT是最高和最广泛表达的抑制性检查点分子,而PDCD1在低水平和少数CD8+T细胞中表达(图7D)。此外,和其他检查点分子在化疗处理的样本的CD8+T细胞中比初始样本低(图7D)。 作者还评估了治疗是否会改变CD8+T细胞、TAMs和恶性细胞之间的检查点分子相互作用。此外,CD8+T细胞可以表现出不同的耗竭状态,并且较大的CD8+群体更能代表对检查点分子与化疗相互作用的反应。在该项研究的两个样本(图7E)和验证数据集中,观察到TAM和CD8+T细胞之间的潜在和受体相互作用比癌症细胞和CD8+T细胞之间更多。比较未处理和未处理的样本,作者注意到所有假定的抑制性配体-受体相互作用仅在未处理样本中有显著作用,而TAMs和CD8+细胞之间的免疫刺激相互作用在未处理和处理样本中均有显著作用(图7E)。唯一显著的PD-1(PDCD1)相互作用发生在未处理样品中,在C1QC+TAM上的PD-1和CD8+T细胞上的PD-L2(PDCD1LG2)之间(图7E)。作者还检测到CD8+T细胞和癌症细胞之间的三种重要相互作用,TIGIT-PVR也是处理过的样本中唯一仍然显著的相互作用,尽管其效果比未处理过的样品弱(图7E)。 图7 化疗降低PDAC中抑制性检查点分子和配体-受体相互作用的表达 + + + + + + + + + + + 结 论 该研究利用单细胞分析对PDAC进行了包括CAF、T/NK、髓系细胞等多方面的分析,深入了解了肿瘤异质性和潜在的调控因素,以及化疗对肿瘤转录、亚型分期、免疫检查点表达和配体-受体互作的影响。作者使用的单细胞方法进一步阐明了PDAC的细胞异质性,并确定了潜在的治疗靶点,有助于制定合理的治疗策略。


 English
English


