文献解读|Signal Transduct Target Ther(39.3):嗜酸性粒细胞通过组织蛋白酶 L 促进肺基质破坏和肺气肿
✦ +
+
论文ID
原名:Eosinophils promote pulmonary matrix destruction and emphysema via Cathepsin L
译名:嗜酸性粒细胞通过组织蛋白酶 L 促进肺基质破坏和肺气肿
期刊:Signal Transduction and Targeted Therapy
影响因子:39.3
发表时间:2023.10.11
DOI号:10.1038/s41392-023-01634-x
背 景
血液嗜酸性粒细胞水平升高的慢性阻塞性肺病 (COPD) 患者通常会出现肺功能恶化和更严重的肺气肿,这意味着嗜酸性粒细胞可能参与肺气肿的发展。然而,嗜酸性粒细胞介导的肺气肿发生的确切机制仍不清楚。
实验设计

结 果
01
弹性蛋白酶诱导的小鼠肺气肿中嗜酸性粒细胞积聚
研究者团队通过在 4 周内每周气管内滴注猪胰腺弹性蛋白酶 (PPE) 溶液来建立小鼠肺气肿模型(图1a),急性损伤涉及初始 PPE 滴注,以检测PPE 引起的肺部早期反应。对小鼠肺部进行了严重肺气肿评估,与对照组相比,肺气肿模型的平均线性截距显著增加(图1b-c)。在急性和肺气肿模型中,肺泡壁中的弹性纤维减少(图1d)。此外,各肺组织的苏木精和伊红(H&E)染色表明,PPE在第一次滴注后引发炎症细胞流入肺部(图1b)。在第一次 PPE 滴注后的第三天,急性损伤模型中积累了中性粒细胞,而在第四次 PPE 滴注后,小鼠肺气肿肺中的嗜酸性粒细胞数量增加。与对照组相比,患有急性损伤或肺气肿的肺部的肺泡巨噬细胞水平保持稳定(图1e)。这些数据表明,在反复使用 PPE 后,炎症从中性粒细胞炎症转变为嗜酸性粒细胞炎症。
随后,他们比较了三组肺细胞的转录组。GO分析显示,与对照组相比,免疫相关通路(尤其是急性损伤组内的 TNF 和 IL-17 信号传导)显著上调。相反,涉及钙信号转导、血管平滑肌收缩和细胞粘附的通路显著下调(图1f)。与对照组相比,肺气肿模型中与 2 型炎症相关的炎症细胞因子(包括 CCL11、CCL17 和 CCL22)水平显著升高。此外,与溶酶体功能相关的基因在肺气肿模型中富集(图1g)。同样,基因集富集分析表明,急性损伤模型中 IL-17 信号通路有所增加。相反,与溶酶体相关的基因在肺气肿模型中下调。这些结果证实了 PPE 诱导的肺气肿模型中从急性中性粒细胞炎症向慢性嗜酸性粒细胞炎症的转变。
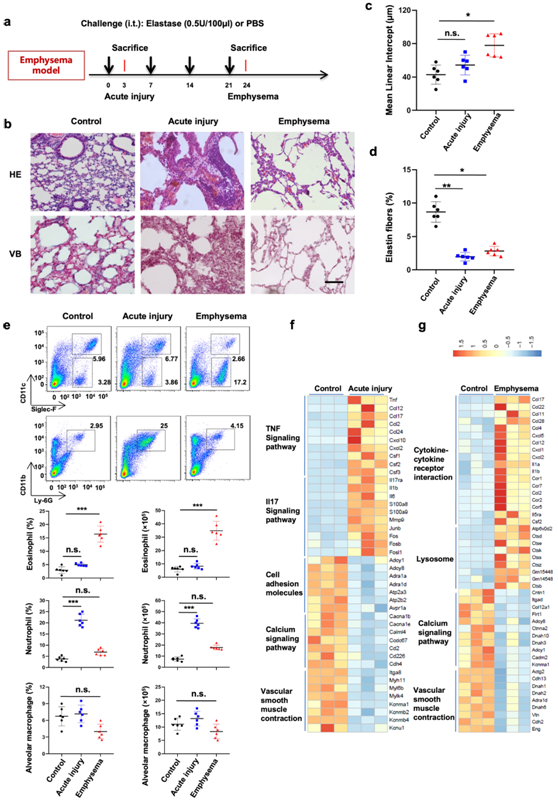
图1. 嗜酸性粒细胞在慢性弹性蛋白酶诱导的肺气肿中积聚。
(a) 连续四周每周向 C57BL/6 小鼠鼻内施用弹性蛋白酶 (0.5 U/100 µL)。 (b) 对肺组织切片进行苏木精和伊红 (H&E) 以及维多利亚蓝 (VB) 染色以进行表征。 (c-d) 处理过的小鼠肺部的平均线性截距和弹性蛋白纤维含量。 (d) (e) 分离完整的肺细胞,并进行流式细胞分析。(f-g) 肺组织中聚集性基因表达标记物在对照组与急性损伤组、对照组与肺气肿组间差异表达的热图。
02
肺细胞亚群的表征
他们对小鼠肺部的蛋白酶解离细胞进行单细胞转录组分析(scRNA-seq),以研究嗜酸性粒细胞是否参与肺气肿的发展。收集了19775 细胞,分为 19 个聚类(图 2a)。聚类19代表粒细胞和红细胞标记物。聚类9、10和15高度表达经典的嗜酸性粒细胞标记,如Ccr3、IL5ra、Epx、Prg2和Alox15(图2b-c)。Rnase2a、C1qa和Alox15 mRNA的原位杂交和ECP+的免疫染色发现,聚类9、10和15分别分布在ECP+细胞的一个子集中(图2d)。因此,聚类9、10和15(表达C3ar1、Epx、Ms4a7、C1qa和Ctsl)是嗜酸性粒细胞(图2e-f)。GO分析表明,嗜酸性粒细胞与溶酶体、脱颗粒、炎症反应、吞噬体和细胞外基质(ECM)降解有关(图2g),这表明嗜酸性粒细胞对肺气肿的发展至关重要。

图2. 肺细胞亚群的表征。
(a) 对每组1只小鼠的全肺细胞进行scRNA-seq分析。基于原代细胞团的单个细胞的t-SNE图。(b) 不同细胞类型差异表达标记基因的热图。(c) 共有细胞类型的相关系数分析。(d) 原位杂交分析。(e) 小提琴图显示嗜酸性粒细胞中选定标记的表达。 (f) t-SNE 图概述了肺组织中的嗜酸性粒细胞类型。 (g)GO分析。
03
不同嗜酸性粒细胞状态的表征
对不同实验模型的肺细胞的单细胞转录组分析表明,免疫细胞和基质细胞的数量和组成在不同的疾病模型中存在差异。嗜酸性粒细胞在哮喘和 PPE 诱导的肺气肿模型中积聚,但在对照组和恢复组中没有积聚。嗜酸性粒细胞的重新聚集鉴定出了七种亚型(图3a)。随后,他们利用 Monocle 在伪时间内沿着可能的粒细胞生成轨迹区分嗜酸性粒细胞群体,以确定嗜酸性粒细胞之间的基因动态转化关系(图3b)。
嗜酸性粒细胞分化和成熟发生在一个紧密组织的轨迹过程中,从对照模型中的 C7 和 C4 细胞开始,到肺气肿模型中的 C2 和 C5 细胞结束(图 3c)。早期伪时间样本在哮喘组中富集,并且在 II 类主要组织相容性复合体、哮喘和核糖体中发生改变。后期伪时间样本在肺气肿模型中富集,并且溶酶体、吞噬体和自噬过程发生变化。有趣的是,肺气肿模型中的晚期伪时间样本富含FcγR介导的吞噬作用和凋亡信号传导(图3d),这些结果用于将嗜酸性粒细胞区分为三种状态(图3e)。状态1是主要在哮喘模型中发现的与哮喘相关的嗜酸性粒细胞,包括以下基因:H2Aa、Ms4a2、Fcer1g和Rpl10(图3f)。表达Ctsl、Ctsk、Dnase2a和Atp6v0a1的状态3嗜酸性粒细胞出现在肺气肿模型中,并且与溶酶体、吞噬体和自噬过程相关(图3g)。此外,伪时间分析表明,聚类9在后期伪时间样品中主要富集于状态3和2,而聚类10在早期伪时间样品中主要富集于状态1。聚类15在状态1和状态3中都富集,这些数据表明疾病微环境可能在嗜酸性粒细胞分化和成熟中起重要作用。
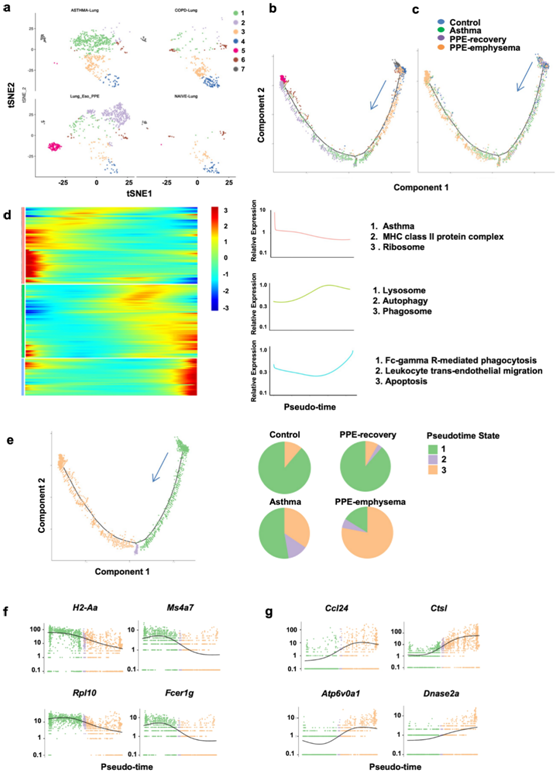
图3. 表征嗜酸性粒细胞的不同状态。
(a) 嗜酸性粒细胞单细胞亚群的随机邻域嵌入 (SNE) 图。(b) 使用 Monocle 2 分析确定嗜酸性粒细胞的发育伪时间轨迹。 (c) 使用不同的经验模型着色的 Monocle 伪时间轨迹。 (d) 肺嗜酸性粒细胞内伪时间相关基因的伪时间动态。(e) 来自不同实验模型的细胞状态和嗜酸性粒细胞比例。(f-g) 在分化过程中显著抑制或激活的基因根据细胞状态着色。
04
与嗜酸性粒细胞成熟和分化相关的转录因子 (TF) 特征
利用 SCENIC 分析,他们评估了整体基因调控网络,以更深入地研究与嗜酸性粒细胞分化相关的固有分子机制。四个组中确定了四个主要模块(图4a-b)。模块 1 在对照组和恢复组中包含最高的调节活性,以及具有细胞增殖、分化调控作用的TF(Fosl1、Jun、Junb、Rel和Ets2)。在所有实验模型中,与NF-κB活化和血管生成相关的tf(包括Myb、E2f1、Ets1、Cebpb、Rela、Nfkb1和Nfkb2)在模块2中表现出较高的调控活性。TF如Xbp1、Pparg、Bhlhe41和Usf2在ppe诱导的肺气肿模型的模块3中上调,并具有最高的调控活性。这表明与嗜酸性粒细胞成熟和溶酶体产生有关。相比之下,在pep诱导肺气肿模型的模块4中,下调的tf (Mafb、Tead1、Irf8和Runx3)的调控活性最低,这表明嗜酸性粒细胞在肺气肿模型成熟过程中形成主要组织相容性复合体II类蛋白复合体和执行抗原呈递的能力降低(图4e-f)。
在肺气肿模型中,嗜酸性粒细胞表现出其细胞质膜部分破坏,颗粒显示核心染色逆转,并且细胞质囊泡形成增多(图4g),含有特定颗粒的结构与嗜酸性粒细胞的成熟和活化有关。结果表明,特定的转录因子控制嗜酸性粒细胞的成熟和从哮喘到肺气肿的分化。

图4. 与嗜酸性粒细胞成熟和分化相关的转录因子。
(a) 热图描绘了每个模块的活性。(b) 连接特异性指数 (CSI) 矩阵强调了各种实验模型中不同细胞类型的调节子之间的相关性。 (c) 模块 3 内转录因子 (TF) 靶基因差异表达受体之间的假定通讯。(d) GO分析。(e) 模块 4 内 TF 靶基因差异表达受体之间的假定通讯。(f) GO分析。(g) 嗜酸性粒细胞的透射电子显微镜图像。
05
肺气肿的发生需要嗜酸性粒细胞
肺组织的定性组织学分析表明,IL-5阻断后平均线性截距显著下降(图5a-b)。与接受对照抗体的肺气肿组相比,阻断IL-5后肺泡壁中的弹性纤维升高(图5c),内源性IL-5的中和显著降低了肺嗜酸性粒细胞数量,而对肺泡巨噬细胞或中性粒细胞的影响有限(图5d-e)。
随后,他们建立了转基因嗜酸性粒细胞缺陷小鼠模型(PHIL)来减少肺气肿发展过程中的嗜酸性粒细胞。与野生型对照相比,嗜酸性粒细胞减少导致 PHIL 小鼠肺气肿显著减轻(图5f-g),表明了嗜酸性粒细胞在肺气肿的发展中起着至关重要的作用。
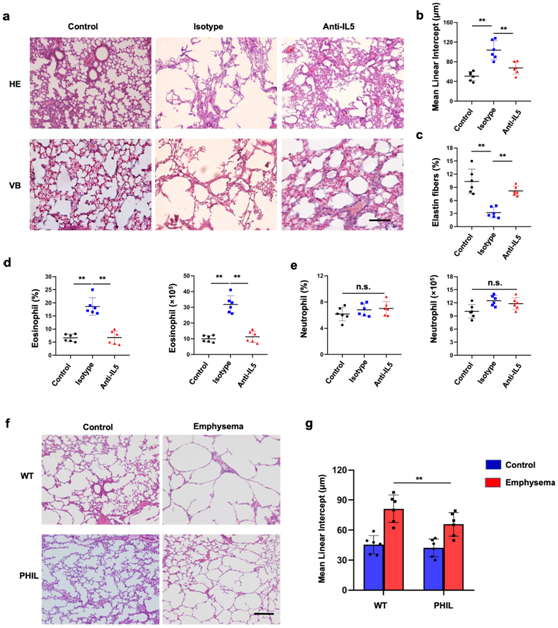
图5. 嗜酸性粒细胞缺失可降低肺实质中的肺气肿水平。
(a) 苏木精和伊红 (H&E) 以及维多利亚蓝 (VB) 对肺部病理切片进行染色。(b-c) 在IL-5阻断后对治疗小鼠的肺中的平均线性截距和弹性蛋白纤维含量进行量化。(d) 使用流式细胞测定接受指定治疗的小鼠肺中嗜酸性粒细胞的比例和绝对数量。(e) 用抗 IL5 单克隆抗体或非特异性对照 IgG 预处理的小鼠肺部中的中性粒细胞计数。 (f-g) 对 H&E 染色的肺切片进行平均截距长度 (Lm) 评估,并发现宽型 (WT) 小鼠和嗜酸性粒细胞缺陷 (PHIL) 小鼠肺中的肺泡空间有所增加。
06
PPE 引起的肺气肿的嗜酸性粒细胞中 CTSL 水平升高
多项研究表明,蛋白酶在细胞外基质降解和重塑中至关重要。他们检测了肺气肿模型中不同细胞组中的Ctsl、Ctss、Mmp9和Elane表达,其中Ctsl在肺气肿模型的嗜酸性粒细胞中高表达(图6a)。CTSL 动力学的转变类似于肺气肿发展过程中嗜酸性粒细胞的转变(图6b)。免疫荧光分析表明CTSL在嗜酸性粒细胞中表达,并在肺气肿肺组织中表达增加(图6c-d)。免疫印迹分析显示,野生型小鼠PPE诱导的肺气肿肺中CTSL蛋白水平显著增加,但PHIL小鼠中则没有(图6e)。这些结果表明,嗜酸性粒细胞是整个肺气肿发展过程中肺部 CTSL 的主要来源。

图6. PPE 引起的肺气肿的嗜酸性粒细胞中组织蛋白酶 L 水平升高。
(a) 两种典型嗜酸性粒细胞颗粒基因的表达。 (b) 对ECP和CTSL切片进行免疫组织化学分析。 (c) 免疫荧光分析。 (d) 评估 CTSL 荧光强度。 (e) 对 Pro-CTSL 和 CTSL 进行免疫印迹分析。
07
源自嗜酸性粒细胞的 CTSL 对于 PPE 诱发的肺气肿至关重要
与对照组相比,给予 CTSL 抑制剂处理的小鼠肺气肿严重程度显著降低(图7a-b)。CTSL阻断后,嗜酸性粒细胞(但不是肺泡巨噬细胞或中性粒细胞)的数量显著下降(图7c-d)。抑制剂处理后Ctsl和Mmp12表达降低。相反,Ctss、Mmp9和Elane的表达与模拟组没有显著差异。此外,从肺气肿模型中分离的嗜酸性粒细胞的弹性蛋白溶解能力受到CTSL抑制剂的限制(图7g)。肺气肿模型中嗜酸性粒细胞释放的蛋白酶表现出强大的胶原酶活性,而哮喘模型中释放的蛋白酶缺乏这种活性(图7h)。这些数据表明,源自嗜酸性粒细胞的 CTSL 在肺气肿发展过程中促进 ECM 破坏。

图7. 源自嗜酸性粒细胞的组织蛋白酶 L 对于肺气肿至关重要。
(a-b) 小鼠肺部的平均线性截距。 (c-d) 鼠肺部的嗜酸性粒细胞计数和中性粒细胞计数。 (e) 肺组织中CTSL的表达分析。(f) 小鼠肺部的平均线性截距。 (g-h) 组织蛋白酶活性分析。
08
嗜酸性粒细胞中的 CTSL 表达与 COPD 患者的肺气肿有关
他们从 56 名 COPD 患者获得临床数据,以确定嗜酸性粒细胞和肺气肿之间的关联。据胸部计算机断层扫描数据确定的肺气肿指数与血液嗜酸性粒细胞水平呈正相关(图8a)。这些数据表明慢性阻塞性肺病患者的肺气肿与高血嗜酸性粒细胞计数有关。免疫荧光分析表明,CTSL 主要定位于嗜酸性粒细胞,并且与健康对照相比,COPD 患者的肺泡组织中 CTSL 升高(图8b-c)。此外,与无肺气肿的患者相比,肺气肿患者的血清CTSL和组织蛋白酶 S (CTSS)水平升高(图8d-e)。正如预期的那样,COPD 患者的血液嗜酸性粒细胞水平与血清CTSL 水平呈正相关(图8f-g)。
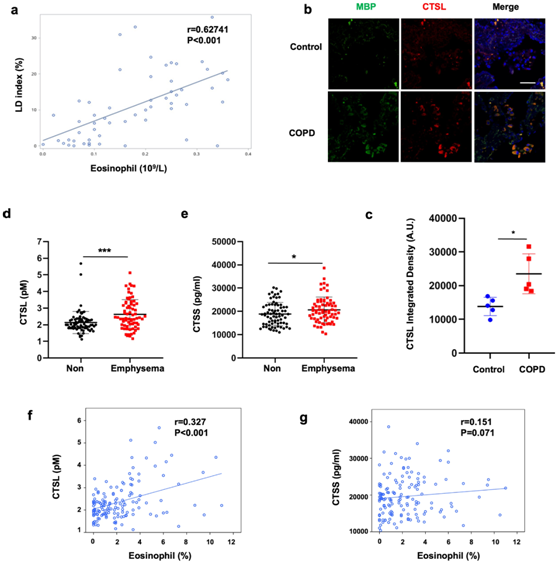
图8. 嗜酸性粒细胞中的 CTSL 表达与 COPD 患者的肺气肿有关。
(a) 通过 Spearman 相关性分析肺密度指数与血液嗜酸性粒细胞水平之间的关联。(b) 对健康对照和 COPD 患者的肺组织进行染色分析。(c) CTSL荧光强度分析。 (d-e) CTSL和 CTSS血清水平的比较。(f-g) 血清总 CTSL、CTSS和嗜酸性粒细胞水平之间关系的 Spearman 相关性分析。
+ + + + + + + + + + +
结 论
本项研究采用scRNA-seq 来鉴定哮喘和肺气肿小鼠模型中的嗜酸性粒细胞亚群,然后对这些亚群进行功能分析。对累积嗜酸性粒细胞的评估揭示了弹性蛋白酶诱导的肺气肿的转录组数据。通过使用抗白细胞介素 5 抗体消除嗜酸性粒细胞可改善弹性蛋白酶诱导的肺气肿。嗜酸性粒细胞衍生的组织蛋白酶L有助于细胞外基质的降解,从而导致肺组织中的肺气肿。在小鼠模型中,抑制组织蛋白酶 L 可减少弹性蛋白酶诱导的肺气肿。重要的是,嗜酸性粒细胞水平与血清组织蛋白酶 L 水平呈正相关,肺气肿患者的血清组织蛋白酶 L 水平高于无肺气肿患者。嗜酸性粒细胞中组织蛋白酶 L 的表达与 COPD 患者的肺气肿直接相关。总的来说,这些发现强调了嗜酸性粒细胞衍生的组织蛋白酶 L 在细胞外基质降解和重塑中的重要作用,及其与 COPD 患者肺气肿的相关性。因此,靶向嗜酸性粒细胞衍生的组织蛋白酶 L 可能为肺气肿患者提供一种治疗途径。
+ + + + +



 English
English


