文献解读|Signal Transduct Target Ther(39.3):预制 CD8+ T 细胞的特征决定了 CAR-T 对弥漫性大 B 细胞淋巴瘤患者的疗效
✦ +
+
论文ID
原名:Characteristics of premanufacture CD8+T cells determine CAR-T efficacy in patients with diffuse large B-cell lymphoma
译名:预制 CD8+ T 细胞的特征决定了 CAR-T 对弥漫性大 B 细胞淋巴瘤患者的疗效
期刊:Signal Transduction and Targeted Therapy
影响因子:39.3
发表时间:2023.10.25
DOI号:10.1038/s41392-023-01659-2
背 景
弥漫性大B细胞淋巴瘤(DLBCL)是一种常见的侵袭性血液恶性肿瘤,部分的患者在最初的蒽环类药物和含利妥昔单抗的治疗方案后达到完全缓解(CR)。目前,嵌合抗原受体(CAR)T细胞已成为复发/难治性B细胞恶性肿瘤患者的重要治疗选择,但超过60%的DLBCL患者接受CAR-T细胞疗法后未能获得持久的反应。因此,探究CAR-T 细胞疗法的变化并确定反应生物标志物显得格外重要。
实验设计
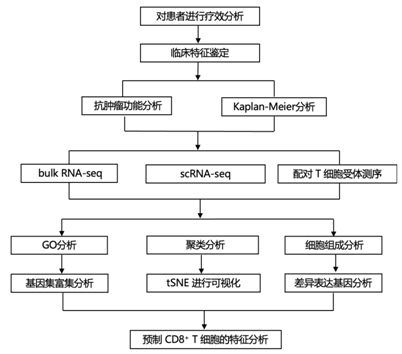
结 果
01
有反应患者的CAR-T细胞比耐药患者具有更好的抗肿瘤能力和激活能力
2017年7月至2020年1月期间,58名DLBCL患者接受串联 CD19 和 CD20 CAR-T 细胞(TanCAR7 T细胞)治疗。在 58 名 DLBCL 患者中,完全缓解率(CRR) 为 71%。截至研究截止日期 2022 年 5 月 10 日,58% 的患者仍处于缓解状态,49%(在输注 24 个月后未出现疾病进展(图 1a),24个月时的生存概率为67%(图1b)。
在本研究中,缓解患者包括CAR-T细胞输注后达到CR或部分缓解(PR)的患者,持久反应(DR)或复发的定义是根据这些患者在细胞治疗后1年内是否出现疾病复发(图1c)。
为了评估临床疗效是否源于CAR-T细胞产品的固有因素,他们在排除个体患者差异和肿瘤异质性的影响后,使用临床制备的CAR-T细胞随时间的推移来杀伤人类白血病细胞系,以评估患者CAR-T细胞的抗肿瘤疗效。从CR患者获得的CAR-T细胞在72小时内比从PD(耐药)患者获得的CAR-T细胞更有效地杀死Naml6肿瘤细胞(图1d)。从CR患者获得的CAR-T细胞分泌的TNFα和IFNγ水平明显高于从PD患者获得的CAR-T细胞(图1e)。与Nalm6细胞共培养1小时后,从CR患者获得的CAR-T细胞的CD107a表达高于从耐药患者获得的细胞的CD107a表达(图1f)。
接下来,他们研究了CAR-T细胞对活化反应的TCR特异性功能特性。在采用流式细胞分析之前,他们将注入的CAR-T细胞刺激4小时,诱导下游TCR信号(iononomycin)或Nalm6细胞。CR患者的CD8+CD25+CAR-T细胞群在刺激后比耐药患者表达更高水平的颗粒酶B(GZMB)、IFNγ和TNFα(图1g)。在对56例可评估患者细胞输注后的细胞因子水平的回顾性分析中,在细胞输注后6周内的大多数时间点,有反应患者的血清IFNγ水平明显高于有反应的患者(图1h)。这些数据表明,与细胞治疗前的耐药患者相比,来自应答患者的CAR-T细胞具有更好的抗肿瘤和活化能力。
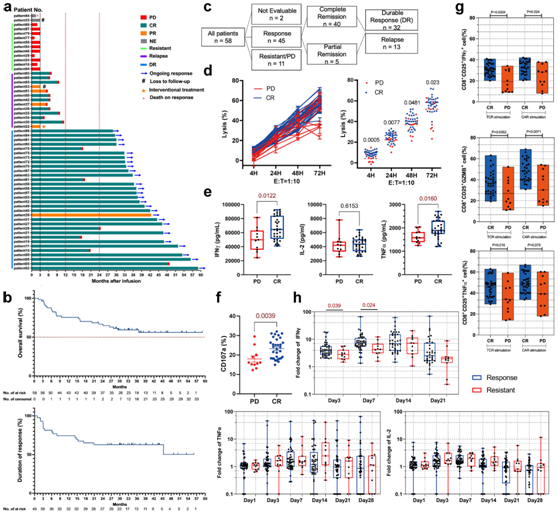
图1. 联合CAR-T细胞治疗r/rDLBCL患者的临床疗效和抗肿瘤功能评价。
(a) 接受串联 CAR-T 细胞输注后的反应持续时间和存活时间。 (b) Kaplan-Meier 对总生存期(上)和反应持续时间(下)的估计。 (c) 所有 58 名 r/rDLBCL 患者的分组列表。(d) 采用 CytoTox® 9分析。(e) 使用 Luminex 测定法测量输注的 CAR-T 细胞与 Nalm6 细胞以 1:1 的 E:T 比例共培养 24 小时的细胞因子产量。(f) CAR-T细胞与Nalm6细胞以1:1 E:T比例共培养1小时后,观察CD107a的表达。(g) 用 TCR 信号传导小分子模拟物刺激的输注 CAR-T 细胞中表达的 IFNγ、TNFα 和 GZMB 的直方图。
02
CD8+ TSCM CAR-T 细胞在 CAR-T 细胞治疗的反应中发挥重要作用
有反应患者的CAR-T细胞产品的CD4/CD8比值显著低于耐药患者(图2a)。相应地,在有反应患者中,体内CAR-T细胞扩增以CD8+ T细胞为主。这种扩增在细胞输注后5天开始并持续3-4周(图2b)。在本项研究中,在全部56例的DLBCL患者的CAR-T细胞产品中,缓解患者的CD8+ TSCM(干细胞样记忆T细胞,CD45RA+CD62L+)比例显著高于耐药患者(图2c)。CD8+ TSCM人群根据ROC曲线下面积成功区分了缓解和耐药患者(图2d)。然后,他们对45例缓解的患者进行了Kaplan-Meier分析,并根据CAR-T细胞产品中CD8+ TSCM人群的高水平和低水平分为两组,采用Kaplan-Meier分析评估了无进展生存期(PFS)。CD8+ TSCM人群水平较高的患者PFS略长(图2e)。在肿瘤负荷大的患者中,CD8+ TSCM含量高的患者的PFS较长(图2f)。值得注意的是,CAR-T细胞产品中CD8 + TSCM的数量在持久缓解和复发之间存在显著差异(图2g)。这些数据表明,CAR-T 细胞产品中的 CD8+ TSCM 群体与接受 CAR-T 细胞疗法治疗的 复发/难治性 DLBCL(r/rDLBCL) 患者的持久反应最显著相关,特别是在肿瘤负荷较重的患者中。输注的CAR-T细胞中缺乏CD8+ TSCM细胞可能是与初次治疗耐药相关的主要因素。
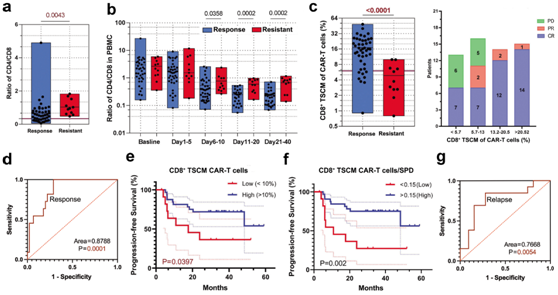
图2. CAR-T细胞多因素与CAR-T细胞治疗DLBCL疗效的相关性分析。
(a)根据应答状态分析患者体内CAR-T细胞产品的CD4/CD8比值。 (b) 在指定时间测量所有患者血液中CD4+和CD8+CAR-T 细胞的比率。 (c) 通过反应状态(左)和56例可评估患者反应的四分位数图(右)分析患者输注CAR-T细胞的CD8+ TSCM。(d) 基于 CAR-T 细胞产品中 CD8+TSCM 群体的反应预测的 ROC 曲线。(e-f) 对缓解患者的 PFS 进行 Kaplan-Meier 分析。 (g) 基于CAR-T 细胞中CD8+ TSCM 群体的复发预测的 ROC 曲线。
接下来,他们对来自 DR 和耐药患者的 CD8+ CAR-T 细胞产品进行了bulk RNA转录组分析(bulk RNA-seq)(图3a) 。CD8+ CAR-T细胞产物在缓解和耐药患者之间的基因表达存在差异(图3b)。有反应患者CD8+ CAR-T细胞中CD27、TCF7、CCR7、LEF1、BACH2、SELL和CAPG等大部分记忆相关基因的表达水平显著高于耐药患者;此外,与激活和耗竭相关的基因,如GZMK、TBX21、EOMES、TOX、TIGIT和SP140的表达显著下调(图3b-c)。GO分析显示,T细胞相关通路的激活,包括活化、黏附、增殖和共刺激通路,在有反应患者和耐药患者之间存在差异(图3d-e)。基因集富集分析(GSEA)结果显示,CD8+CAR-T细胞中激活相关和细胞增殖相关基因的表达水平较低,而DR患者获得的CD8+CAR-T细胞中记忆相关和复杂相关基因的表达高于耐药患者(图3f-h)。与耐药患者的CD8+ CAR-T细胞相比,DR患者的CD8+ CAR-T细胞处于相对静止状态。
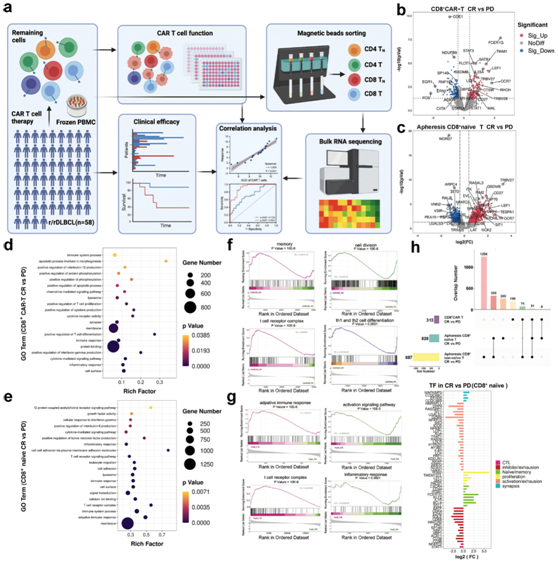
图3. 对输注的 CD8 + CAR-T 细胞和预制单采 CD8 +幼稚 T 细胞进行bulk RNA 测序分析。
(a) 验证bulk RNA 测序实验设计的示意图。(b-c) 比较耐药患者和 DR 患者,火山图显示输注的 CD8+ CAR-T 细胞和单采 CD8 +幼稚 T 细胞中基因表达的差异倍数。(d-e)GO分析。(f-g) GSEA分析。 (h) 维恩图显示了各种TF基因的交集。
03
输注的 CD8+ CAR-T 细胞中 CCR7 基因表达缺失和激活/抑制剂特征基因表达增加与 CAR-T 细胞治疗耐药相关
为了对结果相关的 CAR-T 细胞群进行全面表征,他们进行了单细胞转录组分析(scRNA-seq)和配对 T 细胞受体测序。通过聚类分析鉴定出21个具有不同转录组特征的亚群,并使用t分布随机邻居嵌入(tSNE)进行可视化(图4a)。DR患者的细胞相对比例与耐药患者的细胞相对比例存在显著差异(图4b),输注的CAR-T细胞在T细胞活化、细胞增殖、免疫反应、AP-1复合物、细胞黏附、溶酶体和对干扰素-γ的反应方面存在异质性(图4c)。使用97种典型的细胞周期标志物进行的细胞周期分析显示,来源于耐药或DR患者的CAR-T细胞包含具有类似细胞周期的类似细胞亚群,提示CAR-T细胞的功能差异与细胞增殖周期无关。C2、C6、C9-10和C16-18细胞聚类中耐药患者相关基因表达水平最高(超过80%)(图4b)。他们将C6细胞聚类定义为耗竭/终末CD8+ T细胞聚类,其特征在于LAG3、TIGIT、GZMB、GZMK、GZMA、GZMH、NKG7和EOMES的表达(图4d)。这些特征在 C6 句累中最高,在 C9、C15 和 C16 句累中的表达逐渐减少,并且伴随着 MKI67 表达的逐渐增加。
他们进一步分析了上述不表达记忆相关基因的效应细胞聚类,包括TCF7、LEF1、SELL和CCR7(图4d),发现T细胞激活相关转录因子TBX21、EOMES和耐药患者的 CAR-T 细胞中 NKG7 基因表达显著高于 DR 患者的 CAR-T 细胞,同时伴随抑制因子的表达升高,包括 CD38、LAG3、TIGIT、ADA 和 ID2 基因,但 PDCD1 的表达较低在整个细胞群中。C1、C3、C5、C13、C14 和 C19 聚类内的细胞具有最高比例的来自实现 DR 的患者的 CD8+ T 细胞(图4b-e)。
TSCM 细胞是一种罕见的记忆淋巴细胞亚群,具有由 CD62L 和 TCF7 定义的干细胞样特性,具有增强的自我更新能力以及生成中央记忆、效应记忆和效应 T 细胞的能力。他们注意到来自 DR 患者的CD8+ CAR-T 细胞中以 CCR7 阳性表达为特征的细胞显著增加(图4f)。TSCM 细胞的特点是高表达干记忆细胞样特征,包括 TCF7、LEF1、SELL、CCR7、CD27、IL7R 和 TNFRSF6。DR患者CAR-T细胞中的TSCM细胞中LEF1、CCR7和TCF7的平均表达水平高于耐药患者。TSCM在TCR激活后比TCM细胞具有更强的自我更新能力和多能性,主要表现在CCR7的表达上。有趣的是,在耐药患者的CD8+ TCF7 CAR-T细胞中,CCR7表达的丧失伴随着上述基因的表达(图4g),但在CD8+CCR7 CAR-T细胞中,上述基因的表达在耐药患者和DR患者之间没有显著差异(图4h)。
这些结果表明,在接受 CAR-T 细胞治疗的患者中, CD8+记忆 CAR-T 细胞中 CCR7 表达降低,同时激活/抑制基因 LAG3、TIGIT、GZMB、GZMK、GZMA、GZMH、NKG7 和 EOMES 表达增加,可能是由于治疗耐药性的重要基因表达特征。
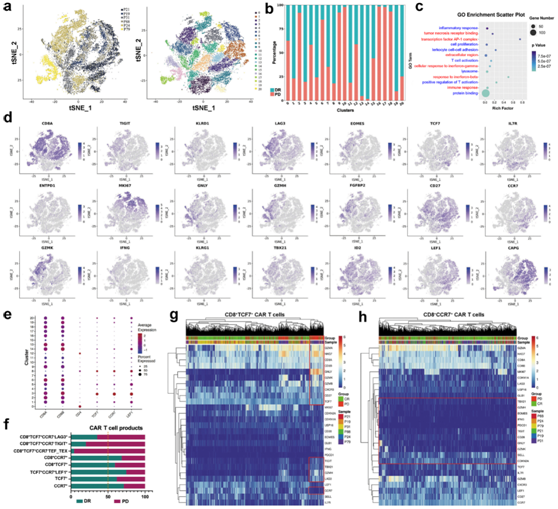
图4. 注入CAR-T细胞产物的scRNA-seq。
(a) tSNE 可视化。(b) 柱状图显示来自DR和耐药患者的细胞在聚类中的分布。(c)GO分析。 (d) 所选基因的表达覆盖在 tSNE 图上。 (e) 显示每个聚类的 T 细胞记忆相关标记的表达。 (f) DR 和耐药患者中具有不同基因表达特征的细胞比例的定量。(g-h) 热图显示了从 DR 患者获得的CD8 + TCF7 + CAR-T 细胞和从 PD 患者获得的 CD8 + CCR7 + CAR-T 细胞之间差异表达的基因。
04
接受CAR-T细胞治疗的患者幼稚单采T细胞的组成和功能与治疗前不同
他们进一步分析了 11 名耐药患者和 26 名在 24 个月内具有持久反应的长期 DR 患者的单采 T 细胞的组成和功能。他们添加了细胞表面标记 CCR7 来区分记忆细胞群和效应细胞群。长期DR患者和耐药患者的淋巴细胞、T细胞、CD4+ T细胞、CD8+ T细胞和TEM细胞(CD45RA−CCR7−CD62L−)水平无差异,但DR患者的幼稚T细胞(CD45RA+CCR7+CD62L+)比例显著高于耐药患者,而TEFF细胞(CD45RA+CCR7−CD62L−)和TCM细胞(CD45RA−CCR7+CD62L+)比例显著升高(图5a)。这些差异主要由CD8+T细胞的比例引起(图5b)。在刺激TCR信号后,DR患者的单采T细胞表达的GZMB、IFNγ和TNFα水平高于耐药患者(图5c)。
单采T细胞的bulk RNA-seq分析结果与CAR-T细胞的结果相似,在有反应患者和耐药患者之间的单采细胞CD8+ T细胞中观察到基因表达差异(图3c)。重要的是,DR患者和耐药患者在CD8+ 幼稚 T细胞和CD8+ CAR-T细胞中的基因具有相似的差异(图3c),差异基因包括记忆、增殖、突触、迁移、激活和抑制剂相关的转录因子(TF) 和基因(图3h)。从 DR 患者获得的CD8+幼稚 T 细胞中这些差异改变的基因在膜成分、受体介导的信号传导、T 细胞复合物和钙离子通道方面富集(图3g)。
这些数据表明,CAR-T细胞产品之间的抗肿瘤功效差异已经存在于其最初来源的T细胞中。
他们试图通过使用幼稚 T 细胞作为 CAR-T 细胞产品的源细胞,改善针对耐药患者的 CAR-T 细胞产品的细胞组成和抗肿瘤功能。通过与从耐药患者和DR患者获得的幼稚T细胞培养的CAR-T细胞,TSCM细胞群的数量均得到有效增加(图5d)。与幼稚T细胞共培养的CAR-T细胞杀伤肿瘤细胞系的功效高于输注的CAR-T细胞,但仍低于输注的从长期DR患者获得的CAR-T细胞(图5e-f)。这些数据表明,CAR-T细胞产品的抗肿瘤功效差异可能是由预制的幼稚T细胞的数量和功能决定的。
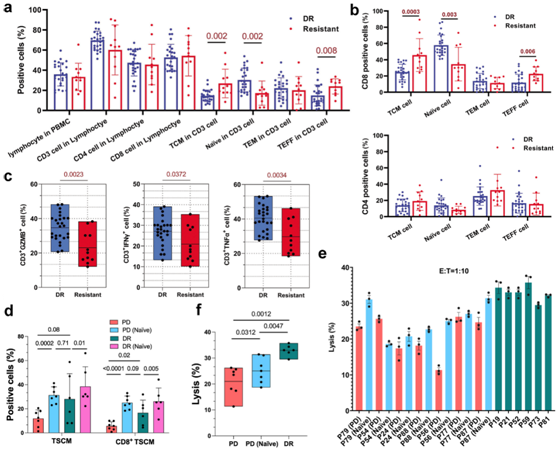
图5. 分析幼稚单采T细胞的组成和功能。
(a) DR 和耐药患者中单采 T 细胞的细胞群分析。 (b) DR及耐药患者CD8 +单采T细胞(上)和CD4 +单采T细胞(下)多项指标分析。 (c)使用 TCR 信号传导小分子模拟物刺激的单采 T 细胞中表达的 IFNγ、TNFα 和 GZMB 的直方图。(d) 不同组 CAR-T 细胞中TSCM 和 CD8 + TSCM 细胞群的百分比。(e) 输注的 CAR-T 细胞和与单采 T 细胞的幼稚 T 细胞与 Nalm6 细胞(E:T 比例为 1:10)培养的 CAR-T 细胞的细胞毒性活性。(f) 输注的 CAR-T 细胞和与幼稚 T 细胞公培养的 CAR-T 细胞的细胞毒活性的统计分析。
05
预制单采T 细胞中的CD8+ T 细胞记忆特征与 CAR-T 细胞疗法的持久反应相关
单细胞数据由15118个单采T细胞组成,通过聚类鉴定出具有不同转录组特征的10个亚组(图6a)。在tSNE图中,来自耐药患者和DR患者的单采T细胞相互重叠且未完全分离,但来自DR患者的细胞相对比例在CD4 +和CD8 +中明显更高记忆/幼稚聚类(图6b-c)。
在DR和耐药患者中,非记忆T细胞聚类中细胞的相对比例相对相似,但来自耐药患者的单胞分离T细胞中效应和抑制剂基因表达的平均强度高于DR患者(图6g)。
然后他们重点研究了不同患者中表达记忆相关基因的细胞的表达情况。CD8 +幼稚T细胞和CD4+幼稚T细胞聚集成单独的聚类(图6a),表达CCR7、TCF7、LEF1、SELL、CD27和CD28(图6c)。与 CAR-T 细胞产品的 scRNA-seq 一致, DR 患者的CD4+和 CD8+幼稚 T 细胞中 CCR7 的平均表达强度高于耐药患者,而其他记忆相关基因的表达强度没有差异(图6d)。DR患者的CD8 +幼稚细胞和CD4+幼稚细胞的相对比例超过70%(图6e)。此外,耐药患者的TCF7+幼稚T和TCF7+ 记忆细胞的相对比例与DR患者相似,但CCR7表达的特征能够区分耐药患者和DR患者的记忆细胞,并且CCR7+ DR患者中单采T细胞的幼稚细胞和记忆细胞数量显著高于耐药患者(图6f-g)。耐药患者的 CD8+TCF7+ CCR7 -细胞相对数量显著高于DR 患者,同时表达激活相关基因,包括 GZMB、GZMA 和 IFNG(图6g-h)。这一结果与CAR-T产品的分析一致,提示患者CAR-T细胞的功能记忆表型差异在预制T细胞中已经存在,且耐药患者中的CCR7+T细胞表现出记忆功能降低和表达增加激活和抑制剂相关基因 TIGIT 和 LAG3。
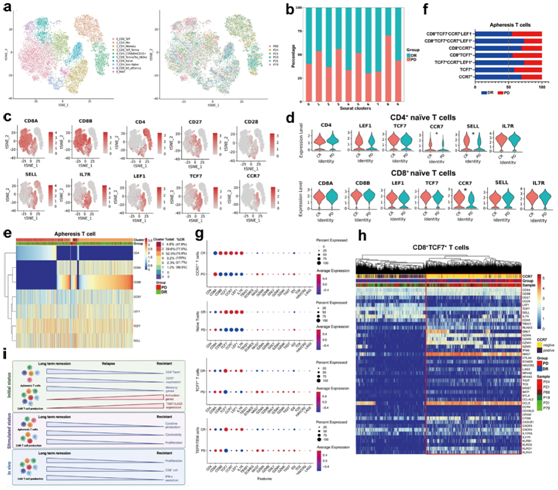
图6. 对与 CAR-T 细胞产品共有TCR 的单采 T 细胞进行scRNA-seq 。
(a) t-SNE可视化。(b) 条形图显示 DR 和 PD 患者的细胞在聚类中的分布。 (c) 所选基因的表达覆盖在 tSNE 图上。(d) 小提琴图显示 CD4 +幼稚(上)和 CD8 +幼稚(下)T 细胞群中选定的基因表达。(e) 热图显示了从 DR 患者和从 PD 患者获得的单采 T 细胞之间差异表达的基因。 (f) DR 和 PD 患者中具有不同基因表达特征的单采 T 细胞比例的量化。 (g) 不同细胞的 T 细胞记忆相关基因和激活/抑制相关标记的表达。(h) 热图显示来自 DR 和耐药患者的单采细胞的CD8 + TCF7 + T 细胞之间的差异表达基因。(i) DR 和耐药患者之间输注的 CAR-T 细胞和单采 T 细胞的功能/分子差异的表征。
+ + + + + + + + + + +
结 论
本项研究对来自 DLBCL 患者的 CAR-T 细胞产品和预制 T 细胞进行了bulk RNA-seq 、scRNA-seq 和配对 T 细胞受体测序。具有更高比例的CD8+干细胞样记忆T细胞群以及CAR-T细胞产品增强的激活能力是实现持久临床反应的关键。预制 T 细胞的细胞和分子特征的异质性导致了 CAR-T 细胞治疗 DLBCL 后疗效的变化。具有不同临床结果的患者中 CAR-T 细胞抗肿瘤功效的差异是由于 CCR7 基因表达缺失,以及CD8+幼稚 T 细胞中激活和抑制相关基因表达增加所致。这些结果增进了对预制 T 细胞功能的潜在分子标志物的理解。
+ + + + +



 English
English


