文献解读|J Infect(28.2):COVID-19的临床结果与上呼吸道微生物组动态密切相关
✦ +
+
论文ID
原名:The clinical outcome of COVID-19 is strongly associated with microbiome dynamics in the upper respiratory tract
译名:COVID-19的临床结果与上呼吸道微生物组动态密切相关
期刊:Journal of Infection
影响因子:28.2
发表时间:2024.02.09
DOI号:10.1016/j.jinf.2024.01.017
背 景
上呼吸道(URT)是严重急性呼吸综合征冠状病毒 2 (SARS-CoV-2) 的入口。尽管 SARS-CoV-2 以外的多种呼吸道病原体与 COVID-19 疾病的重症病例有关,但疾病过程中上呼吸道微生物群的动态以及它们如何影响疾病表现仍不确定。
实验设计
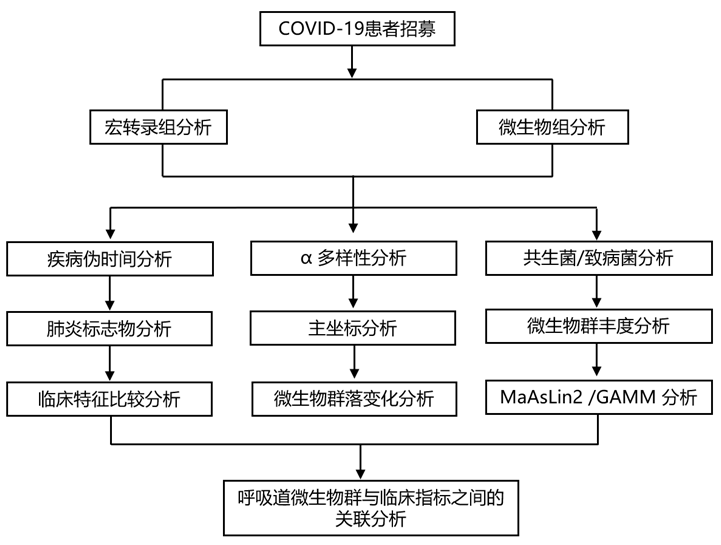
结 果
01
研究设计和队列
本项研究共纳入了 152 名受试者,包括 65 名 COVID-19 患者(纵向队列 1)、28 名从 COVID-19 康复的健康个体(出院后超过 3 个月)(队列 2)和 59 名没有已知感染史的健康对照者(队列 3)(图1A)。根据临床评分将临床疾病分期定义为伪时间,以描述疾病的纵向病程:进展期(伪时间1,临床症状和炎症标志物增加)、危重期(伪时间2、机械通气,肺散在有磨玻璃或实变征象)、复杂期(伪时间3,间歇补氧,轻微炎症征象,磨玻璃和实变逐渐消退)、恢复期(伪时间4,无补氧)、长期随访(伪时间5,出院后至少三个月)(图1B)。
为了研究SARS-CoV-2感染期间上呼吸道微生物组的动态,他们收集了65名COVID-19患者在疾病进展过程中多个时间点采集的349份咽拭子并对其进行了宏转录组分析(图1C)。为了进行比较,收集了28名从COVID-19中康复的健康个体(出院后> 3个月)和59名同一地理区域内无已知感染史的健康对照者的咽拭子(图1A)。为了描述异质性疾病随时间的发展轨迹,他们使用了WHO临床进展量表、胸部CT肺部变化和几种炎症标志物(血清c-反应蛋白[CRP]、白细胞介素-6 [IL-6]、d -二聚体[DD]和血清淀粉样蛋白[SAA]),将疾病阶段分为六个阶段,分别为“健康”(伪时间0)、“进展期”(伪时间1)、“危重期”(伪时间2)、“复杂期”(伪时间3)、“恢复期”(伪时间4)和“长期随访”(伪时间5)(图1A-C)。
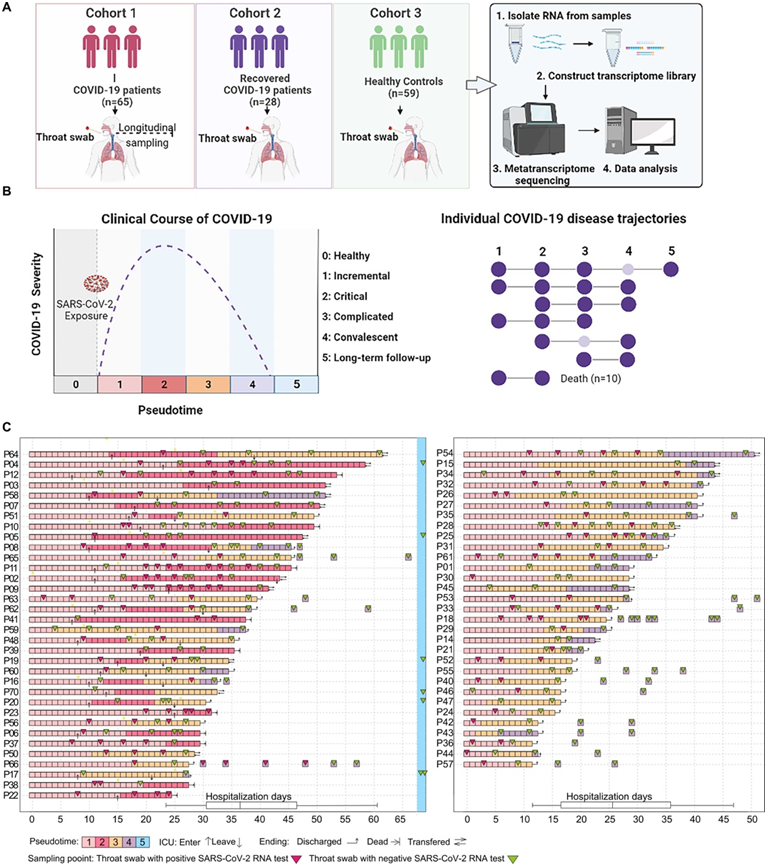
图1. COVID-19患者研究概况及临床疾病轨迹分析。
(A)研究队列的图形概述。(B)疾病期伪时间的定义。(C) 队列1患者COVID-19病程、干预措施和样本收集概况。
02
SARS-CoV-2感染后呼吸道微生物生态失调
对上呼吸道微生物组(包括RNA和DNA病毒、细菌和真核微生物)的宏转录组学表征显示,α多样性在不同疾病阶段存在显著差异。特别是,进展期、危重期、复杂期和恢复期的α多样性低于长期随访期和健康对照组,提示SARS-CoV-2感染可能伴随着上呼吸道微生物多样性的降低(图2A)。在调整年龄和性别后,不同疾病阶段的微生物组成也存在显著差异,这部分归因于群体之间的不同分散(图2B)。危急和其他疾病阶段之间的差异比其他阶段之间的差异更明显,这表明在COVID-19更严重的阶段,群落结构发生了更大的变化(图2B)。
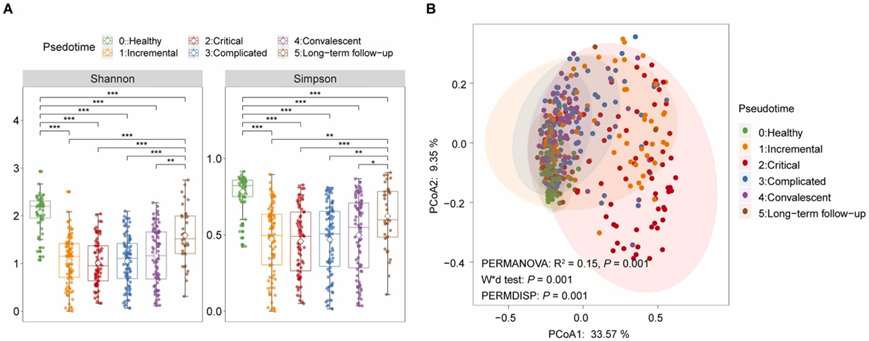
图2. 上呼吸道微生物组在COVID-19疾病过程中的变化。
(A) 不同临床疾病阶段COVID-19患者与对照组呼吸微生物群α多样性。(B) PCoA(主坐标分析)图。
他们还探讨了属水平上呼吸道微生物组成与队列 1 中与患者人体测量、临床变量和药物相关的 29 个协变量之间的潜在关联(图S1)。在单变量分析 (dbRDA) 中,29 个协变量中有 27 个显示出与微生物群组成显著相关。此外,根据多变量分析 (dbRDA),27 个显著协变量中的 7 个占该数据集中 53.8% 的非冗余变异。值得注意的是,患者 ID(即患者身份)对微生物组组成的影响最大,很可能是由于对同一COVID-19 患者进行纵向采样,其次是疾病阶段/严重程度(伪时间和 WHO 量表)以及治疗前的抗真菌治疗(图S1)。采样时或采样前的抗菌处理也显示出对 URT 微生物组组成的影响虽小但显著。总的来说,这些结果表明疾病进展导致 URT 微生物群组成发生深刻变化。
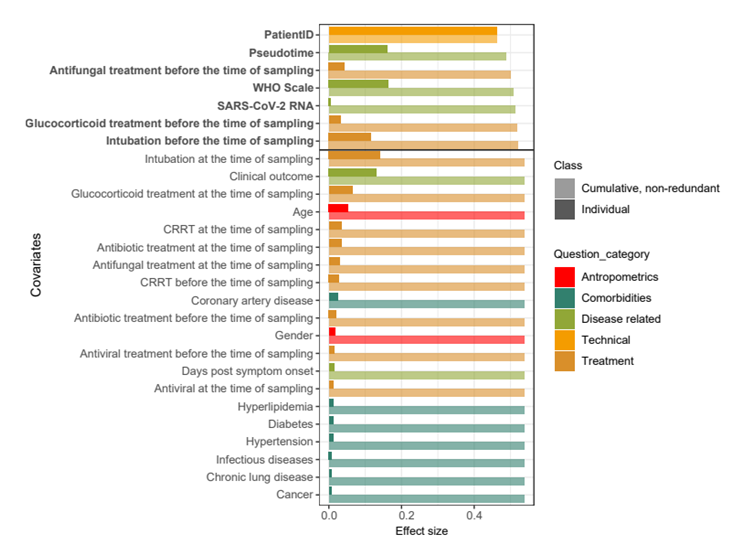
图S1. 影响呼吸道微生物组组成的协变量。
03
疾病进展过程中微生物群落的改变
由于疾病阶段个体之间微生物组成的高度变异性,他们还使用狄利克雷多项式混合物(DMM)来表征微生物群落组成的模式,确定了与疾病阶段显著相关的六种群落类型(图S2A-C,图3A)。检测到的 121 个微生物属的丰度在聚类之间存在显著差异。DMM1和DMM2聚类主要与健康对照和长期随访阶段的样本相关,并且以先前研究中描述的上呼吸道共生微生物为主,如链球菌、Gemella、Prevotella、Veillonella和Capnocytophaga(图3B,图S2D)。相反,DMM3和DMM4聚类主要与临界阶段的样本相关,并以呼吸道病原体Betacoronavirus(包括SARS-CoV-2)和潜在病原体,即疱疹病毒属、不动杆菌、肠球菌和念珠菌等为主(图3B,图S2D)。
他们揭示了在COVID-19疾病期间“共生型”和“病原型”微生物在属水平上的区别。根据普遍接受的分类,共鉴定出38个“共生型”属。这些代表了先前描述的上呼吸道正常菌群,包括弯曲杆菌、梭杆菌、普雷沃氏菌、链球菌和韦荣球菌属。值得注意的是,这些微生物的丰度在健康和长期随访阶段明显高于COVID-19疾病的其他阶段(图3C)。相反,30种“病原体类型”包括单纯疱疹病毒属(HSV-1)、不动杆菌、克雷伯氏菌和念珠菌,在进展期和危重阶段的相对丰度较高(图3D)。引人注目的是,“病原型”微生物的总相对丰度高达767701 RPM(占总非核糖体RNA的76.77%),表明它们在疾病进展的关键阶段在宿主呼吸系统内活跃增殖。
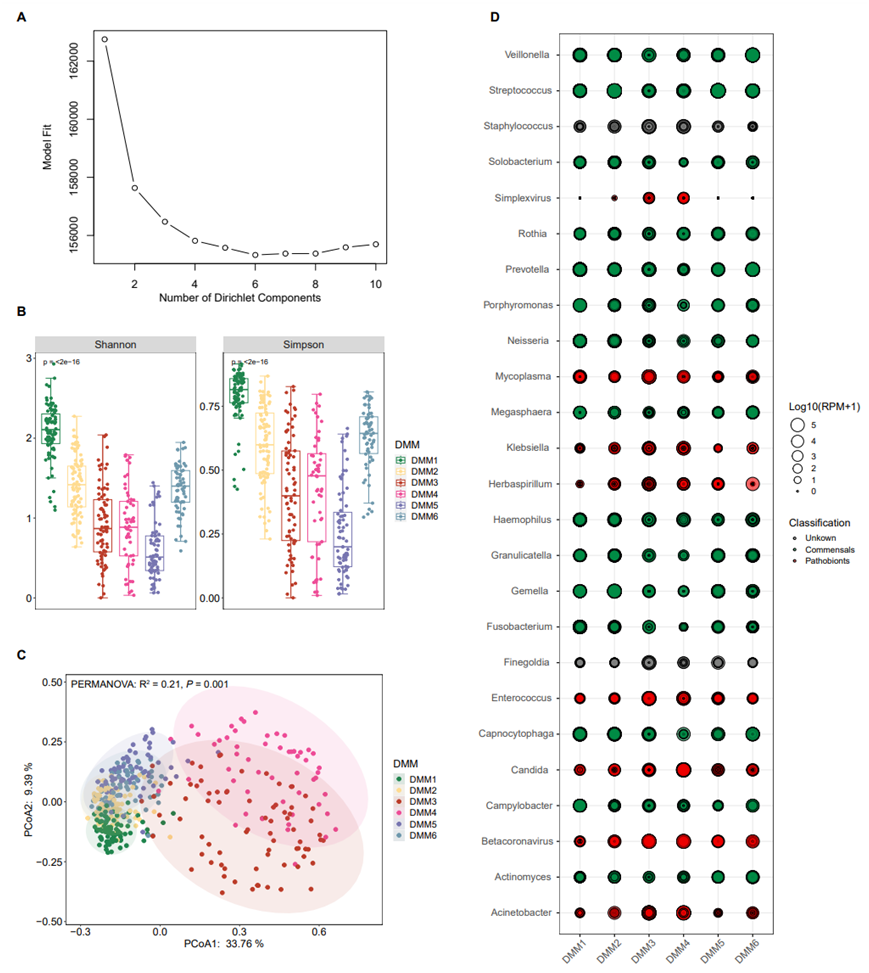
图S2. URT 微生物组的 DMM 聚类。
(A)URT 中的微生物群落聚类。(B)箱线图显示每个聚类的 α 多样性。(C)基于聚类间 Bray-Curtis 差异的 PCoA。(D)六个聚类的优势属的丰度。
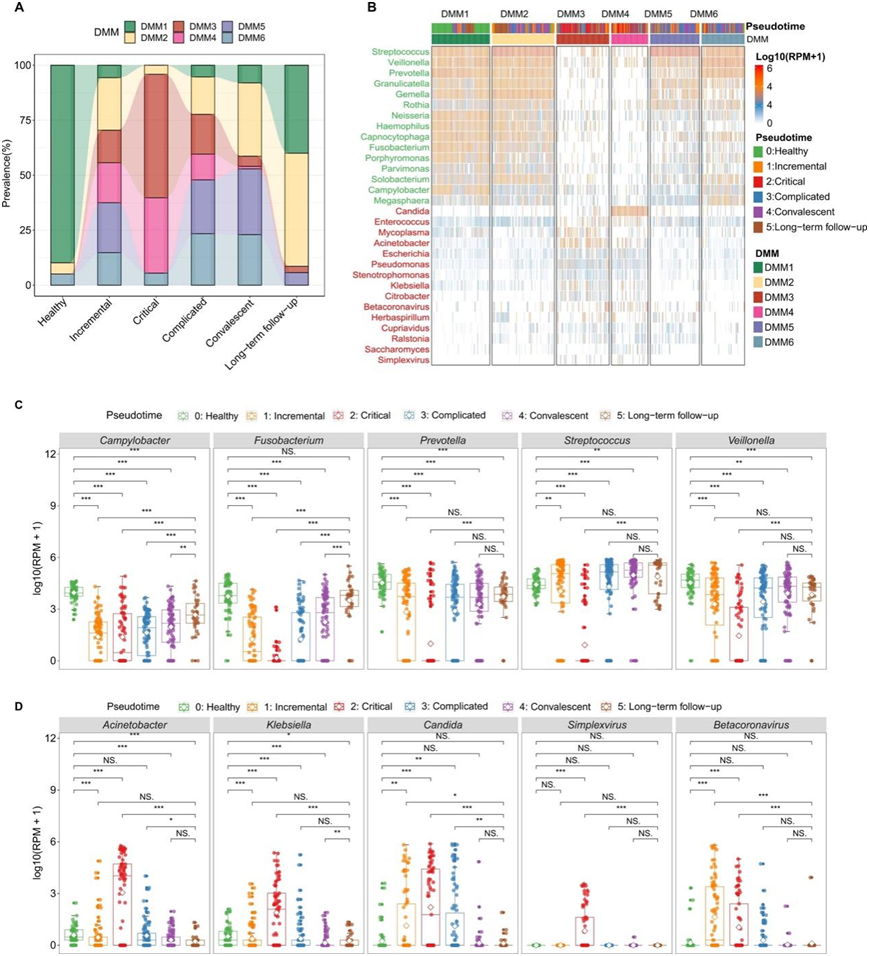
图3. 上呼吸道微生物组在COVID-19疾病过程中的组成。
(A) Dirichlet多项式混合(DMM)模型应用于表征上呼吸道微生物群的微生物群落。(B) 热图显示了每个DMM聚类中10个最主要的微生物属的丰度。 (C-D) 总结COVID-19患者病程中上呼吸道最丰富的共生菌和病原菌。
04
疾病进展的微生物指标
接下来,他们确定了一系列微生物指标,可用于将进展分为更严重的疾病阶段(图4A)。其中,β冠状病毒在进展期富集最多,而“病原型”微生物在危重期富集较多,如单纯疱疹病毒、不动杆菌、念珠菌、克雷伯菌、柠檬酸杆菌和肠球菌。相反,在疾病较严重的阶段,“共生型”微生物的丰度减少,如梭杆菌、Alloprevotella和Tannerella。使用MaAsLin2混合线性模型调整混杂因素(图4B),发现Betacoronavirus与进展期呈正相关,而多种“病原体类型”微生物,包括不动杆菌、Citrobacter、假单胞菌、克雷伯菌和Simplexvirus与危重期呈正相关。MaAsLin2分析发现链球菌是与疾病进展至危重阶段负相关的最重要微生物。
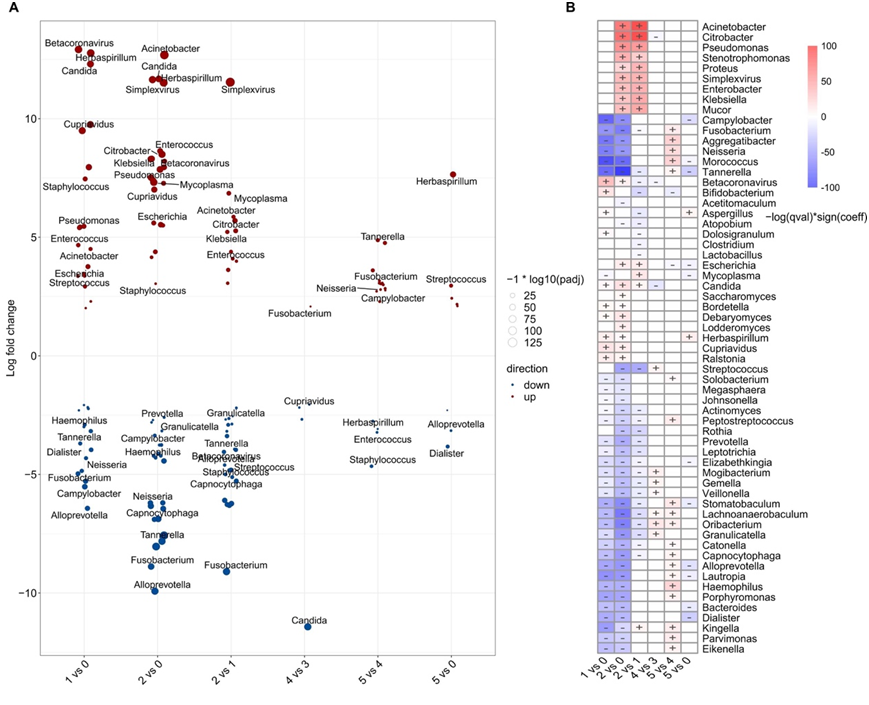
图4. COVID-19患者在病程中上呼吸道微生物群的差异。
(A) 在疾病进展过程中,不同数量的微生物群。 (B) 使用MaAsLin2确定微生物群与疾病进展之间的相关性。
05
SARS-CoV-2感染后上呼吸道微生物组的时间动态
本项研究还揭示了与疾病进展更严重阶段相关的复杂和高度动态的微生物组成。通过监测COVID-19患者(纵向队列1)的微生物动力学(图5A)和微生物群落类型(DMM聚类)随时间的变化,他们确定了病原体的存在,主要病原体存在的持续波动,以及在感染严重阶段共生体的抑制(图5A)。纵向GAMM分析显示,HSV-1、鲍曼不动杆菌、Corynebacterium striatum、肺炎克雷伯菌、白色念珠菌等病原菌的相对丰度在恢复期呈先上升后下降的趋势,而正常菌群的相对丰度呈相反趋势(图5B)。
他们根据临床结果进一步对患者队列1进行分层:即轻度(即只有轻微症状的患者)、重度(病情危重但康复的患者)和死亡(死亡的患者)。亚组分析显示,在整个病程中,死亡患者的微生物群变化幅度高于非死亡患者(轻度和重度)(图5C)。具体来说,在早期(伪时间1),DMM3和DMM4在死亡患者中富集,而DMM1和DMM2在轻度组中富集最多,在重度组中较少,在死亡组中完全耗竭(图5C)。事实上,使用Cox比例风险模型分析,经年龄、性别和合并症调整后,DMM3和DMM4与较差的结果相关(图5D)。他们使用MaAsLin2分析将上呼吸道微生物群与COVID-19疾病死亡率联系起来,调整了年龄、性别和合并症。共有38个上呼吸道微生物群与COVID-19死亡率呈显著负相关,35个上呼吸道微生物群也富集于DMM3或DMM4群,与COVID-19死亡率呈显著正相关。他们的纵向GAMM分析还显示,许多分类群与疾病过程中的临床结果相关(图5E)。
总体而言,这些数据表明,COVID-19患者的临床结局与上呼吸道微生物组的动态变化有关。
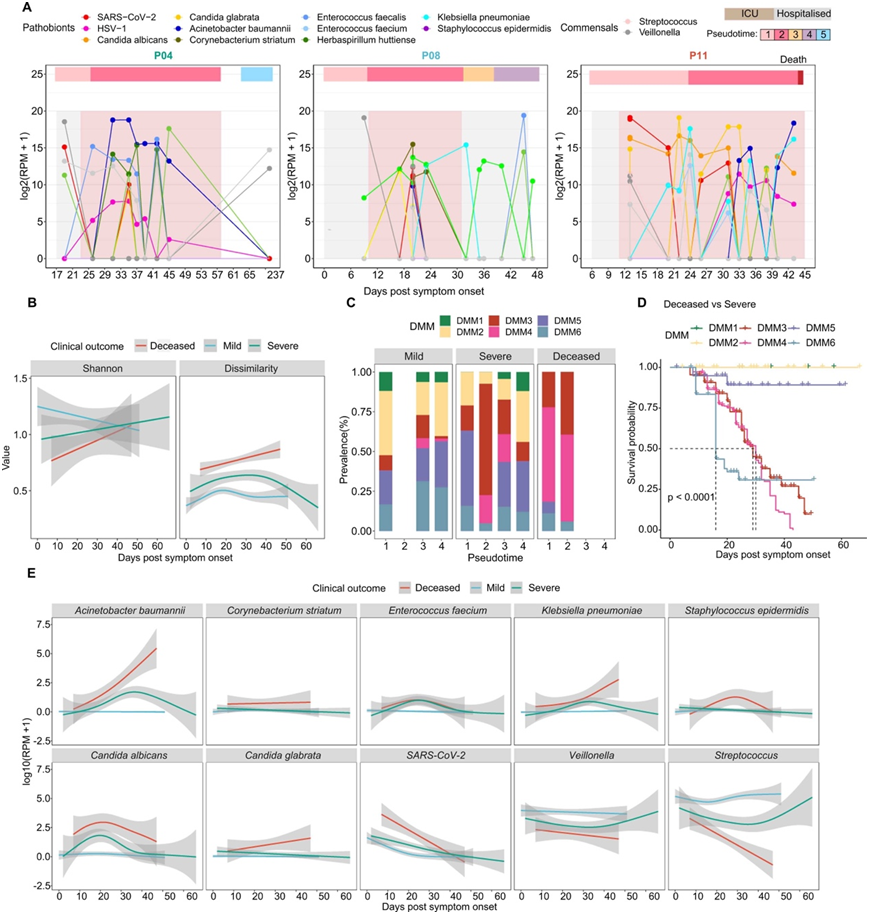
图5. COVID-19患者上呼吸道微生物群动态及其与临床预后的关系。
(A) 不同时间点上呼吸道COVID-19患者中最丰富的致病物种。 (B) 纵向Shannon指数和β指数在轻、重度和死亡患者病程中的差异。(C) 轻、重度和死亡患者不同阶段呼吸道感染微生物群落类型(DMM) 。(D) Kaplan-Meier曲线在严重和死亡的急性呼吸道损伤患者中按DMM聚类分层的70天生存率。(E) 轻度、重度和死亡患者病程中纵向上呼吸道微生物组的变化。
06
呼吸道微生物群与临床指标之间的关联
接下来他们探讨了 URT 微生物组与 COVID-19 患者临床指标之间的相关性。值得注意的是,多种炎症指标的浓度,如中性粒细胞计数 (NEUT)、白细胞计数 (WBC)、中性粒细胞与淋巴细胞比率 (NLR)、降钙素原 (PCT)、D-二聚体 (DD)、白细胞介素 6 (IL-6) 和乳酸脱氢酶(LDH),与早期和所有阶段的死亡率呈正相关(图6A),揭示了死亡患者的炎症反应加剧和延长。此外,免疫生物标志物,如 CD4+T、CD8+T、B 细胞和 NK 细胞,在死亡患者的整个病程中显著下降,表明免疫反应不佳可能会导致 COVID-19 患者的预后不佳。
他们进一步研究了个体微生物与临床特征之间的关联。这揭示了致病微生物群的丰度与多种炎症指标(如 NLR、IL-6、DD、WBC、NEUT、PCT 和 LDH)之间呈正相关。引人注目的是,正常菌群和这些指标之间观察到相反的趋势。一些免疫生物标志物,如LYMPH、T细胞、CD4 + T细胞和CD8 + T细胞,与共生菌群呈正相关,与病原微生物群呈负相关(图6B)。在“病原体类型”组的物种水平上,SARS-CoV-2仅与NLR呈正相关,而白色念珠菌和鲍曼不动杆菌与NLR、WBC和NEUT的相关性最强,并且与免疫学生物标志物也呈负相关(图6C)。
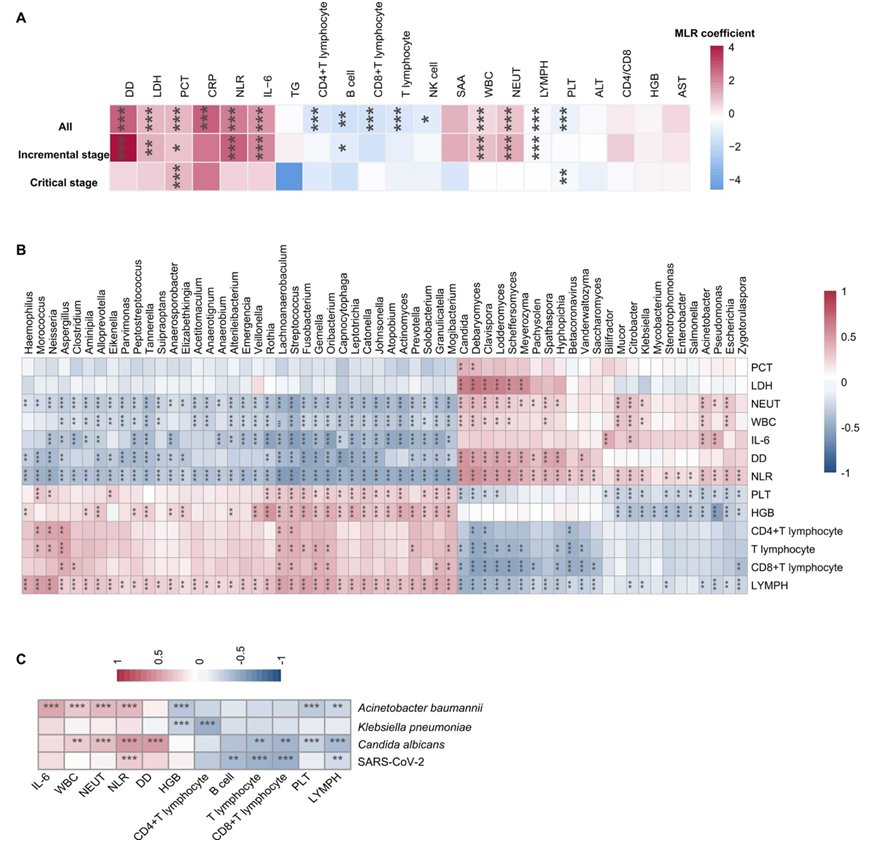
图6. 上呼吸道微生物群与临床指标的相关性。
(A) 临床指标与住院期间的死亡率通过多变量线性回归确定。 (B-C) 热图显示了与临床指标相关的上呼吸道微生物群的丰度。
+ + + + + + + + + + +
结 论
本项研究发现URT 微生物组在疾病过程中表现出显著的异质性。两个以低α多样性和多种病原体或潜在病原体(包括不动杆菌和念珠菌)富集为特征的微生物群落与疾病进展和较差的临床结果相关。本项研究还确定了一系列微生物指标,将疾病进展分为更严重的阶段。纵向分析显示,尽管在 COVID-19 期间微生物群表现出复杂且不断变化的模式,但在大多数患者中观察到 URT 微生物群从早期生态失调恢复到疾病后期更加多样化的状态。此外,一组潜在的病原体与炎症指标的浓度和死亡率密切相关。这项研究揭示了 URT 微生物组动态与 COVID-19 疾病进展和临床结果之间的密切联系,这意味着严重疾病的治疗应考虑存在的全部微生物病原体。
+ + + + +



 English
English


