文献解读|Plant J (7.2):MYB转录因子在茶树(Camellia sinensis)次生代谢产物生物合成、新梢发育和逆境胁迫响应中发挥着不同的调控作用
✦ +
+
论文ID
原名:Diverse roles of MYB transcription factors in regulating secondary metabolite biosynthesis, shoot development, and stress responses in tea plants (Camellia sinensis)
译名:MYB转录因子在茶树(Camellia sinensis)次生代谢产物生物合成、新梢发育和逆境胁迫响应中发挥着不同的调控作用
期刊:The Plant journal: for cell and molecular biology
影响因子:7.2
发表时间:2022.3.24
DOI号:10.1111/tpj.15729
背 景
茶树(Camellia sinensis)由于其顺滑的口感和众多的健康益处而越来越受欢迎,其产生的儿茶素、咖啡碱、茶氨酸和萜类化合物等次生代谢产物共同决定了茶汤的丰富风味和健康益处。MYB转录因子(Transcription factors, TFs)是植物中最大的转录因子家族,它们参与调控植物生长和组织器官发育(如木质部、保卫细胞、表皮毛和根毛的形成等),以及多种次生代谢产物的生物合成及胁迫响应和抗病性。尽管许多研究已经涉及到茶树次生代谢,但有关这些代谢物的生物合成、运输和储存的调控机制仍然是未知的。此外,关于茶树茎尖生长发育的调控机制知之甚少,以及这些次生代谢产物在茶树茎尖中的协调积累等因素仍不清楚。
实验设计
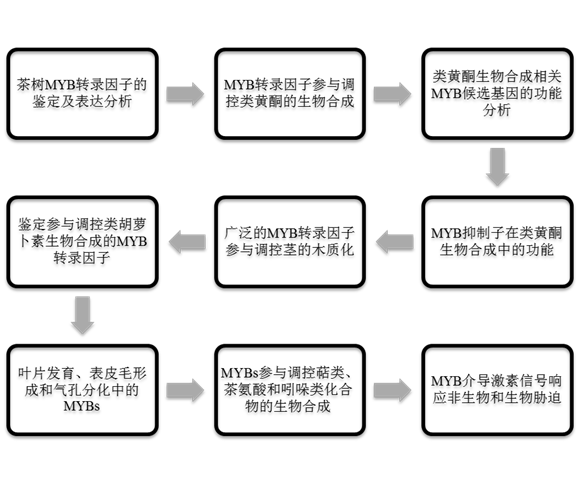
结 果
01
茶树MYB转录因子的鉴定及表达分析
以MYB DBD模型(PF00249)为关键词在Pfam程序中搜索,在茶树基因组中鉴定到221个典型的非冗余MYB蛋白,其中包括59个1R MYB (MYB-related)、155个2R MYB (R2R3-MYB)和7个3R MYB (R1R2R3-MYB)蛋白。在目前的茶树基因组中,虽然一些关键的MYB转录因子没有被鉴定,但在最近的功能鉴定和全长转录组研究中被鉴定和表征(图 1a)。用茶树和拟南芥MYB转录因子构建的邻接(NJ)系统进化树将162个R2R3-和R1R2R3-MYB转录因子分为20个亚组,至少得到50%的Bootstrap法验证支撑(图 1a)。基于茶树转录组数据,分析了这些MYB基因在16个组织中的表达模式,发现有7个MYB基因的转录本未被检测到,而另外214个基因表现出不同的组织表达模式(图 1b)。亚组13中的MYB转录因子被预测参与正调控类黄酮生物合成和表皮毛起始,而亚组12中的MYB转录因子可能是负调控苯丙烷途径的阻遏子(图 1a)。此外,检测到48个MYB基因在茶树根中高表达,37个基因在顶芽和幼叶中表达量较高(图 1b)。这些具有特殊表达模式的MYB基因可能在调控茶叶特征代谢物的生物合成中起着不同的作用,从而决定了茶叶产品的品质。

图1 MYB转录因子的系统进化和表达模式分析
02
MYB转录因子参与调控类黄酮的生物合成
儿茶素是茶树中主要的类黄酮,包括表没食子儿茶素没食子酸酯(EGCG)、表没食子儿茶素(EGC)和表儿茶素没食子酸酯(ECG)等可溶性PAs,有助于茶汤的涩味和多种营养功效。它们的生物合成受到MYB转录因子的严格调控。茶树基因组中至少有31个MYB转录因子可能参与调控类黄酮生物合成,包括10个PA相关MYB、1个花青素相关MYB和3个黄酮醇相关MYB (图 2a)。对发育中的叶片(第一、二、三、四、五片叶和最老叶)进行了转录组和代谢物相关性分析。23个MYB基因的表达模式与儿茶素、儿茶酸(C)、表儿茶酸(EC)、ECG和EGCG的积累以及花青素还原酶(ANR)、UDP-葡萄糖类黄酮3-O-糖基化转移酶(UGT)和丝氨酸羧肽酶样Clade 1A (SCPL1A)等关键生物合成基因的表达谱高度相关(图 2b)。除CsMYB65和CsMYB66外,其余10个儿茶素生物合成激活子中有8个与茶叶中儿茶素含量呈正相关(图 2b)。此外,20个类黄酮抑制子中有13个与儿茶素生物合成密切相关,包括10个正相关和3个负相关(图 2b)。

图2 参与调控黄酮生物合成的MYB转录因子的鉴定
非生物胁迫或激素,如茉莉酸甲酯(MeJA)处理,可以激活茶树中类黄酮的产生。通过分析MeJA处理茶树叶片的转录组数据,证实了MeJA激活了茶树类黄酮的生物合成(图 2c)。对MYB基因的表达模式进行相关性分析,发现其表达模式与类黄酮生物合成关键基因高度相关(图 2c)。其中,除CsMYB65外,其余10个儿茶素激活子中有9个与茶树叶片中儿茶素产量呈正相关(图 2c)。CsMYB8和CsMYB55与黄烷醇生物合成激活子AtMYB12/11/AtMYB111具有较高的同源性,其表达模式与黄烷醇生物合成基因CsFLSs和CsUGT78A14的表达高度相关(图 2c)。CsMYB110的表达与花青素生物合成基因CsANS2表现出较低的相关性(图 2c)。在MeJA处理下,预测到20个抑制子调控茶树叶片中类黄酮的生物合成,它们的表达模式与茶树叶片中儿茶素、黄烷醇或花青素生物合成基因的表达呈正相关或负相关(图 2c)。CsMYB81和CsMYB111表达模式与花青素和儿茶素生物合成基因呈正相关,而与黄烷醇生物合成基因呈负相关(图 2c)。这些阻遏物可能调控苯丙烷代谢途径中的多个代谢分支。
紫岩和紫娟是2个著名的紫叶茶树品种,其幼叶中积累了大量的花青素。对它们的紫叶和对照品种云抗的绿叶进行转录组分析,发现CsPAP1、CsTT8、CsTTG1等调控基因在紫叶品种中的表达量显著高于绿叶品种云抗。有趣的是,与云抗相比,参与花青素苷生物合成的类黄酮3'-羟化酶(F3'H)等基因在紫研和紫娟中上调表达,而参与木质素生物合成的羟基肉桂酰辅酶A:莽草酸羟基肉桂酰转移酶1 (HCT)、肉桂酰辅酶A还原酶(CCR)和肉桂醇脱氢酶(CAD)在紫岩和紫娟中显著下调表达(图 3a)。这些绿叶和紫叶茶树中花青素和儿茶素含量之间的强负相关关系支持了这些紫叶品种中两个平行途径之间的竞争(图 3b)。推测的儿茶素生物合成激活子,如CsMYB184,CsMYB167,CsMYB85,CsMYB31和CsMYB196,受UV处理下调,与儿茶素生物合成基因,如ANR,LAR和SCPL1A的表达水平降低一致(图 3c)。而一些假定的MYB抑制子,包括CsMYB141、CsMYB12、CsMYB156、CsMYB112、CsMYB28、CsMYB171和CsMYB94 (图3c ),其他MYB抑制子基因,包括CsMYB111、CsMYB81、CsMYB134、CsMYB152、CsMYB132、CsMYB199、CsMYB13、CsCPCa、CsCPCb和CsMYBL2b,在UV处理下表达量下调(图3c )。后3个抑制子的抑制与花青素苷生物合成的显著上调一致。有趣的是,UV处理下紫君和紫岩叶片中黄酮醇含量降低,与茶树中黄酮醇合成酶(FLS)基因和AtMYB12同源基因CsMYB55的下调表达一致(图 3c)。这些数据表明,木质素、黄酮醇、花青素和儿茶素的生物合成之间存在复杂的代谢竞争,这可能需要多个MYBs和其他TFs对代谢调控的协调作用(图 3d)。
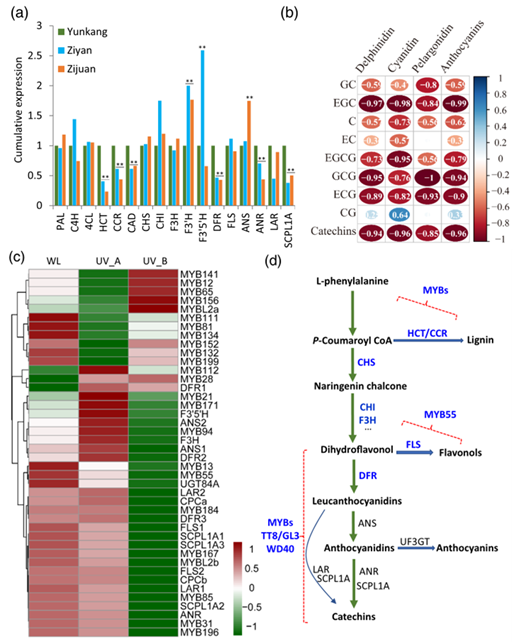
图3 参与代谢调控的MYB转录因子分析
03
类黄酮生物合成相关MYB候选基因的功能分析
由于不同的MYB转录因子通过形成MBW复合体单独或与其他转录因子协同调控不同类黄酮的生物合成,该团队进一步评估了15个MYB的功能,特别是这些能够与bHLH转录因子(TT8、GL3)和WD40蛋白相互作用的MYB。在酵母双杂交(Y2H)实验中,除了CsMYB167外,MYBs与其他转录因子之间至少检测到一个互作(图 4a)。例如,假定的多胺生物合成激活子CsMYB85与CsWD40、CsTT8s或CsGL3s有很强的相互作用,形成MBW复合体(图 2a, 4a)。通过双分子荧光互补(BiFC)实验在烟草叶片细胞中进一步验证了这些转录因子之间的相互作用和MBW复合物的形成,表明这些MBW复合物在茶树中也是保守的(图 4a)。3个代表性的MYBs,来自AtMYB5亚族的CsMYB66,来自VvMYBPA1亚族的CsMYB85和来自AtTT2亚族的CsMYB196,在植物中进一步验证了它们在调控PA生物合成中的功能(图 2a)。这些蛋白和一个与绿色荧光蛋白(GFP)融合的CsMYB55在烟草表皮细胞中表达,并显示出唯一的核定位,暗示它们在调节基因表达方面的功能(图 4b)。当CsMYB66、CsMYB85和CsMYB196在35S启动子驱动的拟南芥tt2-1突变体中表达时,将CsMYB66、CsMYB85和CsMYB196过表达至野生型(WT)水平,tt2-1突变体种皮中的PA积累缺陷被完全挽救(图 4c)。此外,推测CPC和MYBL2同源基因CsCPCa、CsCPCb和CsMYBL2b在紫岩叶片中被UV处理下调表达(图 3c)。它们被认为是微调的调控抑制子,以CsPAP1和/或CsTT2介导的MBW复合物为靶标(图 3c)。

图4 参与调控儿茶素生物合成的候选MYBs的特征
04
MYB抑制子在类黄酮生物合成中的功能
在植物中,有许多MYB抑制因子负调控苯丙烷途径,用于木质素、酚酸或类黄酮的产生,该团队也从茶树基因组中鉴定了大量的MYB抑制因子。这些MYB抑制子又分为R2R3-MYB和R3-MYB两种类型。R2R3-MYB抑制子含有特征性的抑制结构域,而R3-MYB抑制子如CPC缺乏抑制结构域,仅在C端存在保守的Lx6Lx6L基序。在含有'EAR'或'TLLLFR'阻遏结构域的23个MYB阻遏子中,只有CsMYBL2b、CsMYB143和CsMYB206同时含有EAR和TLLLFR结构域,尤其是CsMYB159和CsMYB199含有2个EAR结构域(图 5a)。其他MYB抑制子仅有一个EAR或一个Lx6Lx6L结构域(图 5a)。
拟南芥AtMYBL2同源基因CsMYBL2b在茶树叶片中的表达被UV-A和UV-B处理显著抑制,这与其作为类黄酮生物合成的负调控因子的作用一致(图 3c)。强光处理促进了茶树幼叶中花青素的积累(图 5b),随后谷胱甘肽S-转移酶(GSTF1)和MYB75被强光处理显著上调(图 5c)。同时,检测到CsMYBL2b表达量明显下降,CsMYBL2a表达量增加(图 5c)。AtCPC编码一个单重复的R3-MYB,是拟南芥花青素苷生物合成的阻遏因子。本实验室前期的全长单细胞RNA测序(RNA-Seq)数据回收到2个AtCPC同源基因CsCPCa和CsPCb (图 3c)。当在atcpc突变体中过表达CsCPCa时,由于atcpc突变体在地上部分积累了比野生型更多的花青素苷,互补植株(CPCa/atcpc)与野生型和atcpc突变体植株相比,表现出叶片花青素苷缺乏和无毛的表型(图 5d)。与对照相比,共表达CsMYB196、CsWD40和CsTT8a或CsMYB184、CsWD40和CsTT8a可显著激活CsANR或CsANS启动子驱动的荧光素酶报告基因(图 5e)。加入CsCPCa或CsMYBL2b抑制剂后,这种激活被抑制,表明CsCPCa和CsMYBL2b通过干扰MBW复合体对关键生物合成基因的刺激作用来抑制类黄酮生物合成(图 5f)。

图5参与调控花青素苷生物合成的候选MYBs的特征
05
广泛的MYB转录因子参与调控茎的木质化
木质素含量是反映嫩度的关键指标,是茶叶品质和产量的重要农艺性状。为了了解茶树中木质素的生物合成模式,该团队选取了从顶芽到第四片叶的各个发育节点。茎横切面间苯三酚染色表明木质素含量在茎发育过程中增加(图 6a)。发育茎中木质素生物合成相关基因的表达模式表明,除HCT家族基因外,大多数木质素生物合成相关基因的表达与木质素含量呈正相关(图 6b)。
次生细胞壁沉积和木质化的转录调控已被深入研究,多个MYB转录因子在这一过程中发挥关键作用。在拟南芥中,AtMYB83和AtMYB46是多个NAC转录因子的直接靶基因,包括NST1/2/3,它们是次生壁加厚过程的主要调控因子。AtMYB83和AtMYB46随后触发了一组下游MYB转录因子(AtMYB58、AtMYB63等)的表达,它可以直接激活参与次生细胞壁形成的基因(图 6c)。MYB转录因子被证明是木质素、纤维素或半纤维素生物合成的抑制因子,其中R2R3-MYBs具有pdLNL[D/E]Lxi[G/S]抑制结构域(图 6c)。在茶树基因组中,通过系统发育和共表达分析分别有12个和4个MYB被预测为次级细胞壁构建的正调控因子和负调控因子(图 6d, e)。12个MYB激活子以及3个NAC同源基因CsNST1,CsNST2和CsNST3显示出不同的表达模式,反映了它们在发育茎中的调控关系(图 6e)。在木质素生物合成的主调控网络中,CsNST1,2和3,CsMYB164,CsMYB192和CsMYB140在茎发育早期的S1和S2中高表达(图 6e)。随后,在茎发育过程中,CsMYB191、CsMYB215和CsMYB89的表达从S2到S4被激活并增加(图 6e)。在调控网络的下游,CsMYB44、CsMYB102、CsMYB133、CsMYB119、CsMYB175和CsMYB114在S4中被强烈激活,直接激活木质素生物合成相关基因(图 6e)。相比之下,这些阻遏基因表现出不同的表达模式。CsMYB5、CsMYB28和CsMYB112在茎发育早期表达量较高,随后表达量下降;但CsMYB132和CsKNAT7的表达量仅在茎秆生长到时增加(图 6e)。相关性分析发现,大多数调控转录因子基因的表达模式与木质素生物合成相关基因的表达模式高度相关(图 6f)。
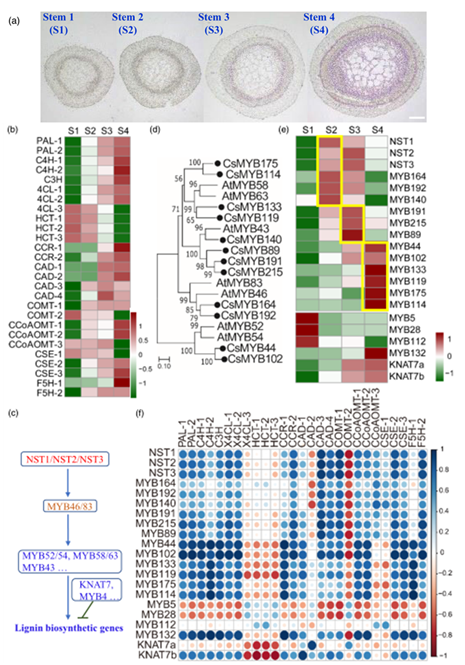
图6 参与调控木质素生物合成的MYB转录因子的鉴定
06
鉴定参与调控类胡萝卜素生物合成的MYB转录因子
类胡萝卜素也有助于茶叶感官感知品质,如茶汤颜色和香气,但对茶树中类胡萝卜素的生物合成知之甚少。通过系统发育分析发现,与类胡萝卜素生物合成相关的关键基因主要在叶片中表达,尤其是成熟的叶片和花,其中类胡萝卜素(主要是叶黄素和β-胡萝卜素)显著积累(图 7a)。该团队鉴定到至少7个可能参与茶树类胡萝卜素合成的MYB转录因子,主要在叶片和花中表达(图 7b)。相关分析进一步鉴定到7个正调控类胡萝卜素合成的MYB转录因子,分别为CsMYB56、CsMYB110、CsMYB68、CsMYB147、CsMYB193、CsMYB148和CsMYB120 (图 7c)。共表达分析表明,只有CsMYB127、CsMYB69和CsMYB110与生物合成基因高度相关(图 7c)。其中,CsMYB110是MtWP1的茶树同源基因,调控蒺藜苜蓿中类胡萝卜素的生物合成。因此,CsMYB110被认为是茶树类胡萝卜素生物合成调控因子的有力候选者。
为了进一步鉴定CsMYB110的功能,利用反义寡核苷酸(asODN)技术在茶树叶片中敲低CsMYB110 (MYB110-KD) (图 7d)。与正义ODN处理(MYB110-CK)的对照(MYB110-CK)相比,asODN处理72 h后,MYB110-KD中CsMYB110的转录水平显著降低,通过定量反转录PCR (qRT-PCR)验证,与MYB110-CK相比,MYB110-KD叶片中叶黄素和β-胡萝卜素的含量也显著降低(图 7e, f)。与这些观察结果一致,几个关键的类胡萝卜素生物合成基因,如八氢番茄红素合成酶(PSY),八氢番茄红素去饱和酶(PDS)和胡萝卜素去饱和酶(ZDS),在MYB110-KD叶片中被显著抑制(图 7g)。事实上,在Y2H和BiFC实验中,CsMYB110、CsTT8和CsWD40相互作用形成MBW复合体(图 4)。共表达CsMYB110、CsWD40和CsTT8a显著激活了CsPSY和CsZDS启动子驱动的荧光素酶报告基因,表明CsMYB110通过MBW复合体调控茶树叶片中类胡萝卜素的生物合成(图 7h)。

图7 鉴定参与调控类胡萝卜素生物合成的MYB转录因子
+ + + + + + + + + + +
结 论
本研究通过对茶树中不同MYB转录因子的探究,进一步挖掘茶树中编码MYB的功能基因,阐明了化学多样性和数量浓缩的次生代谢产物的生物合成与茶树发育的协调调控,同时为了解茶树中的各种激素信号和应激反应提供了极好的参考。由于茶树富含多种类型的次生代谢物,未来以茶树为模型的MYBs和其他TFs的研究可以在代谢和发育数据以及胁迫环境中得到加强。因此,本研究为进一步探索MYB介导的茶树发育和次生代谢产物积累的调控网络奠定了坚实的基础。
+ + + + +



 English
English


