文献解读|Poultry Sci(4.014):高、低精子活力的公鸡睾丸转录组分析
✦ +
+
论文ID
原名:Transcriptome analysis of the testes of male chickens with high and low sperm
motility
译名:高、低精子活力的公鸡睾丸转录组分析
期刊:Poultry Science
影响因子:4.014
发表时间:2022.9.14
DOI号:10.1016/j.psj.2022.102183
背 景
种鸡的繁殖性能在禽业养殖中具有重要的经济意义,精液品质和精子活力是公鸡繁殖能力的指标,影响着鸡蛋受精率乃至后代的生产性能。家禽生产中,80%低生育力的公鸡表现为精子活力低下。研究表明,转录基因调控在包括精子运动在内的多种生理过程中起着关键作用。目前,对哺乳动物和海洋动物精子的遗传分子机制研究较多,而对鸡精子活力影响的研究更多集中在外部因素和微量元素上。然而,家禽饲养业的发展和改善减少了外界因素对精子活力的影响。本研究通过RNA-Seq技术,对具备高、低精子活力的固始鸡的睾丸组织进行转录组测序分析,研究结果将有助于阐明鸡精子活力的分子遗传机制。
实验设计
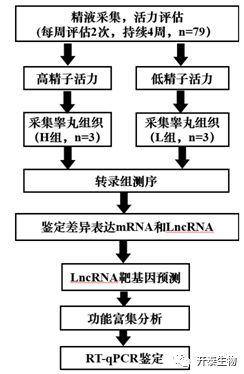
结 果
01

精液质量评估
作者统计了79只公鸡的精液质量参数,得出平均精子活力为0.51±0.12,精子活力中位数为0.52,下四分位数和上四分位数分别为0.42和0.61(图1a)。精子活力的频率呈正态分布(图1b)。根据之前的研究,精子活力低于0.42低活力,高于0.61为高活力。基于以上数据,本研究选择了3只高精子活力的公鸡(0.74±0.03)和3只低精子活力的公鸡(0.24±0.02),分别采集睾丸组织进行后续实验。
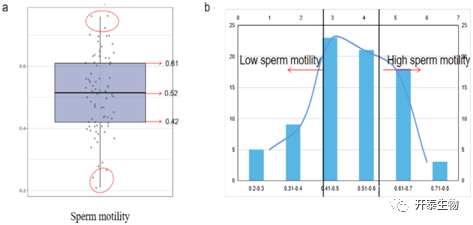
图1. 公鸡精子质量(活力)参数
02

转录组测序数据质量评估
对6个文库(高精子活力组H1, H2, H3+低精子活力组L1, L2, L3)进行测序,得到的高质量reads分别为49673570、45968990、43805848、41691346、46183652和39461786;map ratio>92%,unique map ratio>96%。
03

差异表达mRNA分析
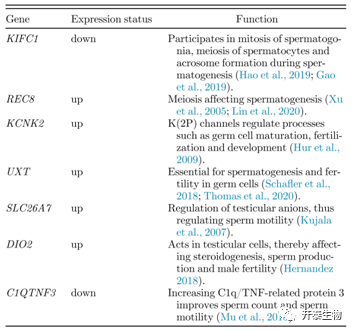
本次测序,共鉴定了16837个mRNA,其中191个和195个分别在低精子活力组和高精子活力组中特异性表达(图2a)。共有140个差异表达mRNA,其中73个上调,67个下调(图2b)。其中,包括几个与精子发生和精子活力相关的基因,如KIFC1、REC8和DIO2(表2)。差异表达mRNA的聚类分析如图2c所示。
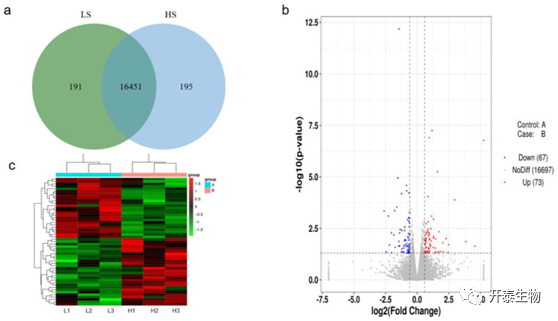
图2. 高、低精子活力的公鸡睾丸mRNA差异表达分析
表2. 精子发生和精子活力相关的差异表达基因
04

GO和KEGG分析
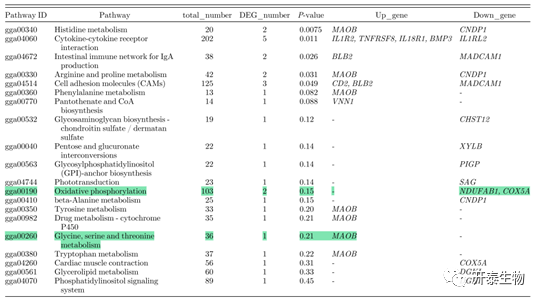
对差异表达mRNA进行功能富集分析以确定与精子活力相关的通路。结果表明,差异表达mRNA编码G蛋白偶联受体(GABBR2)、热休克蛋白(CRYAB和HSPB2)。其中,GABBR2显著下调,CRYAB和HSPB2显著上调(表3)。根据KEGG结果和已有的研究,认为和氧化磷酸化相关的基因(NDUFAB1、COX5A [下调],MAOB [上调])以及甘氨酸、丝氨酸和苏氨酸代谢相关的基因可能参与精子活力的调节(表4)。
表3. 最显著富集的GO通路
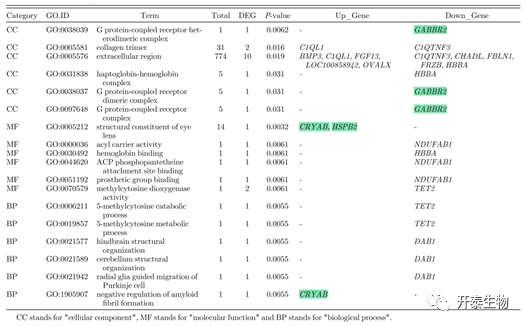
表4. 差异表达基因显著富集的前20个KEGG通路
05

测序结果验证
为了验证测序结果的可靠性,随机选择9个差异表达基因(KCNK2, DIO2, HABP2, ANO8, CRYAB, KIFC1, OMP, TPPP3, KCNIP1),使用RT-qPCR进行验证(图3)。PCR结果表明:KCNK 2、DIO 2、HABP 2、ANO 8和CRYAB在高活力组中表达上调,而KIFC 1、OMP、TPPP 3和KCNIP 1在高活力组表达下调,与RNA-Seq结果一致。
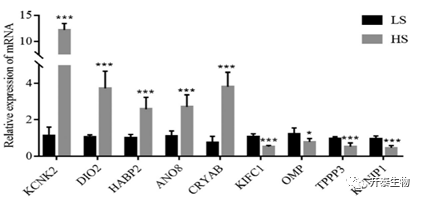
图3. RNA-Seq和RT-qPCR结果之间的一致性
06

LncRNA鉴定
使用PLEK、CNCI和PfamScan鉴定LncRNA,并选择了7830个LncRNA用于后续分析。为了评估mRNA水平对精子活力的影响,整合了两个组之间的差异表达LncRNA。和LncRNA相比,mRNA序列更长(图4a),数目更多(图4 b)。大多数LncRNA含有2或3个外显子,而大多数mRNA具有10个以上的外显子(图4c)。共有7400个LncRNA在高和低活力精子组中共表达。其中,227和202分别在低活力和高活力组中特异性表达(图4d)。共有103个差异表达的LncRNA,其中56个下调,47个上调(图4 e)。根据差异倍数的变化,LncRNA分为2组(图4f)。
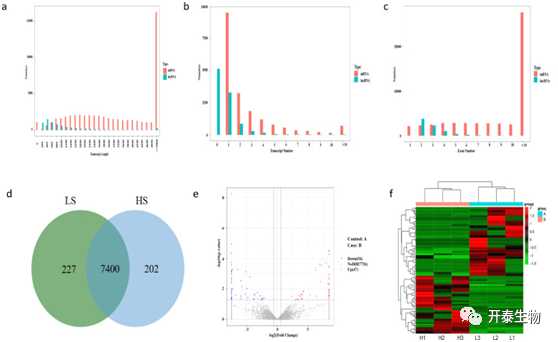
图4. 高、低精子活力的公鸡睾丸LncRNA差异表达分析
07

差异表达LncRNA分析
为了进一步研究LncRNA及其靶基因对精子运动的调控作用,对15895个顺式调控基因和3000个反式调控基因进行了功能富集分析,发现差异表达基因与生长发育、生殖、免疫和代谢等功能密切相关(图5a),并且在mTOR信号传导通路、VEGF信号传导通路、磷脂酰肌醇信号传导通路、RNA转运和氨酰tRNA生物合成通路中显著富集(图5b)。
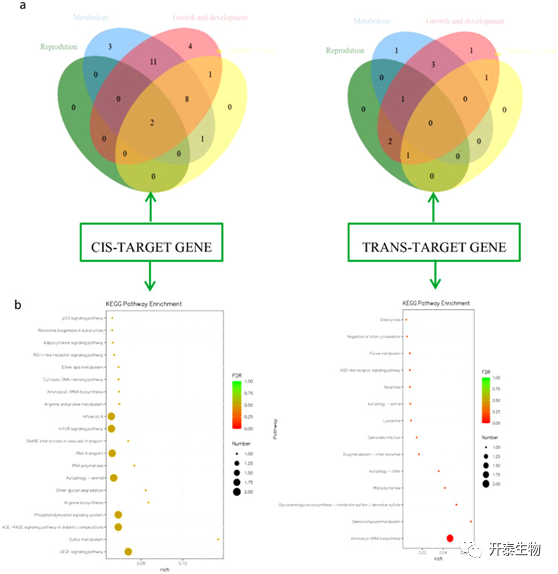
图5. 顺式和反式调节基因的功能注释和富集分析
08

LncRNA-mRNA互作网络分析
使用R中的Igraph软件包分析LncRNA和mRNA之间的相互作用(图6)。7个顺式调控基因与7个LncRNA相互作用。基因HBBA、TET2和SH3TC1下调,而C1QL1、LOC112530336、LOC100858942和LOC112531346上调(图6a)。13个反式调节基因与12个LncRNA相互作用。基因LRRC74A、BORCS6、TPPP3、TEF、LOC112530178、CHST12和ZNF692下调,而LOC101749307、LOC107054355、MROH7L4、CRYAB、REC8和VWC2上调(图6b)。REC8抑制MSTRG.15920.1和MSTRG.11860.2,而VWC2抑制MSTRG.11860.2。研究表明,REC8影响精子减数分裂,VWC2是骨形态发生蛋白拮抗剂,BMP4促进鸡原生殖细胞的形成。
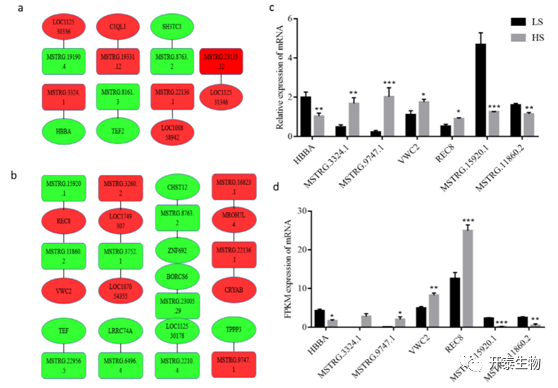
图6. LncRNA-mRNA相互作用网络以及RT-qPCR和RNA-Seq结果之间的一致性。
注:方框代表LncRNA,椭圆代表靶基因,绿色表达下调,红色代表上调。
+ + + + + + + + + + +
结 论
综上所述,本研究通过RNA-Seq分析鉴定了固始鸡睾丸组织中差异表达的mRNA和LncRNA。KIFC1和REC8等基因参与了精子活力的调控。LncRNA MSTRG.15920.1、REC8、LncRNA MSTRG.11860.2和VWC2之间的互作通路可能涉及精子活力的调节。此外,LncRNA MSTRG.15920.1也通过调节REC8来调控精子活力。本研究有助于阐明鸡精子运动的分子机制。
+ + + + +



 English
English

