文献解读|Signal Transduct Target Ther(39.3):单细胞转录组分析揭示了 COVID-19 相关小儿脑病的全身免疫失调
✦ +
+
论文ID
原名:Single-cell transcriptomic analysis reveals a systemic immune dysregulation in COVID-19-associated pediatric encephalopathy
译名:单细胞转录组分析揭示了 COVID-19 相关小儿脑病的全身免疫失调
期刊:Signal Transduction and Targeted Therapy
影响因子:39.3
发表时间:2023.10.18
DOI号:10.1038/s41392-023-01641-y
背 景
脑病是一种与 SARS-CoV-2 相关的严重中枢神经系统 (CNS)并发症,其特征是弥漫性脑功能障碍。因此,了解 COVID-19 相关脑病的免疫反应和病理生理学对于开发有效的治疗方法至关重要。
实验设计
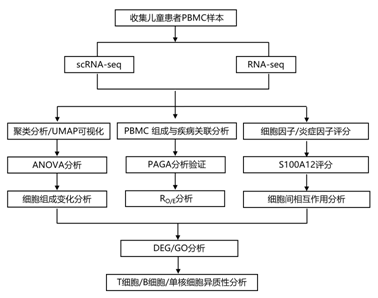
结 果
01
COVID-19 脑病患者的外周血单核细胞 (PBMC) 单细胞转录组分析
为了阐明 COVID-19 相关脑病的免疫特征,研究者团队收集 17 名儿童患者的 22 份 PBMC 样本进行了 scRNA-seq,以研究 COVID-19 脑病患者的免疫学和致病机制。这些样本包括7例住院脑病患者[4例急性坏死性脑病(AE)、3例非急性坏死性脑病(NE)]、2例重度症状但无脑病(SE)的患者,2例轻度或中度症状(MI)的患者,以及6例健康供体(HD)(图1a)。根据疾病类型和严重程度,将 22 个样本分为 6 组:AE、NE、MI、SE、CO(恢复期,其中1例与AE病例配对,3例与NE病例配对)和HD(图1a-b)。聚类分析和UMAP可视化鉴定出了8种主要细胞类型和30种细胞亚型(图1c-d),成功地定义了外周血中的细胞群/亚群组成。在UMAP投影上可以看到明显的差异(图1a)。主要细胞类型的疾病偏好用RO/E表示(图1e)。值得注意的是,在COVID-19合并急性坏死性脑病组中,大多数淋巴细胞群(包括CD8+ T、CD4+ T、NK、γδT细胞)显著减少(图1e),提示淋巴细胞减少可能是COVID-19相关急性坏死性脑病的一个突出特征。相反,急性坏死性脑病样本中的大多数髓样细胞(如单核细胞)发生富集(图1e)。用方差分析(ANOVA)分析时,淋巴细胞减少、髓样细胞增加和急性坏死性脑病之间存在相关性(图1f)。这些结果(淋巴细胞减少和髓样细胞升高)也见于表现严重疾病的COVID-19患者(图1e)。此外,他们发现COVID-19非急性坏死性脑病患者的外周免疫细胞组成变化与轻/中度症状患者相似(图1e)。
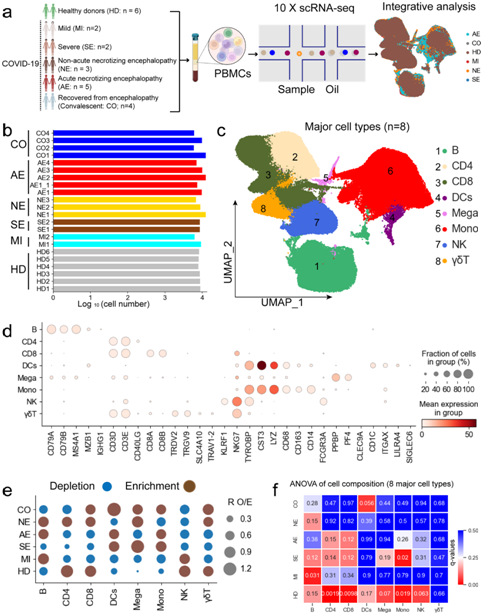
图1. PBMC 单细胞转录组研究设计和结果概述。
(a) 总体研究设计示意图。从17个人中收集了22份样本。 (b) 箱形图表示每个样品的细胞数。(c) 22个样本中8种主要细胞类型(右)的聚类结果(左)。 (d) 8种主要细胞类型(列)及其标记基因(行)的点图。(e) 用RO/E估计的主要细胞群的疾病偏好。 (f) 显示细胞组成和疾病类型之间关系的热图。
02
PBMC 组成与疾病类型之间的关联
他们进一步剖析了不同细胞亚型组成的变化及其与疾病类型的关系,使用ANOVA来评估这六组之间的关联,并确定了显著关联(图2a-b)。大多数 B 细胞亚型似乎与所有疾病类型相关,而 B_Plasma 和 B_Plasmablast 显示与患有脑病的 COVID-19 患者存在明显相关性(图 2b )。CD38、MZB1、MKI67、JCHAIN、XPB1和PRDM1在 B_Plasmablast 中高表达,证实该细胞亚型为循环浆细胞(也称为浆母细胞)。B_Plasma 高表达CD38、MZB1和IGHM,但不表达MKI67,表明该亚群为浆细胞。与健康供体相比,患有脑病的血浆和循环浆细胞富集(图2c)。有趣的是,他们还发现b_memory和B_GC聚类在COVID-19脑病患者中富集,显示出与脑病的关联(图2b-c),该数据揭示了B细胞亚群与COVID-19相关疾病之间的关联。
对于T细胞,他们发现大多数T细胞亚型与脑病恢复状态相关,而两种增殖性T细胞亚型(CD4_Pro和CD8_Pro)显示出与COVID-19脑病类型的明显关联(图2b)。CD4_Pro细胞聚类基于分区的图抽象(PAGA)的图谱从幼稚 CD4细胞(CD4_Naïve)中获得,其表达MKI67、CCR7和TCF7的水平相对较高。尽管CD4_Pro在COVID-19患者中降低(图1c),但该聚类与非急性坏死性脑病相关(图2b)。特别是,CD4_Pro似乎是一种中间状态(图2c),在幼稚CD4和调节性T细胞(CD4_Treg)之间表现出高度的连通性。同样,在COVID-19患者中,特别是脑病组和重症组,CD4_Naïve聚类也有所减少(图2c)。增殖性CD4及其前体CD4_Naïve T细胞的减少可能部分提示COVID-19适应性免疫反应失调,特别是对那些表现为脑病的患者。
CD8_Pro是一种增殖效应记忆CD8+ T细胞亚群,具有增殖、细胞毒性和记忆标记(如MKI67、TYMS、GPR183、S100A4、GNLY、GZMK等),它在严重疾病和急性坏死性脑病组中,尤其是在恢复期显著增加(图2c)。特别是,CD8_Pro与COVID-19急性坏死性脑病患者有明显的相关性(图2b)。
与 COVID-19 患者中增殖性 CD8 + T 细胞增加相比,大多数 T 和 NK 细胞亚群[例如 CD4_Treg、CD4_Th1、CD4_Th2、γδT、NK_CD56 (dim)]减少,特别是对于那些表现出严重疾病和急性坏死性脑病的患者,它们与不同疾病类型的关联也各不相同(图2b-c)。
与患有急性坏死性脑病的COVD-19患者中淋巴细胞耗竭不同,外周血中大多数骨髓细胞亚群(例如Mono_CD14)增加(图2c)。在骨髓细胞中,他们在外周血中发现了一种特定的亚型(图2a),称为骨髓源性抑制细胞(MDSC),它抑制T细胞反应并在炎症条件下增加。PAGA分析证实MDSC源自Mono_CD14,证实该聚类是单核MDSC。在外周血中,除了CD14的高表达外,该聚类还具有HLA-DR -/lo表型(图2e)。钙卫蛋白(S100A8/A9)的上调和免疫抑制功能(例如PD-L1表达升高和CD62L表达降低)是单核细胞MDSC的标志。与以往报道一致,单核细胞MSDC中钙保护蛋白(如S100A8和S100A9)和PDL-1(特别是HLA-DR分子)的表达较高,CD62L的表达较低(图2e)。
除了单核细胞MDSC外,还鉴定出表达C1QA/B/C的单核细胞(Mono_C1QA)(图2a),其在急性坏死性脑病和严重症状患者中富集程度更高。进一步分析表明,Mono_C1QA 是 C1 补体成分的主要来源(图2f)。与健康供体和其他疾病类型相比,编码补体成分的基因,包括C1QA、C1QB和C1QC,在 COVID-19 重症和急性坏死性脑病患者中显著上调(图 2g)。这表明C1QA、C1QB和C1QC对于预测疾病严重程度和诊断 COVID-19 相关急性坏死性脑病具有潜在价值。此外,不同COVID-19疾病条件下单核细胞的不同UMAP投影模式表明这些细胞中转录组标志受到干扰(图2h)。
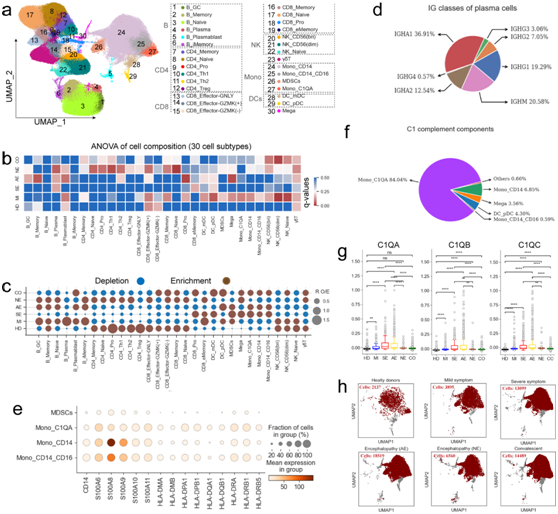
图2. COVID-19 疾病严重程度与 PBMC 细胞组成之间的关联。
(a) UMAP投影显示从22个样本中鉴定出的30个细胞亚型。 (b) 热图显示了疾病类型之间细胞亚型组成差异的方差分析p值。(c)点图描绘使用 R O/E计算的 30 种细胞亚型疾病偏好。(d)来自 AE 的浆细胞重链类别。(e) 点图显示单核细胞亚型中所选单核细胞标记基因的表达。(f)饼图描绘了每种细胞亚型对 C1 补体成分的相对贡献。 (g) 箱线图显示不同组之间 Mono_C1QA 细胞中 C1QA、C1QB 和 C1QC 的表达。(h) 来自不同组的 Mono_CD14 细胞的 UMAP 投影密度图。
03
S100A12主要通过经典单核细胞参与了COVID-19急性坏死性脑病患者的细胞因子风暴
细胞因子风暴(一种失调的免疫免疫应答)是导致 COVID-19 多器官衰竭和死亡的主要原因。本项研究分析了细胞因子释放的潜在来源,根据预先定义的细胞因子和炎症基因的表达,分别为每个细胞聚类定义细胞因子和炎症评分。然后将这两个相互关联的分数用作评估每个细胞聚类对炎症细胞因子风暴的贡献的指标。在COVID-19急性坏死性脑病患者中,细胞因子和炎症基因明显上调(图3a),这表明在这些患者中存在炎症细胞因子风暴。14个亚型,包括3种CD4 T细胞亚型(CD4_Memory、CD4_Th1和CD4_Th2)、5种CD8 T细胞亚型(CD8_Effectory-GNLY、CD8_Effectory-GZMK(+)、CD8_Effectory-GZMK(-)、CD8_Pro和CD8_Memory)、3种NK细胞亚型(NK_CD56 (dim)、NK_CD56 (bri)和 NK_Naïve)、2种骨髓细胞亚型(Mega 和 Mono_CD14)和1种 γδT 细胞亚型,它们的炎症和细胞因子评分显著增加,这表明这些亚型可能是炎症细胞因子风暴的关键因素。有趣的是,表达cd14的单核细胞(Mono_CD14)是COVID-19急性坏死性脑病患者炎症细胞因子风暴的最大贡献者(图3b)。
接下来,他们确定了患有脑病的 COVID-19 患者中这三种细胞亚群的比例,观察到这些亚群在COVID-19急性坏死性脑病患者中显著升高,并且炎症细胞的比例表现出不同的富集模式(图2c)。在每个炎症细胞亚群中,观察到促炎细胞因子基因的独特表达模式,例如S100A12、CCL3、TNFSF13、IL -1B、LTA、OSM、XCL2、XCL1和PF4(图3c),这意味着多种机制导致炎症细胞因子风暴。进一步分析发现,分泌最高的 10 种细胞因子(S100A12、IL16、TNFSF13、XCL2、TXLNA、PF4、IL1B、CCL3、IL12RB1和XCL1)贡献了 COVID-19 急性坏死性脑病患者 >99% 的炎症细胞因子评分(图3d),证实了这些促炎细胞因子在导致细胞因子风暴中发挥的核心作用。在前10种细胞因子中,S100A12主要由Mono_CD14细胞亚群分泌(图3d-e),可能在引发COVID-19急性坏死性脑病患者细胞因子风暴中发挥重要作用,因为该细胞因子占了> 96%的细胞因子评分。在COVID-19急性坏死性脑病患者中,S100A12基因的表达也显著升高(图3f)。Mono_CD14亚型还表达了更多的细胞类型特异性促炎细胞因子(如S100A12、CCL3、CXCL2、IL1B和CXCL10),表明该聚类在驱动炎症细胞因子风暴中起核心作用(图3c)。
S100A12作为炎症性疾病的标志物,在炎症过程中过度表达。该细胞因子是TLR4 (toll样受体4)配体,其信号转导可触发促炎激活。与健康对照组和非急性坏死性脑病的COVID-19患者相比,TLR4在COVID-19急性坏死性脑病患者中表达显著升高(图3f),尤其是在炎症单核细胞中。这与之前的结果一致,S100A12通过TLR4信号激活单核细胞。该信号通过MYD88通路导致多种促炎细胞因子的释放。正如预期的那样,在COVID-19急性坏死性脑病患者中,MYD88的表达也显著升高(图3f)。这些发现表明,COVID-19 急性坏死性脑病与S100A12 - TLR4诱导的炎症相关,凸显了促炎性S100A12分子对于开发急性坏死性脑病潜在治疗策略的重要性。
接下来,他们探讨了 COVID-19 急性坏死性脑病患者的三种高炎症细胞亚群之间不同配体-受体配对的模式,观察到患有急性坏死性脑病的 COVID-19 患者炎症细胞之间存在显著的配体-受体相互作用。与 CD4_Memory 和 CD8_Pro 亚型相比,表达 CD14 的单核细胞 (Mono_CD14) 表现出更多的相互作用(图3h)。Mono_CD14细胞表达多种受体(例如TNFRSF1A、TNFRSF1B、TNFRSF10B、DPP4、IL15RA和CXCR3),表明这些细胞可以同时响应其他细胞分泌的多种细胞因子。Mono_CD14 和其他细胞之间的相互作用似乎依赖于 PF4 | CXCR3、TNFSF13 | FAS、IL15 | IL2RG、TNFSF12 | TNFRSF25、NECTIN2 | CD226、CD58 | CD2、RETN | GPR25 和 ALCAM | CD6(图3h)。
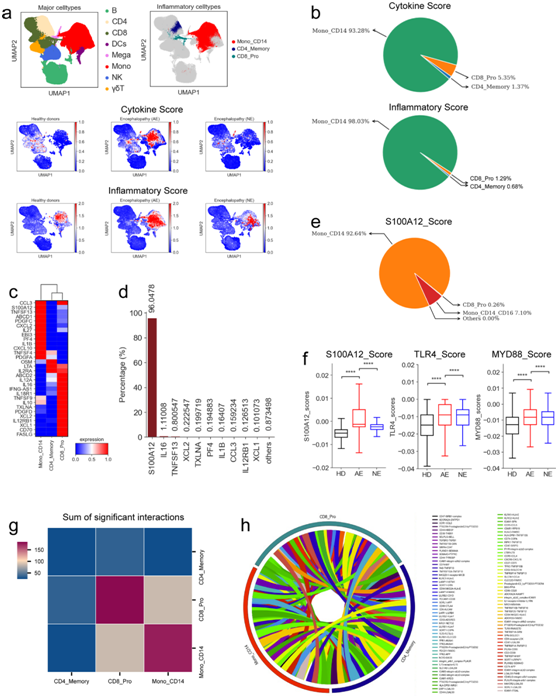
图3. S100A12对严重疾病中的 COVID-19 细胞因子风暴的贡献。
(a) PBMC 的 UMAP 可视化。 (b) 饼图描述了每种炎症细胞亚型对细胞因子和炎症评分的相对贡献。(c) 热图描绘了所识别的每种高炎症细胞亚型内细胞因子的表达。 (d) 条形图描绘了患有急性坏死性脑病的 COVID-19 患者中前 10 种细胞因子的相对贡献。 (e) 饼图描绘了每种细胞亚型对S100A12分数的相对贡献。(f) 箱线图描绘了不同组之间的 S100A12、TLR4 和 MYD88 基因表达评分。 (g) 3 种高炎症细胞亚型之间显著相互作用总和的热图。 (h) Circos 图描绘了 3 种高炎症细胞亚型之间的配体-受体对相互作用。
04
COVID-19急性坏死性脑病患者t细胞反应失调
为了进一步了解 COVID-19 脑病患者 T 细胞的功能状态,他们进行了转录组分析(RNA-seq)。在T细胞的差异表达基因(DEG)中,与健康供体相比,轻中度组、重度组、急性坏死性脑病和非急性坏死性脑病组分别有780、908、119和148个基因上调(图4a)。在上调的基因中,55个基因是所有COVID-19患者共有的(图4a)。除了在COVID-19急性坏死性脑病组中富集的抗病毒反应(例如,“干扰素反应”、“对病毒的防御反应”和“对病毒的细胞反应”)通路外,与其他COVID-19组相比,该组中性粒细胞激活和中性粒细胞介导的免疫反应的通路也显著富集(图4b)。在COVID-19急性坏死性脑病组中,参与中性粒细胞活化的基因(S100A8、S100A9、S100A12、ANXA1等)的表达一致升高(图4c)。
在COVID-19急性坏死性脑病患者中,MHC-II基因(HLA-DQB1、HLA-DPB1和HLA-DQA1等)的表达降低(图4c),表明T细胞的免疫失调。
然后他们研究了不同组的T细胞毒性评分(图4d)。COVID-19脑病患者的T细胞在整体水平上表现出更高的细胞毒性评分,其中急性坏死性脑病的T细胞毒性评分最高(图4d)。五种 T 细胞亚型:CD8_Pro、CD8_effector-GNLY、CD8_effector-GZMK (+)、CD8_effector-GZMK (-)和 γδT 具有更高的细胞毒性评分。COVID-19脑病患者多种细胞毒性基因显著过表达,这些毒性基因包括PRF1、GZMK、GZMA、GZMB、GNLY和CST7(图4d)。
除了抗病毒反应外,溶细胞分子也参与细胞凋亡。他们研究了与颗粒酶/穿孔素介导的细胞凋亡相关的基因(例如GZMA、CASP3和PRF1)(图4d)。与T细胞中的GZMA、PRF1、GZMK和GZMB类似,CASP3在患有COVID-19的脑病患者中也显著增加,并且在急性坏死性脑病患者中观察到该基因的表达最高(图4e)。此外,在 COVID-19 脑病患者的 T 细胞中也观察到TNF-、FAS- 和 XAF1- 凋亡相关通路(例如TNFSF10、FAS、FASLG和XAF1)中基因的显著上调(图4d),特别是在那些患有急性坏死性脑病的患者中。
接下来,他们研究了与 COVID-19 脑病中 T 细胞免疫反应功能失调和免疫耗竭相关的潜在因素。使用耗竭相关标记的整理列表,定义了每个激活的 T 细胞的耗竭分数。在总体水平上,COVID-19脑病组中激活的T细胞的耗竭基因表达显著升高,特别是在急性坏死性脑病组中(图4f)。检测到五种 T 细胞亚型(CD4_Pro、CD4_Th2、CD8_Effector-GNLY、CD8_Effector-GZMK (+)和 γδT)具有较高的耗竭分数,表明这些细胞亚型可能是耗竭下的主要 T 细胞。进一步分析发现,COVID-19脑病患者的T细胞中多种抑制分子(例如PDCD1、LAG3和HAVCR2等)高表达(图4g)。PDCD1与PDL-1/PDL2和HAVCR2与半乳糖凝集素-9相互作用,募集PTPN6(也称为SHP1)和/或PTPN11(也称为SHP2)酪氨酸磷酸酶,这导致细胞增殖和细胞因子的产生减少。有趣的是,PTPN6和PTPN11在COVID-19脑病患者中的表达显著升高(图4h)。此外,与健康供体相比,在COVID-19脑病患者中,关键转录因子(TF) PRDM1的表达也显著增加(图4h)。PRDM1上调与抑制性受体表达升高和耗竭 T 细胞中多功能性降低相关。这些结果表明,耗尽的 T 细胞可能会导致 COVID-19 脑病患者的免疫功能障碍,特别是急性坏死性脑病。
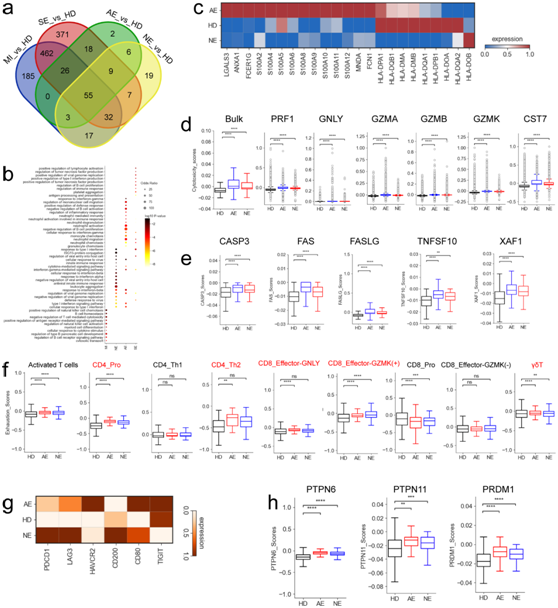
图4. 不同COVID-19组T细胞基因表达差异。
(a) 维恩图显示了T细胞中deg上调的数量。 (b) GO分析。 (c) 热图显示了不同组间T细胞中选定的中性粒细胞活化相关基因和HLA-II基因的标准化表达。(d) 箱形图显示了细胞毒性评分(左)和不同组(HD、AE和NE)T细胞中表达的细胞毒性相关基因。(e) 箱形图显示了不同组(HD、AE和NE) T细胞中凋亡相关基因的表达。(f) 箱形图显示了不同组(HD、AE和NE)效应T细胞的衰竭评分。(g) 热图描绘了不同组(HD、AE和NE)T细胞中标准化的衰竭相关基因表达。 (h) 箱形图描绘了不同组(HD、AE和NE)T细胞中表达的选定基因。
05
COVID-19脑病患者的B细胞异质性
相比于健康供体,他们发现来自COVID-19轻度至中度、重度、急性坏死性脑病和非急性坏死性脑病组的B细胞中分别有626、269、84和83个DEG上调(图5a)。在 B 细胞中上调的 DEG 中,有 35 个在所有 COVID-19 患者中很常见(图5a)。
GO分析显示,COVID-19相关的急性坏死性脑病的特点是干扰素(IFN)反应相关通路(例如“对I型干扰素的反应”和“对IFN-α的反应”等)富集(图5b)。与健康供体和其他COVID-19组相比,与ifn反应通路相关的基因(如ISG15、IFITM1/2/3、OAS3和IFIT1/2/3)在COVID-19相关的急性坏死性脑病组中显著上调(图5c)。
接下来,他们还研究了重要的b细胞活化基因在covid -19中的表达。血浆/循环浆细胞的功能和身份依赖于三个转录因子(tf),即IRF4, XBP1和PRDM1。在本研究的COVID-19患者中,这些tf显著上调(图5d)。IRF4促进浆细胞的产生并调节 Ig 类别转换重组,XBP1维持浆细胞中的蛋白质产生,PRDM1决定 B 细胞分化中的分泌臂并增加 Ig 的产生。此外,与健康供体相比,COVID-19 患者的CD4 + T 细胞中CD2AP基因表达显著升高(图5e)。该基因调节Tfh(滤泡辅助性T)细胞分化,并在病毒感染期间,增加保护性抗体反应。同样,支持浆细胞功能的TNFSF14在T细胞(包括CD4 T和CD8 T细胞)中的表达也显著增加(图5e)。此外, B/NK/T细胞活化所需的KDM5A在CD8T细胞和自然杀伤(NK)细胞中显著增加(图5e)。
除了激活血浆的相关通路外,他们还在幼稚B细胞中观察到FCER2下调,而SLAMF7上调,这表明这些细胞在COVID-19中显著活化(图5f)。记忆B细胞群(B_Memory)表现出组织样记忆B细胞表型(FCRL5和ITGAX的高表达),在COVID-19严重症状和脑病组中观察到高表达(图5g)。参与记忆B细胞激活的基因,包括CD69和ZEB3,在COVID-19患者中表达水平更高(图5h)。
此外,他们发现大多数HLA II类基因(HLA-drb5, HLA- dqb1和HLA- dqa2等)在COVID-19患者的B细胞中显著下调,特别是在严重和急性坏死性脑病组中(图5i),表明适应性免疫细胞之间的相互作用失调。

图5. 来自不同 COVID-19 组的 B 细胞的基因表达差异。
(a) 维恩图显示了 B 细胞中上调的 DEG 数量。 (b)GO分析。 (c) 组间 B 细胞中选定的 IFN 反应基因的点图。(d) COVID-19 患者和健康供体之间 B 细胞中选定基因的箱线图。 (e) COVID-19患者与健康供者之间CD4(左)、CD8(中)和NK(右)细胞中选定基因的箱形图。 (f) 箱线图显示了不同组的幼稚B 细胞中选定基因的表达。 (g) 箱线图显示了不同组的记忆 B 细胞中表达的选定基因。 (h) 箱线图显示了不同组的记忆 B 细胞中的ZEB2和CD69基因表达。(i) 箱线图显示了不同组 B 细胞中HLA-II基因的表达。(j) 箱线图显示了来自不同组的 B 细胞中的 CXCR5 表达。
06
COVID-19脑病患者循环单核细胞的重塑
CD14+单核细胞中的DEG中,在COVID-19轻、中度、重度、急性坏死性脑病和非急性坏死性脑病患者中分别有1265、899、332和232个基因上调,其中有175个是共享的(图6a)。与在B细胞中的观察结果相似,相对于健康对照组和其他COVID-19组,COVID-19急性坏死性脑病患者的CD14+单核细胞中,与IFN反应相关的通路(例如,I型干扰素信号通路,对干扰素α的反应等)发生显著富集(图6b)。进一步分析发现,COVID-19急性坏死性脑病患者也有多种isg基因上调(如ISG15、IF27和IFITM1/2/3等),与GO分析一致(图6c)。GO分析显示,包括对神经元死亡的调控相关通路,在COVID-19脑病患者中也富集程度更高(图6b),这表明经典单核细胞可能在COVID-19相关脑病的发展中具有直接作用。
巨核细胞参与止血,但尚不清楚它们是否会导致 COVID-19 相关脑病。在COVID-19组中,与血小板聚集和激活相关的两条通路(GO:0070527和GO:0030168)显著上调(图6d)。相反,没有观察到COVID-19脑病患者的血小板聚集/活化通路上调(图6d),表明这些患者血栓形成的风险较低。巨核细胞也可以促进炎症信号传导,但在包括脑病患者在内的COVID-19患者的巨核细胞中没有观察到炎症相关基因(例如CCL2、CLL3、IL-6和CXCL8等)的上调,即该亚型不是促炎细胞因子的外周来源,并表明巨核细胞不是 COVID-19 相关脑病发病机制的主要贡献者。
树突状细胞(DC)是重要的抗原呈递细胞,可激活包括 T 细胞在内的适应性免疫反应。他们分析了 COVID-19 疾病中 DC 的吞噬作用和抗原呈递能力,与健康供体相比,来自 COVID-19 患者的 DC 的吞噬能力降低(图6e)。吞噬作用相关基因(例如CDC42、WASF2、RAC2和VASP等)的表达也减少。同样,来自COVID-19患者的dc也表现出比健康供体更低的抗原呈递能力(图6e),与抗原呈递相关的基因(例如HLA-DQB1、HLA-DEB5和HLA-DQA1等)在来自COVID-19组(包括脑病患者)的dc中下调(图6f)。这些结果表明,dc导致COVID-19患者(包括脑病患者)的免疫失调。
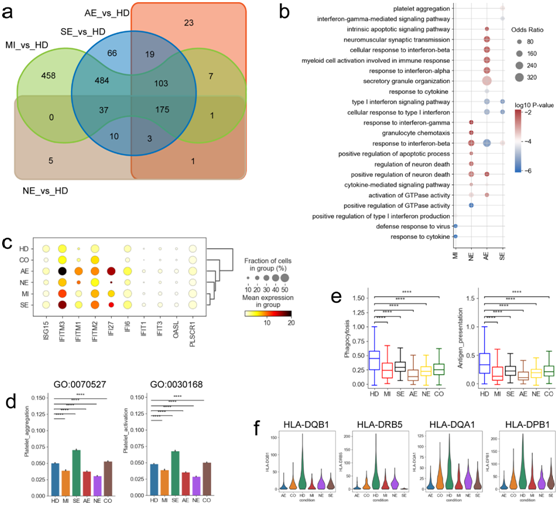
图6. 不同 COVID-19 组的骨髓细胞的基因表达差异。
(a) 维恩图显示了骨髓细胞中上调的 DEG 数量。 (b) GO分析。(c) 组间骨髓细胞中选定的 IFN 反应基因的点图。(d) 巨核细胞中两个 GO 基因集[血小板聚集 (GO:0070527) 和血小板_激活 (GO:0042113)]标准化表达评分的条形图。(e) DC 中吞噬作用评分和抗原呈递评分的箱线图。(f) 来自不同 COVID-19 群体的 DC 中代表性 HLA-II 基因的小提琴图。
+ + + + + + + + + + +
结 论
本项研究利用单细胞转录组分析并综合临床结果来探究宿主免疫反应,揭示了 COVID-19 相关小儿脑病的病理机制。淋巴细胞减少是患有脑病的COVID-19患者的免疫失调的一个显著特征,其特征是各种淋巴细胞(例如CD8 + T 和CD4 + T 细胞)显著减少,而其他炎症细胞(例如单核细胞)显著增加。本项研究还揭示了多种细胞凋亡通路的激活(例如颗粒酶/穿孔素、FAS和TNF诱导的细胞凋亡)可能是淋巴细胞减少的原因。主要来自经典单核细胞的全身性S100A12上调可能导致了 AE 患者的细胞因子风暴。I 型干扰素 (IFN) 反应失调,这可能进一步加剧AE 患者中S100A12驱动的炎症。最后,患有脑病的 COVID-19 患者还具有 NK 和 T 细胞广泛衰竭、较高的细胞毒性评分和炎症反应以及 B 细胞介导的体液免疫反应失调的特征。总而言之,本项研究为阐明免疫发病机制提供了详细的资源,并将有助于开发有效的 COVID-19 相关儿科脑病治疗方法,特别是对于 AE 患者。
+ + + + +



 English
English


