文献解读|Cell Metab(29.0):通过限时喂养调节昼夜节律可挽救阿尔茨海默病小鼠模型的大脑病理并改善记忆
✦ +
+
论文ID
原名:Circadian modulation by time-restricted feeding rescues brain pathology and improves memory in mouse models of Alzheimer's disease
译名:通过限时喂养调节昼夜节律可挽救阿尔茨海默病小鼠模型的大脑病理并改善记忆
期刊:Cell Metabolism
影响因子:29.0
发表时间:2023.10.03
DOI号:10.1016/j.cmet.2023.07.014
背 景
除了大脑中 β-淀粉样蛋白 (Aβ) 和磷酸化 tau (pTau) 蛋白的积累外,昼夜节律紊乱几乎影响所有阿尔茨海默病 (AD) 患者,然而,AD 中介导昼夜节律失调的途径及其调节机制尚未明确。
实验设计
结 果
01
AD 小鼠的睡眠、笼内活动和昼夜节律调节受到干扰
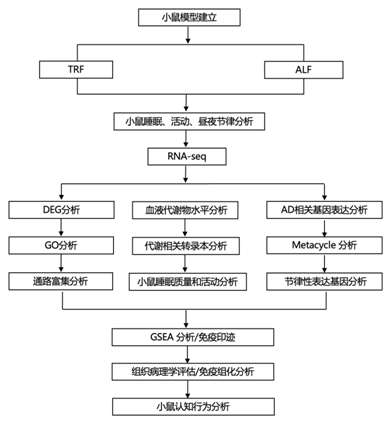
研究者团队建立了APP23 转基因 (TG) 小鼠模型,在 6 个月大时,发现小鼠的皮质和海马中出现稀疏的淀粉样斑块,这个年龄的 TG 小鼠已经表现出浅阶段睡眠碎片化增加以及一些认知改变。与非转基因 (NTG) 对照相比,11 个月大的 TG 小鼠在活动期表现出平均总睡眠时间减少和显著的睡眠不足(图 1 A-B),并在黑暗阶段过度笼内活动而改变活动节律(图 1 C-D)。在持续黑暗条件(DD)下对内源性昼夜节律活动节律的评估显示,昼夜节律发生了一些变化,与 NTG 对照相比,TG 雌性显示出更长的周期,而雄性则表现出更短的周期(图 1 E-F)。TG 小鼠在 DD 下也表现出活动碎片化增加,表现为活动回合长度减少和活动回合次数增加的趋势,而明暗 (LD) 与 DD 的总活动没有变化。此外,相比于对照组,雌性TG小鼠生物钟发生了明显改变(在雄性中未观察到这种行为)(图 1 G-H)。总而言之,这些观察结果表明,TG 小鼠在出现大量淀粉样蛋白病理之前的早期疾病阶段表现出睡眠、笼内活动和昼夜节律调节的破坏。
接下来,他们进行了转录组分析(RNA-seq),在TG小鼠中鉴定出258个差异表达基因(DEG),其中包括28个与AMP-AD和DisGENET数据库重叠的AD基因(图1I-J)。GO分析显示这些DEG涉及胆固醇生物合成、核心基质体和细胞外基质(ECM)、血管发育、神经元和胶质细胞功能、记忆、炎症、内吞和吞噬,其中星形胶质细胞标记物显著富集。
为了评估 APP23 TG 小鼠海马中一天中时间基因表达的潜在变化,他们分析了在 zeitgeber 时间 (ZT)0 和 ZT12 获得的大脑样本的 RNA-seq 数据,鉴定了 NTG 小鼠中的 248 个基因和 TG 小鼠中的 623 个基因在 ZT0 和 ZT12 之间差异表达(图 1 K-L),NTG 和 TG 小鼠之间有 127 个 DEG 重叠。该组包括核心时钟基因Dbp、Nr1d2、Per3和Arntl,以及时钟控制基因Ciart、Egr1、Hspa5、Nfil3、Cldn5和Egr2(图 1 M)。海马基因的昼夜变化通路分析显示,蛋白质折叠、对激素和生长因子的响应以及昼夜节律等通路发生富集(图1N)。
值得注意的是,他们确定了121个基因,这些基因在TG小鼠中失去了时间特异性的表达(图1O),在功能上与对激素、血管生成、ECM和食欲素信号的应答相关,并且在少突胶质细胞标志物中富集(图1P),他们观察到Kcnip4和Sirt1的峰值时间提前,Col1a2和Sirt1的振幅增加(图1Q-T)。
总之,这些结果表明,在AD中受到干扰的基因中,有很大一部分表现出一天中特定的时间表达,强调了在疾病早期,昼夜节律障碍对破坏海马转录组产生的影响。
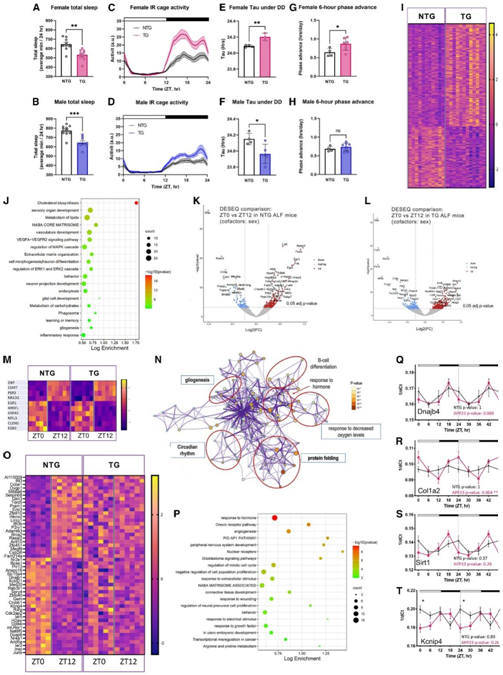
图1. AD小鼠的睡眠、活动、昼夜节律和大脑转录的变化。
(A-B) 总睡眠量表示为每 24 小时平均分钟数,来自两个 24 小时睡眠-觉醒周期收集的数据。(C-D) 平均为 7 至 10 天的活动。(E-F) DD下的Tau(昼夜周期长度)根据活动开始时间计算,并以小时单位表示。(G-H)生物钟时间相改变分析。(I) 基于使用 DESEQ2 对海马组织进行 RNA-seq 分析,APP23 TG 与 NTG 小鼠中显著 DEG 的热图。(J) 使用 Metascape 在 TG 小鼠中差异表达的基因的GO分析。(K-L) RNA-seq转录谱显示APP23 TG和NTG小鼠海马中的时间表达。(M)生物钟基因在NTG和TG小鼠中的表达情况,以热图形式呈现,以Z评分中基因表达的阶段排序。(N) 使用 Metascape 对节律基因进行通路富集分析,显示与神经退行性变和生物钟相关的功能富集。(O) APP23 TG 小鼠海马中的一些基因中的时间表达模式发生消除,如按 NTG 中的表达阶段排序并由 Z 分数表示的热图所示。(P) 对 TG 小鼠中失去节律性的基因进行 GO 分析。(Q-T) 使用每 6 小时采集的样本通过 qPCR 检测所选 AD 相关核心时钟基因表达节律模式的变化。
02
TRF 有效调节 AD 小鼠的代谢标志物和酮反应基因
他们评估了昼夜节律和代谢干预是否可以改善 AD 表型。将TG 和 NTG 同窝小鼠随机分配到随意喂养 (ALF) 或限时喂养 (TRF) 组,采用 6 小时喂养/18 小时禁食方案,喂养期与活动期的中间对齐 (ZT15- ZT21)(图 2 A)。
与 ALF 条件下的小鼠相比,TRF 条件下的小鼠在 ZT14 时血液中的 β-羟基丁酸显著增加,葡萄糖水平显著降低(图 2B-C)。此外,如RNA-seq数据所示,在TRF下,与脂质和碳水化合物代谢相关的酮反应基因和转录本在TG小鼠的大脑中存在差异表达(图2D)。
TRF 组中的雌性 TG 小鼠的总睡眠时间有所增加,与 NTG 小鼠的睡眠时间相当(图 2E-F)。虽然 TRF 组中的TG 雄性小鼠的总睡眠没有变化,但这些小鼠表现出中午觉醒程度增加(图 2G-H)。重要的是,TRF 组的 TG 雌性和雄性在 ZT24(睡眠阶段的开始)的入睡时间有所改善(图 2F-H)。值得注意的是,TRF模式挽救了雌性和雄性 TG 小鼠的特定行为异常,这些小鼠不再表现出活动期多动症,其活动模式与 NTG 小鼠中观察到的活动模式相似(图2I-L)。
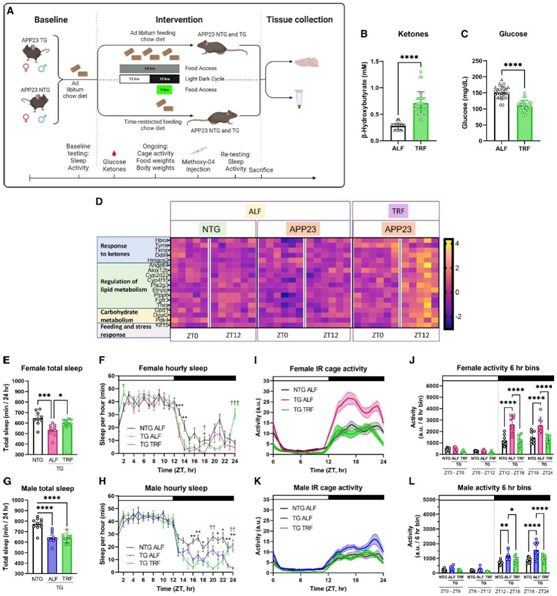
图2. 限时喂养诱导AD小鼠代谢变化、调节大脑转录并挽救行为和睡眠。
(A) TRF 干预的示意图,指示喂养模型和进行的测定/评估。(B-C) 与 ALF 小鼠相比,经 TRF 处理的动物的 β-羟基丁酸和葡萄糖发生显著变化。(D) APP23 TG 小鼠海马中一组代谢相关基因的表达受到 TRF 以阶段依赖性方式的调节。(E–H) 总睡眠表示为每 24 小时平均分钟数,睡眠表示为每 1 小时平均睡眠时间。(I–L) 以 3 分钟和 6 小时的时间段报告的活动记录,平均为 7 至 10 天的活动。
03
TRF 调节海马转录以及与 AD 和炎症相关的通路
APP23 TG小鼠在TRF或ALF方案下的比较中,显示出86个AD基因和100个与髓鞘形成、递质合成和储存、自噬、细胞因子重塑和适应性免疫反应相关的神经炎症基因的差异表达(图3A-J)。这些结果表明,TRF可以影响脑转录组,但更重要的是,它可以调节直接参与AD病理的通路。
接下来,他们使用 RNA-seq 进行无偏转录组范围的分析,以全面评估 TRF 对大脑的影响。在本次分析中,纳入了在四个时间点收集的 TG 小鼠的大脑样本,从两个维度分析了 TG 小鼠中 TRF 引起的变化:(1) 在横断面分析中显示出响应 TRF 的差异丰度的转录本,以及 (2) 在 TRF 处理后显示节律性变化的基因,获得或失去节律表达。在前一类中,他们鉴定了 TRF-TG 小鼠与 ALF 组相比差异表达的 415 个基因(图3 K),其中41个基因与阿尔茨海默病有关。从功能上讲,这些基因在AD病理相关的通路中富集,而这些通路包括髓鞘形成、血管系统、小胶质细胞分化、脑脊液循环和整合素信号传导(图3L)。对可能共调控这些TRF应答基因的上游因子的分析显示Bmi1和Id2富集。
另一方面,使用JTK和LS统计量的Metacycle分析确定了142个基因(包括7个AD相关转录本)在TRF作用下表现出不同的表达模式,其中59个基因在TRF作用下获得了节律性表达,83个基因失去了节律性表达(图3M)。GO 分析显示血管内皮生长因子 A/血管内皮生长因子受体 2 (VEGFA/VEGFR2) 信号传导、血管发育和黏附连接的富集,可能涉及脑血屏障以及染色质组织和组蛋白修饰的影响、胆固醇代谢、脂肪酸转运和自噬(图 3 N)。在这组受 TRF 调节的节律基因中富集的转录因子中,他们鉴定了 Phf2(富集度最高),这是一种组蛋白去甲基酶,可增加海马神经元的兴奋性突触后电位有助于记忆巩固,还鉴定了DNA 结合蛋白 2 (ID2) 抑制因子,这是一种可通过Bmal1:Clock二聚体消除基因激活的转录抑制因子,其在小鼠中的缺陷与运动活动节律紊乱和光引导增强相关。
最后,他们评估了标记不同代谢状态的特定时间点的基因表达变化,包括 ZT12,它代表禁食的最长持续时间,以及ZT18(对应重新喂食),他们鉴定了30个TRF组 TG 小鼠在ZT12 时差异表达的基因,在功能上与营养反应、哺乳动物雷帕霉素靶(mTOR)信号、脂质代谢、髓鞘形成和PPAR信号相关。另一方面,TRF模式在ZT18影响了151个基因,这些基因在胶质形成、趋化性、凋亡、整合素信号传导和脂肪酸氧化方面功能富集,表明昼夜节律禁食的影响在喂养状态下仍然存在(图3O-R)。
图3. TRF对海马转录及基因表达昼夜节律的影响。
(A–J) TRF和ALF 方案下的 APP123 TG 小鼠中与阿尔茨海默病和神经炎症相关的基因的差异表达。(K) 基于使用 DESEQ2 对海马组织进行 RNA-seq 分析。(L) TG 小鼠中受 TRF 调节的基因的GO分析。(M) 基因热图,显示 TG 小鼠海马中响应 TRF 的节律表达变化。(N) GO分析显示在 TRF 下获得或失去节律性的基因。(O-P) 火山图表示最大禁食时间 ZT12或在 ZT18 重新喂养后 TG TRF 和 ALF 之间的 DEG。(Q-R)在 TRF 下发现 TG 小鼠 ZT12 (Q) 或 ZT18 (R) 差异表达的基因。
04
Bmi1 是 APP23 TG 小鼠海马 TRF 诱导转录变化的潜在介质
他们观察到APP23 TG小鼠海马中异常表达的基因(图1I)有40%在TRF后恢复正常表达,其表达水平接近NTG ALF小鼠(图4A-E)。这些“挽救”的基因包括18个AD转录本(Tgfbr2, Gns, Tlr2, Col1a2, Cd74, Nrn1, Iqgap1),它们在胶质细胞发生,突触传递,谷氨酸能突触和ECM受体相互作用等方面功能富集。
他们进行基因集富集分析(GSEA),他们重点关注了Bmi1(也称为Pcg4, Polycomb group RING finger protein 4),它是调节47/415 trf应答基因的最富集的转录因子(图4F)。这种调节蛋白在大脑中大量表达,参与DNA损伤反应和染色质重塑,重要的是,在AD大脑中特异性减少。Bmi1缺陷小鼠重现迟发性AD病理特征,并显示淀粉样斑块和pTau增加。在APP23 TG小鼠中,Bmi1调节了25个异常表达的基因,并且几乎一半的基因在TRF后恢复正常表达。与Bmi1在AD中的作用一致,他们在ALF的TG小鼠中检测到Bmi1蛋白水平低于NTG小鼠,而TRF使Bmi1在TG脑中的表达正常化(图4G-H)。此外,他们验证了TRF恢复了Bmi1的几个下游靶点,包括一些与AD病理高度相关的靶点,如视黄醇转运蛋白Stra6、神经调节剂Npy和作为Aβ触发小胶质细胞炎症反应的受体的Tlr2(图4I-L)。总而言之,这些结果证明 Bmi1 在部分介导 TRF 对 APP23 TG 小鼠的正向调节作用。
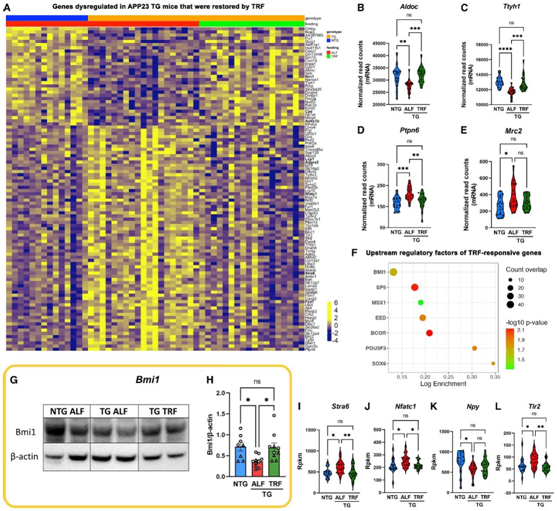
图4. 海马转录的TRF挽救部分由Bmi1介导。
(A-E) 热图代表由 TRF 挽救的 TG 小鼠中基因表达失调的变化。(F) 使用 GSEA 富集 TRF 响应基因的上游调控因子。(G-H) NTG、TG ALF和 TG TRF小鼠脑裂解液中 Bmi1 蛋白水平的分析。(I–L)在 TRF 下恢复的选定 Bmi1 下游靶标的小提琴图。
05
TRF 减少 APP23 TG 小鼠的 AD 病理进程
Aβ 的免疫染色显示,TRF 后的小鼠出现稀疏、小核心(致密)斑块和 Aβ 细胞内积累(图5A-H)。在 TRF后,TG 小鼠中斑块的总面积和每只小鼠的斑块数量均显著减少(图 5I-J)。斑块大小分析显示,在TRF下,任何大小的斑块都较少,较小的斑块(小于3000 μm2)变化更明显,可能表明淀粉样蛋白沉积速率的变化(图5K)。此外,线性回归分析显示,在所有组中,APP23 TG小鼠的斑块负荷和年龄均与预期的正相关,但曲线的升高有显著差异,TRF中的TG小鼠的斜率(1.429)与ALF组(6.009)相比降低了42.8%,表明治疗显著减缓了总体疾病进展(图5L)。
他们通过腹腔注射甲氧基-X04 (MX04) 进行初始时间戳标记。在TRF结束时,他们使用抗淀粉样蛋白82E1抗体对新积累的淀粉样蛋白进行尸检后的免疫组织化学标记。他们利用mx04标记的斑块(蓝色通道)和82E1斑块(红色通道)的z堆叠图像的正交投影,量化了7-18周实验期间斑块大小的纵向变化(图5N)。在第7周时,与ALF组小鼠相比,TRF组的小鼠的斑块大小已经明显减小。此外,根据82E1染色,TRF也减少了新斑块的积累(图5M-N)。这些数据证明TRF在诱导清除已有斑块和降低新淀粉样蛋白沉积率方面的作用。
接下来,他们利用本项研究的RNA-seq数据评估了参与APP代谢的70种酶的表达(mSigDB GO)。在ALG组TG小鼠中,与Aβ肽分解代谢有关的酶Neprylisin的表达仅有轻微变化,这可能与TG小鼠的淀粉样蛋白沉积有关。另一方面,TRF仅诱导Bace1的转录轻微下降,Bace1切割APP并产生C端淀粉样蛋白片段(CTF)。他们发现TRF降低了TG小鼠的全长APP水平和CTF水平(图5O-5Q)。此外,使用抗人淀粉样蛋白6E10多重试验检测可溶性和不溶性部分的淀粉样蛋白片段显示,TRF处理小鼠大脑中Aβ40和Aβ42水平降低(图5R-U),TRF处理可能通过多种机制促进淀粉样蛋白的清除。与这些观察结果一致,血清中Aβ40和Aβ42水平的检测显示,在TRF组的TG小鼠中,由于Aβ42浓度的增加,Aβ42/40比值显著升高(图5V-X),进一步证实了TRF诱导的Aβ清除率的增加。
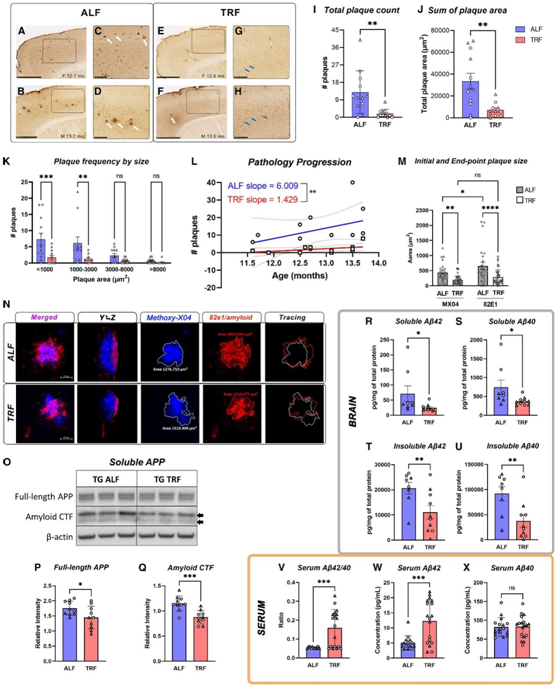
图5. TRF显著改善AD小鼠的淀粉样蛋白病理学和疾病进展。
(A–H) APP23 TG 小鼠表现出进行性淀粉样蛋白病理学,在额叶和内侧皮质中出现斑块积累。(I-K) TRF与ALF条件下APP23 TG小鼠淀粉样斑块计数、斑块占据面积和按大小分组后斑块数量的比较。(L) 通过比较 TRF 和 ALF 条件下 APP23 TG 小鼠中每只小鼠总斑块数作为年龄函数的简单线性回归所获得的斜率,可以看出 TRF 减缓了疾病进展。(M-N) APP23 TG 小鼠斑块生长的体内分析。(O–Q)检测 TG 小鼠可溶性脑裂解物中的全长 APP 和淀粉样蛋白 C 末端组分。(R–U) TRF 降低 APP23 TG 小鼠脑裂解物中可溶性和不溶性 Aβ40 和 Aβ42。(V–X) TRF 调节治疗小鼠的临床相关血液生物标志物。
06
TRF 减少了AD 小鼠模型的快速病理进展
接下来,他们采用对 4.5 个月大的 APP敲入(APP-KI)小鼠进行为期 3 个月的 TRF处理(图 6 A)。与 ALF 下的小鼠相比,TRF 下的 APP-KI 小鼠在 ZT14 时血液中的 β-羟基丁酸显著增加,葡萄糖水平显著降低(图 6B-C)。与 ALF 小鼠相比,TRF 减少了这些小鼠的淀粉样蛋白负荷,无论是斑块数量还是面积(图 6D-E)。斑块大小分析还显示,在 TRF 作用下,APP-KI 小鼠中任何大小的斑块均减少,并且观察到小斑块发生更明显且显著的变化(图6 F)。重要的是,与斑块相关的 pTau 斑点减少(图 6G-H),尽管 pTau 呈阳性的斑块比例(占斑块总数的百分比)在 TRF 和 ALF 条件之间没有变化(图6 I)。
最后,他们使用新颖的物体识别测试和旋转臂迷宫评估了 TRF 诱导的 AD 表型改善是否延伸到认知功能,特别是测试海马依赖性记忆。APP-KI 小鼠在新物体识别测试中表现出学习和记忆缺陷,TRF 可以改善这一缺陷(图 6 J)。此外,在旋转臂迷宫测试中,TRF改善了APP-KI小鼠的短期和长期记忆,其中ALF小鼠在回忆最近接触过的(工作记忆)和奖励(参考记忆)位置方面的损伤通过TRF处理得到了恢复(图6K)。APP-KI小鼠的工作记忆和参考记忆障碍从第3天开始就很明显,ALF组小鼠在短期和整个迷宫的工作记忆(图6L-N)和长期参考记忆(图6M)方面表现出缺陷。值得注意的是,TRF 将 APP-KI 小鼠所有这些领域的认知能力恢复到接近野生型 (WT) 的水平。
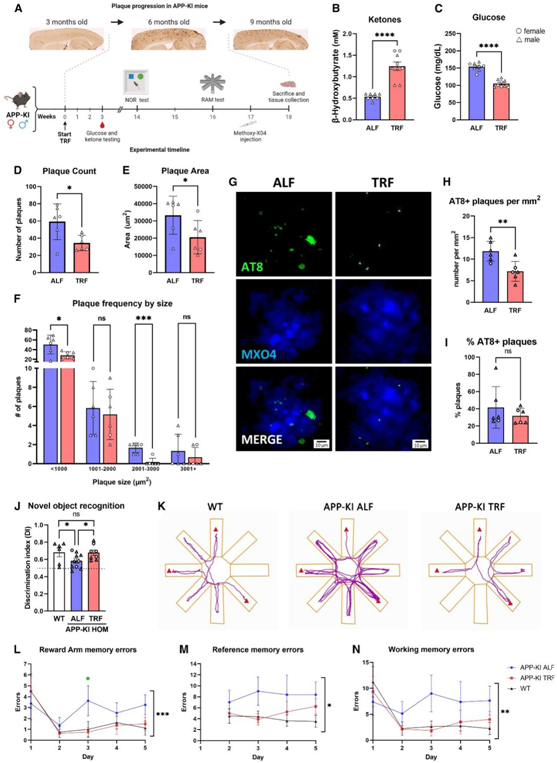
图6. 限时喂养可挽救APP-KI AD小鼠模型的认知行为并减少疾病进展。
(A) APP-KI 中 TRF 干预的示意图,表明与病理进展的时间尺度相关的评估。(B 和 C) 与 ALF 条件下的 APP-KI 小鼠相比,APP-KI TRF 处理的小鼠的 β-羟基丁酸和葡萄糖发生显著变化。(D–F) 斑块计数和斑块总面积减少,按大小排列的频率显示 TRF 下任何大小的斑块均减少。(G–I) 在 TRF 和 ALF 条件下,在注射甲氧基 X04 的 APP-KI 中评估与斑块共存的 AT8+ 斑点。(J) 使用新物体识别测试来测试学习和记忆。(K–N) 使用旋转臂迷宫评估海马依赖性记忆缺陷。
+ + + + + + + + + + +
结 论
本项研究表明,在两种 AD 转基因 (TG) 小鼠模型中,TRF改善了关键疾病成分,包括行为时间、疾病病理、海马转录和记忆。TRF 同时减少淀粉样蛋白沉积、增加 Aβ42 清除率、改善睡眠和记忆力以及使多个基因(包括与 AD 和神经炎症相关的基因)日常转录模式正常化。该研究首次揭示了TRF对 AD 的多效性,它具有超越新陈代谢、改善神经退行性变和昼夜节律失调的深远影响。由于 TRF 可以显著改变疾病轨迹,因此这种干预措施具有直接转化潜力,满足了对抑制 AD 进展的可行方法的迫切需求。
+ + + + +



 English
English


