文献解读|Cell Death Dis(9.685):肿瘤微环境研究热点:癌相关成纤维细胞促进卵巢癌进展
✦ +
+
论文ID原名:CRMP2 derived from cancer associated fibroblasts facilitates progression of ovarian cancer via HIF-1α-glycolysis signaling pathway
译名:癌相关成纤维细胞外泌的CRMP2通过HIF-1α-糖酵解信号通路促进卵巢癌的进展
期刊:Cell death & disease
影响因子:9.685
发表时间:2022.8.4
DOI号:https://doi.org/10.1038/s41419-022-05129-
背 景
卵巢癌是全球死亡率非常高的恶性妇科肿瘤,其中约90%的患者是具有转移特性的上皮性卵巢癌 (EOC),因此,研究卵巢癌的转移机制有助于临床卵巢癌患者的临床治疗。近年来的研究表明,肿瘤微环境 (TME)在多种肿瘤的发生发展中发挥着重要作用,癌症相关成纤维细胞 (CAFs) 是TME的主要基质细胞,通过分泌各种细胞因子调节肿瘤进展,因此作者想去探究CAFs在卵巢癌发生发展中的作用及机制,为临床卵巢癌患者提供潜在的治疗靶点。
实验设计

结 果
01

CAFs促进卵巢癌细胞的增殖、迁移和侵袭
首先作者从上皮性卵巢癌(EOC)患者组织中分离原代CAFs 和 NOFs,两者形态均呈纺锤状并表达特异性标志物 α-SMA、FAP 和Vimentin(图1A)。Western-blot,RT-qPCR和免疫荧光实验表明,相比于NOFs,CAFs中的α-SMA和FAP的表达水平显著上调,Vimentin水平无差异(图1B,C)。
接着作者收集 CAFs和NOFs的条件培养基 (CAFs-CM,NOFs-CM) 共培养 EOC 细胞系 (SKOV3 和 A2780)。CCK8 实验结果表明相比于NOFs-CM ,CAFs-CM能明显促进EOC增殖(图1D);侵袭实验结果表明,相比于NOFs-CM 或阴性对照 (NC) ,CAFs-CM 能明显促进SKOV3 和 A2780的侵袭(图1E,F);划痕实验结果表明,CAFs-CM 能明显提高SKOV3 和 A2780 的迁移能力(图1G,H)。综上,表明CAFs可以促进的卵巢癌进展。
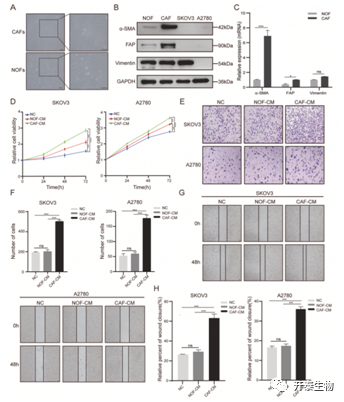
图1. CAFs促进卵巢癌细胞的增殖、迁移和侵袭
02

通过液质联用技术鉴定CAFs-CM 和 NOFs-CM 差异蛋白质
作者为了探究是什么原因导致了CAFs 和 NOFs对卵巢癌的不同影响,收集了CAFs-CM和NOFs-CM进行LC/MS分析。实验共发现126个差异蛋白,其中95个蛋白在CAFs-CM中上调,31 个蛋白下调(图2A,B)。在众多上调的蛋白中作者将目光靶向于CRMP2(图2C),目前的研究表明CRMP2参与多种恶性肿瘤进展,因此作者猜想CRMP2可能是CAFs促进卵巢癌进展的关键因子。同时作者进行了验证,ELISA结果表明相比于NOFs-CM ,CAFs-CM中CRMP2含量较高(图2D)。Western-blot结果表明,相比于NOFs、SKOV3 和 A2780,CAFs 中CRMP2表达水平上调(图2E)。
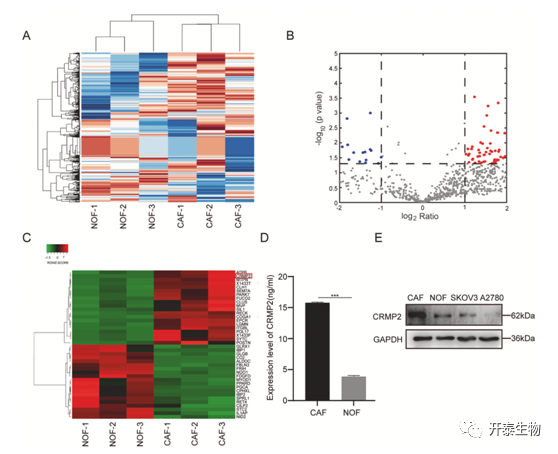
图2. 液质联用鉴定CAFs-CM 和 NOFs-CM 差异蛋白质
03

CAFs外泌的CRMP2促进卵巢癌细胞的增殖、迁移和侵袭
作者为了验证CAFs外泌的CRMP2对卵巢癌细胞的影响,将SKOV3和 A2780 细胞分别与 CAFs-CM、NOFs-CM、CAF-CM + IgG 和 CAF-CM + CRMP2 中和抗体共培养。CCK8 实验表明,相比于与NOFs-CM,CAFs-CM共培养的卵巢癌细胞增殖能力更强, 但用CRMP2-Ab处理后显着抑制细胞增殖(图3A)。侵袭和迁移实验表明,相比于与NOFs-CM,与 CAFs-CM 共培养的 SKOV3 和 A2780 细胞都表现出更强的侵袭性和迁移能力,但用CRMP2-Ab处理后削弱了CAFs-CM的促转移作用(图3B-E)。同时,在细胞培养基中添加 r-CRMP2 能够显着增强卵巢癌细胞的增殖、侵袭和迁移能力(图3F-J)。
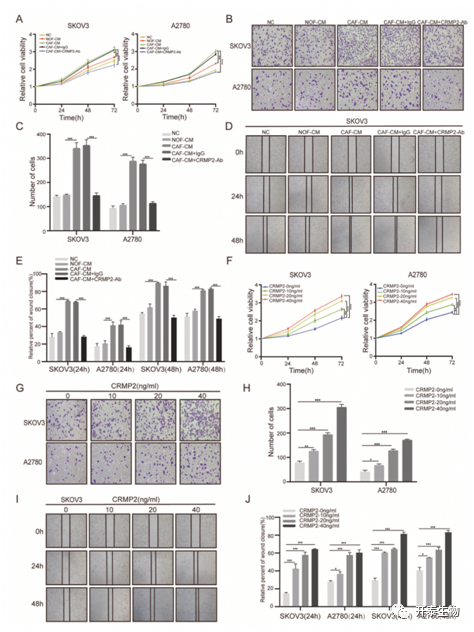
图3. CAFs外泌的CRMP2促进卵巢癌细胞的增殖、迁移和侵袭
04

CAFs外泌的CRMP2激活卵巢癌细胞HIF-1α-糖酵解信号通路
为了探究CRMP2的下游作用机制,作者用 r-CRMP2处理A2780细胞,并进行RNA测序。结果显示,与对照组相比,r-CRMP2处理组共有 1045 个基因表达上调和 1500 个基因表达下调。KEGG通路富集显示,排名前三的通路为疱疹病毒感染、HIF-1信号和Hedgehog信号通路(图4A)。近年来的研究表明糖酵解通路受HIF-1α信号通路的调节,并参与多种恶性肿瘤进展。RNA测序结果也表明,糖酵解信号通路在通路富集中排名18,并包含16个基因富集在HIF-1信号的下游,包括HK2、PFKFB3、PDK1、PGK1和VEGFA(图4A)。
接着作者通过Western-blot和 RT-qPCR对上述结果进行验证,SKOV3和 A2780 分别用CAFs-CM和r-CRMP2进行处理,结果显示,卵巢癌细胞与CAFs-CM共培养 1 天至 3 天时,CRMP2、HIF-1α、糖酵解相关酶、GLUT3、P-Akt 和 P-S6k 的蛋白水平显著上调(图4B)。同时 r-CRMP2 以剂量依赖性方式诱导上述基因表达上调(图4C)。作者为了研究CRMP2的具体作用机制,分别在 A2780 细胞中过表达,SKOV3 细胞中敲低CRMP2。实验结果表明,敲除SKOV3 细胞中的 CRMP2 显着降低了 HIF-1α 及其下游糖酵解相关酶的蛋白水平,包括HK2、PGK1、PFKFB3、PKM2、PDK1和LDHA。同时,GLUT3和VEGFA的表达均下调。相反,过表达CRMP2上调了上述蛋白的表达(图4D,E)。同时作者检测了过表达和敲除CRMP2后卵巢癌细胞的细胞外酸化率 (ECAR)。结果表明敲除CRMP2后ECAR显著降低,但过表达组ECAR增加(图4F)。耗氧率(OCR)显示出与 ECAR 相反的趋势(图4G)。综上,表明CAFs外泌的CRMP2激活卵巢癌细胞HIF-1α-糖酵解信号通路。
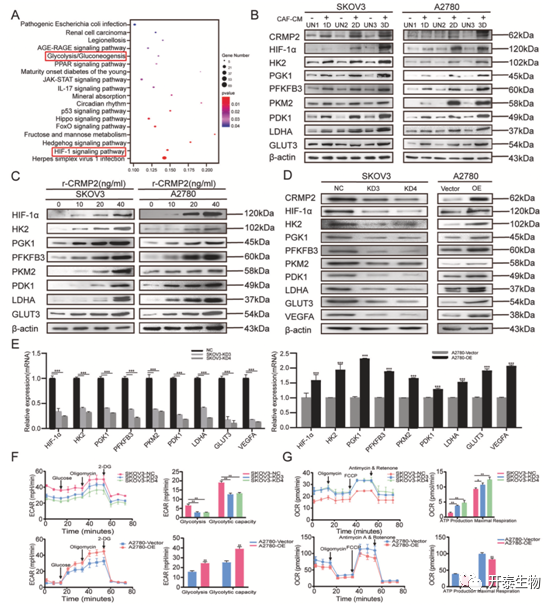
图4. CAFs外泌的CRMP2激活卵巢癌细胞HIF-1α-糖酵解信号通路
05

CAFs外泌的CRMP2 在体内促进卵巢癌生长和转移
接着作者使用BALB/c 裸鼠在体内建立异种移植和腹膜转移模型。SKOV3 分别与CAFs/NOFs 以 4:1 的比例混合进行皮下和腹腔注射。接种后第二天开始腹腔注射 IgG 和 CRMP2-Ab。实验结果表明SKOV3 与 CAFs 共注射组的肿瘤体积比NOFs 与SKOV3共注射组以及SKOV3单注射组大1-2 倍 (图5A, B )。有趣的是,注射CRMP2-Ab 明显抑制了肿瘤的生长(图5A,B,C)。腹膜内转移模型结果显示,SKOV3与CAFs共注射组的肿瘤重量最大,同时,CRMP2-Ab 给药组显着降低了肿瘤重量和转移灶的数量(图5D-F)。免疫组化(IHC)结果显示,CAFs 与 SKOV3 同时增殖,CRMP2-Ab 能有效减弱 CRMP2 和 HIF-1α 的表达(图5G)。上述结果表明CAFs外泌的CRMP2 在体内促进卵巢癌生长和转移。
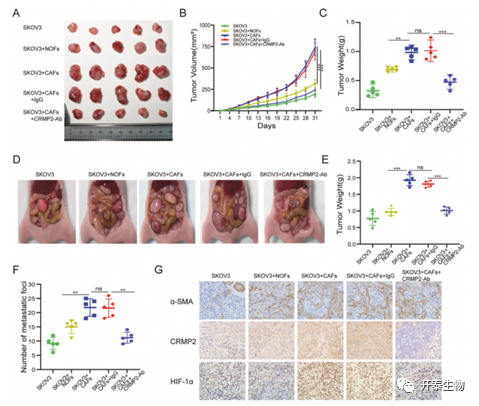
结果5. CAFs外泌的CRMP2在体内促进卵巢癌生长和转移
06

CRMP2导致卵巢癌患者的不良预后
接着,作者想去探究CRMP2与卵巢癌患者预后之间的关系。免疫组化结果显示,与正常组织相比,α-SMA 和CRMP2 在肿瘤组织中高表达(图6A)。组织芯片结果表明,α-SMA 和 CRMP2 在转移性病例中高表达(图6B)。CRMP2与肿瘤转移呈正相关,与生存率呈负相关(P = 0.0083)(图6C,E)。同时采用Kaplan-Meier法进一步验证了 CRMP2 的表达与总生存期、无进展生存期和进展后生存期的相关性(图6D)。通过免疫荧光实验检测α-SMA 和 CRMP2 在肿瘤和癌旁组织中的共定位,结果表明它们仅在肿瘤基质组织中共表达,同时,正常组织中无法检测到共表达信号(图6F)。此外,作者将患者分为四组:CRMP2-/α-SMA-、CRMP2+/α-SMA-、CRMP2-/α-SMA+ 和 CRMP2+/α-SMA+, CRMP2+/α-SMA+与肿瘤转移和预后不良呈正相关(P =0.0437)(图6G, H)。结果表明,肿瘤基质中 CAFs 的 CRMP2导致卵巢癌患者的不良预后。

图6. CRMP2导致卵巢癌患者的不良预后
+ + + + + + + + + + +
结 论
在本研究中,作者发现CAFs-CM共培养卵巢癌细胞能明显效促进癌细胞增殖、迁移和侵袭。通过质谱技术发现了CAFs-CM和NOFs-CM中的关键差异蛋白CRMP2。接着在体外利用r-CRMP2证明了该蛋白能明显促进卵巢癌细胞增殖、迁移和侵袭。并通过RAN测序,证明CAFs外泌的CRMP2激活卵巢癌细胞HIF-1α-糖酵解信号通路。同时作者在体内也证明了CAFs外泌的CRMP2 在体内促进卵巢癌生长和转移。通过组织芯片证明了CRMP2导致卵巢癌患者的不良预后。本文从肿瘤微环境的角度出发,为卵巢癌患者提供了潜在的治疗靶点。
+ + + + +



 English
English

