文献解读|Signal Transduct Target Ther(39.3):短期禁食后小鼠大脑整体代谢特征动态的代谢组图谱
✦ +
+
论文ID
原名:A metabolome atlas of mouse brain on the global metabolic signature dynamics following short-term fasting
译名:短期禁食后小鼠大脑整体代谢特征动态的代谢组图谱
期刊:Signal Transduction and Targeted Therapy
影响因子:39.3
发表时间:2023.09.08
DOI号:10.1038/s41392-023-01552-y
背 景
热量限制 (CR) 或禁食是预防慢性代谢紊乱、改善自身免疫性疾病和延缓衰老的最有效的非药物干预措施之一。CR包括间歇性的反复的短期禁食(STF),不同形式的 CR 对健康有益,包括减轻体重、改善代谢综合征和心血管疾病以及延长寿命,但是CR 改善健康、特别是大脑健康的机制仍不完全清楚。
实验设计
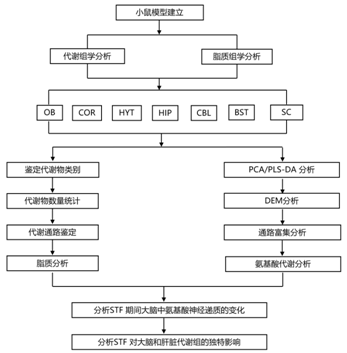
结 果
01
小鼠的大脑代谢组学分析
为了分析不同区域的大脑代谢组图谱并研究喂养方案对整体代谢重塑的影响,研究者团队对对不同禁食时间(3、6、12和24小时)或自由喂养的C57BL/6雌性小鼠的的七个大脑区域进行了基于气相色谱-质谱 (GC-MS) 的代谢组学和基于 LC-MS 的脂质组学分析(图1a)。这七个解剖学定义的区域包括嗅球(OB)、额叶皮质(COR)、下丘脑(HYT)、海马(HIP)、小脑(CBL)、脑干(BST)和脊髓(SC)。
在GC-MS分析中,他们利用NIST11文库和内部数据库中的保留时间、保留指数和质谱信息,人工整合了144个离子特征的色谱峰,并对其中126个离子特征进行了明确的结构。注释根据HMDB分类方案,将这些代谢物定义为14个化学类,并鉴定每种化学类别中代谢物的数量和百分比(图1b-c)。使用MetaboAnalyst 5.0将这些代谢物映射到54个代谢通路中(图1d)。
对于脂质组学分析,使用 MS-DIAL(版本 4.93)软件识别了正电离模式下的 801 个脂质离子特征和负电离模式下的 431 个脂质离子特征。去除通过两种电离模式重复检测到的脂质以及低信噪比和高变异系数的脂质后,保留了 22 个脂质类别的 671 种独特脂质(图1e-f)。
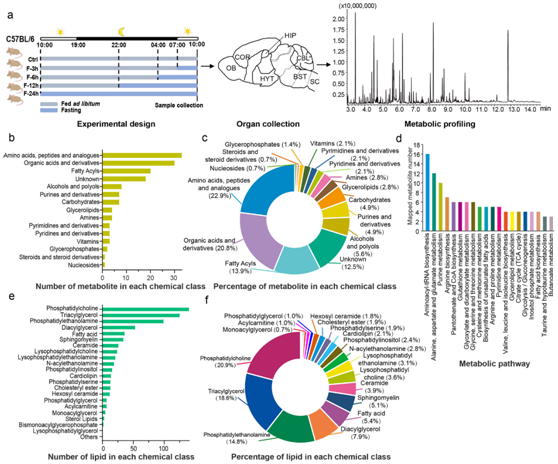
图1. 小鼠脑代谢组数据集概述。
(a) 获取小鼠大脑代谢组数据集的实验设计。(b) 使用 HMDB 分类方案 (GC-MS) 检测到的每个化学类别中代谢物的数量。(c) GC-MS 检测到的代谢物中每种化学类别的百分比。 (d) Top-20 在 GC-MS 中绘制了注释代谢物的代谢通路。 (e) 每个化学类别中检测到的脂质数。 (f) 每种脂质类别的百分比。
02
不同大脑区域的代谢差异
由于区域专门化是大脑结构和功能的标志,因此他们研究了不同大脑区域代谢组的差异。首先,对所有大脑区域中鉴定的代谢物进行了主成分分析(PCA),发现主要根据区域类型进行分离(图2a),将七个大脑区域的代谢特征分为五个聚类。一个聚类由BST和SC组成,它们在细胞成分上含有更多的轴突,而不是神经元细胞体和树突。一个聚类由 HIP 和 COR 组成,富含神经元细胞体和树突,但缺乏轴突。根据 PCA 分析,其余三个区域(OB、CBL 和 HYT)表现出三种不同的代谢特征。对自由进食的小鼠样本进行PCA分析也产生了类似的样本聚类(图2b)。
为了鉴定不同大脑区域之间的差异表达代谢物 (DEM),他们进行了单向方差分析 (ANOVA),并在七个大脑区域中鉴定了 538 个 DEM。与 PCA 结果一致,这些DEM 的变化分为五种模式(图2c)。值得注意的是,他们没有发现大脑区域的葡萄糖、果糖或乳酸水平有任何差异。为了更好地可视化代谢通路的差异,他们使用每个大脑区域中高表达或低表达的代谢物进行了通路富集分析(图2d)。例如,OB中富集程度最高的代谢物参与牛磺酸和亚牛磺酸代谢以及谷胱甘肽代谢,而富集程度较低的代谢物涉及甘氨酸、丝氨酸和苏氨酸代谢以及烟酸和烟酰胺代谢。然而,在HYT中,丰度最高的代谢物涉及β-丙氨酸代谢和赖氨酸降解通路,而牛磺酸和亚牛磺酸代谢以及谷胱甘肽代谢通路中的代谢物表达水平较低。此外,不同的大脑区域表现出不同的脂质成分。层次聚类显示磷脂酰乙醇胺 (PE) O-/己糖基神经酰胺 (HexCer) 在 SC 和 BST 中富集。相反,COR 和 HIP 脑区显示出截然相反的脂质成分。
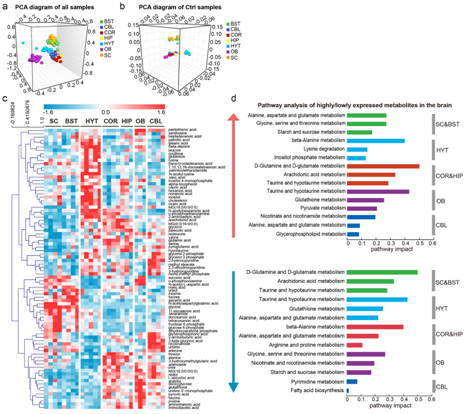
图2. 不同大脑区域的代谢特征。
(a) 自由进食或STF小鼠脑代谢组PCA三维图。 (b) 自由进食的小鼠大脑代谢组的PCA三维图。 (c) 自由进食的小鼠七个脑区差异表达代谢物的热图。(d) 不同脑区高表达和低表达代谢物的通路分析。
03
STF对不同脑区代谢组的影响
接下来,他们关注 STF 对大脑代谢组的时空影响,进行了偏最小二乘判别分析 (PLS-DA) 来鉴定不同禁食时期后代谢产物的显著变化,发现大脑对STF的代谢反应是区域依赖的。通过计算STF在各脑区诱导的DEM数量,他们发现SC、OB和HIP中的代谢物成分受影响最大,其次是CBL、COR、HYT和BST(图3b)。他们的数据还表明,STF 对大脑代谢组的影响随着 SC、OB、CBL、HYT 和 BST 禁食时间的延长而增强相反,在禁食6小时后观察到对COR和HIP代谢组的最为明显(图3c)SC和BST之间以及COR和HIP之间STF持续时间的影响相似。在STF期间,SC和HIP比BST和COR观察到更深刻的代谢变化(图3d-e)。除了仅在 SC、 COR、BST或 HIP中鉴定的 DEM 之外,在 STF 期间在 SC 和 BST(或COR 和 HIP)中鉴定的 DEM 也发现了类似结果(图 3f-g)。
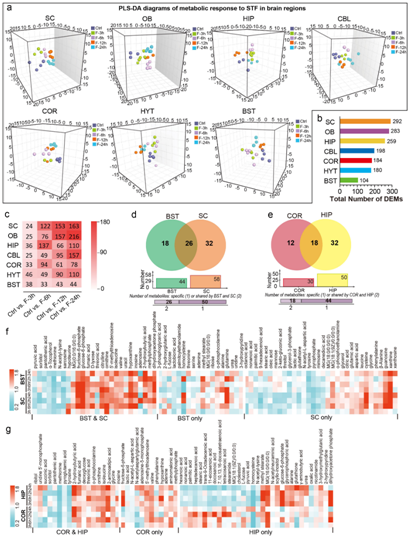
图3. STF 对多个脑区代谢组的时空影响。
(a) SC中不同时期STF代谢反应的PLS-DA三维图。 (b) 七个脑区 STF 上的 DEM 数量。(c) 7个脑区在STF不同时段后的DEM数量。(d-e) 维恩图显示DEM 数量的。(f-g) DEM 热图。
04
脂质代谢重塑
STF 引起所有大脑区域甘油脂水平的显著变化。STF后二酰基甘油 (DG)、单酰基甘油(MG) 和脂肪酸 (FA) 的丰度增加,而总三酰基甘油 (TG) 水平下降(图4a)。除 DG 外,MG、FA 和 TG 中的每种脂质都遵循相同的模式。STF 还影响大脑中鞘脂(Cer 和 SM)和磷脂的水平。
除了脂质代谢外,STF 期间还观察到氨基酸的整体变化(图4b-e)。通路富集分析表明,缬氨酸、亮氨酸和异亮氨酸(支链氨基酸,BCAA)和苯丙氨酸、酪氨酸和色氨酸(芳香族氨基酸,ArAA)的生物合成,以及精氨酸、丙氨酸、天冬氨酸和谷氨酸代谢,这些都是与STF相关的最具代表性的通路(图4e)。
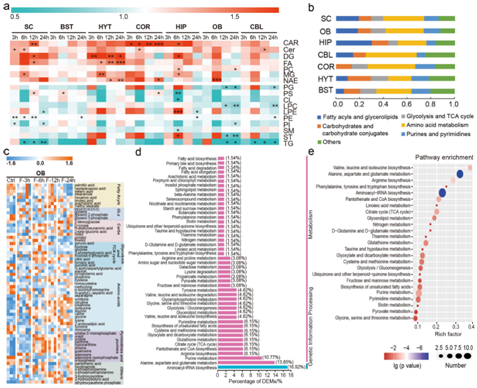
图4. 对大脑中禁食反应的差异表达脂质和代谢物进行可视化和通路分析。
(a) STF 后七个大脑区域中每种脂质类别总丰度的变化。(b) GC-MS在7个脑区检测到的差异代谢物。 (c) STF后OB的DEM的热图。(d) 在OB不同代谢通路中的DEM百分比。 (e) OB中与STF相关的前25条代谢通路。
05
氨基酸代谢的重塑
他们注意到七个大脑区域的支链氨基酸水平在整体范围内升高。相反,在STF期间观察到酪氨酸(SC、COR、HIP、OB和CBL)水平的降低和苯丙氨酸(SC、COR)(两者都是ArAA)水平的升(图5a)。此外,禁食期间 SC、BST、COR、HIP 和 OB 中 BCAA/ArAA 的比率显著增加(图5b)。考虑到禁食3小时对这些代谢物的水平有轻微影响,他们将样本分为两个阶段(阶段I:Ctrl和F-3 h;阶段II:F-6 h、F-12 h和F -24h)研究不同禁食状态下代谢物之间的相关性。
在 COR 中,长时间禁食后酪氨酸和异亮氨酸水平之间存在显著的负相关(图5c-d)。然而,较长禁食时间后,苯丙氨酸/天冬氨酸 (Asp)-异亮氨酸/亮氨酸的正相关性发生破坏(图5d)。
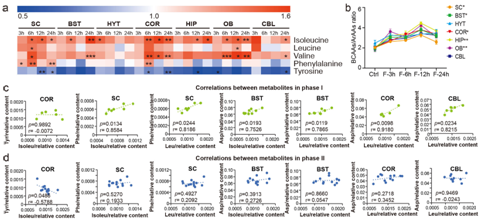
图5. STF 期间大脑中 BCAA 和 ArAA 的变化。
(a) 不同禁食时间后七个大脑区域的 BCAA 和 ArAA 水平热图。(b) STF 后七个脑区 BCAA/ArAA 比率的变化。 (c) I 期代谢物之间的相关性。(d) II 期代谢物之间的相关性。
BCAA可以为谷氨酸 (Glu) 和GABA的合成提供氮源,两者在STF期间均增加(图6a)。禁食后N-乙酰天冬氨酰谷氨酸(NAAG、COR和OB)和N-乙酰-L-天冬氨酸(NAA、SC、COR和OB)的水平降低(图6a)。此外,SC中NAA/Asp比率下降,表明禁食期间催化Asp合成NAA的酶活性可能降低(图6b)。OB 中 NAAG/NAA 和 NAAG/Glu 比率也降低(图6c-d)。
STF后OB中编码NAA转化为NAAG的酶的Rimkla和Rimklb的mRNA表达显著降低,这可能表明禁食期间NAAG的合成受到抑制。空腹6 h后,HYT中NAAG/Glu比值升高,这可能与HYT中NAA升高有关(图6e)。此外,研究结果表明,较长的禁食时间可以诱导NAAG-Asp在大脑中呈正相关,但NAAG-Asp在大脑中呈负相关(图6f-g)。
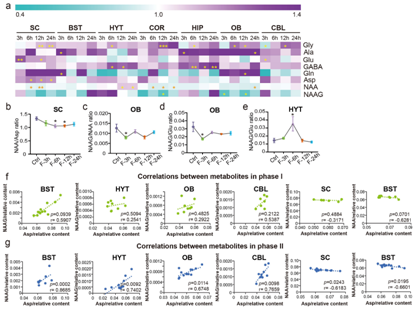
图6. STF 期间大脑中氨基酸神经递质的变化。
(a) 七个脑区 STF 差异表达氨基酸神经递质的热图。 (b) SC 中 STF 后 NAA/Asp 比率的变化。 (c-d) OB 中 STF 后 NAAG/NAA 和 NAAG/Glu 比率的变化。 (e) HYT 中 STF 后 NAAG/Glu 比率的变化。 (f) I期代谢产物的相关性。 (g) II期代谢产物的相关性。
06
STF 对大脑和肝脏代谢组的独特影响
STF 诱导脂质和氨基酸代谢的整体重塑,特别是在 BCAA、ArAA、神经递质、蛋氨酸和瓜氨酸-NO 循环方面,以促进大脑在有限营养条件下的适应性反应。与大脑相反,STF 诱导肝脏能量代谢的显著重塑。在禁食状态下,肝脏中发现 FA 氧化增强,糖酵解和 TCA 循环下降(图7)。
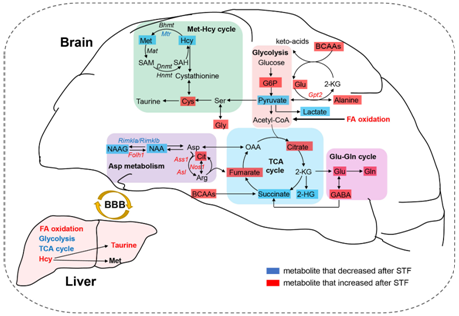
图7. STF 后大脑和肝脏的代谢重塑。
+ + + + + + + + + + +
结 论
本项研究应用基于气相色谱-质谱法的代谢组学和脂质组学,涵盖了 797 种结构注释的代谢物,研究了禁食(3、6、12 和 24 小时)和自由进食条件下小鼠七个脑区的代谢组。使用多变量和单变量统计技术,生成了短期禁食(STF)后多个大脑区域的整体代谢特征动态的小鼠大脑代谢组图谱,确定了大脑区域之间显著的代谢差异以及 STF 触发的区域依赖性代谢重塑。他们发现 STF 会引起三酰甘油降解和脂肪分解,以补偿禁食条件下的能量需求。此外,还观察到氨基酸谱的变化,这可能在调节 STF 的能量代谢、神经递质信号传导以及抗炎和抗氧化方面发挥着至关重要的作用。此外,这项研究首次表明STF 会引发N-酰基乙醇胺(一类神经保护脂质,存在于大脑和肝脏中)的显著升高。这些发现为 CR 的分子基础和机制提供了新的理论依据。
+ + + + +



 English
English


