文献解读|Nat Commun(16.6):在大规模伤口再生过程中利用空间锚追踪生物材料周围的免疫细胞
✦ +
+
论文ID
原名:Tracing immune cells around biomaterials with spatial anchors during large-scale wound regeneration
译名:在大规模伤口再生过程中利用空间锚追踪生物材料周围的免疫细胞
期刊:Nature Communications
影响因子:16.6
发表时间:2023.09.26
DOI号:10.1038/s41467-023-41608-9
背 景
严重皮肤损伤后,产生的疤痕通常含有致密的细胞外基质(ECM)纤维,缺乏毛囊(HF)和皮脂腺(SG),缺乏感觉和内分泌功能以及正常皮肤的灵活性。因此,迫切需要探索刺激皮肤修复中高频再生的基本机制。本项研究开发了一种使用可生物降解的对齐细胞外基质支架进行大面积伤口再生的方法。
实验设计
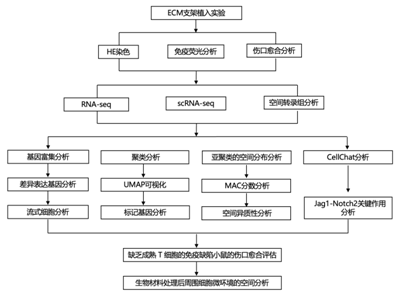
结 果
01
通过激活适应性免疫系统增强支架植入伤口的心力衰竭新生
研究者团队将ECM支架放置在ECM_LW(用ECM支架处理大伤口)组的大伤口下方,而Ctrl_LW(用盐水处理大伤口)组不接受生物材料处理(图1a-b)。啮齿动物模型中的伤口愈合主要依靠肉膜的收缩来闭合伤口,而在人类中,上皮再形成和肉芽组织形成发挥着更大的作用。他们创建了一个夹板伤口切除的小鼠模型,可以限制肉膜的收缩,而无夹板组则不使用硅胶夹板进行处理。在夹板小鼠中观察到伤口闭合率降低以及肉芽形成和新生HF 增加。为了最大限度地减少啮齿动物的伤口收缩并模拟皮肤紧绷的人类伤口愈合过程,他们选择夹板伤口愈合模型进行进一步评估。ECM_LW组在术后第7天(POD7)的伤口覆盖更快(图 1c-d),并且ECM_LW组在POD 7和POD 14上皮间隙宽度也更小(图 1e-f)。
在 Ctrl_LW 组中,自手术后第21天(POD 21)以来,伤口中心存在有限的 HF 新生。相比之下,他们观察到 ECM_LW 组重现了正常皮肤结构,具有同等数量的成熟 HF(图 1e-h)。ECM支架诱导的新生HF模仿胚胎毛囊发育模式(图 1e-g),在POD7上的毛胚(HG)中具有高KRT17(绿色)和真皮凝结物(Dc)中的TWIST2(红色)。形态发生后,ECM_LW 组中的新生 HF 含有表达 Ki67(红色)和皮脂腺(SCD1/绿色)的增殖上皮细胞。他们观察到 POD14 上的降解片段,并且 POD28 上没有可见的颗粒残留(图 1e)。该膜优异的生物相容性和可降解性可以在进一步的临床应用中避免免疫排斥和二次手术的风险。
为了探索潜在的机制,他们对 POD 7 收获的两组进行了bulk RNA测序(bulk RNA-seq)。基因富集分析显示Ctrl_LW组上调基因表明了一种准备激发先天免疫反应的状态(图 1i)。2 型细胞因子如白细胞介素 4 受体 α (IL-4Rα) 可以激活抗炎巨噬细胞并导致疤痕形成中胶原纤维的交联。Ctrl_LW组中2型骨髓免疫细胞的积累可能是细胞外基质组织过多的原因。相反,ECM的上调基因揭示了ECM_LW组中Wnt信号通路和Hedgehog信号通路驱动的毛囊发育和间充质形态发生等基因的富集(图1i)。流式细胞分析证实早期植入的生物材料周围T细胞(CD3+)浸润增加(图1j)。
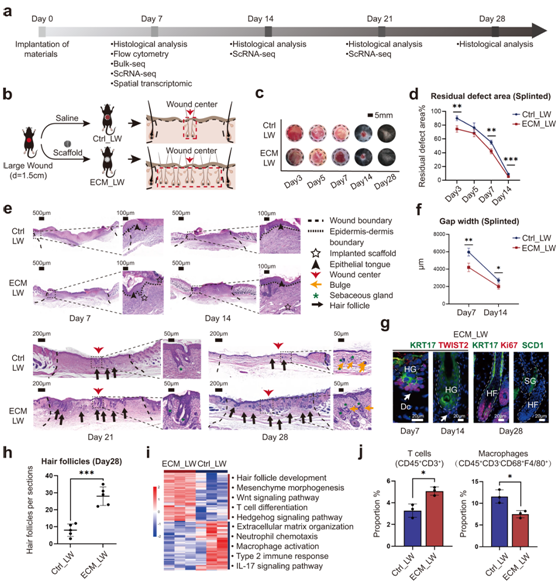
图1. ECM 支架治疗伤口愈合过程的评估。
(a) 用于评估大规模伤口愈合的实验流程。 (b) 皮肤夹板切除伤口模型的手术过程。(c) 3、5、7、14 和 28 天时的残余伤口面积。(d) 残留伤口的分析。 (e) 两组在第 7、14、21 和 28 天时的代表性 H&E 图像。(f) 新上皮间隙宽度的定量评估。(g) ECM_LW 组内新生 HF 的代表性 IF 图像。 (h) POD28 新生 HF 的组织学定量。(i) 对 POD7 上的 ECM_LW 与 Ctrl_LW 小鼠进行bulk RNA-seq。 (j) 过流式细胞分析测定 POD7 伤口环境中T 细胞 (CD45+CD3+) 和巨噬细胞 (CD45+CD3-F4/80+ CD68+) 细胞群的比例。
02
生物材料组织微环境的单细胞图谱
为了探索伤口愈合过程中单细胞的空间特征,他们应用空间转录组(ST)和单细胞转录组分析(scRNA-seq)来比较两组之间的空间基因表达谱(图 2a)。首先,他们选择了定义为角质形成细胞的主要聚类,并对它们进行第二轮无监督聚类(图 2b)。HF新生是通过上皮HFSC或毛囊祖细胞(HFP)迁移到创面中心并形成基板激活乳头状成纤维细胞(PF)命运特化进入真皮凝析液(Dc)而发生的。他们发现在术后第7、14和21天,ECM_LW组中Krt25+Krt28+Krt17+毛囊祖细胞1 (HFP1)和Crip1+Lrig1+Lgr5+毛囊干细胞1 (HFSC1)的比例较高(图2b),这可能为后续的新生HF重建提供了足够的条件。
成纤维细胞是皮肤真皮层中的主要间充质细胞,不同的成纤维细胞亚群占据不同的位置,表现出相当大的功能多样性。一般来说,真皮成纤维细胞来自两个不同的谱系: (1) 上层谱系:乳头状成纤维细胞 (PF),接触表皮并产生 HF 的真皮成分;(2)下层谱系:合成大部分ECM蛋白的网状成纤维细胞(RF)和提供皮下组织前脂肪细胞祖细胞的脂肪成纤维细胞(LF)。此外,皮肤还含有特殊的成纤维细胞样细胞,包括真皮乳头(DP)和真皮凝结细胞(Dc),它们与通用成纤维细胞具有独特的转录特征。他们根据公开发布的定义标记定义了五个成纤维细胞和两个成纤维细胞样细胞亚群(图 2c)。在胚胎期HF形态中,Dc作为生态位信号刺激上皮生长,从而促进HF形态的发生。由于ECM_LW组中真皮凝结细胞1(Dc1)和乳头状成纤维细胞1(PF1)在术后第7天和第14天的比例显著较高(图2c),这可能也为生物材料植入组后续HF的形成提供了足够的间充质成分。
单核细胞和巨噬细胞(MAC)在生物材料相关的FBR中至关重要,通过调节成纤维细胞活化来协调组织修复。他们确定了MAC的三个亚群,包括Cd14+Ly6c2+单核细胞1 (Mono1)、Ptgs2+Nos2+促炎巨噬细胞1 (PIM1)和Mrc1+ C1qa+抗炎巨噬细胞1 (AIM1)(图2d)。富集分析显示,单核细胞可由多种警报素激活产生促炎(经典的/ M1样)巨噬细胞,导致促炎细胞因子包括TNF和IL-1β的表达。在IL-4和IL-13的诱导下,抗炎细胞亚群(替代性激活/ M2样)是2型免疫应答的主要效应因子,通过TGF-β和各种基质重塑介质的表达在异常的胶原沉积中发挥重要作用。值得注意的是,AIM1富集与胶原形成相关的基因,是ECM_LW组中唯一一个在POD 7、14和21时持续下降的亚聚类,这表明支架可能在减少2型巨噬细胞浸润中起作用。
T细胞亚群可分为Cd8b1+细胞毒性T细胞1 (CTL1)、Tyrobp+Nkg7+Xcl+自然杀伤细胞1 (NKT1)、Il17a+Il17f+辅助性T细胞171 (Th171)、Foxp3+Gata3+调节性T细胞1 (Treg1)、Trdv4+Cd7+ γδT细胞1 (Tγδ1)和Gata3+Il4+辅助性T细胞21 (Th21) 6个亚群。在POD7、14和21时,Th21细胞群体中更多的细胞来自Ctrl_LW样本,而更多的Treg1来自ECM_LW样本。Il4+ Il13+ Th2细胞是与2型免疫应答相关的效应细胞之一,可以促进2型AIM的分化(图2e)。
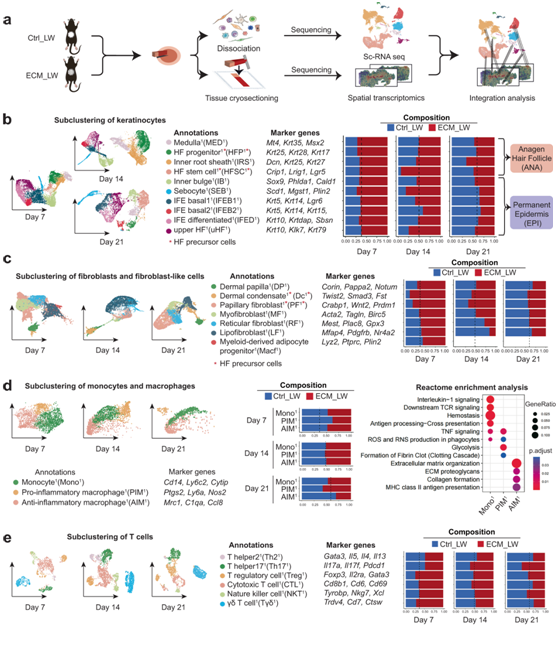
图2. 生物材料介导的微环境的单细胞图谱。
(a) 用于从 POD 7、14 和 21 上的大面积切除伤口生成 scRNA-seq 和空间转录组学数据的示意图。 (b) 角质形成细胞的亚聚类显示来自生长期毛囊的四个子集和来自永久表皮的六个子集。(c) 成纤维细胞亚聚类显示两个成纤维细胞样亚群和五个成纤维细胞亚群。(d) 单核细胞/巨噬细胞的亚聚类显示三个子集。(e) T 细胞亚聚类显示六个子集。
03
发现生物材料周围的空间异质性
为了探索支架植入伤口中细胞异质性的空间特征,他们应用 ST 来分析空间基因表达谱。在 ST 切片中鉴定了解剖结构(图 3a)。基于ST的基因富集分析(图 3b),Ctrl_LW组富集了细胞外基质组织、胶原蛋白生物合成过程以及抗炎(Mrc1和Clec10a)和氧化磷酸化过程(Cox6a2和Actn3)相关的基因(图 3c),表明Ctrl_LW组中典型的AIM驱动的纤维化趋势。相比之下,ECM_LW 样本富含与糖酵解过程相关的代谢特征(Eno1、Gapdh)。此外,ECM_LW组表达包括与T细胞活化和α-β T细胞增殖调节相关的基因集,表明生物材料驱动的微环境中存在适应性免疫优势状态(图3b-c)。空间特征图显示角质形成细胞在植入的生物材料周围“爬行”(图 3d)。有趣的是,来自不同谱系的成纤维细胞在Ctrl_LW组中表现出不同的空间分布模式。上层谱系PF1(HF相关)局限于肉芽组织上层,而下层谱系RF1(纤维反应相关)在下层占主导地位(图3e)。相反,在ECM_LW组中,PF1(HF相关)在生物材料周围的分布扩大(图3e),并且ECM_LW显示出较高的PF1表达水平(图3f),表明ECM样本具有促进再生的潜力。此外,在ECM_LW组的ST谱图中,他们确定了由新表皮中的HFP和真皮下的Dc聚集组成的毛芽的初始结构(图3g),这在空间基因表达水平上突出了ECM_LW组中早期HF形成的特征(图3h)。为了评估支架诱导的免疫微环境的空间特征,他们以类似的方式整合了免疫细胞亚群和ST切片,ECM表显出减少AIM1募集的能力(图3i-j)。F4/80和CD206的IF染色证实了ECM_LW组中AIM1的减少(图3k),这可能减轻了随后的成纤维细胞活化和胶原沉积。相反,他们注意到T细胞的明显聚集(图3l),尤其是Treg1(图3m),与生物材料周围的PF1(HF相关)共定位。免疫荧光(IF)证实Treg1的募集可能有助于抑制AIM1激活的2型免疫(图3n)。

图3. 空间锚点追踪 ECM 支架周围的细胞分布。
(a) 无监督聚类表明了样本的解剖结构。 (b) ECM_LW和Ctrl_LW组之间的基因富集分析。(c) 小提琴图,显示 ST 谱的 Ctrl_LW 和 ECM_LW 样本的上调基因。 (d) 空间特征图,显示组织切片中IFEB 1和 IFED 1亚聚类的分布。 (e) 空间特征图显示组织切片中PF 1和 RF 1亚聚类的分布。(f) 源自每个亚聚类的 scRNA-seq 数据(sc-FIB 分数)的各个点的 FIB 分数小提琴图。 (g) 空间特征图突出显示了迁移新表皮中Krt28 +毛囊祖细胞和Twist2 +真皮凝结物的表达。 (h) 插图显示了生物材料介导的愈合过程中的上皮化以及新生的HF。 (i) 空间特征图显示组织切片中 MAC 亚聚类的分布。 (j) 从每个亚聚类的 scRNA-seq 数据(sc-MAC 分数)得出的各个点的 MAC 分数小提琴图。(k) 染色 AIM 1 (F4/80+CD206+)的代表性 IF 图像。(l) 空间特征图和小提琴图显示TC 1在组织切片中的分布和表达水平。(m) 空间特征图和小提琴图显示 Treg 1在组织切片中的分布和表达水平。(n) 染色 Treg 1 (FOXP3)的代表性 IF 图像。
04
预测生物材料周围空间共定位细胞群之间的关键信号传导模式
基于多模式分析,他们观察到ECM_LW组中T细胞(图 4a)和HF前体细胞比例较高,这意味着它们之间存在潜在的细胞通讯。接下来,他们应用 CellChat 来预测 ECM_LW 和 Ctrl_LW 组之间免疫细胞和皮肤细胞的细胞间通讯模式。圆形图显示了Ctrl_LW和ECM_LW组中配体-受体的总体相互作用数(图 4b)。在两组中都观察到成纤维细胞和免疫细胞之间存在密集的通讯网络。Ctrl_LW 组中更丰富的相互作用似乎是从 RF 1、LF 1、MF 1和 Macf 1亚群发出的,表明真皮中纤维化成纤维细胞相互作用信号占主导地位。相比之下,ECM_LW 组中更丰富的相互作用是从 Dc 1和 PF 1亚群发出的,表明生物材料诱导的促再生信号。由于AIM 1可能是导致组织纤维化的主要免疫细胞,因此他们比较了AIM 1和成纤维细胞亚群之间的特定相互作用(图 4c)。在 Ctrl_LW 组中,AIM1通过Tgfb1–(Tgfbr2+Acvr1b)结合与纤维化成纤维细胞的相互作用更加明显,这对靶细胞发挥潜在的促纤维化作用。值得注意的是,他们发现Treg1通过Jag1-Notch2结合与PIM1和Mono1有更显著的相互作用。据报道,Notch信号在巨噬细胞极化中起重要作用。Notch信号选择性抑制剂显著抑制M1样巨噬细胞,促进M2样巨噬细胞。与单细胞水平的基因表达谱一致,他们证实了ST谱中潜在的Jag1-Notch2通信(图4e)。植入生物材料周围观察到Notch2的显著表达,表明Treg在支架介导的微环境中起抑制作用。
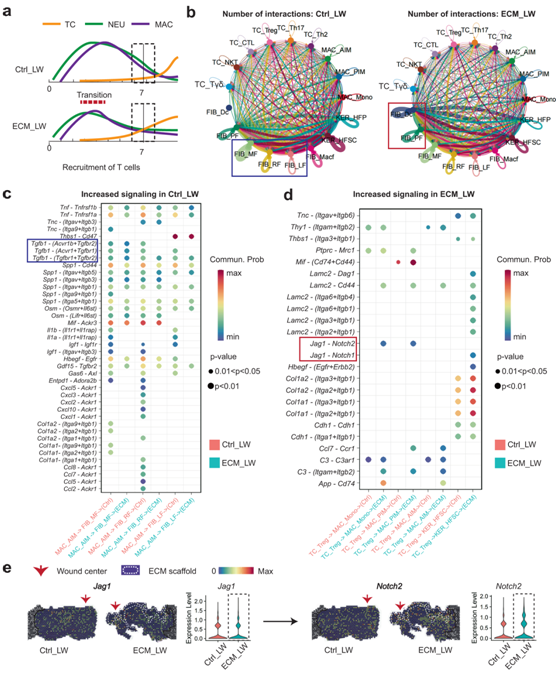
图4. 免疫细胞和皮肤细胞之间的细胞通讯景观。
(a) 时间线示意图,突出显示了 Ctrl_LW(上)和 ECM_LW(下)组中先天性和适应性免疫系统招募免疫细胞的情况。 (b) 使用 CellChat 比较 Ctrl_LW 和 ECM_LW 之间免疫细胞和皮肤细胞的总体细胞间相互作用数量。(c) Ctrl_LW 组中配体-受体对在 AIM 1和成纤维细胞(MF1、RF1和LF 1)之间的特异性上调。(d) ECM_LW组中配体-受体对在Treg1、MAC(Mono1、PIM1、AIM1)和HFSC 1之间的特异性上调。(e) 空间特征图和相应的小提琴图显示了Notch信号通路中配体和同源受体的表达水平。
05
ECM支架介导的皮肤再生需要适应性免疫系统
为了确定适应性免疫系统在心力衰竭再生中的作用,他们将ECM支架放置在缺乏成熟T淋巴细胞的免疫缺陷C57Bl/6 (B6.129-Rag2tm1)小鼠的背部皮肤中(图5a)。他们注意到,Rag2−/−小鼠在POD7上的伤口愈合速度延迟(图5b-d),并且在第28天时HF的新生很少(图5b-e)。
接下来,他们利用scRNA-seq进一步探讨了WT和Rag2−/−小鼠细胞组成和空间基因表达的差异。根据HF再生结果,Rag2−/−组降低了PF2(与HF发展相关)的比例,但提高了RF2(与胶原沉积相关)和LF2(与胶原沉积和血管生成相关)的数量(图5f)。MAC 的亚聚类产生了三个子集,包括 PIM2、AIM2和 Mono2(图 5g)。Rag2−/−显示AIM2、PIM2的聚集程度高,其中AIM 2所占比例最高,T细胞的亚聚类产生七个亚群(图 5h)。Rag2−/−组除NKT2(与自然杀伤细胞介导的细胞毒性相关)和初始Th22外,其他T细胞亚群比例均较低,表明Rag2−/−组的适应性免疫系统功能失调。抑制Treg2的缺失可能是2型AIM2积累和纤维化RF2胶原沉积不受控制的原因。
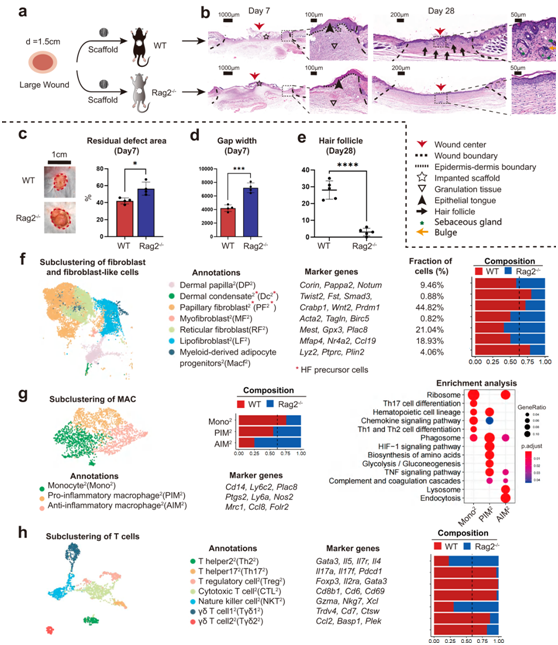
图5. 缺乏成熟 T 细胞的免疫缺陷小鼠的伤口愈合评估。
(a) 评估 WT 和 Rag2 −/−小鼠中 ECM 支架介导的大面积伤口愈合的手术过程。(b) WT 和 Rag2 −/−小鼠在第 7 天和第 28 天伤口愈合的代表性组织学图像。 (c) POD 7 上的残余缺陷面积。(d) 间隙宽度的半定量评估。(e) 新生的HF 的组织学定量。 (f) 成纤维细胞和成纤维细胞样细胞的亚聚类显示两个成纤维细胞样亚群和五个成纤维细胞亚群。列出了成纤维细胞亚群的标记基因。(g) 单核细胞/巨噬细胞亚聚类显示三个子集。列出了每个子集的标记基因、组成和富集分析。 (h) T 细胞亚聚类显示七个子集。列出了每个子集的标记基因和组成。
为了探索免疫缺陷小鼠细胞异质性的空间特征,他们还应用ST分析了空间基因表达谱。在ST切片上可以识别解剖结构(图6a)。基于ST基因富集分析,Rag2−/−样品显示毛囊形态发生基因表达发生下调,但胶原纤维组织相关基因表达发生上调(图6b)。与WT样本相比,PF2(HF相关)的分布和表达水平降低(图6c),相应的标记基因Crabp1的IF染色验证了这一点(图6d)。相比之下,Mest +RF2的分布和表达水平显著增加(图6e-f),与Rag2−/−组的愈合结果一致。在Rag2−/−样品中,AIM2在生物材料周围的聚集更为明显(图6g,-h),这可能是Treg2缺失的原因(图6i-j)。
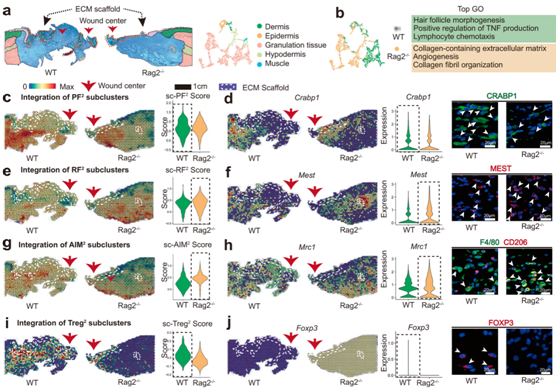
图6. 免疫缺陷小鼠生物材料周围细胞微环境的空间图谱。
(a) 每个样本的解剖结构。 (b) WT和Rag2 -/-组之间的基因富集分析。 (c) 空间特征图和小提琴图显示组织切片中整合的PF 2亚聚类的分布和表达水平。(d) 空间特征图和小提琴图显示组织切片中Crabp1 (PF 2的标记基因)的分布和表达水平。(e) 空间特征图和小提琴图显示组织切片中集成 RF 2亚聚类的分布和表达水平。 (f) 空间特征图和小提琴图显示组织切片中Mest (RF 2的标记基因)的分布和表达水平。(g) 空间特征图和小提琴图显示组织切片中整合的 AIM 2亚聚类的分布和表达水平。(h) 空间特征图和小提琴图显示Mrc1 (AIM 2的标记基因)在组织切片中的分布和表达水平。(i) 空间特征图和小提琴图显示组织切片中整合的 Treg 2亚聚类的分布和表达水平。 (j) 空间特征图和小提琴图显示组织切片中Foxp3 (Treg 2的标记基因)的分布和表达水平。
06
无论伤口大小如何,该生物材料都能促进高频再生
为了检测用该生物材料治疗的小伤口和大伤口之间伤口愈合的差异,他们用植入生物材料的小全层伤口重复了实验(图7a-b)。与ECM_LW组一致,植入小伤口(ECM_SW)的支架没有引发明显的FBR纤维囊并且具有快速的降解速度(图7c)。ECM_SW组织的组织学切片也显示出增强的HF重建的明显迹象(图 7c-d)。他们利用ST分析Ctrl_SW和ECM_SW样本的空间特征和解剖结构,他们观察到Cd3+ T细胞在植入的生物材料周围聚集,在ECM_SW样本中,这些细胞与Crabp1乳头状成纤维细胞共存(图7g),证实了ECM支架的促再生潜力,尽管伤口大小。
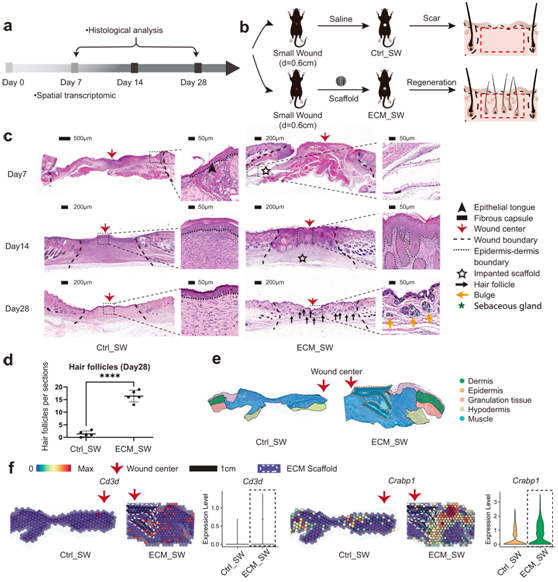
图7. 使用 ECM 支架治疗的小全层伤口的愈合评估。
(a) 评估皮肤伤口愈合的实验流程。 (b) Ctrl_SW组和ECM_SW组皮肤切除创面模型手术过程。(c) Ctrl_SW 和 ECM_SW 样本的代表性 H&E 图像。(d) POD28 上新生HF 的组织学定量。(e) 样本的解剖结构。(f) 空间特征图显示Cd3d(T 细胞标记基因)和Crabp1(乳头成纤维细胞标记基因)在 ST 谱中的表达及相应的定量分析。
+ + + + + + + + + + +
结 论
本项研究表明ECM支架的植入加速了伤口覆盖并增强了毛囊新生,结合RNA-seq、scRNA-seq和空间转录组学,探索生物材料周围的免疫反应,发现调节性 T 细胞通过抑制过度的 2 型炎症来减轻组织纤维化的潜在作用。缺乏成熟T淋巴细胞的免疫缺陷小鼠表现出由2型巨噬细胞炎症驱动的组织纤维化的典型特征,验证了生物材料激活的适应性免疫系统的潜在治疗效果。这些发现有助于了解免疫系统在伤口再生中的协调作用,并有助于未来免疫调节生物材料的设计。
+ + + + +



 English
English


