文献解读|Cell(64.5):综合空间分析揭示了胶质母细胞瘤的多层组织
✦ +
+
论文ID
原名:Integrative spatial analysis reveals a multi-layered organization of glioblastoma
译名:综合空间分析揭示了胶质母细胞瘤的多层组织
期刊:Cell
影响因子:64.5
发表时间:2024.04.22
DOI号:10.1016/j.cell.2024.03.029
背 景
神经胶质瘤包含不同状态的恶性细胞。本项研究将结合空间转录组学、空间蛋白质组学和计算方法来定义神经胶质瘤细胞状态并揭示其组织。
实验设计

结 果
01
神经胶质瘤的空间转录组学
研究者团队使用 10X Visium 空间转录组学平台对神经胶质瘤进行空间转录组分析(图 1 A)。他们分析了 13 个胶质母细胞瘤 (GBM)切片和 6 个 异柠檬酸脱氢酶(IDH)突变神经胶质瘤切片(三个 1p/19q 共缺失少突胶质细胞瘤和三个星形细胞瘤)。
他们使用两种初始方法来对斑点进行分类和注释。首先,通过平均每个染色体区域中基因的表达来进行拷贝数畸变(CNA)推断,将斑点分类为大多数恶性、大多数非恶性或混合。正如预期的那样,推断出的CNA包括GBM(7号染色体增益和10号染色体缺失)和少突胶质细胞瘤(1p/19q染色体共缺失)的特征,并且与癌症富集区域(例如肿瘤核心区与浸润区)显著相关(图1B-C)。其次,他们采用Leiden聚类方法对每个样本进行聚类,并在多个切片的情况下对每个肿瘤进行聚类,并通过基因集富集分析对聚类进行注释(图1C-D)。
虽然每个样本的Leiden聚类将样本中相似成分的点离散地分组在一起,但他们接下来的目标是更好地捕获细胞状态的连续性质。为此,对每个样本进行了非负矩阵分解 (NMF),并得出了稳健的表达程序,这些程序在多个参数中一致检测到(图 1 D)。
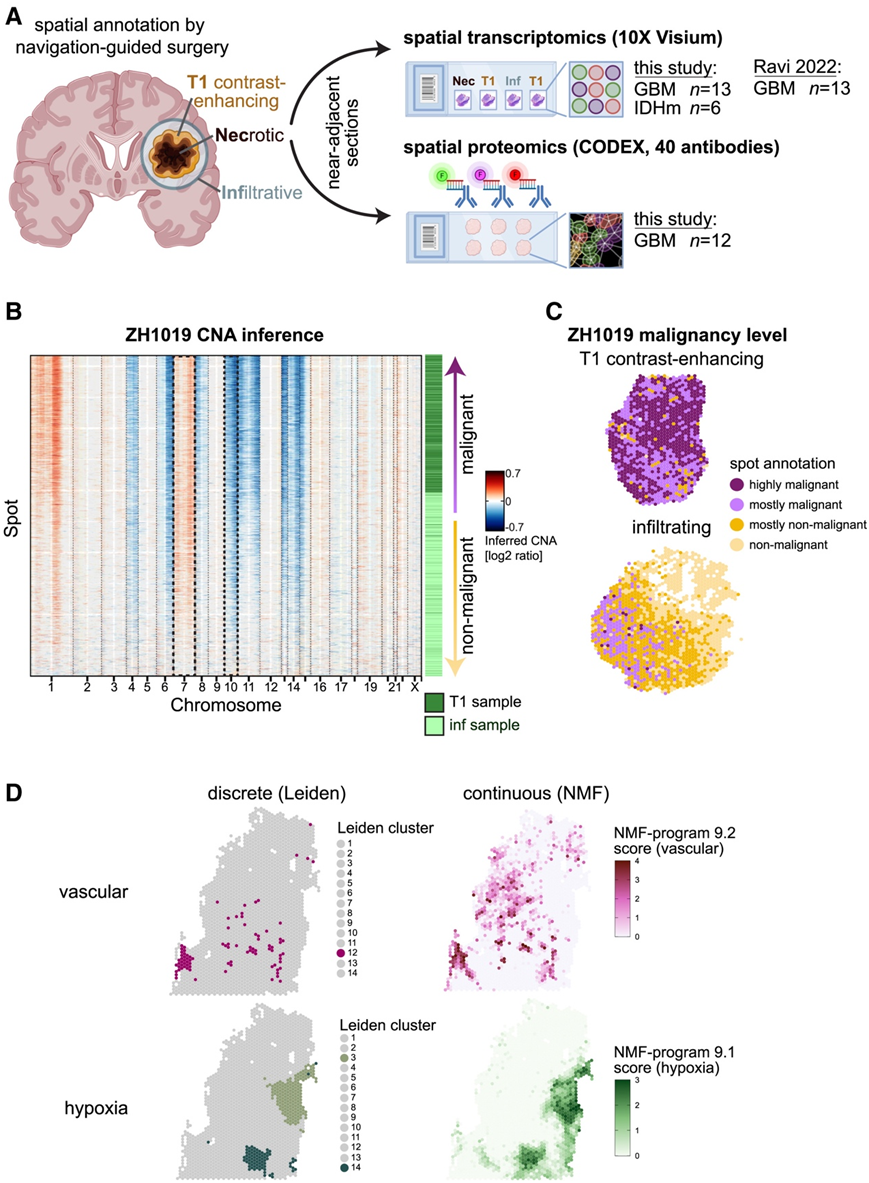
图1. 整体实验设计。
(A) 实验设计和患者队列。(B) 按染色体位置对基因进行排序后,通过 150 个分析基因的滑动窗口中的平均相对表达来推断拷贝数畸变 (CNA)。(C) ZH1019 T1 对比度增强和 ZH1019 浸润样本的空间图。(D) ZH916 块体的血管和缺氧聚类的每个样本 Leiden(左)和 NMF 聚类(右)。
02
神经胶质瘤表达异质性的重复模式
为了定义反映表达异质性核心模式的表达程序,他们比较了通过莱顿聚类或 NMF 在单个 GBM 样本中识别的 492 个基因表达程序,发现了相当大的相似性,这使他们能够根据基因特征重叠来定义 14 个程序聚类,每个聚类都涵盖源自多个 GBM 样本的程序(图 2 A-B)。对于每组程序,他们定义了一个由 50 个基因组成的共识程序,称为宏程序 (MP),它反映了 GBM 中异质性的反复出现模式(图 2 C)。同样,他们在 IDH 突变神经胶质瘤中定义了 6 个 MP。
虽然斑点的表达谱通常反映状态的组合,但 MP 与单细胞状态高度相似(图 2 D)。他们确定了 14 个 GBM 空间 MP,包括 8 个恶性程序和 6 个非恶性程序,每个程序反映癌细胞状态或非恶性细胞类型(图 2C-D)。非恶性 MP 包括 Mac(巨噬细胞/小胶质细胞)和 Inflammatory-Mac(炎性巨噬细胞/中性粒细胞)、Oligo(少突胶质细胞)、Vasc(内皮细胞和周细胞)、Neuron 和 Reactive-Ast(反应性星形胶质细胞)。后者包括经典的星形胶质细胞标记物(例如AGT和GJA1)和表明反应性星形胶质细胞状态的其他标记物(例如金属硫蛋白)。在八种恶性 MP 中,五种直接映射到单细胞 GBM 状态:MES 缺氧 (MES2)、MES (MES1)、NPC 样、OPC 样和 AC 样(图 2 D)。另外三种恶性空间MP包括:(1)星形细胞样间充质MPs (MES-Ast),富集与胶质瘤肿瘤微管相关的基因(如GAP43、KCNF1和PTN);(2)增殖和代谢(proliferation- metab),富含与增殖相关的(如CTNNB1、CNTD1和TP53)和代谢(如SLC16A1 [MCT1]、GGCX和PHGK1)基因;(3)染色质调控(染色质- Reg),富含染色质和转录调控因子(如ATRX、KMT2E、BRD4和SOX4)以及npc相关基因。
接下来,他们用得分最高的空间MP对所有点进行注释。每个GBM样本的整体组成变化很大(图2E),样本之间MES-Hyp和Neuron频率变化最大,MES样频率变化最小。即使是从同一肿瘤的不同区域分离的样本,其细胞类型组成也存在很大差异(图2E)。
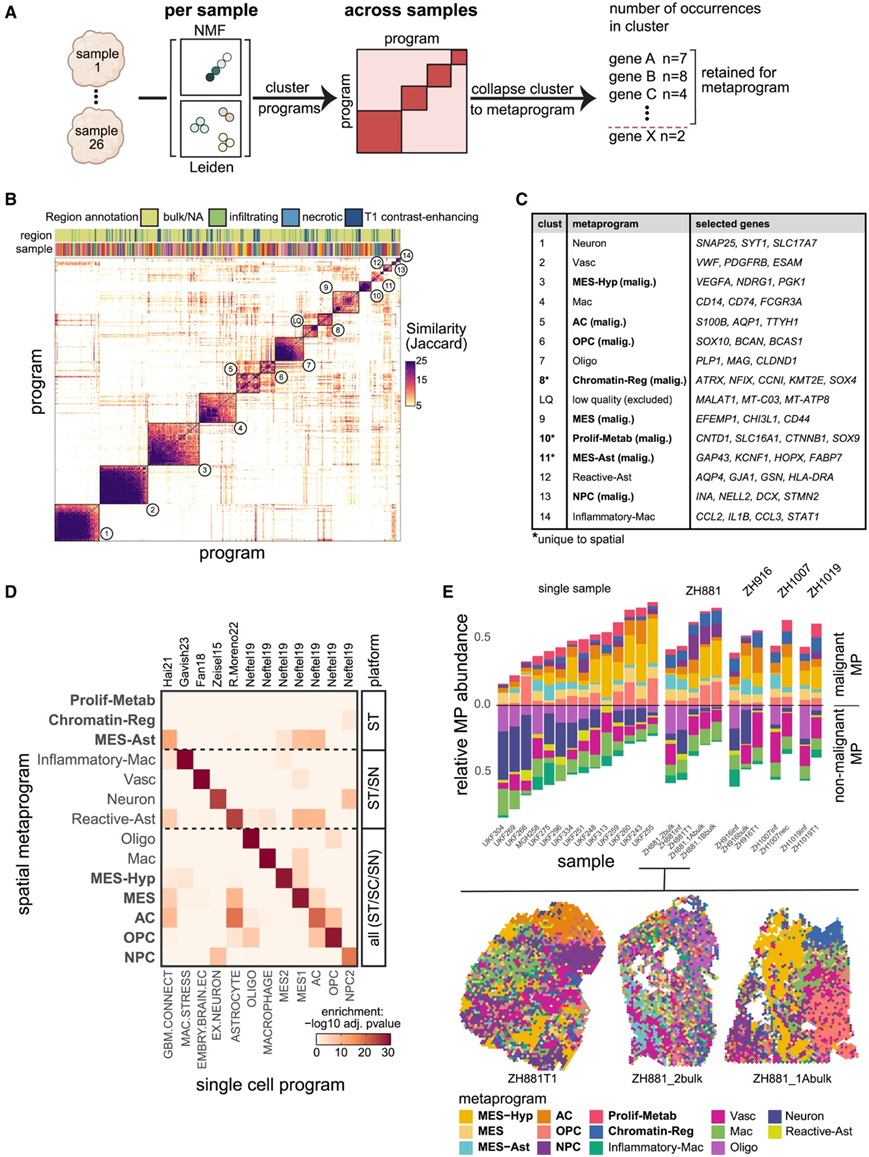
图2.空间宏程序的导出和注释。
(A)宏程序 (MP) 生成方法方案。(B) 基于基因特征重叠的相似性矩阵(通过 Jaccard 指数量化),适用于源自 NMF 和 Leiden 集群的所有程序。(C) 宏程序名称和对应于中编号的聚类的所选基因的表。(D) 使用先前所示的研究中定义的基因集(列)来富集空间宏程序(行)。(E) 对于每个样本(由一个条表示),显示分配给每个 MP 的斑点比例。
03
空间蛋白质组学作为神经胶质瘤图谱的补充方法
虽然Visium通过覆盖大多数基因提供了全面的数据,但它的空间分辨率较低,不适合捕获罕见或空间分散的细胞类型和细胞状态。因此,他们使用CODEX作为补充方法,在真正的单细胞蛋白水平上进行验证。他们的40个标记抗体小组是基于单细胞GBM MP和标准标记设计的,几乎涵盖了所有相关的细胞类型和细胞状态(图3A-B)。他们从12份样本中保留了428395个细胞,鉴定了所有主要分化的非恶性细胞类型,包括星形胶质细胞、少突胶质细胞、神经元、血管细胞(内皮细胞和周细胞)、T细胞、B细胞和巨噬细胞/小胶质细胞(图3C-D)。他们还确定了主要的恶性细胞状态,包括MES样、MES-Hyp、染色质- Reg、OPC样、NPC样和AC样细胞(图3E)。
为了能够直接比较 CODEX 和 Visium 数据,他们使用 STalign 对两个数据集进行空间对齐,然后将 CODEX 数据从单个细胞转换为与 Visium 相当的伪斑点,并将这些数据分配给 MP。在 80% 的样本中,MP 分配在来自邻近部分的 CODEX 和 Visium 数据之间显著相关,作为 MP 分配的交叉验证(图 3 F)。
使用单细胞CODEX数据使他们能够分析Visium大小的伪斑点内细胞的完整组成。在64%的伪斑点中,一个MP足以解释该伪斑点中的大多数细胞,而在99%的伪斑点,一个或两个MP足以说明大多数细胞(图3 G-H)。因此,大多数斑点仅由一个状态主导,这证明通过其主导MP来注释Visium斑点的方法的可行性(图2E)。
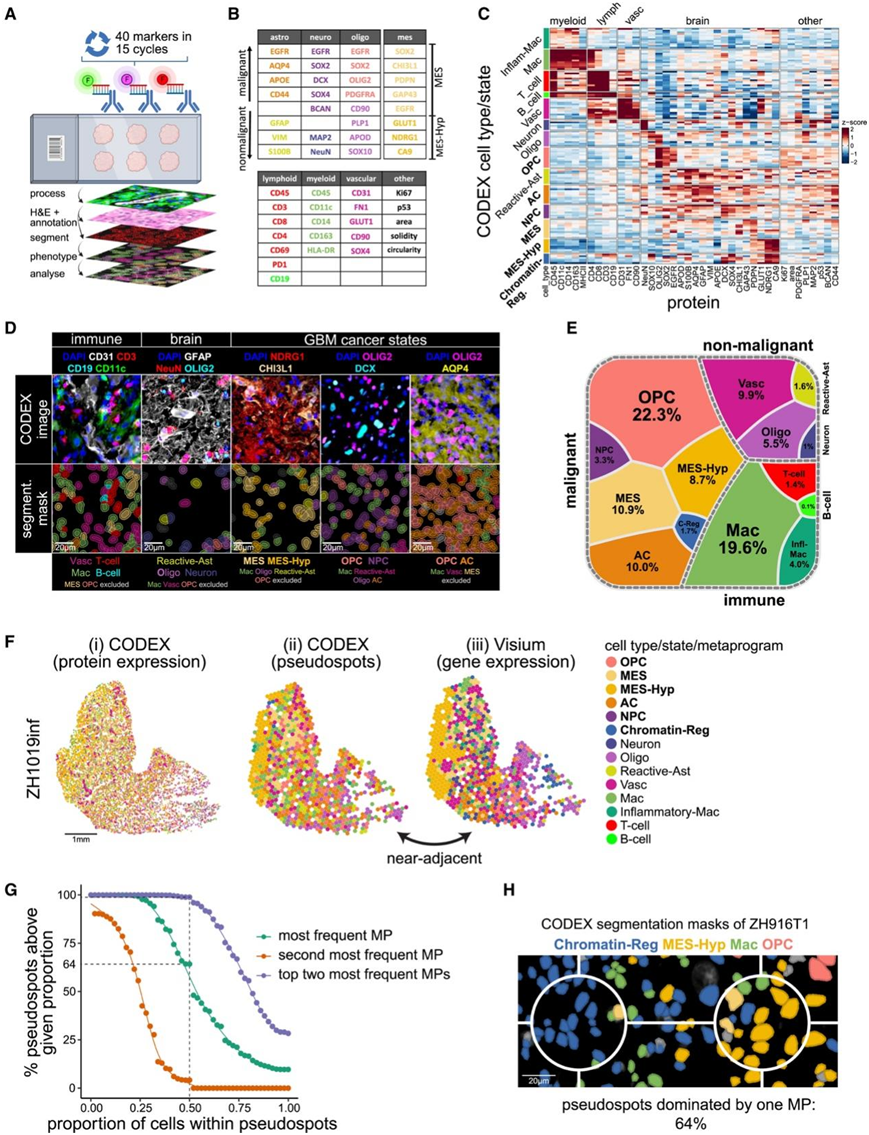
图3. 通过 CODEX 对神经胶质瘤进行空间分析。
(A) CODEX 实验、图像处理和计算分析的示意性工作流程。(B) CODEX 分析的蛋白质标记。(C) 按Z评分计算的每种细胞类型(或状态)的相对蛋白质表达。(D) 代表性示例的 CODEX 染色。(E) Voronoi 图显示所有样本的细胞类型/状态丰度。(F) (i) CODEX 单细胞数据、(ii) CODEX 伪斑点和 (iii)细胞类型/状态注释的空间图。(G) 累积分布图显示伪斑点的频率。(H) 示例性 CODEX 图像。
04
GBM 肿瘤包含同时存在的结构化和无序区域
在用得分最高的空间 MP 对每个点进行注释后,他们接下来分析了每个样本中相邻点与分散点中每个状态的富集程度,称之为“空间一致性”(图 4 A)。空间相干性因样品而异,例如在一些样品(称为“结构化”)中,大多数状态往往具有高相干性,而在其他样品(称为“无组织”)中,大多数状态往往具有低相干性(图4B)。虽然大多数状态的空间相干性根据样本和位置而变化,但少数状态要么一致地分组(高空间相干性),要么分散(低空间相干性)(图4C)。这包括 MES-Hyp 和 Neuron,它们在样本之间始终具有较高的空间相干性,而 Prolif-Metab 则始终具有较低的空间相干性。空间一致性在样本之间的变化比在州之间的变化更大,这表明它更具有区域特定性。
为了进一步探索这种区别,他们设计了一种计算方法,根据局部环境的一致性将每个点分类为结构化、无组织或中间区域(图 4D)。在肿瘤的核心(富含 MES-Hyp)和正常大脑的浸润区域(富含神经元)都发现了结构化区域。因此,他们根据其恶性程度(CNA信号)进一步细分结构化和无序区域,定义四类:Struct-Malig、Disorg-Malig、Struct-Norm和 Disorg-Norm(图4D-E)。将其余点注释为中间点,对应于组织区域之间的边界。所有具有多个切片的 GBM 肿瘤均由结构化和无组织的区室组成,表明这些模式的共存是 GBM 的重复出现的空间特征(图 4 E)。MES-Hyp 在 Struct-Malig 区域富集。即使从空间相干性计算中删除 MES-Hyp 点后,富含 MES-Hyp 的样品也具有较高的平均空间相干性。因此,与缺氧相关的组织增加超出了缺氧癌细胞状态本身,并且 MES-Hyp 点附近的所有恶性细胞状态比缺乏 MES-Hyp 点的区域中的相同状态更有组织性(图 4 F)。因此,缺氧周围的结构区明显比与缺氧相关的两种组织学注释——伪滑膜和坏死(PAN)和MVP更为丰富(图4G)。GBM 和 IDH 突变神经胶质瘤中的非缺氧区域很大程度上是无组织的 (Disorg-Malig)(图 4 E),与组织学上看到的神经胶质瘤的整体无组织一致。
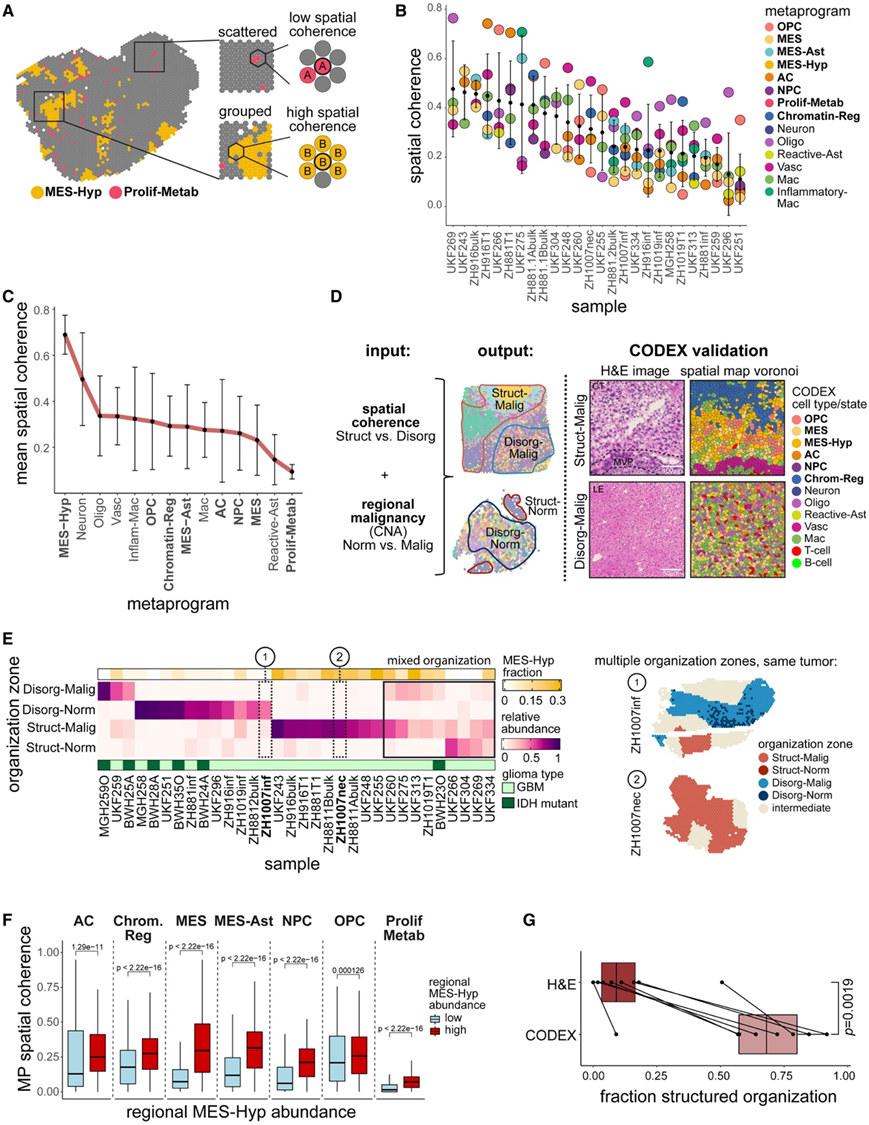
图4. 细胞状态和组织区的空间分布。
(A) ZH881_T1 的方案,说明了空间相干性得分计算,描绘了分组细胞状态的高空间相干性得分和分散细胞状态的低空间相干性得分。(B) 样本的 MP 空间相干性。(C) 所有样本的 MP 平均空间相干性。(D) 左:描述组织区域分配的方案。空间相干性和斑点恶性程度(从 CNA 推断)用于将斑点分配为结构性恶性 (Struct-Malig)、结构性正常 (Struct-Norm)、无组织性恶性 (Disorg-Malig) 和无组织性正常 (Disorg- Visium 数据中的范数)。右:在 CODEX 数据中也发现了结构化和无组织区域。(E) 左:每个样本(列)中不同组织模式(行)的相对丰度的热图。注释条显示每个样本的 MES-Hyp 丰度(黄色)和神经胶质瘤类型的分配(绿色)。右图:Visium 描绘的同一肿瘤的两个样本的空间图,显示多个组织区域。(F) MES-Hyp 丰度高 (>10%) 与 MES-Hyp 丰度低的区域(窗口)的恶性 MP 空间相干性评分的箱线图。(G) 基于 H&E 染色(MVP 和 PAN)的结构化区域分数与基于 CODEX 空间相干性的结构化区域分数。
05
成对的状态-状态空间关联在样本和尺度上重复出现
为了量化状态之间的空间关系,他们设计了三种补充措施,强调不同分辨率水平下的状态耦合。首先,两种状态的区域组成,定义为它们在预定义半径(用r表示)的六角形窗口上的丰度之间的相关性(图5A)。第二,两状态之间的邻接性,定义为一个状态在另一个状态的直接邻近点上的富集。同一点(或 CODEX 中的伪斑点)内两个状态的共定位。他们观察到规模不断扩大的区域中状态关系的总体一致性,同时在考虑所有措施时还确定了特定的尺度相关转变(距离相关耦合)(结构化区域中措施的一致性为 67%,无组织区域中措施的一致性为 57%)(图5B)。按区域组成划分,结构化区域和无组织区域具有相似数量的显著空间关联,并且这些关联基本一致,而共定位和邻接度量主要确定结构化区域特有的相互作用(图 5 C)。因此,即使没有相邻单元或点定义的直接空间图案,区域组成也往往会保持不变。
他们发现结构化 GBM 区域中的共识交互比无组织 GBM 区域多 10 倍(图 5 C)。无组织的 GBM 区域中唯一的共识交互是类 MES/Mac 和类 NPC/Neuron,共识交互由 CODEX 验证(图 5 D-E)。恶性状态主要根据共识相互作用分为两组,每组都有许多组内相互作用:(1)神经发育状态(OPC 样、NPC 样和 AC 样)和(2)间充质和缺氧状态-相关状态(MES-Hyp、MES-Ast、MES样和 Chromatin-Reg)(图 5 D-E)。神经发育恶性状态不仅在它们之间相互作用,而且与同一谱系对应的非恶性状态相互作用-AC样与Reactive-Ast相互作用,NPC样与Neuron相互作用,OPC样与Oligo相互作用(图5F)。所有三种间充质状态都与免疫细胞有很强的相互作用,但每种状态都与不同的免疫细胞亚群相互作用(图 5 F)。
免疫细胞(Mac、T 细胞和 B 细胞)也与 Vasc 强烈相互作用,突出了它们对运输的依赖(尤其是骨髓来源的巨噬细胞)(图 5 E)。
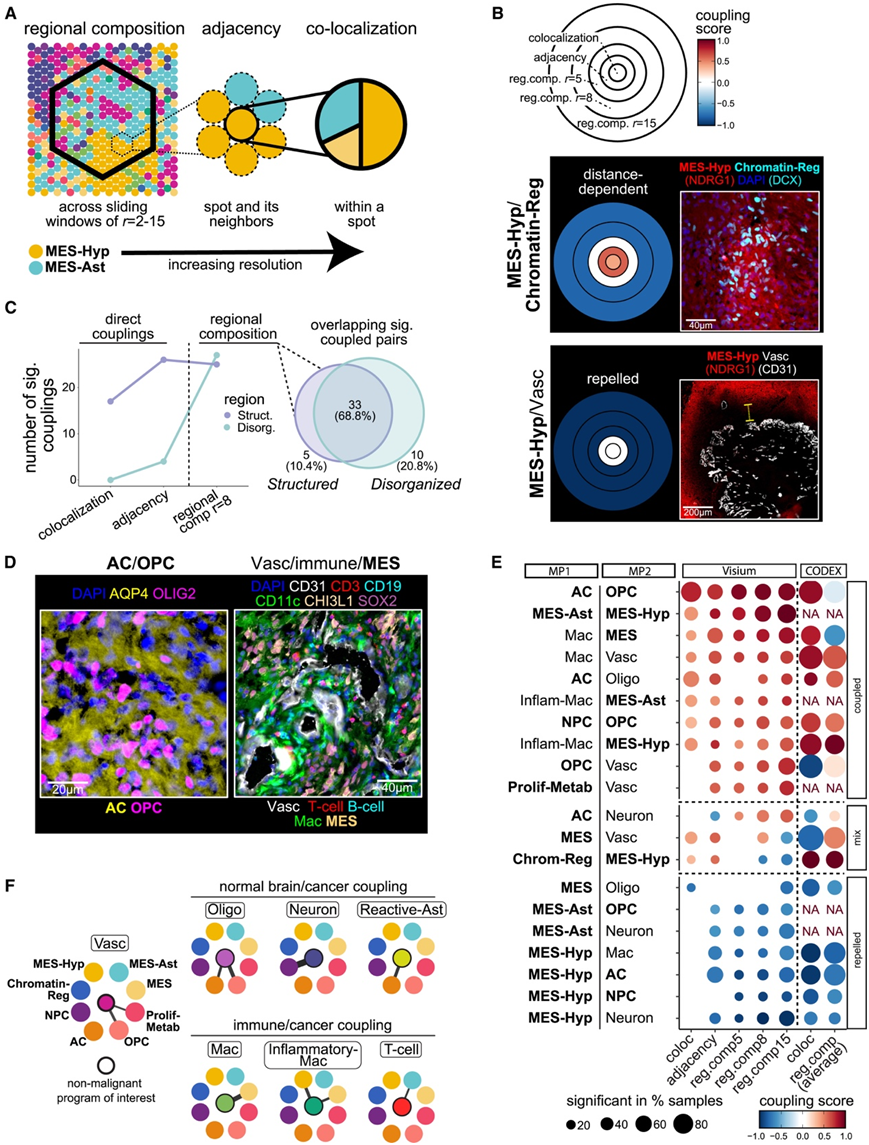
图5. 跨尺度状态之间的空间关联。
(A)描述不同尺度(从低分辨率到高分辨率)MP之间空间关系的三种度量方法的方案:(i)区域组成,(ii)邻接性,(iii)共定位。(B)嵌套圆形图,描绘了跨分辨率尺度的空间关系强度。上:嵌套圆图示意图。下:与CODEX图像相邻的嵌套圆形图(Visium)关联的示例,图像中显示的比例尺。(C) 左:线图显示结构化区域与无组织区域中不同分析中显著交互的数量。右:区域构成分析中显著相互作用数量的维恩图。(D) CODEX 图像突出显示 (C) 中选定的耦合细胞类型对。(E) 跨尺度多状态的热图分析。(F)上:正常脑细胞类型或Vasc与恶性状态耦合的网络图;下:免疫细胞与恶性状态的偶联。
06
结构化区域的 GBM 空间组织的分层模型
为了检测上述各个交互是否可以组合起来形成一个高阶组织,他们生成了一个网络图,其中节点代表状态,边代表共识交互(图 6A-B)。该图揭示了五层组织,其中边缘仅存在于同一层内或相邻层之间。该组织似乎以缺氧梯度为主,第一层由 MES-Hyp[L1:核心缺氧/坏死)组成,第二层由 MES-Ast、MES-like 和 Inflammatory-Mac(L2)组成:缺氧相关]。第三层包括可能有助于解决缺氧的免疫和血管生成相关的细胞类型和状态,包括 Vasc、Mac 和 Prolif-Metab(L3:血管生成反应/免疫中枢)。L3后,缺氧可能消失,使得神经发育恶性状态的存在可能更加依赖氧气- ac样,opc样和npc样(L4:恶性神经发育状态)。最后,非恶性脑细胞类型(反应性ast、寡糖和神经元)反映了向浸润脑实质(L5:脑实质)的转变。将点映射到五层保留了结构化和无组织区域之间的区别(图6C-D)。
他们将样本分配到五层的情况与组织病理学注释以及源自组织病理学特征的 IVY Gap 转录特征进行了比较(图 6 E)。本项研究的模型和经典注释之间具有高度一致性,L1类似于PAN,L3类似于MVP,L4类似于细胞肿瘤,L5类似于前沿区域。值得注意的是,经典组织病理学或 IVY Gap 转录程序无法区分缺氧相邻层 (L2) 和局部缺氧的小区域。现阶段可以在细胞状态的详细分辨率下重新定义经典的组织病理学特征(图6E)。
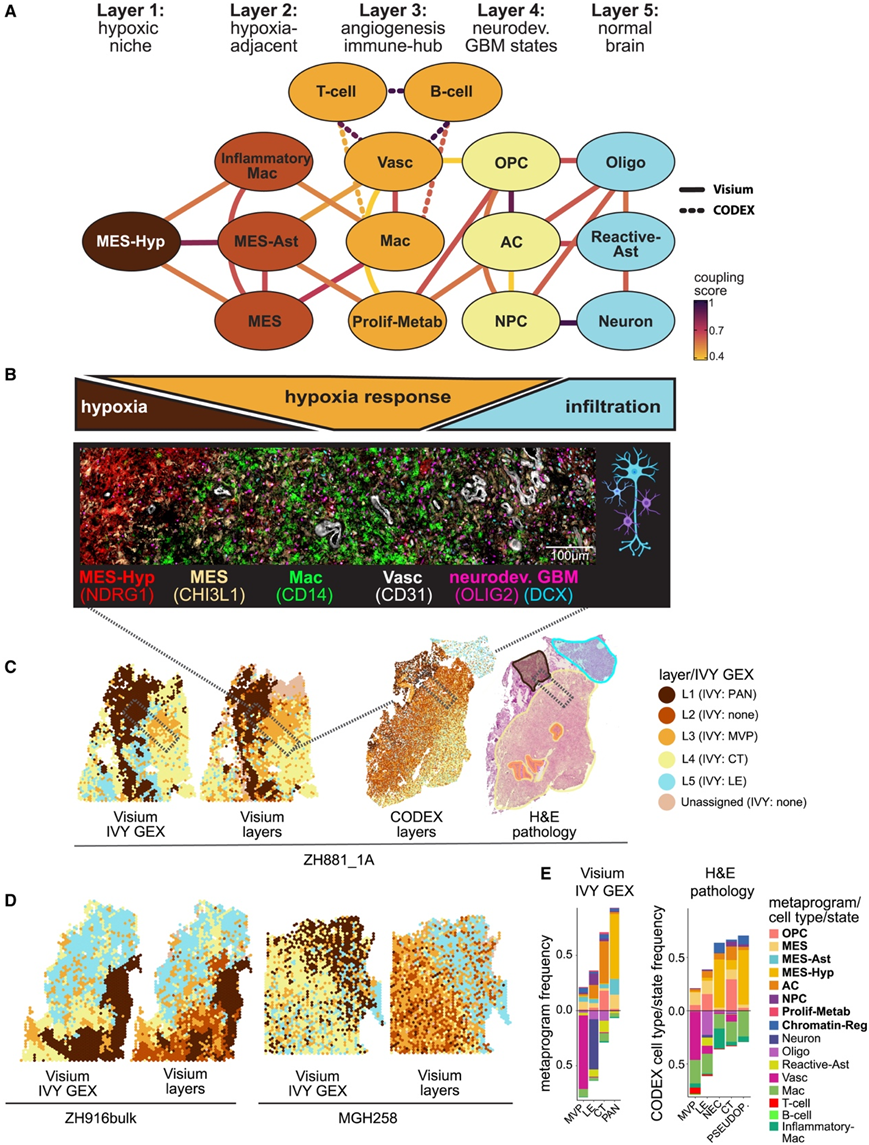
图6. GBM空间组织的分层模型。
(A) 上网络图,其中节点代表细胞类型/状态,边缘代表经常性相互作用。下:显示缺氧梯度、缺氧反应和与层对齐的渗透的方案。(B) CODEX 图像显示指定的细胞类型和标记,代表第 1-4 层。(C) 样本 ZH881_1A 的空间图。(D) 由 IVY 间隙组织学特征相关转录程序(左)注释的 Visium 样本与由层注释(右)的空间图比较。(E) 堆积条形图显示每个 IVY Gap 组织学特征转录程序注释的 MP 组成(左)和每个组织学注释的 CODEX MP 组成(右)。
+ + + + + + + + + + +
结 论
本项研究结合空间转录组学、空间蛋白质组学和计算方法来定义神经胶质瘤细胞状态并揭示其组织,发现了三种突出的组织模式。首先,神经胶质瘤由小的局部环境组成,每个环境通常富含一种主要的细胞状态。其次,特定的状态对优先位于多个尺度上的邻近区域。这种状态配对在肿瘤中是一致的。第三,这些成对的相互作用共同定义了一个由五层组成的全局架构。缺氧似乎驱动了细胞层,因为它与包括所有癌细胞状态的远程组织有关。因此,远离任何缺氧/坏死病灶的肿瘤区域和缺乏缺氧的肿瘤(例如低级别 IDH 突变神经胶质瘤)的组织性较差。
+ + + + +



 English
English


