文献解读|(10.753)转录组测序和代谢物分析揭示了微塑料和邻苯二甲酸二(2-乙基己基)酯对南美白对虾的单一和联合影响
原名:Transcriptome sequencing and metabolite analysis reveal the single and combined effects of microplastics and di-(2-ethylhexyl) phthalate on Peneaus vannamei
译名:转录组测序和代谢物分析揭示了微塑料和邻苯二甲酸二(2-乙基己基)酯对南美白对虾的单一和联合影响
期刊:Science of the Total Environment
影响因子:10.753
发表时间:2023.4.1
DOI号:10.1016/j.scitotenv.2023.161549
背 景
塑料使用量的增加,使得塑料碎片遍布整个海洋生态系统,并对海洋生物产生不利影响。此外,由于塑料生产过程添加了增塑剂,塑料可能会对海洋生物产生不可预知的毒性作用。因此,本研究旨在揭示微塑料(MPs)、塑料添加剂(邻苯二甲酸二(2-乙基己基)酯,DEHP)以及MPs和DEHP(MPs-DEHP)共污染对南美白对虾在氧化应激、转录组学和代谢组学方面的潜在影响和机制。
实验设计
结 果01

MPs、DEHP和MPs-DEHP对南美白对虾抗氧化防御机制的影响
如图1A、1B所示,MPs、DEHP和MPs-DEHP显著激活了超氧化物歧化酶(SOD)和过氧化氢酶(CAT)。CK组(No pollution group)、MPs组和DEHP(DEHPL和DEHPM)组之间的谷胱甘肽过氧化物酶(GSH-Px)活性无显著差异。另外,DEHPH和MPs-DEHP显著诱导GSH-Px活性。DEHP显著提高丙二醛(MDA)含量。令人惊讶的是,MDA含量明显受到MPs的抑制,但在MPs-DEHP组中保持在稳定的水平。与MPs相比,MPs-DEHP明显增加过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)以及丙二醛(MDA)含量,显著抑制超氧化物歧化酶(SOD)活性。MPs-DEHP与DEHP(DEHPM)对超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性无显著影响,但与DEHP(DEHPM)比较,MPs-DEHP显著降低丙二醛(MDA)含量。为了进一步研究MPs的存在是否会对DEHP的毒理学效应产生影响,作者选择MPs、DEHP(DEHPM)和MPs-DEHP进行分析。
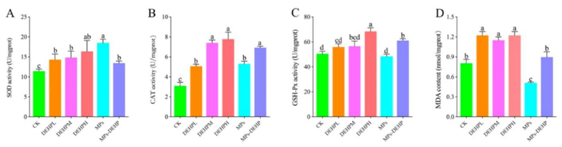
图1 MPs、DEHP和MPs-DEHP对南美白对虾抗氧化防御机制的影响
02

MPs、DEHP和MPs-DEHP对南美白对虾转录组学的影响
为了深入研究MPs、DEHP和MPs-DEHP对南美白对虾的潜在影响,作者对南美白对虾的肝胰腺组织进行转录组学分析。PLS-DA显示,每组有3个生物重复聚类(图2A),表明了组间的显著差异。通过在四组(CK、MPs、DEHP和MPs-DEHP)中进行5种对比(CK/MPs、CK/DEHPM、CK/MPs-DEHP、MPs/MPs-DEHP、DEHP/MPs-DEHP),与MPs-DEPH相比,DEHP诱导大量的DEGs(差异表达基因),MPs组只有少量DEGs显著改变。
与CK组相比,通过Venn图展示了治疗组的KEGG通路显著改变的数目(图2B)。具体来说,KEGG通路分析显示了MPs组中12条通路均被显著诱导,如戊糖和葡萄糖酸盐相互转化(ko00040,1 DEGs)、花生四烯酸代谢(ko00590,1 DEGs)、PPAR信号通路(ko03320,1 DEGs)。同样,在DEHPM组中23条通路显著变化(图2C),如局灶性粘连(ko04510,11 DEGs),PI3K-Akt信号通路(ko04151,10 DEGs)和ECM受体相互作用(ko04512,8 DEGs),相反,在MPs-DEHP组7条显著(p < 0.05)改变的通路中,最具代表性的是嘌呤代谢通路(ko00230, 5 DEGs)、PPAR信号通路(ko03320, 2 DEGs)和AMPK信号通路(ko04152, 2 DEGs)。
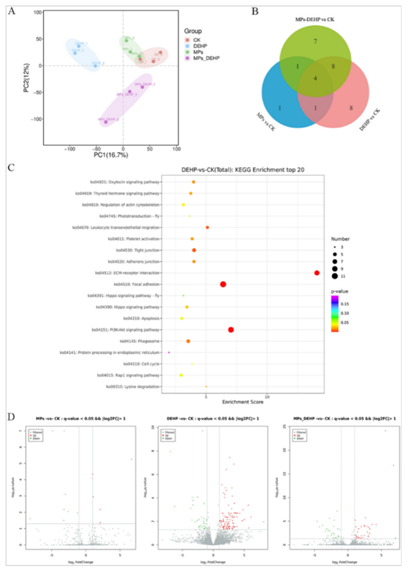
图2 组织学分析MPs、DEHP和MPs-DEHP对南美白对虾转录组学的影响
03

MPs、DEHP和MPs-DEHP对南美白对虾代谢组学的影响
进一步探讨MPs、DEHP和MPs-DEHP DEHP对南美白对虾的生理和代谢的毒理学效应。作者使用UHPLC-MS/MS进行代谢组分析,利用PLS-DA,观察到CK与MPs、DEHPM和MPs-DEHP组之间的显著分离(图3A),表明南美白对虾用MPs、DEHPM和MPs-DEHP处理后发生了显著的生化改变。此外,共鉴定出1261种代谢物(ESI+和ESI−离子分别为759个和502个)。具体来说,21个(8个上调,13个下调),82个(52个上调,30个下调)和39个(25个上调,14个下调)。总之,这些结果表明DEHPH和MPs-DEHP处理的南美白对虾代谢水平有明显的波动。此外,DEMs(原位差分电化学质谱仪)来区分MPs/MPs-DEHP和DEHP/MPs-DEHP,其中37个(16个上调,21个下调)和57个(25个上调,32个下调)(图3B)。在MPs、DEHP和MPs-DEHP组中诱导了三种共表达的代谢物(尿苷、壬烷酸和丙酰肉碱)(图3C)。DEMs的KEGG通路富集分析表明,在MPs、DEHP和MPs-DEHP的反应中,DEMs参与了不同的代谢途径。结果表明,MPs显著干扰嘧啶代谢和DEHPH显著改变花生四烯酸代谢、视黄醇代谢、α -亚麻酸代谢、醚类脂质代谢、嘧啶代谢、亚油酸代谢和不饱和脂肪酸的生物合成(图3D)。此外,MPs-DEHP显著影响视黄醇代谢、半乳糖代谢和甘氨酸、丝氨酸、苏氨酸代谢。
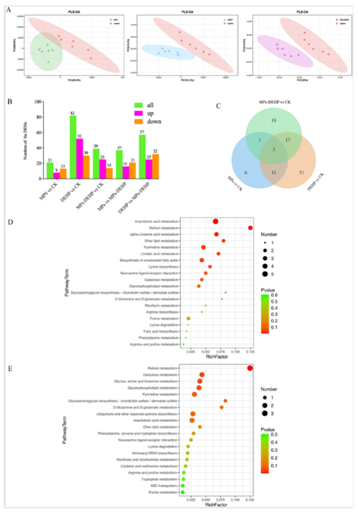
图3 MPs、DEHP和MPs-DEHP对南美白对虾代谢组学的影响
04

RT-qPCR验证DEGs
从RNA-Seq中随机选择的9个基因,利用RT-qPCR验证RNA-Seq结果的可靠性。上述选择的基因参与花生四烯酸代谢(CYP2L1)、甘油脂代谢(PNLIPRP1),嘌呤代谢(PDE3B),PPAR信号通路(DBI、PCK2),PI3K-Akt信号通路(HSP90AA1、PCK2),NOD样受体信号通路(HSP90AA1)和AMPK信号通路(EF2、PCK2)。三个治疗组的RT-qPCR结果和靶基因相对表达水平的转录组分析比较如图4所示。在三个治疗组中,这些基因在RT-qPCR中的表达趋势与转录组分析结果基本一致,说明RNA-Seq结果是可靠的。

图4 RT-qPCR验证DEGs
05

转录组学和代谢组学的综合分析
为了筛选相关的DEGs和DAMs,我们进一步通过Pearson相关系数对DEGs和DAMs进行分析。图5表明为前20位的DEGs和DAMs的相关性,说明DEGs和DAMs的相关性较高。转录组和代谢组的综合分析显示,MPs、DEHP和MPs-DEHP毒理学效应的代谢应答可能分别涉及1、7和4条功能通路。在这些途径中,MPs组中具有代表性的途径是中的甘油磷脂代谢。同样,在DEHPM组中,最明显的途径是嘌呤代谢、赖氨酸降解、血小板活化、氨基糖和核苷酸糖代谢以及神经活性配体-受体相互作用。此外,MPs-DEHP组最丰富的途径是嘌呤代谢和视黄醇代谢。

图5 转录组学和代谢组学的综合分析
+ + + + + + + + + + +
结 论
本研究首次采用对比方法,系统地研究了MPs、DEHP和MPs-DEHP对南美白对虾的生物学危害。研究抗氧化生物标志物的研究结果表明MPs和DEHP对MDA有拮抗作用;MPs、DEHP和MPs-DEHP诱导抗氧化防御系统失衡。转录组学和代谢组学分析表明,MPs、DEHP和MPs-DEHP干扰了南美白对虾的氨基酸和脂质代谢,并进一步诱导炎症反应和嘌呤代谢功能障碍。此外,MPs的存在可能会减轻DEHP对南美白对虾的生物毒性。这些发现为MPs和塑料添加剂对海洋生物群的单一和联合毒理学效应提供了新的见解。
+ + + + +



 English
English

