文献解读|Nat Commun(16.6):食管细胞图谱揭示了活动性嗜酸性粒细胞性食管炎和缓解期间的动态重塑
✦ +
+
论文ID
原名:An esophagus cell atlas reveals dynamic rewiring during active eosinophilic esophagitis and remission
译名:食管细胞图谱揭示了活动性嗜酸性粒细胞性食管炎和缓解期间的动态重塑
期刊:Nature Communications
影响因子:16.6
发表时间:2024.04.18
DOI号:10.1038/s41467-024-47647-0
背 景
食管内协调的细胞相互作用维持体内平衡,破坏可能导致嗜酸性粒细胞性食管炎(EoE),这是一种发病机制知之甚少的慢性炎症性疾病。
实验设计
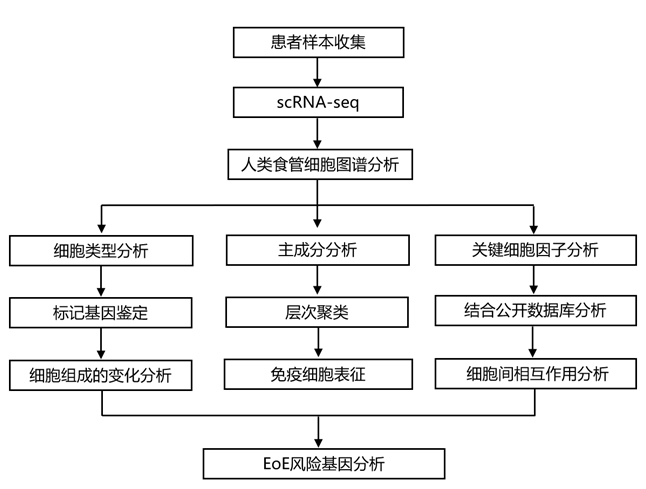
结 果
01
人类食管细胞图谱
为了了解 EoE 期间的细胞变化,研究者团队分析了 22 名人类捐赠者的 37 份食管活检样本(8 名活动性 EoE 患者、7 名缓解期 EoE 患者和 7 名因一般消化不良而接受内窥镜检查但未报告病理结果的健康参与者),男性和女性数量相等(图 1a-b)。对于 15 名捐献者,他们从食管近端和远端区域获取并分别分析了活检(图 1a-b)。
他们将 421312 个单细胞谱分配给 60 个普遍的亚群,涵盖 93.5% 的细胞,并通过不同标记基因的表达进行注释(图 1c-d,图S2a-b)。60个流行的亚群包括4个上皮细胞亚群,10个间质和胶质细胞亚群,17个骨髓[单核细胞、巨噬细胞、树突状细胞(DC)]亚群,5个B细胞亚群,20个T/自然杀伤(NK)淋巴细胞亚群,1个红细胞亚群,1个嗜酸性细胞亚群[表达沙克-莱登晶体(CLC)和CCR3]、2个肥大细胞亚群[表达胰蛋白酶α/β1 (TPSAB1)和CPA3](图1c-d)。一部分(21.6%)肥大细胞也表达乳糜酶(chymase)(CMA1)(图S2c),提示食管黏膜中存在tryptase+chymase+ 肥大细胞(MCTC)亚型和tryptase+chymase- 肥大细胞(MCT)亚型。在三组的多个供体中分别观察到60个亚群中的每一个亚群的细胞。另外12个罕见亚群的细胞仅在少数患者活检中检测到,包括小窝、顶叶、黏液颈、Paneth、导管、肠色素样细胞和胃促生长素或胃泌素表达细胞亚群(图2d)。
60 个常见亚群中有 11 个由增殖细胞组成,包括循环基底区上皮细胞、成纤维细胞、血管内皮细胞 (BEC)、周细胞、肥大细胞、巨噬细胞、DC、血浆 B 细胞、CD4 +和 CD8 + T 细胞,以及NK细胞(图 1d)。来自 10 个循环细胞亚群(不包括循环基底细胞)的细胞概况形成了清晰的圆形图案(补充图 2e),并且与相比,每个细胞检测到的表达基因数量更高它们的非循环对应物。
除了特异性抗原呈递细胞(APC)外,CD8+ T细胞、BEC(尤其是静脉内皮细胞)和神经胶质细胞的一个亚群表达了主要的组织相容性复合体II类(MHC-II)基因(图1d),但是其表达水平低于巨噬细胞和dc。在B细胞区室中,只有记忆B细胞表达高水平的MHC-II基因(图S2f)。
上皮区室包括四个子集:表达TSLP(EoE 风险基因)、CXCL14、IL1R2和KRT14/15 的静止基底细胞;表达KRT78和CRNN 的顶端细胞;循环基底细胞;基底上细胞表达基底、顶端和细胞类型特异性基因的混合,例如SERPINB3/4和DSC2(图 1d)。他们对食管上皮间室的注释与最近的研究一致,标记基因的表达相匹配(例如COL17A1在静止的基底细胞中,KRT4在分化的基底上细胞中,但在基底细胞中没有,CRNN主要在顶端细胞中)(图S2g)。基底上细胞表达了最高水平的EoE风险基因CCL26(图S2h),该基因编码eotaxin-3,一种IL-13诱导的嗜酸性粒细胞的趋化因子。根据上基细胞和基底细胞标记基因的表达,循环的基底细胞可分为两个亚群,他们将其称为“分化”和“更新”(图S2i-j)。
扩散图分析的力导向布局嵌入预测,循环“更新”基底细胞分化为静止基底细胞,而循环“分化”基底细胞分化为基底细胞,随后分化为顶端细胞(图S2k)。在活动性的EoE中,基底上细胞向顶端细胞的分化减少(图S2k)。
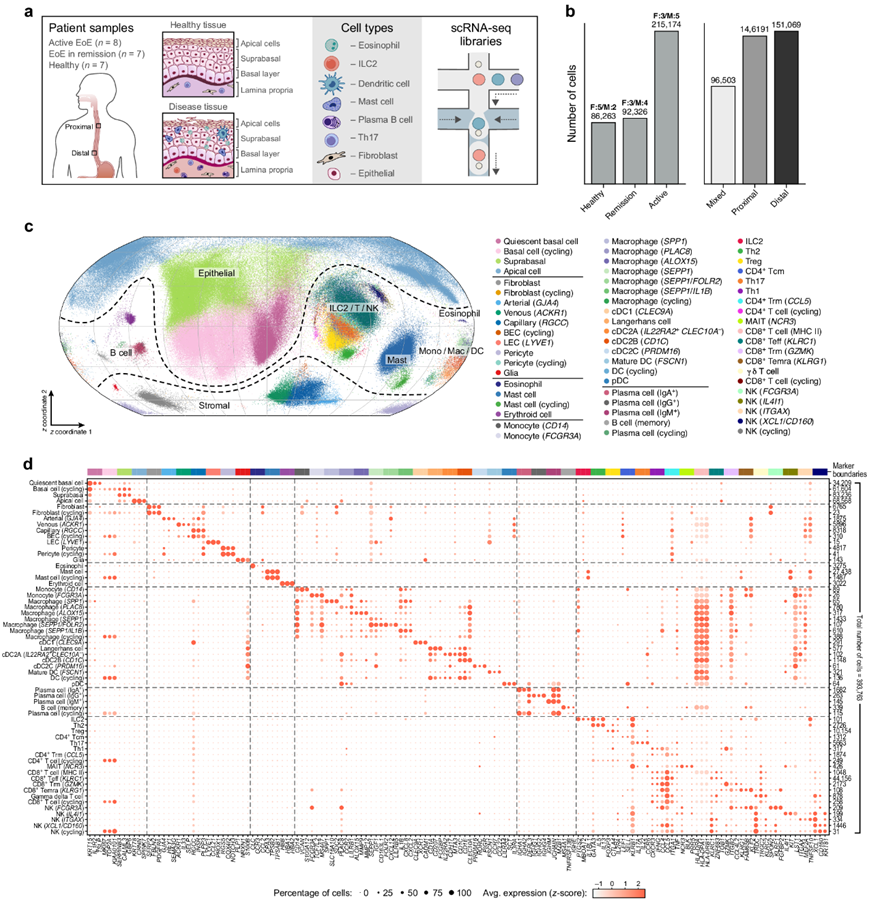
图1. 人类食管细胞图谱。
(a)实验设计。(b) 数据构成。(c-d) 食管图谱中 60 个常见细胞亚群。
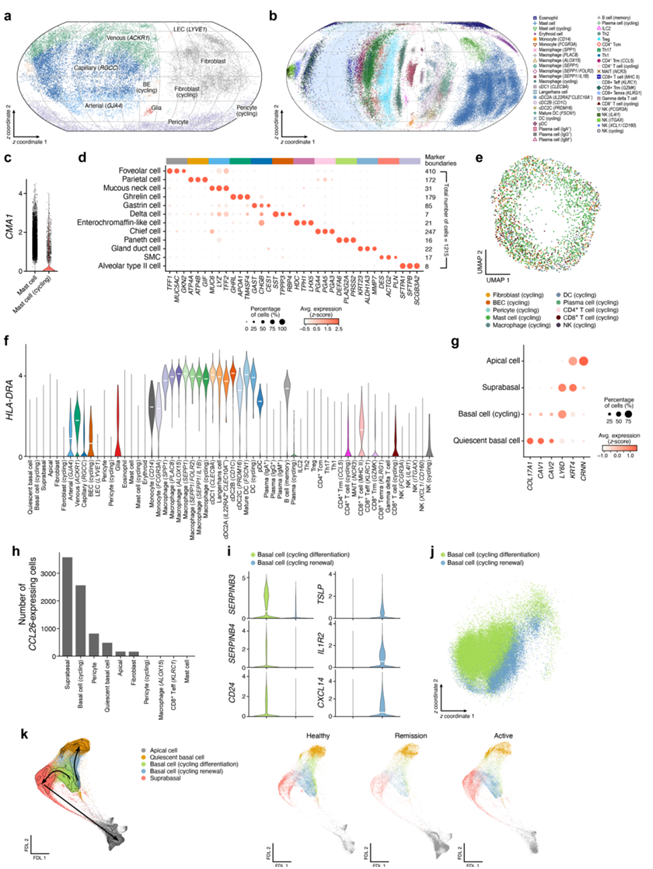
图S2. 人食管黏膜scrna-seq图谱。
(a-b) 基质和免疫区室。所有供体间质和免疫细胞图谱。(c) 一小部分肥大细胞表达CMA1。(d) 12个罕见细胞亚群的标记基因。(e) 在图谱中循环细胞。(f) 在不同细胞类型中检测到HLA-DRA的表达。(g) 经过验证的食管上皮标记基因在适当的细胞亚群中表达。(h) 表示子集的CCL26。(i) 基于上基细胞和基底细胞标记基因的表达,循环型基底细胞可进一步分为“分化”和“更新”亚型。(j) 循环分化(绿色)和循环更新(蓝色)基底细胞轮廓的球形嵌入。(k) 根据细胞类型着色的上皮细胞轮廓。
02
细胞组成在活动性的 EoE 中发生变化,并在缓解时大部分恢复
接下来,他们使用负二项式回归模型定量不同疾病条件下的细胞成分变化。与缓解期和健康期相比,活动性 EoE 具有除嗜酸性粒细胞之外的多种细胞类型的不同比例,通常与疾病活动相关。与缓解期或健康参与者相比,活动性 EoE 患者的嗜酸性粒细胞和肥大细胞频率如预期增加(图 2a)。此外,在活动性EoE中, PLAC8 +巨噬细胞、ALOX15 +巨噬细胞、PRDM16 + DC和浆细胞样DC(pDC)的比例增加,而FOLR2 +巨噬细胞和顶端细胞的比例减少(图2a)。TH2 细胞(IL-4 和 IL-13 的主要来源)以及循环 CD4+ T 细胞和血浆 B 细胞在活动性 EoE 中的比例也有所增加(图 2a)。嗜酸性粒细胞、肥大细胞、其他骨髓细胞和淋巴细胞是丰度与疾病活动高度相关的细胞类型,这是通过对组织病理学样本中通过组织病理学样本中每高倍视野(HPF)嗜酸性粒细胞数量的临床注释测量的(图2b-c)。这些结果遵循典型的细胞比例梯度,从健康到缓解再到活动性EoE,但是两名活动性EoE患者的近端活检显示每HPF的嗜酸性粒细胞很少(图2c)。
除了嗜酸性粒细胞外,多种细胞类型的增加是活动性EoE成分变化的特征。一致地,在基于细胞比例的主成分分析(PCA)中,通过第一主成分(PC),细胞组成谱将活动性EoE与健康和缓解区分开,富含活动性EoE的细胞(嗜酸性粒细胞、循环肥大细胞和循环浆细胞)与PC1高度正相关。尽管一名患者(E1054)在远端和近端区域的嗜酸性粒细胞/HPF不一致,但近端和远端都没有显示活动性的EoE特征。对于8名患者(不包括2名活动性的EoE患者,但在远端和近端区域嗜酸性粒细胞计数不一致),分别对近端和远端活检进行了分析,基于负二项模型,在校正了多次比较后,他们没有发现显著的细胞组成变化。
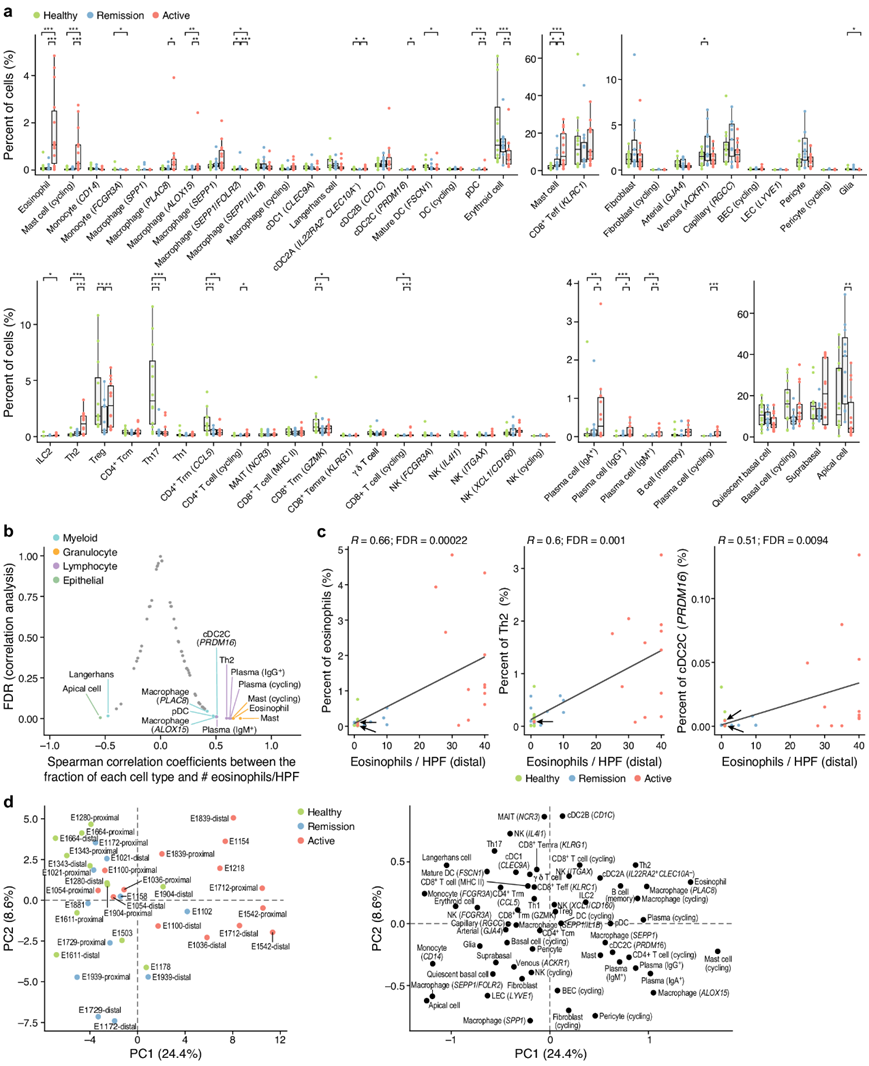
图2. 缓解期和活动期 EoE 期间细胞组成的变化。
(a) 不同条件下细胞组成的变化。(b-c) 细胞比例与嗜酸性粒细胞浸润相关。(d) 每种情况下独特的细胞组成概况。
03
ALOX15 +巨噬细胞和PRDM16 + DC 与活动性的 EoE 相关
巨噬细胞跨越多个亚群,具有组织常驻或单核细胞来源的特征,包括与疾病相关的ALOX15+亚群。总体而言,巨噬细胞(图3a-d)主要表现为M2表型(表达STAB1、CD163/209、F13A1、VSIG4和TREM2),并表达补体成分1q基因(如C1QA)、CD14/81和MAFB。大多数巨噬细胞表达SEPP1 (SELENOP),并跨越不同的状态,一种上调FOLR2、CXCL12和LILRB5,另一种上调IL1B和CXCL2/8。此外,脂质相关的SPP1+巨噬细胞亚群显示C1QA水平较低,CD14+单核细胞基因S100A8/A9和C5AR1表达较高,可能起源于食道的单核细胞。PLAC8+巨噬细胞的一个子集表达标记基因CCR2、LGALS2和LILRB1,这些基因也在单核细胞中表达,可能代表近期单核细胞来源的巨噬细胞处于短暂状态。巨噬细胞表达IL-4极化基因ALOX15+在活动性疾病中比例增加(图2a),与PLAC8+和SEPP1+巨噬细胞具有相似的特征,但也表达MMP9/12和TREM2。因此,在EoE活动性患者的细胞中,ALOX15的细胞内在表达上调(图3c-d)。ALOX15+巨噬细胞的特征是通过巨噬细胞亚群的无监督非负矩阵因子分解确定的表达程序,其中MMP12 、 MMP9和ALOX15作为前三个基因(图 3e)。
食管 DC 亚群包括传统的 1 型树突状细胞 (cDC1)、cDC2B 和最近在脾脏中发现的IL22RA2+CLEC10A−cDC2A,以及表达 EoE 风险基因ATP10A的PRDM16 + cDC2C亚群,这些细胞在健康组织中很少见。cDC2A和cDC2B之间的差异表达分析恢复了已知的cDC2A标记基因(图3f)。表达PRDM16、RORC和PIGR(图3g)的cDC2在活动性EoE中富集(图2a)。这些细胞不表达DC4标记基因(FCGR3A和SERPINA1),也不表达AS DC标记基因(AXL和SIGLEC6)。重新分析几个已发表的scRNA-seq数据集显示,具有类似特征的细胞存在于其他组织中,包括胶质母细胞瘤肿瘤、脾脏、腮腺、淋巴结、腹股沟淋巴结、肠系膜淋巴结、肺引流淋巴结、肺和结肠(图3h-k)。PRDM16+ cDC2C高表达PTPRC、MHC-II基因、CD52、AIF1、LST1、cle4a和TYROBP,但不表达CD68、MAFB和C1q基因,证实它们是骨性DC。PRDM16+ cDC2C和cDC2A均不表达cle10a。PRDM16+ cDC2C谱与cDC2A比cDC2B更相似,cDC2C和cDC2A都表达ATP10A。一些PRDM16+cdc2C处于表达细胞周期标记基因(如KIAA0101和TYMS)的不同状态(图3a-b)。因此,PRDM16+ cdc2c是一个罕见的DC亚群,在EoE中增加,并表达EoE风险基因ATP10A。
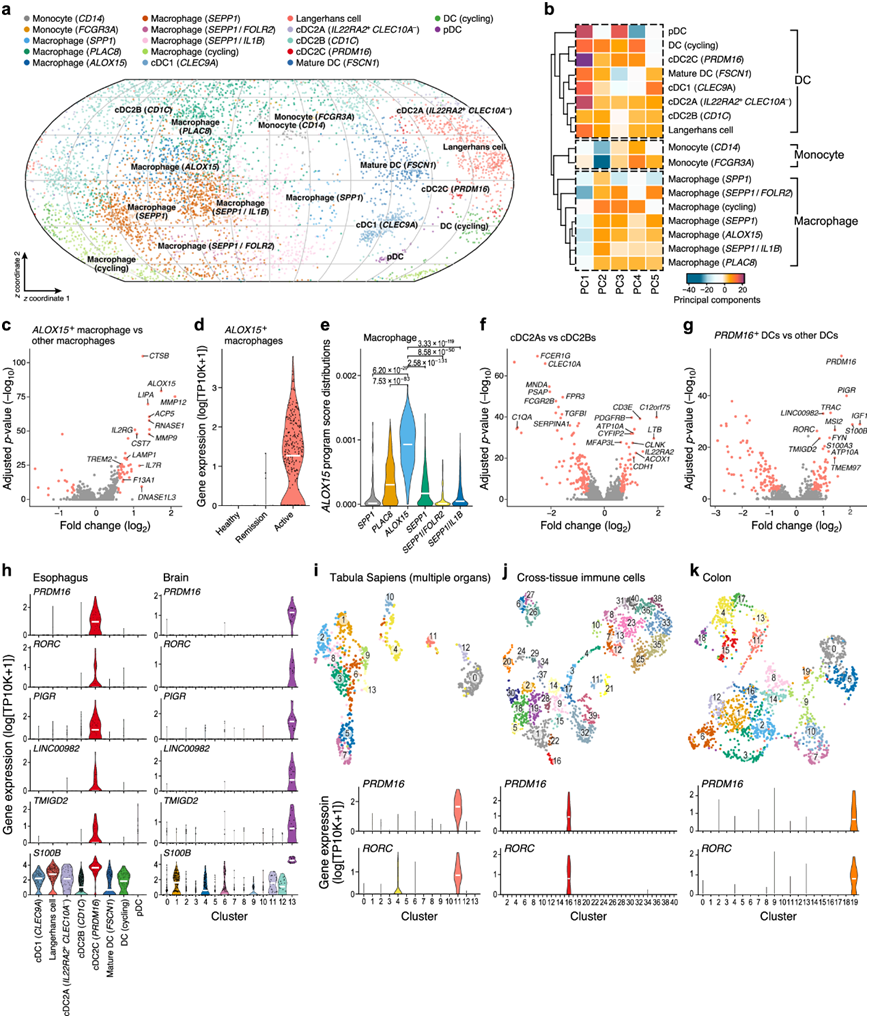
图3. EoE 骨髓区室中与疾病相关的ALOX15+巨噬细胞和PRDM16+DC。
(a-b) 食管细胞图谱的骨髓区室。(c) ALOX15之间每个基因差异表达的显著性。(d) 每种条件下 ALOX15 + 巨噬细胞中ALOX15的表达分布。(e) 不同巨噬细胞子集中ALOX15 NMF 程序得分的分布。(f) dc2子集。(g) 差异表达基因的显著性。(h) cDC2C标记基因的表达分布。(i-k)UMAP可视化和PRDM16+cDC2C标记基因在每个聚类中的表达水平分布。
04
罕见的常驻 ILC2 产生 IL-13、IL-5 和前列腺素
他们发现了罕见的ILC2(图4a),与健康状态相比,它们在活动EoE中的比例显著增加(图 2a)。基于CD69和ITGAE的表达,ILC2可能是组织驻留的,但不是循环标志物FAM65B(图 4b)。与组织驻留一致,食管ILC2具有较高的标记物表达,这些标记物在肺和结肠ILC2中高表达,但在血液和扁桃体ILC2中低表达(图4c)。与组织驻留一致,食管ILC2具有较高的标记物表达,这些标记物在肺和结肠ILC2中高表达,但在血液和扁桃体ILC2中低表达(图4d)。有趣的是,ILC2 和 TH2 细胞表达受磷蛋白 (PLN),这是由人食管平滑肌细胞和 EoE 肌成纤维细胞中的 TGFβ1 诱导的,但食管中的 ILC2 表达较高水平的双调蛋白 (AREG),这表明它们可能在EoE 期间的组织修复。
他们鉴定了这些和另外五个具有不同标记的CD4+ T细胞亚群,包括表达幼稚标记(SELL和LEF1)和KLRB1的TCM细胞;CD4+常驻T(TRM)细胞表达CCL5、ITGA1、TNF;表达IFNG、CXCR3和CCL4的TH1细胞;表达IL17A、IL22和CCR6的TH17细胞;和循环T细胞(图1d)。他们重新分析了1088个谱,证实了该数据集中存在少量的TCM和TH17细胞(图4e)。
与健康参与者相比,在公开数据和本项研究的数据中,活动性EoE患者的TH17细胞都发生耗竭(图2a),IL17A/F、IL22和IL26下调(图4f)。这与儿童EoE患者外周血单个核细胞(PBMC) IL-17缺失结果一致。在T细胞内,与健康参与者相比,活动性EoE的TH2比例增加,TH17比例减少(图4g)。因此,EoE影响TH细胞区室,而细胞毒性细胞亚群的组成基本上不受影响。
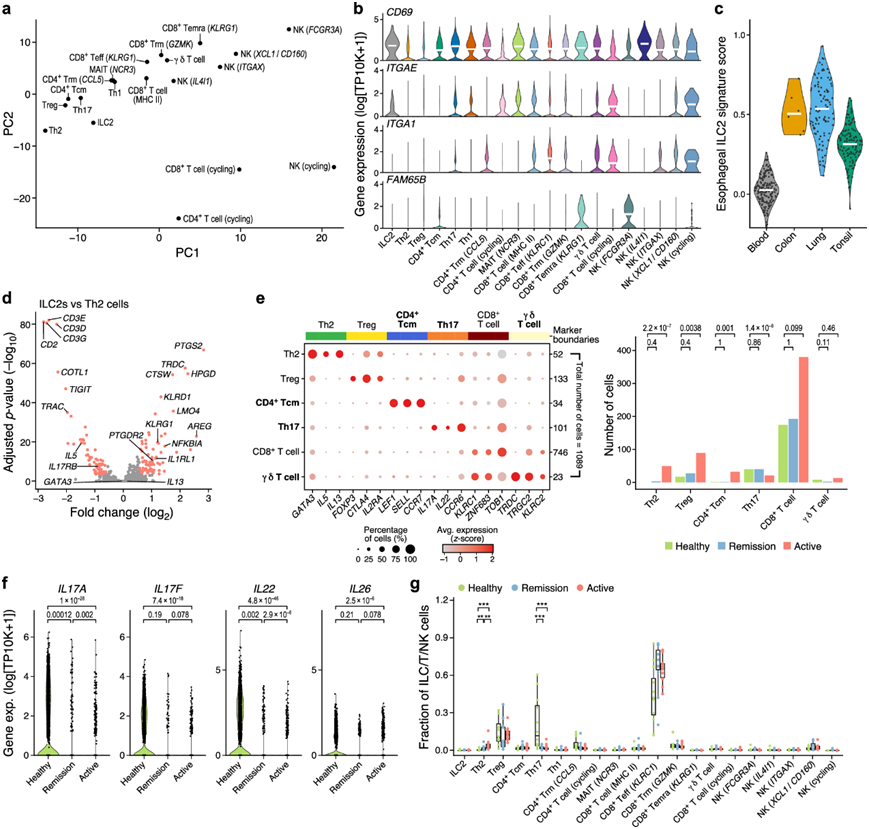
图4. EoE 中 ILC2 和 T 细胞的表征。
(a) T、NK 和 ILC 细胞室。(b) 组织驻留(CD69、ITGAE、ITGA1)和循环(FAM65B)标记基因在 T/ILC/NK 区室中各子集中的表达分布。(c) 来自不同组织的 ILC2 中食管 ILC2 特征的分数分布。(d) ILC2 之间每个基因(点)差异表达的显著性。(e) 左:标记基因的平均表达量和表达细胞比例。右:每种条件下检测到的每个T细胞子集的细胞比例。(f) 关键细胞因子基因的表达分布。(g) 每次活检中每个T/NK/ILC细胞亚群的细胞类型比例分布(y轴)。
05
活动性EoE 中共有和细胞类型特异性基因程序的变化
接下来,他们通过检测健康、活动性 EoE 和缓解样本之间相同类型细胞中差异表达的基因来关注 EoE 的细胞内在变化(图5a)。在 60 个普遍的子集中,总共有数百个基因在活动性 EoE 和健康之间(主要来自上皮细胞、基质细胞或肥大细胞,从顶端细胞中检测到 133 个差异表达基因)或活动性 EoE 和缓解期之间的特定细胞类型中存在差异表达。具体来说,在活动性 EoE 和健康样本之间的细胞中差异表达的基因中,26.7% 在活动性和缓解性样本之间也有类似的差异表达(在相同的细胞类型中)(图 5a)。与标准化一致,22.3%在缓解和健康样本之间有差异表达,与持续存在的差异一致(图 5a)。表明,虽然许多变化在缓解后正常化,但其他变化却没有或仅部分正常化。事实上,在缓解期和健康期之间特定细胞类型中差异表达的许多基因在活动性 EoE 中遵循相似的表达趋势(图 5a)。活动性 EoE 中具有细胞类型特异性表达变化且在缓解期正常化的基因富集了免疫功能和免疫系统过程、胞吐作用和肽酶活动性的调节因子,包括成纤维细胞、巨噬细胞和 cDC2B 中的多个基因(图 5b)。相反,在缓解期持续表达变化的基因在角化、皮肤发育、上皮细胞增殖调节、脂质反应和细胞运动功能调节方面富集,并且主要在顶端细胞和周细胞中表达。
特别是,在活动性EoE中失调并在缓解期完全或部分正常化的成纤维细胞基因高度富集阳性免疫调节因子(图 5b),包括IL13RA2、IGF2、C3、CFD、IGFBP2、GAS6和C1S(图 5c)。IL13RA2编码IL-13的诱饵受体和溃疡性结肠炎中富含的炎症成纤维细胞的特征基因,几乎仅在活动性的EoE中的成纤维细胞中表达(图 5c)。所有成纤维细胞中 IL13RA2+成纤维细胞的比例与PC1相关(图5d),其反映了细胞类型比例的PCA中的疾病状态(图 2d)。这是由于健康参与者和缓解患者中这些细胞的比例较低(图 5d)以及活动性 EoE 患者中与 PC1 的强正相关性(图 5d)。
IL13RA2+成纤维细胞的比例在远端活检中较高,而在匹配的近端活检E1036和E1839中较低,表明位置特异性关联(图 5d)。 Lasso线性回归进一步将IL13RA2+成纤维细胞与IgG+浆细胞和SEPP1+巨噬细胞的百分比相关联(图 5e)。总的来说,这些结果表明 EoE 还具有细胞类型特异性内在表达反应的特征,包括成纤维细胞中IL13RA2的表达,作为疾病活动和食管黏膜变化的重要相关因素。
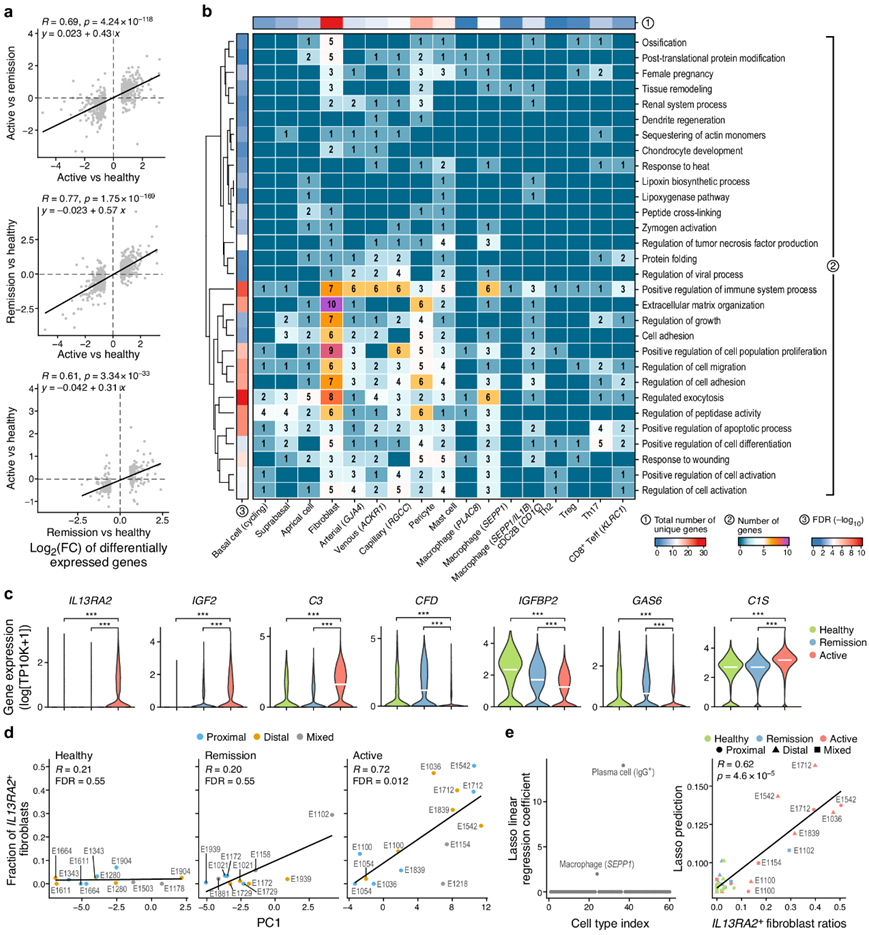
图5. 活动性EoE 的基因程序变化和缓解期的正常化。
(a-b) EoE 中细胞内在程序的基因变化。 (c) 三种条件中成纤维细胞中的表达分布。(d) 来自健康(左)、缓解(中)或活动力EoE(右)患者的每个样本的IL13RA2+成纤维细胞的比例和PC1评分。 (e) 左:各单元格类型的Lasso线性回归系数。(f) 右图:lasso线性回归预测和观察到的IL13RA2+成纤维细胞比率。
06
多细胞相互作用在活动性 EoE 中招募免疫细胞
接下来,他们通过分别将表达配体的细胞与表达健康、缓解和活动性EoE 中的同源受体的细胞连接起来,重点关注推断的细胞与细胞之间相互作用的变化(图 6a)。
在活动性EoE中,与嗜酸性粒细胞相互作用最多的细胞包括成纤维细胞、静脉内皮细胞、TH2细胞、基底上细胞和周细胞。成纤维细胞、静脉内皮细胞和周细胞的细胞比例也存在共同变化(图 6b)。活化的BEC表达粘附分子,包括细胞间粘附分子(ICAM1/2)、P-选择素(SELP)和MADCAM1(黏膜血管寻址细胞粘附分子1)(图 6c),其中在选择性化学引诱剂(如嗜酸细胞趋化因子和CCL5)刺激下,与嗜酸性粒细胞上表达的整合素 α4β7 和 L-选择素结合。嗜酸性粒细胞表达CCR3、eotaxin-1的CC趋化因子受体和CCL26(eotaxin-3)(图 6c)。CCL26也在周细胞和基底上细胞中表达,而CCL11(eotaxin-1)主要在成纤维细胞中表达(图 6c)。IL-5是嗜酸性粒细胞的生长、活化和存活因子,在ILC2和TH2细胞中表达(图 6c)。与缓解期或健康期相比,这些基因在活动性 EoE 中高度表达(图 6d)。
与健康或缓解期相比,在活动期 EoE 中未扩增的成纤维细胞(图 2a)与许多细胞状态的相互作用增加(图 6a)。表达IL-5、IL-4、IL-13和IL-9的TH2细胞与表达同源受体的肥大细胞有许多相互作用(包括IL-9受体基因IL9R和IL2RG)(图6a),并且在细胞比例上共同变化(图6b)。仅在活动性EoE中检测到IL9的表达,IL-9-IL-9R配体受体对是TH2细胞与肥大细胞之间最主要的相互作用。肥大细胞也可能通过IL-33-ST2、liff - lifr /LI6ST和组胺受体HRH1与BEC相互作用(图6e)。BEC还参与嗜酸性粒细胞募集,并表达S1P受体基因S1PR1(图6a-d)。由于BEC可与肥大细胞和嗜酸性粒细胞相互作用,因此S1PR1可能是EoE的治疗靶点。
值得注意的是,除了IL1B(在髓细胞中表达)、IL33(在BEC和静止基底细胞中表达)和IL37(几乎检测不到)外,顶端细胞表达了11种IL-1家族细胞因子基因(图6f)。顶端细胞表达受体拮抗剂IL-1RN,阻断IL-1信号传导(图6f)。
总而言之,相互作用分析提供了对疾病期间观察到的成分差异背后的潜在细胞间相互作用网络的直接见解,并强调了 EoE 的潜在治疗途径,特别是因为其中许多途径已针对其他疾病背景。

图6. EoE 中细胞通过通讯维持组织稳态并协调招募免疫细胞。
(a) 假定的配体-受体相互作用。(b)每对细胞类型的比例之间的Pearson相关系数。(c-d) 基因在每种细胞类型或跨条件的特定细胞类型中的表达分布。(e) 肥大细胞和血液内皮细胞相互作用。编码这些细胞表达的受体和配体对的基因的肥大和内皮细胞子集中的平均表达和表达细胞的比例。(f) 来自活动性EoE 的顶端细胞表达大多数 IL-1 家族细胞因子基因和受体拮抗因子。
07
EoE 风险基因表达凸显了顶端细胞特异性模块
最后,他们通过全基因组关联研究 (GWAS)、候选基因关联研究、表达数量性状位点 (eQTL) 分析或外显子测序分析了与 EoE 风险相关的 52 个基因的细胞类型特异性表达。在与 EoE 相关的孟德尔疾病的九个致病基因中,四个(STAT3、PTEN、ERBB2IP和TGFBR2)在基质细胞和骨髓细胞中表达,两个(DOCK8和TGFBR1)也经常在骨髓细胞中表达,两个(DSP和SPINK5)主要在上皮细胞中表达,其中一个(DSG1)表达较弱(图S10a)。
在其他假定的 EoE 风险基因中,56.8% 在一个或多个细胞亚群中表达。上皮细胞,尤其是顶端细胞,表达CAPN5/14、FLG和SHROOM3。CAPN5/14和SHROOM3表达在顶端细胞之间也存在相关性(图S10b),表明顶端细胞对 EoE 病理生理学的潜在贡献。其他推测的EoE风险基因在静止基底细胞(TSLP)、成纤维细胞(FBN1和NOVA1)、BEC (SEMA6A和LRRC32)、周细胞(CCL26)、肥大细胞(IL1RL1)、ILC2和TH2细胞(GATA3和KIF3A)、cDC2As和cdc2c (ATP10A)中特异性表达。虽然某些循环细胞亚群(如成纤维细胞、BEC、浆细胞和NK细胞)比相应的非循环细胞亚群表达更多的风险基因,但这可能是由于更高的RNA含量和scRNA-seq复杂性(图S10a)。
孟德尔风险基因和假定的EoE风险基因根据它们的细胞类型特异性关联和共表达形成模块(图S10d),其中一些在同一模块中捕获孟德尔风险基因和共同风险基因(GWAS)。他们鉴定了顶端细胞特异性基因(GWAS 基因SHROOM3、CAPN5、CAPN14和FLG以及孟德尔基因DSP和SPINK5)、TH2 和 ILC2 特异性基因(GWAS 基因GATA3和KIF3A)、循环 BEC 的模块。特定基因(GWAS基因LRRC32和WDR36),以及与多种免疫细胞相关的模块(孟德尔基因TGFBR1和PTEN以及GWAS基因STAT6和SLC25A24)(图S10c-d)。
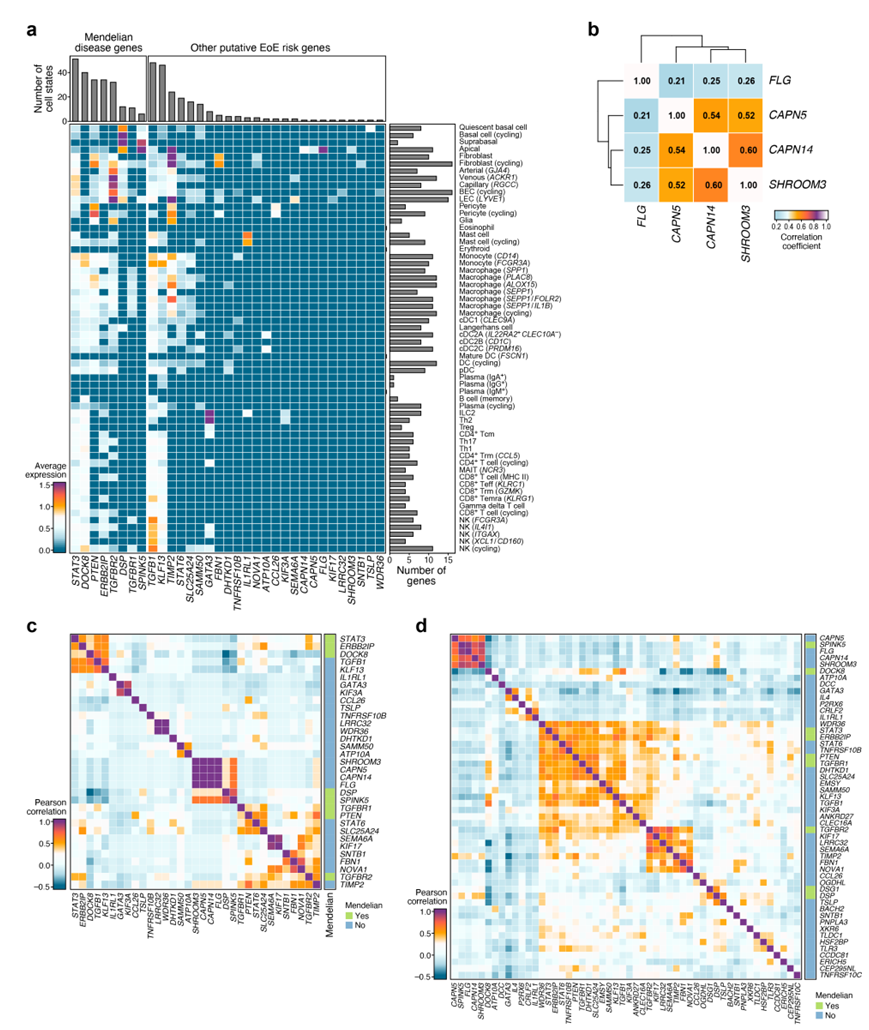
图S10. 食管细胞图谱中EoE风险基因的表达。
(a) 孟德尔和常见EoE风险基因的细胞类型特异性表达。 (b-d) 风险基因在细胞类型内和细胞类型间的模块表达共同变化。
+ + + + + + + + + + +
结 论
本项研究揭示了 60 个食管黏膜细胞亚群以及细胞状态、组成和相互作用的功能改变,突出了以前不清楚的 EoE 特征。活动性疾病表现出ALOX15 +巨噬细胞、PRDM16+表达 EoE 风险基因ATP10A的树突状细胞和循环肥大细胞的富集,同时 TH17 细胞减少。配体-受体表达揭示了嗜酸性粒细胞募集程序、疾病中成纤维细胞相互作用的增加以及IL-9+ IL-4+ IL-13+TH2 和内皮细胞作为潜在的肥大细胞相互作用物。炎症相关特征的解决包括肥大细胞和 CD4+TRM细胞收缩以及嗜酸性粒细胞趋化剂、生长和生存因子的细胞类型特异性下调。
+ + + + +



 English
English


