文献解读|Obesity(9.298):乌头酸脱羧酶1对小鼠血糖稳态和肥胖的调节作用
✦ +
+
论文ID
原名:Aconitate decarboxylase 1 regulates glucose homeostasis and obesity in mice
译名:乌头酸脱羧酶1对小鼠血糖稳态和肥胖的调节作用
期刊:Obesity
影响因子:9.298
发表时间:2022.8.4
DOI号:doi: 10.1002/oby.23509
背 景
肥胖是一项日益严重的公共卫生挑战,其与胰岛素抵抗和II型糖尿病密切相关。肥胖具备慢性、低度的全身性炎症特征。脂肪组织是全身炎症的主要代谢组织,脂肪组织炎症与肥胖期间的代谢调节和免疫应答有关。研究表明,线粒体代谢及代谢产物在调节炎症信号和巨噬细胞表型中至关重要。衣康酸是由顺乌头酸酶1(Acod1)产生的代谢物,在促炎巨噬细胞活化过程中显著上调,同时衣康酸信号通路的增强可以有效减轻各种疾病动物模型的炎症反应。但是,还未见关于Acod1/衣康酸调节葡萄糖代谢、肥胖或糖尿病的研究。本研究对Acod1敲除小鼠进行饮食诱导肥胖(DIO),结合RNA-Seq技术,研究Acod1在肥胖和糖尿病发展中的作用。
实验设计

结 果
01

在DIO期间, Acod1表达增加,但不影响体重增加或脂肪沉积
通过基因敲除小鼠计划(KOMP)得到Acod1-/-小鼠模型,且在脂多糖(LPS)诱导后,骨髓源性巨噬细胞中的Acod1表达受到抑制,表明基因敲除模型构建成功(图1A)。LPS诱导的全身性炎症导致WT小鼠性腺白色脂肪组织(gWAT)、肠系膜白色脂肪组织 (mWAT) 和腹股沟白色脂肪组织 (iWAT) 中的Acod1表达显著增加(图1B);同样,DIO野生型小鼠(WT)的gWAT中Acod1表达也显著增加(图1C)。此外,经LPS诱导的全身性炎症导致Acod1在全身多处组织中表达增加,而在肝脏和脾脏中,LPS诱导的衣康酸产生量最多(图2A, B)。
对WT和Acod1-/-小鼠饲喂高脂饮食12周,发现它们的体重呈等速增长,摄食量也无显著差异(图1D,E)。尽管Acod1-/-小鼠终末体重略高于WT组,但这是因为Acod1-/-小鼠的基础体重更大。此外,WT和Acod1-/-小鼠的脂肪质量和瘦体重没有显著差异(图1F),gWAT和iWAT质量也无显著差异,但Acod1-/-小鼠的棕色脂肪组织(BAT)质量显著高于WT组(图1G)。

图1 在炎症和肥胖期间,脂肪组织Acod1表达增加

图2 LPS诱导的Acod1表达和衣康酸产生
02

DIO期间,Acod1在维持葡萄糖稳态和胰岛素敏感性中起重要作用
在饲喂高脂饮食2周后,WT和Acod1-/-小鼠的葡萄糖耐量试验(GTT)结果没有显著差异,但饲喂12周后,Acod1-/-小鼠血糖浓度显著高于WT组(图3A)。同样,胰岛素耐量试验 (ITT)结果表明,注射胰岛素后,Acod1-/-小鼠血糖浓度显著高于WT组,出现胰岛素抵抗现象(图3B)。此外,WT和Acod1-/-小鼠空腹血糖无显著差异,Acod1-/-小鼠空腹胰岛素水平显著高于WT组,提示出现胰岛素抵抗(图3C)。
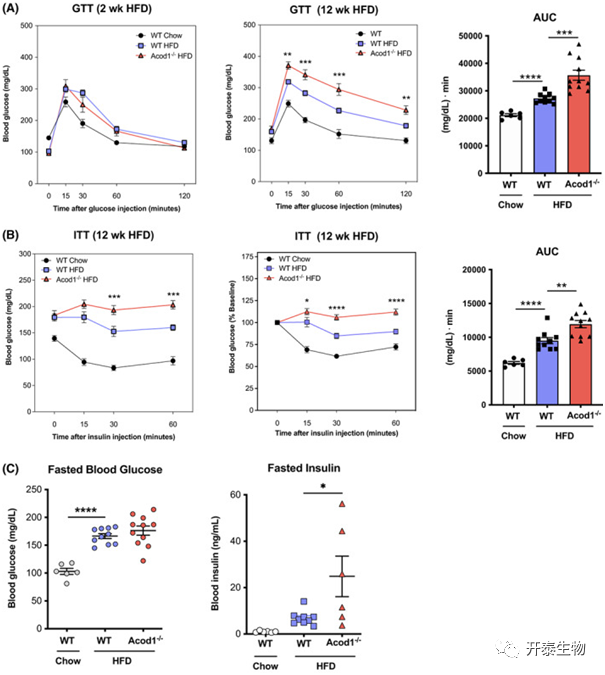
图3 Acod1敲除在肥胖期间对糖代谢的影响
03

Acod1-/-小鼠脂肪组织炎症基因表达增加
组织学检测表明,饲喂高脂饮食不影响附睾脂肪组织(eWAT)的形态和结构(图4A)。Acod1敲除上调MCP1和IL-1RA表达,但TNFα 和 IL-6无显著差异;此外,Adiponectin mRNA表达显著下降(图4B)。接下来对高脂饮食诱导的WT和Acod1-/-小鼠eWAT进行了RNA-seq,鉴定了1033个DEGs。基因集富集分析(GSEA)显示Acod1-/-小鼠的炎症基因显著富集到B细胞活化、淋巴细胞活化、干扰素应答和骨髓应答等(图4C-F)。
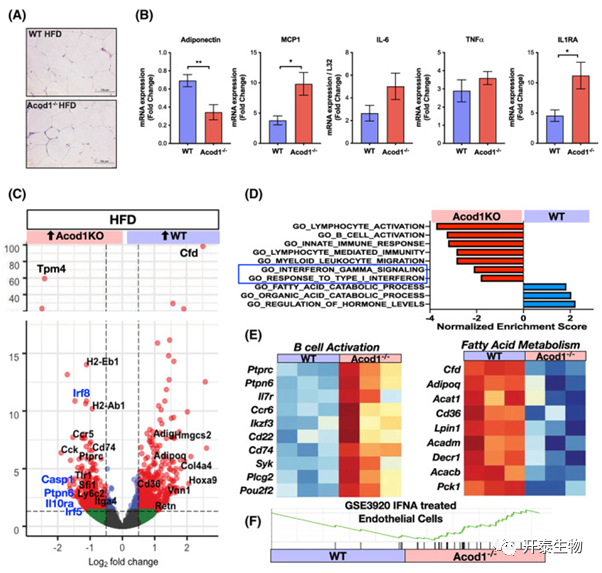
图4 Acod1-/-小鼠eWAT中炎症基因表达增加
04

脂肪细胞表达Acod1,衣康酸处理后炎症信号减弱
为了进一步评估衣康酸在调节脂肪细胞功能中的作用,作者用LPS刺激3T3-L1脂肪细胞,发现Acod1表达显著增加(图5A)。为了评估衣康酸衍生物4-OI和DMI是否影响脂肪细胞的分化,用或不用衣康酸类似物处理3T3-L1细胞,未观察到细胞增殖、分化或形态学差异(图5B-D)。为了进一步评估衣康酸衍生物对炎症的作用,在存在或不存在4-OI或DMI的情况下,用LPS处理3T3-L1细胞,4-OI和DMI均显著抑制LPS诱导的MCP1和IL-6表达,同时Nqo1基因(一个Nrf2依赖基因)表达增加(图5 E)。棕榈酸(PA)是血清中最丰富的游离脂肪酸之一,它促进组织中的炎症和胰岛素抵抗。与LPS刺激相似,用PA处理3T3-L1细胞导致Acod1 mRNA表达增加(图5F)。此外,作者还评估了DMI的影响,发现DMI(125 μM)预处理显著抑制了PA诱导的炎症基因表达(图5G)。
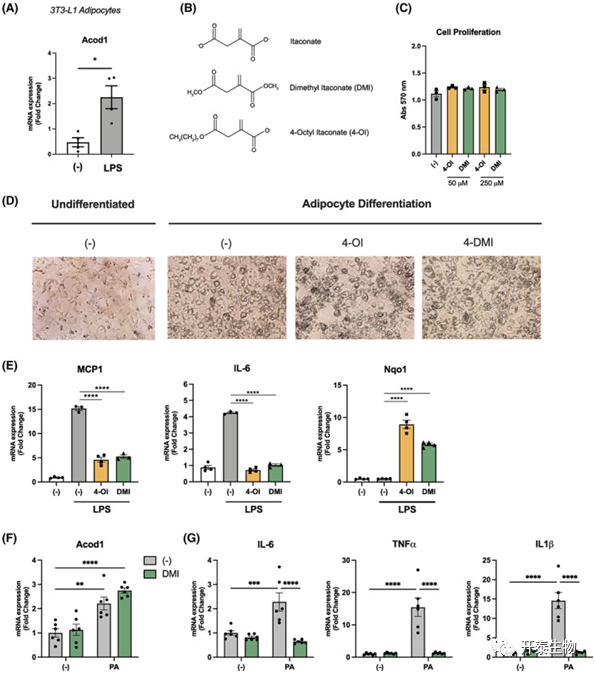
图5 3T3-L1脂肪细胞表达Acod1,且经衣康酸处理后炎症信号减弱
05

Acod1-/-小鼠随年龄增长出现自发性肥胖、葡萄糖耐受不良和脂肪组织炎症
WT和Acod1-/-小鼠在第六个月时体重出现差异,12个月时,Acod1-/-小鼠体重和脂肪组织重量显著高于WT组(图6A、B)。GTT和ITT试验进一步表明,Acod1-/-小鼠存在葡萄糖不耐受和胰岛素抵抗(图6C、D)。组织学分析表明,Acod1-/-小鼠eWAT中的脂肪细胞尺寸更大(图6E)。此外,Acod1-/-小鼠心脏和肾脏重量也显著增加,Acod1-/-小鼠心脏肥大与心肌细胞大小增加相关(图7A-C)。
进一步对eWAT进行RNA-Seq。PCA分析显示,老年Acod1-/-小鼠和高脂饮食组(HFD)组集群,老年Acod1-/-小鼠中炎症基因显著富集到巨噬细胞活化、淋巴细胞活化。和DIO小鼠类似,老年Acod1-/-小鼠中与B细胞活化有关的基因表达增加,这表明Acod1-/-小鼠随着年龄增长而肥胖,导致了不健康的WAT扩张和骨髓炎症(图8A-D)。

图6 Acod1-/-小鼠随年龄增长出现自发性肥胖和葡萄糖代谢受损
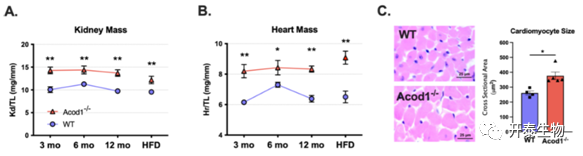
图7 Acod1-/-小鼠的器官肥大

图8 老年Acod1-/-小鼠的炎症基因表达增加及12月龄小鼠eWAT的RNA-Seq
06

Acod1-/-小鼠脂肪组织中脂肪酸合成基因表达增加
基于以上发现,作者使用实验动物检测系统(CLAMS)进一步探究了Acod1-/-小鼠随年龄增加而自发性肥胖的机制。CLAMS期间,Acod1-/-小鼠的食物摄入量增加,每只小鼠的静息能量消耗增加,当瘦体重正常化时,这些都消失了(图9A、B)。Acod1-/-和WT小鼠的活动和呼吸交换率无差异。底物利用评估表明,与WT组相比,Acod1-/-小鼠的脂肪氧化减少,葡萄糖氧化增加(图8 C)。eWAT的RNA-Seq鉴定到1279个DEGs。Acod1-/-小鼠中,和脂肪合成、脂质生物合成、脂肪酸合成等通路相关的基因(如Acly, Fasn, Slc27a1, Acbp)显著增加(图9D、E)。
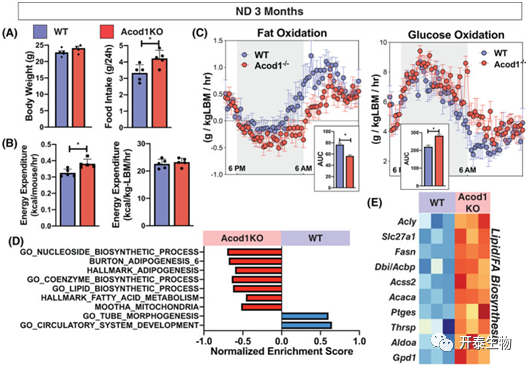
图9 非肥胖Acod1-/-小鼠的能量底物利用发生了改变
+ + + + + + + + + + +
结 论
本研究加强了我们对Acod1/衣康酸通路在免疫代谢调节中的理解,并表明Acod1可以防止DIO和年龄引发的代谢功能障碍,这对我们理解肥胖和衰老引起的代谢功能障碍的发病机制至关重要。
+ + + + +



 English
English

