文献解读|EBioMedicine(8.143):利用正常宫颈、宫颈癌前病变和宫颈癌的单细胞转录组鉴定宫颈癌干细胞
原名:Identification of cervical cancer stem cells using single-cell transcriptomes of normal cervix, cervical premalignant lesions, and cervical cancer
译名:利用正常宫颈、宫颈癌前病变和宫颈癌的单细胞转录组鉴定宫颈癌干细胞
期刊:EBioMedicine.
影响因子:8.143
发表时间:2023.06
DOI号:10.1016/j.ebiom.2023.104612.
背 景癌症是妇科恶性肿瘤中第四大死亡原因。目前的筛查和检查无法准确区分可能进展为侵袭性癌症的少数人和异常会自发退化的大多数人。这种不准确主要是因为我们对宫颈上皮内瘤变自然进展的细胞和分子机制了解有限,尽管其组织学定义明确。此外,HPV感染的关键靶点,即宫颈癌症干细胞或肿瘤起始细胞,也仍不清楚。因此,全面了解宫颈肿瘤的多细胞生态系统至关重要。单细胞信使核糖核酸测序(scRNA-seq)是深入了解宫颈微环境的有力工具。在本研究中,作者对来自5名健康对照、4名高级鳞状上皮间病变(HSIL)患者、5名宫颈微浸润癌(MIC)患者和6名浸润性宫颈鳞状细胞癌(ICC)患者的20个宫颈活检组织的~122400个细胞进行了scRNA-seq。本研究专注于识别宫颈CSC,并比较不同疾病阶段的宫颈生态系统。
实验设计
结 果01

利用正常宫颈、宫颈癌前病变和宫颈癌的单细胞转录组鉴定宫颈癌干细胞
为了表征宫颈癌前病变和恶性病变的多细胞生态系统,对20个活组织进行了scRNA-seq,包括5个健康对照(CON)、4个HSIL、5个MIC和6个ICC样本(图1a–e)。质量控制后,总共保留了~122400个细胞进行分析。在这些细胞中,33622个细胞来自CON组,20880个细胞来自HSIL组,29068个细胞来自MIC组,38848个细胞来自ICC组。使用基于图的均匀流形近似和投影(UMAP),确定了29个高置信度细胞簇(图1e)。
基于典型的基因标记物表达(图1f和g),鉴定了九种主要的细胞类型:T细胞、B细胞、鳞状上皮细胞、柱状上皮细胞、巨噬细胞、中性粒细胞、肥大细胞、成纤维细胞和内皮细胞(图1b)。从CON组到ICC组,相对细胞谱系丰度显示出明显的逐步变化(图1h和i)。

图1正常宫颈、癌前病变和癌症的单细胞图谱。
(a) 显示scRNA-seq实验设计的示意图。总共,来自20个宫颈活检组织(5个健康对照[CON]、4个高级别上皮内瘤变[HSIL]、5个宫颈微浸润癌[MIC]和6个浸润性宫颈鳞状细胞癌[ICC])的-122400个细胞被纳入研究。(b) 通过已知标记基因的表达鉴定的~122400细胞中9个主要细胞群的UMAP图,包括T细胞、b细胞、鳞状上皮细胞、柱状上皮细胞、巨噬细胞、中性粒细胞、肥大细胞、成纤维细胞和内皮细胞。(c) 按样本来源聚类的细胞的UMAP图。(d) 按组起源聚集的细胞的UMAP图。(e) 在~122400个细胞中鉴定的28个细胞簇的UMAP图。(f) 标准细胞标记用于标记具有细胞同一性的簇,如UMAP图所示。(g) 用于鉴定主要细胞类型的代表性基因的小提琴图谱。(h) CON、HSIL、MIC和ICC样本中9种主要细胞类型的平均比例。(i) CON、HSIL、MIC和ICC组中每个样本中9种主要细胞类型的比例。。
02

恶性细胞的鉴定和功能鉴定
上皮样细胞被进一步分为16个簇(图2a–e)。首先检测了每个上皮细胞簇中宫颈癌特异性标记物的表达。大多数宫颈癌标记物在簇C0、C4、C6、C10和C25中高度表达,进一步表明这些簇代表肿瘤细胞(图2b–d)。另外C2簇也高度表达大量的子宫颈癌症标记物,这种表达高于其他肿瘤细胞(图2b–d)。CNV分析证实簇C0、C4、C6、C10和C25是肿瘤细胞;C2细胞是宫颈CSC(图2f)。
接下来对已鉴定的恶性细胞簇(C0、C4、C6、C10和C25)和潜在的CSC簇(C2)进行了功能分析(图2e–h)。单样本基因集富集分析(ssGSEA)显示,与其他上皮样细胞簇相比,C2簇中的E2F靶标、MYC靶标、G2M检查点、有丝分裂纺锤体、糖酵解和精子发生途径显著富集(图2h)。在CancerSEA特征富集分析中,C2簇中的DNA修复、细胞周期、DNA损伤、侵袭和增殖特征最为富集(图2e)。
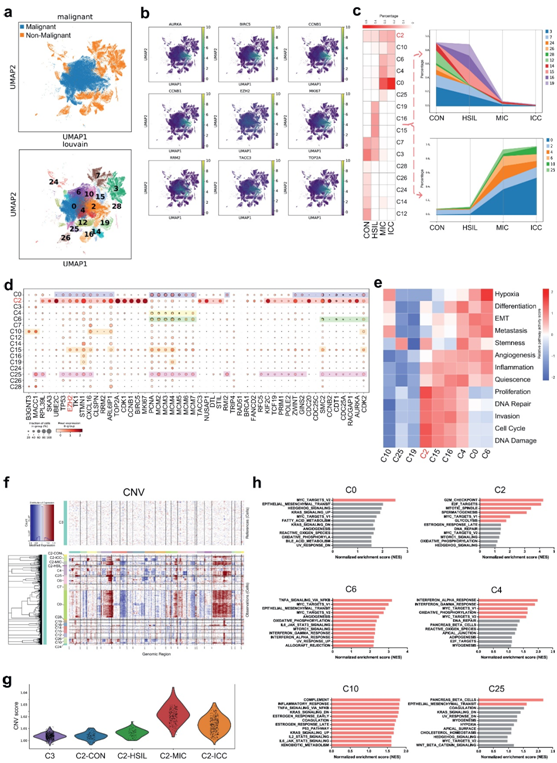
图2 恶性细胞的鉴定和功能表征。
(a) 恶性/非恶性细胞着色的上皮样细胞的UMAP图(顶部)或簇(底部)。(b) UMAP图显示典型宫颈癌症标记物在上皮样细胞簇中的表达和分布。(c) 热图(左)和折线图(右)显示了CON、HSIL、MIC和ICC组中上皮样细胞和恶性细胞簇的比例变化。(d) 点图显示不同上皮样细胞和恶性细胞簇中典型宫颈癌症标记物的平均表达。宫颈癌标记物在簇C0、C2、C4、C6、C10和C25中高度表达。点的大小与各组中表达标记物的细胞的比例成比例。(e) 热图显示了恶性细胞(C0、C4、C6、C10和C25)、潜在的C2宫颈干细胞和HSIL特异性上皮样细胞(C15、C16和C19)之间通过ssGSEA对每个细胞进行评分的CancerSEA特征的差异。(f)根据scRNA-seq数据推断的显示单细胞中大规模CNVs的热图。(g) 小提琴图显示了按组划分的C2子簇中的CNV分数分布。(h) 与其他上皮样细胞相比,在恶性细胞簇中通过ssGSEA鉴定的前12个上调的标志性途径。
03

子宫颈癌症干细胞的鉴定与鉴定
作者计算了上皮和恶性细胞簇的基于mRNA表达的干细胞指数(mRNAsi),C2具有最高评分(图3a),且随着病变进展,C2的mRNAsi得分逐渐降低(图3b)。此外,轨迹分析显示,C2是肿瘤细胞簇进化的起点(图3d)。接下来探讨了C2干细胞在从正常宫颈组织向浸润性宫颈癌恶性转化过程中的功能变化。宫颈CSC的功能变化具有两个主要特征:以高增殖和低分化为特征的原始非恶性干细胞特性逐渐减弱,以EMT、侵袭和转移为特征的CSC特性逐渐增强(图3e和f)。
使用TCGA数据库中的数据进行的生存分析表明,C2标记基因特征高表达的癌症患者的无进展生存率显著低于C2标记低表达的患者(图3h)。此外高百分比的C2簇细胞与较差的总生存率有关(图4b)和无病生存率(图4c)。癌症病灶中C2簇细胞的比例明显高于成对癌旁组织(图4d)。不同病理亚型的癌症病变中C2簇细胞率没有差异(图4g)。
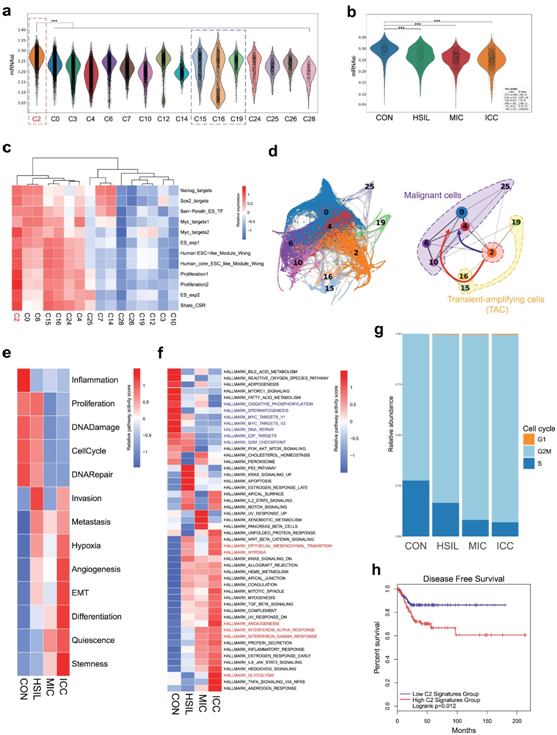
图3 子宫颈癌症干细胞的鉴定和特性。
(a) 显示上皮和恶性细胞簇基于mRNA表达的干性指数(mRNAsi)分布的小提琴图。(b) Violin图显示了根据各组的mRNAsi在C2簇中的分布,这表明C2 mRNAsi评分随着病变进展而逐渐降低。(c)热图显示了上皮和肿瘤细胞簇中富集的干细胞相关基因特征。聚类C2显示出干细胞相关基因特征的显著富集。(d) 恶性细胞(C0、C4、C6、C10和C25)、宫颈干细胞(C2)和HSIL特异性上皮样细胞(C15、C16和C19)的发育轨迹。(e) 根据ssGSEA分析确定的组,热图显示C2簇中富集的CancerSEA特征。(f) 热图显示了根据通过ssGSEA分析鉴定的组的C2簇的富集标志性途径。(g)条形图显示了按组划分的簇C2的细胞周期分布。(h) Kaplan–Meier图显示,TCGA数据集中具有高簇C2标记(C2前30个标记基因特征)表达的CESC患者(n=292)的无进展生存率显著较低(p=0.012)。
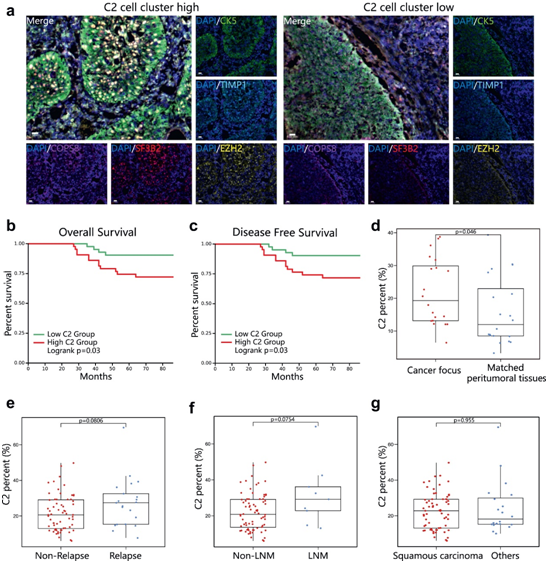
图4 高C2簇细胞百分比的验证与不良患者预后相关。
(a) 宫颈癌组织中C2簇细胞的多重免疫荧光染色的代表性图像。(b)癌组织中C2簇细胞比例不同的癌症患者(n=85)的总体生存分析。(c) 癌组织中C2簇细胞比例不同的宫颈癌症患者(n=85)的无病生存分析。(d) 宫颈癌症患者癌组织和匹配癌旁组织C2簇细胞频率的比较。(e) 复发患者和未复发患者癌组织中C2簇细胞频率的比较。(f) 有淋巴结转移(LNM)患者和无淋巴结转移患者(非LNM)之间癌组织中C2簇细胞频率的比较。(g) 鳞状细胞癌患者和其他病理类型患者癌组织中C2簇细胞频率的比较。
04

解读HSIL、MIC和ICC中恶性细胞的功能异质性
作者对HSIL衍生的肿瘤细胞进行了CNV分析,发现这些细胞表现出异常的CNV信号,证实了肿瘤细胞的身份(图5a和b)。因此研究了恶性细胞在HSIL、MIC和ICC阶段的功能变化。在HSIL组中,仅发现了两种元程序,包括细胞周期和上皮分化(图5c)。在MIC中鉴定出6个元程序;在ICC组中,观察到所有9个元程序(图5a)。这些观察结果表明,恶性细胞的异质性随着疾病的进展而增加。特别是在TCGA数据集中,低氧代谢相关基因高表达的癌症患者的总体生存率显著低于低氧相关表达的患者(图5d)。缺氧与肿瘤增殖、侵袭、转移和血管生成密切相关。此外,通过肿瘤相关特征的ssGSEA比较来自HSIL、MIC和ICC样本的恶性细胞簇,发现恶性细胞中的EMT、转移、血管生成、静止、炎症、缺氧和分化随着病变进展而逐渐增加(图5e和f)。

图5 恶性细胞功能异质性的表征。
(a) 热图和(b)小提琴图,显示了CNV评分在HSIL衍生的肿瘤细胞(C0、C4和C10)中的分布。
(c) 热图描绘了源自HSIL(左)、MIC(中)和ICC(右)的肿瘤内程序的成对相关性。当将这些样本放在一起考虑时,发现了九个突出的元程序,包括细胞周期、上皮-间充质转化(EMT)、上皮分化((Epi dif. 1 和Epi dif. 2)、LncRNA(富含LncRNA的1和富含lncRNA2)、应激反应(应激)、IFN反应基因(IFN反应)和缺氧信号。(d) Kaplan–Meier图显示,来自TCGA数据集的具有高缺氧特征表达的CESC患者的无进展生存率显著较低。(e) HSIL、MIC和ICC组恶性细胞簇(C0、C4、C6和C10)的丰富CancerSEA特征。(f) 热图显示了HSIL、MIC和ICC组恶性细胞簇(C0、C4、C6和C10)中富集的特征通路。
05

高危HPV基因在恶性细胞和癌症干细胞中的表达特征
作者在所有上皮和恶性细胞簇中检测到高风险HPV(HR-HPV)转录物的表达(图6a和b)。结果表明,来自CON组的细胞没有表达HR-HPV基因(图6c)。此外在不同疾病阶段的C2 CSC和恶性细胞簇中鉴定了HR-HPV转录物的不同表达特征,以及共同特征(图6d)。来自HSIL组的C2 CSC和恶性细胞簇(C0、C4、C6和C10)高表达E5,而在MIC阶段在这些簇中观察到高E7表达。此外,ICC组中的C2 CSCs和大多数肿瘤细胞簇(包括C0、C4和C6)表现出高E6表达。通过恶性细胞簇的整合分析获得了类似的结果(图6d)
研究结果揭示了在CSCs和肿瘤细胞簇中HR-HPV转录物表达和宿主基因表达之间的相关性(图6e)。接下来生存分析表明,这些基因集高表达的宫颈癌患者的生存率显著高于低表达的患者(图6f),这表明HPV相关的宿主基因可能与HPV和肿瘤免疫有关。
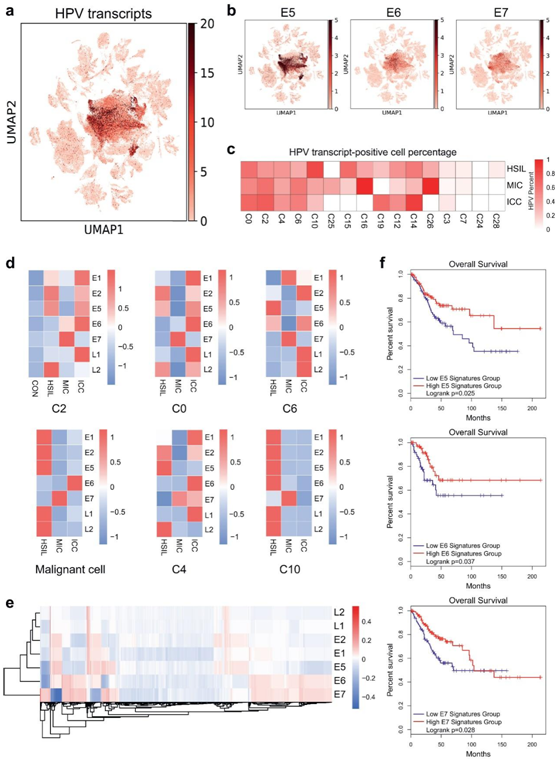
图6 高危型HPV基因和HPV基因相关宿主基因的基因表达谱。
(a) 显示HPV转录物在上皮细胞和恶性簇中的表达和分布的UMAP图。(b) UMAP图显示E5、E6和E7在上皮细胞和恶性簇中的表达和分布。(c) 热图描绘了上皮细胞、癌症干细胞和恶性簇中HPV转录阳性细胞的百分比。(d) 热图显示癌症干细胞和恶性肿瘤簇中HPV转录表达。(e) 热图显示了恶性细胞和癌症干细胞簇中HPV转录表达和宿主基因表达之间的相关性。(f) Kaplan–Meier图显示,TCGA数据集中E5相关(上)、E6相关(中)和E7相关(下)宿主基因集高表达的CESC患者(n=292)的总生存率显著较高(对数秩检验)。
06

CON、HSIL、MIC和ICC中的T细胞聚类和功能分析
作者分析了18697个T细胞中的基因表达,这些T细胞分为10个簇(图7a)。来自T0、T2、T3、T7和T9的T细胞表现出高CD8A和CD8B表达,表明这些细胞是CD8+T细胞,对于CD8+T细胞簇,簇CD8-T9高表达LEF1和TCF7,并被鉴定为初始CD8+T淋巴细胞(图7b–d)。另外簇CD8-T2和CD8-T3表现出高细胞毒性标记物(NKG7、GZMA、GZMH和KLRD1)和耗竭标记物表达(TIGIT、HAVCR2和LAG3)(图7b–c)。生存分析显示,具有高CD8-T2和CD8-T3标志性基因表达的TCGA宫颈鳞状细胞癌(CESC)患者的无进展生存率显著低于低表达患者(图7f)。
结果表明,初始T细胞CD8-T9形成起点,CD8-T0/T7是终态细胞毒性T细胞,CD8-T2/T3是活化偶联耗尽T细胞的终点。两种末端状态之间的潜在联系,其中细胞毒性T细胞可以转化为活化偶联的耗尽T细胞(图7g)。

图7 CON、HSIL、MIC和ICC组宫颈浸润性T细胞的功能状态。
(a) 18697个T细胞的UMAP投影显示了10个主要簇(上部)和组分布(下部)。(b)UMAP图,其显示了经典T细胞标记物在T细胞簇中的表达和分布。(c) T细胞特异性标记物在不同集群中的表达。(d) 折线图显示了CON、HSIL、MIC和ICC组的相对T细胞丰度。ICC组中细胞毒性效应T细胞簇CD8-T0的比例显著较低。MIC和ICC组中活化偶联的耗尽的CD8+T细胞簇T2和T3显著增加。(e) 热图显示T细胞簇的富集细胞毒性和耗竭特征。CD8+T细胞簇(T2和T3)表现出激活偶联耗竭程序。(f) Kaplan–Meier图显示,来自TCGA数据集的具有高CD8-T2信号(上)和CD8-T3信号(下)表达的CESC患者的无进展生存率显著较低(对数秩检验)。(g) CD8+T细胞簇(T0、T2、T3、T7和T9)的发育轨迹揭示了一种二元分支结构,其两种末端状态之间存在联系。
07

CON、HSIL、MIC和ICC中的宫颈微环境组成和细胞-细胞相互作用
为了表征宫颈微环境中的细胞间相互作用,研究了基于单细胞中配体-受体基因表达的细胞-细胞相互作用(图8a),鉴定了CSC和内皮细胞之间的几种血管生成相关的相互作用,包括VEGFA-FLT1、VEGFA-KDR、NRP2-SEMA3F和NOTCH2-JAG2(图8b);宫颈干细胞和成纤维细胞之间的相互作用包括EMT、增殖和转移促进(图8c);宫颈干细胞和T细胞之间的免疫抑制相互作用,包括HLA-E-KLRC1和LGALS9-HAVCR2(图8e)。
生存分析显示,G1组(HSIL样)和G2组(MIC样)的总生存率相似。G1和G2的存活率显著高于G3的存活率(ICC样)(图8f)。之后计算并比较了四组中每种主要细胞类型的IFN评分(IFN-α和IFN-γ评分)。结果表明,宫颈癌症微生态系统中的IFN反应总体上调(图8g)。

图8 CON、HSIL、MIC和ICC组宫颈微生态系统的组成和细胞间相互作用。
(a) 圆圈图显示了CON、HSIL、MIC和ICC组中不同细胞类型之间假定的细胞间相互作用。(b–e)点图显示CSC与内皮细胞(b)、成纤维细胞(c)、巨噬细胞(d)和T细胞(e)之间所选配体-受体相互作用的平均表达水平。(f) Kaplan–Meier图(logrank检验)显示G1组(HSIL样)和G2组(MIC样)的总生存率相似。TCGA数据集显示,两组CESC患者的总生存率均显著高于G3组(ICC样)。(g) 箱线图显示了CON、HSIL、MIC和ICC组中细胞宫颈微环境组成中单个细胞的IFN-α(上)和IFN-γ(下)评分。结果显示,除内皮细胞外,ICC组大多数主要细胞类型的IFN评分均显著较高。
+ + + + + + + + + + +
结 论
宫颈多细胞生态系统中IFN反应的整体上调是病变进展过程中的另一个主要特征。干扰素反应在清除病毒感染方面起着重要作用。然而,干扰素途径在慢性病毒感染和癌症中也起着炎症和免疫抑制的关键驱动因素的作用。因此假设干扰素应答是癌症的双刃剑。尽管最初具有对抗HPV感染的功能,但慢性病毒感染的持续IFN反应会诱导无法消除疾病的功能失调的免疫状态,从而促进HPV的持续存在和肿瘤的发展。到目前为止,肿瘤微环境的这种特征仅在EBV相关的鼻咽癌中报道。总的来说本研究结果表明,HPV感染对癌症期间肿瘤微环境的形成和演变具有综合影响。特别地,肿瘤微环境的病毒形成可能是病毒相关肿瘤的共同特征。
+ + + + +



 English
English

