文献解读|Aging Cell(7.8):全蛋白质组分析揭示骨质疏松症中失调的分子特征和加速衰老:一项为期 9.8 年的前瞻性研究
✦ +
+
论文ID
原名:Proteome-wide profiling reveals dysregulated molecular features and accelerated aging in osteoporosis: A 9.8-year prospective study
译名:全蛋白质组分析揭示骨质疏松症中失调的分子特征和加速衰老:一项为期 9.8 年的前瞻性研究
期刊:Aging Cell
影响因子:7.8
发表时间:2023.11.16
DOI号:10.1111/acel.14035
背 景
骨质疏松症 (OP) 是一种常见的骨骼疾病,其特征是骨矿物质密度 (BMD) 降低和骨折风险升高。循环蛋白质组学在骨质疏松症中的作用尚不清楚。全蛋白质组分析有可能为骨质疏松症提供机制见解。
实验设计

结 果
01
研究概述和参与者特征
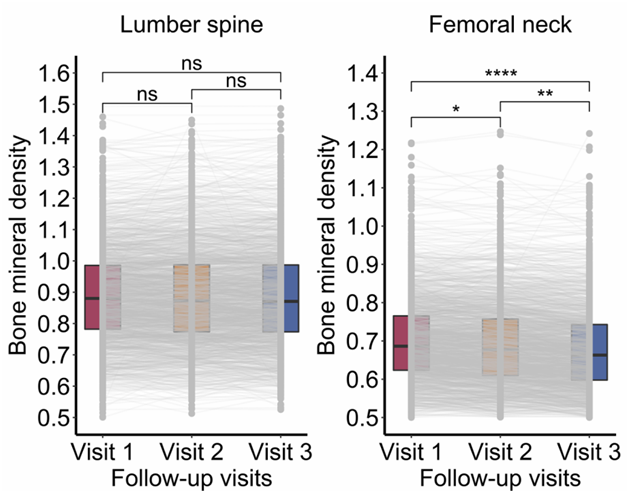
本项研究包括来自广州营养与健康研究 (GNHS) 的 3244 名参与者,从 2008 年到 2019 年每 3 年进行一次随访。研究者团队在基线 (F0) 上分析了413 种血清蛋白,并确定腰椎 (LS) 和股骨颈 (FN) 处的骨矿物质密度 (BMD)(图1)。
首先,他们通过 LightGBM 在发现和内部验证队列中确定了骨质疏松症的基线蛋白质生物标志物。然后,在发现和内部验证队列中通过线性混合效应模型 (LMM) 估计基线血清蛋白和 BMD 之间的关联。使用Meta分析评估了发现和内部验证队列中蛋白质对 BMD 的综合影响。然后使用重要的蛋白质构建蛋白质风险评分(PRS),以评估关节对骨骼结果的“影响”。通过从潜在类轨迹模型 (LCTM) 识别的位点特异性 BMD 轨迹进一步比较了蛋白质平均值。通过 Klemera 和 Doubal 模型 (KDM) 使用 BMD 蛋白生成生物年龄 (BA),以研究骨老化。

图1. 研究队列和设计的概述。
该研究纳入了来自广州营养与健康研究 (GNHS) 的 3244 名参与者,从 2008 年到 2019 年每 3 年进行一次随访。使用液相色谱-串联质谱 (LC-MS/MS) 在基线 (F0) 上对血清蛋白质组学进行了分析。
他们总结了发现组 (n = 1785) 和内部验证组 (n = 1630) 的基线特征(表1)。基线参与者的平均年龄和体重指数(SD)分别为57.5岁,23.1 kg/m 2,其中72%为女性。随访期间的骨质疏松事件发生在 LS 时为 836 例,发生在 FN 时为 521 例。在3 次随访过程中,LS-BMD 显著下降(图S1)。
表1. 来自发现和内部验证参与者的基线特征。
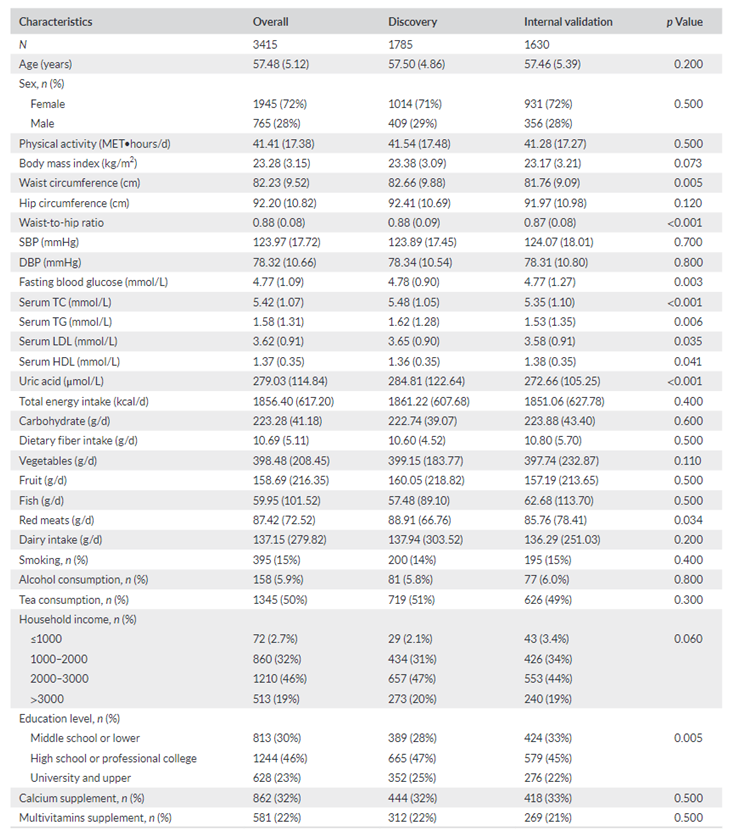
图S1. 骨密度的纵向变化。
02
骨质疏松症蛋白质生物标志物的鉴定
他们在三个时间点对纵向队列蛋白质组学进行了分析(图 S2a)。在9.8年的随访期间,共随访了2966名参与者,将其中的1746名纳入发现队列,1220名纳入内部验证队列(图S2b)。他们使用LightGBM鉴定了53个与骨质疏松相关的蛋白,其中38个蛋白与LS-OP相关(图S3a),28个蛋白与FN-OP相关(图S3b)。LASSO回归发现与骨质疏松相关的蛋白有62个,其中与LS-OP相关的蛋白有43个,与FN-OP相关的蛋白有32个(图S4a)。在发现队列中,所选蛋白准确预测了LS-OP和FN-OP的风险(图S3c-d,图S4b-c)。通过分析发现队列和内部验证队列的差异倍数,能准确评估OP组和对照组之间蛋白质的纵向差异(图2a)。Meta分析显示,其中22种蛋白与骨密度显著相关(图2b)。A2MG蛋白、APOA1蛋白、CO4A蛋白、VTNC蛋白和SAMP蛋白是蛋白-蛋白相互作用网络中最主要的5个蛋白(图2c)。
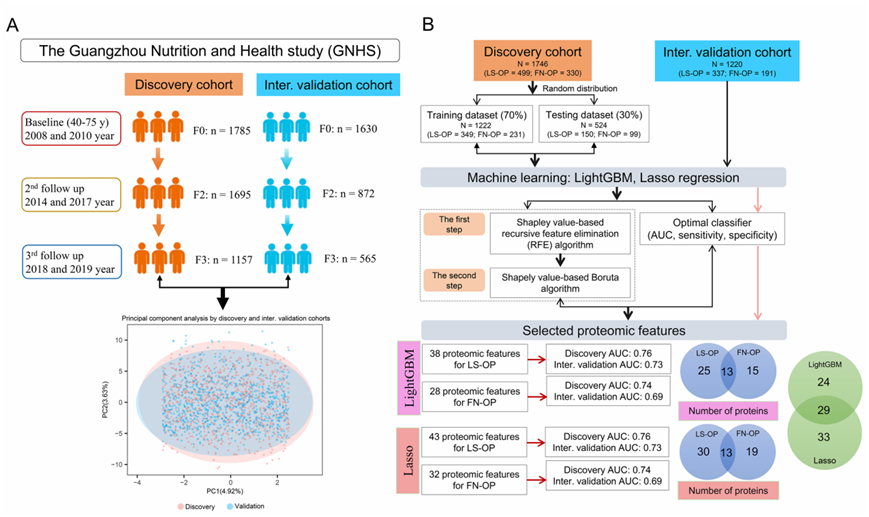
图S2. 预测骨质疏松症风险的机器学习模型。
(A)发现和内部验证队列的纵向血清蛋白质组学概况。(B)基于定量蛋白质组学数据和临床特征构建的机器学习模型的工作流程。
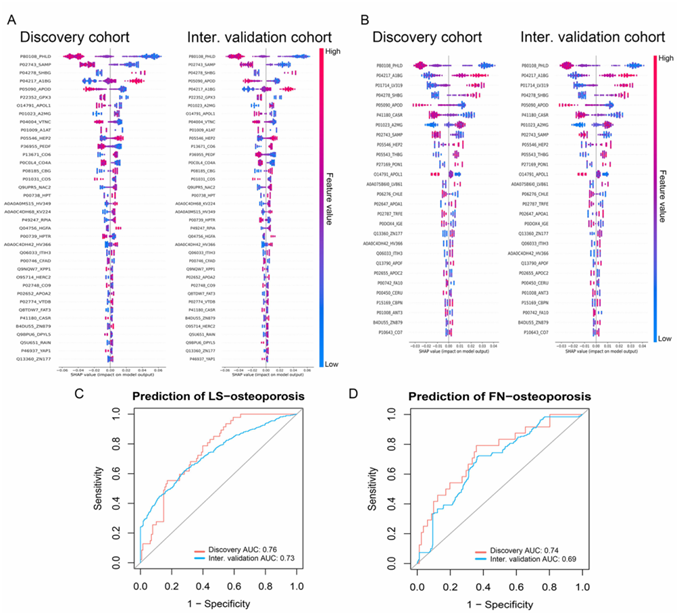
图S3. LightGBM模型鉴定骨质疏松症血清蛋白质组学特征。
LS-OP (A)和FN-OP (B)蛋白质组学特征的Shapley重要性。LS-OP (C)和FN-OP (D) LightGBM模型的受试者工作特征(ROC)图。
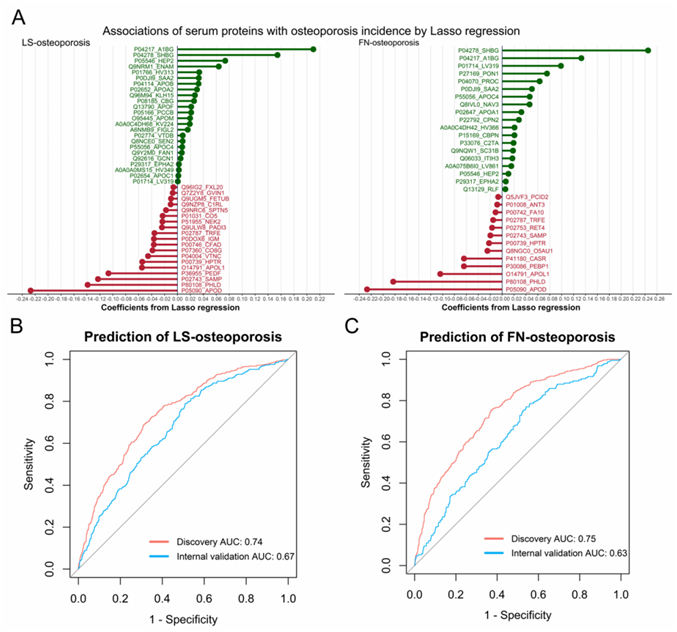
图S4. LASSO模型鉴定骨质疏松症血清蛋白质组学特征。
LASSO模型中LS-OP和FN-OP的蛋白质组学特征(A)。LASSO模型中LS-OP (B)和FN-OP (C)的受试者工作特征(ROC)图。
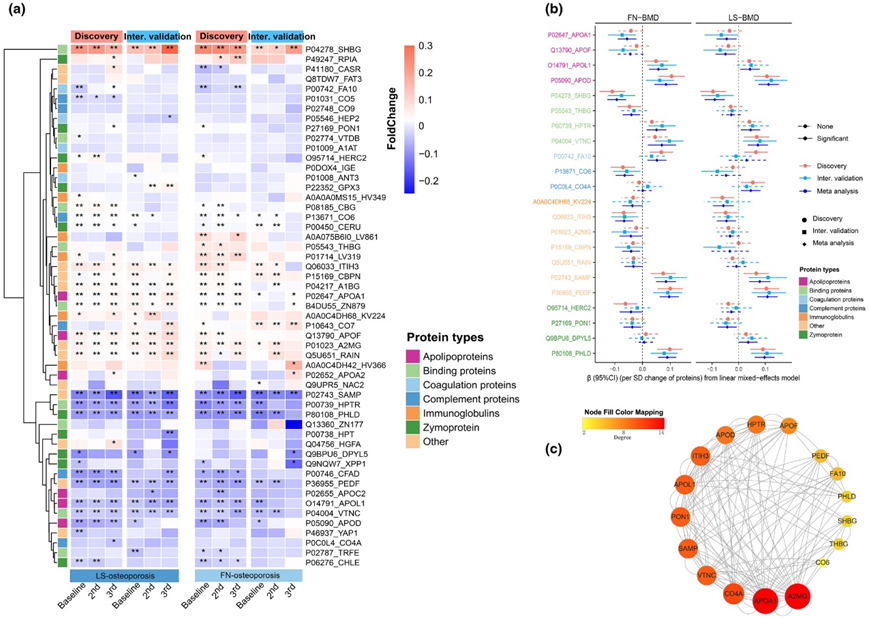
图2. 血清蛋白与骨质疏松症和 BMD 之间的关联。
(a)三个时间点骨质疏松症病例和对照之间血清蛋白丰度的差异倍数。(b) 血清蛋白和 BMD 之间的关联。(c) 血清蛋白的蛋白质-蛋白质相互作用。
03
PRS 与 BMD/骨质疏松症风险之间的关联
他们组装了骨位点特异性蛋白质风险评分 (PRS),通过重复上述对单个蛋白质进行的分析,来检测已识别的蛋白质生物标志物对 BMD 和骨质疏松症风险的联合“影响”。 LMM显示,在大约9.8年随访的纵向研究中,PRS与LS-BMD和FN-BMD呈负相关(图3a)。此外,他们分别探索了横向联系,并使用蛋白质生物标志物和三个时间段的骨密度数据发现了PRS和骨密度之间的相似结果(图4a)。Cox比例风险模型显示,基线PRS每增加一个标准差,发生骨质疏松的风险差(HR) (95% CI)在LS为:1.39,在FN为:1.34 (95% CI: 1.24-1.44)(图3b)。
他们还探索了基线PRS与LS-骨质疏松和FN -骨质疏松风险之间的剂量-反应关系(图3c-d)。一致性分析显示, 3 次随访时 PRS 与骨质疏松风险之间呈负相关(图4b)。
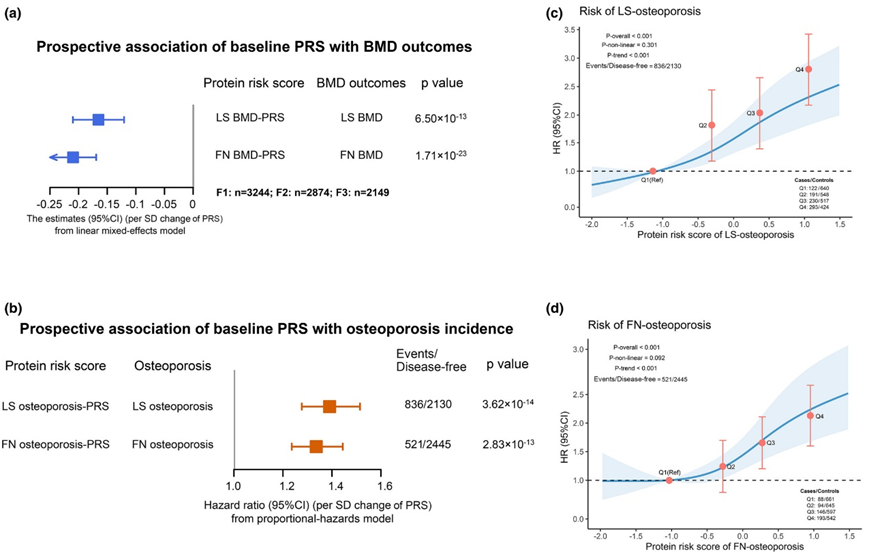
图3. PRS 与骨质疏松症和 BMD 的关联。
(a) 基线蛋白质风险评分 (PRS) 和 BMD 之间的回归系数和 95% CI(SD/SD)。(b) 使用 Cox 回归分析基线 PRS 与 LS 和 FN 骨质疏松风险之间的关联。(c-d) 通过限制三次样条模型分析基线 PRS 与 LS 和 FN 骨质疏松风险之间的剂量反应关联。
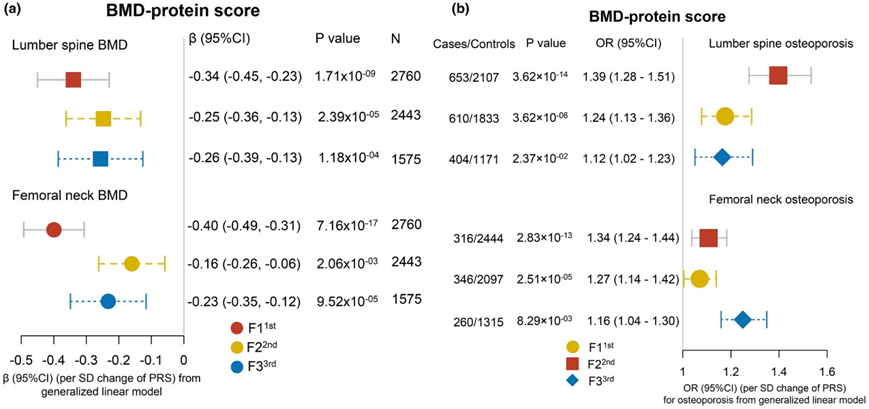
图4. 三次随访时 PRS 与骨质疏松症风险和 BMD 的横向。
每次访视时蛋白质风险评分 (PRS) 与 BMD (a) 和骨质疏松症风险 (b) 的横向联系。
04
生物年龄和OP分析
实际年龄(CA)与12个蛋白质显示出很强的相关性(图 S8a),通过模型生成了Klemera和Doubal蛋白质组学年龄(KDM-Proage)和BioAgeAccel(生物年龄加速)。KDM-Proage 与实际年龄呈显著正相关(图S8b-c)。同时,在KDM-Proage中,每增加一个标准差,骨质疏松的风险比在LS和FN中分别为HR: 1.25和HR: 1.13 (图5a),在BioAgeAcce中分别为HR: 1.23和HR: 1.15(图5b)。
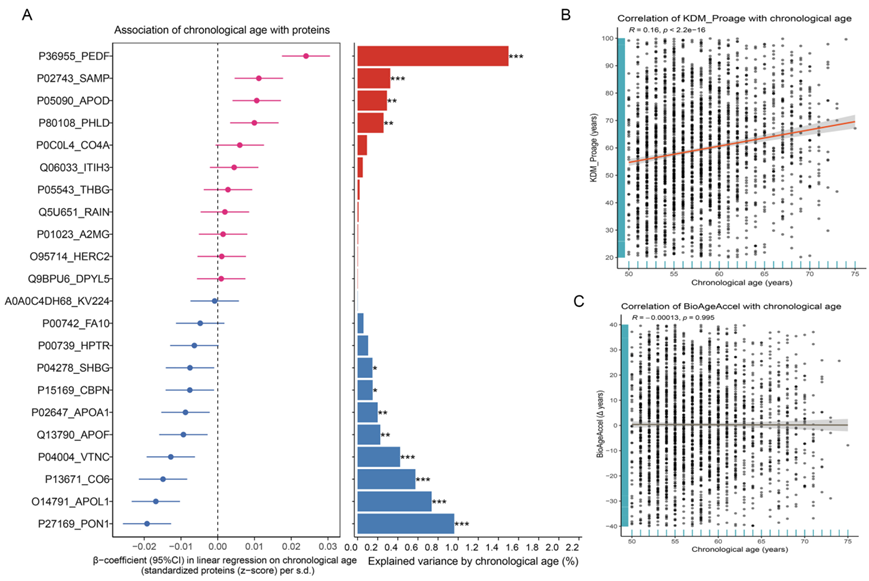
图S8. 从蛋白质组学数据构建骨的生物年龄。
(A)骨密度蛋白与实际年龄的关系。(B-C) 生物年龄评分与实际年龄(CA)的关系及其线性回归线。
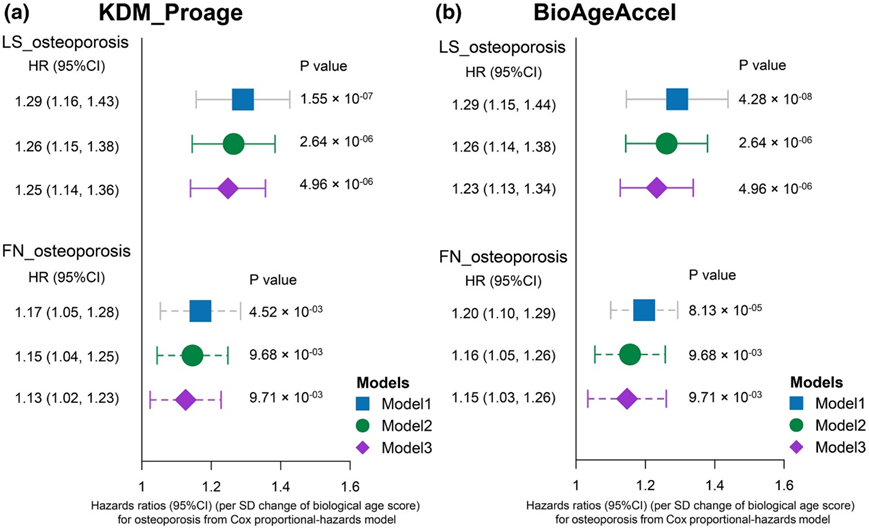
图5. 生物学年龄评分与骨质疏松症风险之间的关联。
KDM-Proage (a) 和 BioAgeAccel (b) 与骨质疏松症风险的前瞻性关联。
+ + + + + + + + + + +
结 论
本项研究通过液相色谱-串联质谱 (LC-MS/MS) 在基线以及 9.8 随访年的中国队列中的第 2 次和第 3 次随访(7704 人测试)中对含有 413 种蛋白质的血清蛋白质组进行了分析:发现队列和内部验证队列。Meta分析显示其中 22 种蛋白质与 BMD 存在显著相关性。其中最常见的蛋白质是 PHLD、SAMP、PEDF、HPTR、APOA1、SHBG、CO6、A2MG、CBPN、RAIN APOD 和 THBG。鉴定出的蛋白质用于生成骨骼的生物年龄(BA),血清蛋白质组学可能是评估骨老化的重要指标。
+ + + + +



 English
English


