文献解读|Cell(64.5):对具有免疫特征的基质细胞控制的早期妊娠的时空洞察
✦ +
+
论文ID
原名:Spatiotemporal insight into early pregnancy governed by immune-featured stromal cells
译名:对具有免疫特征的基质细胞控制的早期妊娠的时空洞察
期刊:Cell
影响因子:64.5
发表时间:2023.09.07
DOI号:10.1016/j.cell.2023.08.020
背 景
子宫内膜蜕膜化是成功怀孕的第一步和核心步骤之一。它的特点是子宫内膜间质成纤维细胞(eSF)转化为特殊的细胞类型,称为蜕质间质细胞(DSC),这一过程涉及间质-上皮转化(MET)。这些转分化的DSC可以提供营养,保护胚胎免受母体免疫系统的侵害,并支持母体早期血管的形成。子宫内膜蜕膜化过程是短暂的,但对成功妊娠至关重要,然而,目前尚未对蜕膜化过程进行系统性地研究。
实验设计
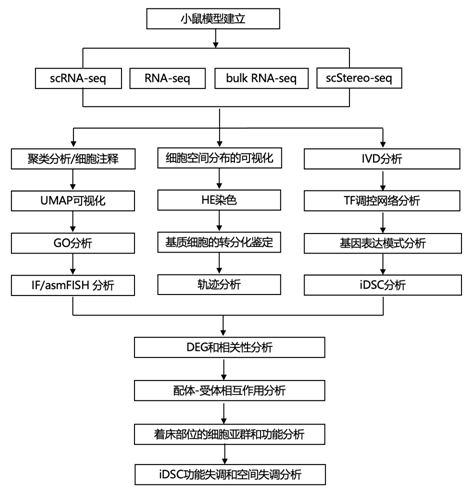
结 果
01
scRNA-seq分析小鼠着床部位的单细胞转录组图谱
子宫内膜蜕膜化是成功怀孕必不可少的,然而,到目前为止,对这一过程在着床部位的时空动态还没有全面的了解。本研究将ROSA26- CAG-tdTomato C57BL/6雄性小鼠与野生型ICR雌性小鼠杂交,获得着床部位 (E5.5-E10.5) 的组织和表达tdtomato的胚外组织,并进行单细胞转录组分析(scRNA-seq)(图1A )。首先,他们鉴定出13个主要的细胞聚类,其中8种表达tdTomato基因的细胞来自胚胎,包括滋养细胞。另外5种不表达tdTomato的细胞类型为母源性细胞,包括蜕膜基质细胞(DSC)、免疫细胞、子宫内皮细胞(uEC)、上皮细胞 (Epi) 和平滑肌细胞(SMC)(图1B-C)。此外,我们发现妊娠早期不同时间点的细胞组成反映了不同的生物学事件(图1D)。
接下来,他们分别将免疫细胞、内皮细胞和滋养细胞重新聚类,以获得细胞亚聚类(图1E)。他们首先分析了6个uEC亚群,增殖的内皮细胞和血管生成的内皮细胞参与血管生成,而静脉EC1和EC2与血管成熟相关。此外,他们还发现了动脉内皮细胞和少数淋巴内皮细胞(图1E-F)。在胚胎日(E)5.5 ~ E10.5之间,各uEC亚聚类在着床部位的比例呈动态变化(图1G)。
他们检测到6个免疫细胞亚群,包括自然杀伤细胞(NK)、中性粒细胞、单核细胞、T细胞、B细胞、巨噬细胞、增殖巨噬细胞和两种类型的树突状细胞 (DC)(图1E)。他们还定义了6个滋养细胞亚群,包括两个滋养细胞祖细胞亚群:TBPC1和TBPC2,两个胎盘锥细胞亚群:EPC1和EPC2,滋养细胞巨细胞 (TGC) 和海绵滋养细胞(SpT)。
他们将25791个DSC划分为8个亚群(D1-D8)(图1E)。值得注意的是,D8细胞表达DSC特异性基因和滋养层细胞特异性基因,并根据以往的研究将其归类为吞噬DSC的TGC(图1E)。其余的亚群(D1-D7)高表达已知的DSC标记,如Des、Hand2和Pgr(图1H),表明这些细胞受到孕激素黄体酮的影响。
GO分析显示D1亚聚类(表达Lum、Postn和Col6a3)参与了“细胞外结构组织”调控,是DSC的前体,称为eSF(图1H-I)。其余的亚群(D2-D7)特别激活了脱个体化标记基因,包括Hand2和Des,表明蜕膜化过程的开始或完成。D2亚聚类参与“上皮细胞增殖”调控,代表DSC前体细胞经历间质-上皮转化 (MET),这是驱动蜕膜化过程的经典转分化事件。D3亚聚类是细胞分裂相关通路富集的增殖性DSC,而D4亚聚类是生物矿物质调节的DSC。有趣的是,他们发现D5亚聚类富集Gatm,在细胞能量稳态和激素分解代谢过程中发挥作用,他们将其命名为滋养型DSC。血管生成的DSC (D6)高表达与血管调控相关的基因,如Angpt2。最后,D7亚群缺乏成熟的个体标记物Wnt4,但表达Htra1, Erv3和Prl8a2,并鉴定为成熟后的DSC。这些成熟后的DSC富集了参与脂质稳态和颗粒酶介导的凋亡信号传导的基因,表明这些细胞已进入最终状态(图1H-I)。有趣的是,这些成熟的DSC在E6.5时出现,特别是血管生成的DSC在E8.5和E9.5左右显著增加,与大血管形成的增加相一致(图1J)。
接下来,他们采用免疫荧光(IF)染色和原位杂交技术(asmFISH)对上述DSC亚聚类进行验证(图1K-L)。这些结果清楚地显示了DSC前体细胞(RXFP1和HAND2)、增殖DSC(TOP2A和WNT4)、过成熟DSC(仅HAND2)和其他成熟功能DSC(HAND2和WNT4)的空间分布(图1K-L)。
为了验证滋养DSC的功能,他们使用针对滋养DSC特异性标记物GATM的抗体进行糖原染色结合IF分析。他们在E8.5着床部位的反泌体区中间层检测到GATM标记的滋养DSC中的糖原颗粒(图1L-M)。通过scRNA-seq转录组学分析,他们确定了7个具有不同分子特征的DSC亚群,这些亚群可以在小鼠着床部位进行实验和功能验证。
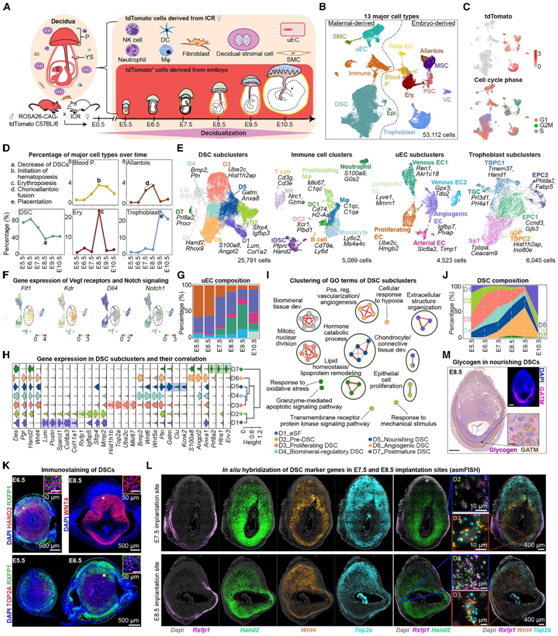
图1. 利用scRNA-seq技术分析小鼠着床部位单细胞转录组图谱。
(A)实验设计示意图。(B) UMAP可视化显示13种主要细胞类型。(C) UMAP可视化显示tdTomato基因表达(上)和细胞周期阶段(下)。(D)显示不同细胞类型百分比的折线图。(E) UMAP可视化显示了每种细胞类型的亚聚类。(F) UMAP可视化显示VEGF信号受体和Notch1的表达。(G)柱状图显示每个时间点的uEC亚聚类组成。(H)小提琴图显示了基因表达和DSC亚聚类的层次聚类。(I) GO分析。(J)显示DSC组成随时间变化的面积图。(K)小鼠着床部位HAND2、WNT4、TOP2A和RXFP1蛋白的免疫染色。(L) Rxfp1、Hand2、Wnt4和Top2a在E7.5(上)和E8.5(下)着床部位的asmFISH。(M) GATM免疫染色(棕色)联合PAS染色(糖原染色,粉色)分析。
02
使用scStereo-seq对动态功能性蜕膜中心进行空间鉴定和可视化
接下来,他们对E6.5/E7.5/E8.5/E9.5着床部位的7个组织切片进行了scStereo-seq(图2A)。结果表明,一个大的培养皿(例如50号培养皿)可以获得高特异性的大细胞大小的细胞,如DSC,而一个小的培养皿(例如20号培养皿)可以获得更多的免疫细胞,包括T细胞和中性粒细胞,但细胞较小(5到15毫米)(图2B)。最终,他们确定并定位了着床部位的7个DSC亚群,9种免疫细胞,5个uEC亚群,5个滋养层亚群(图2B-C)。
引人注目的是,空间分布的可视化显示明显的层状结构,包含明显的DSC亚团聚类,与苏木精和伊红(H&E)染色观察到的着床部位一致(图2C)。有趣的是,从scStereo-seq数据中,他们观察到不同类型的具有相关功能的细胞聚集在着床部位的某些区域,形成功能性的蜕膜中心(hub I-VIII) (图2C-D)。内皮细胞(外层)和DSC前体细胞(内层)相互靠近,形成MET枢纽(hub I),发生间质样向上皮样细胞转变,邻近的增殖中心 (hub II) 仅由增殖的DSC组成,这与IF和asmFISH的结果一致。此外,他们定义了一个滋养中心(hub III),包含位于胚胎近端的滋养和成熟的DSC,并在E6.5和E7.5由增殖的DSC(hub II)包围(图2C-D),分别类似于先前定义的初级和次级蜕膜区。值得注意的是,大多数免疫细胞在E6.5时聚集在MET中心,然后在E7.5后聚集在子宫内膜。随后,这些免疫细胞在E8.5和E9.5周围形成免疫细胞组装中心 (hub IV)。此外,他们观察到血管生成的DSC在E7.5时增加,并且在个体中系膜区域与增殖的DSC相邻。在E7.5之后,大多数uEC与血管生成性DSC共定位形成血管中心 (hub V)(图2C-D)。
此外,他们能够鉴定出早期胎盘中心(hub VI),由EPC1、EPC2、TBPC1和SpT细胞组成,在E7.5后显著出现。最后,他们检测到含有TGC的侵袭性滋养细胞中心(hub VII),它包围了卵黄囊(YS) (hub VIII)和早期胎盘中心(图2C-D)。
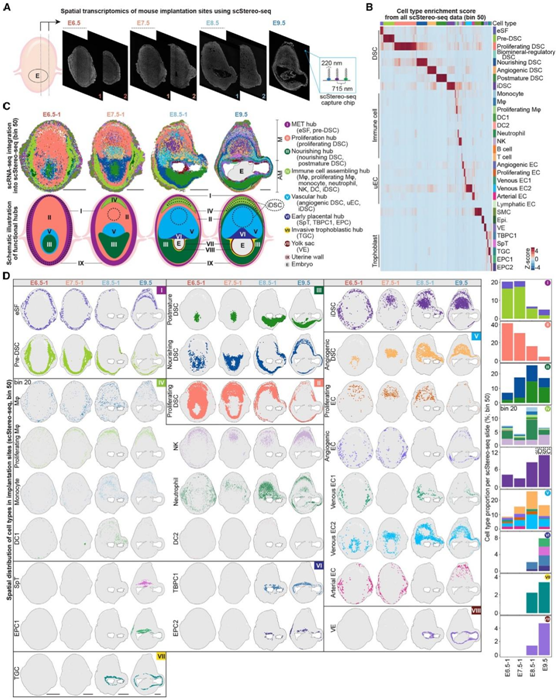
图2. 使用scStereo-seq对动态功能性蜕膜中心进行空间识别和可视化。
(A)用于空间转录组学(scStereo-seq)的样品示意图。(B)热图显示所有scStereo-seq切片的细胞型富集分数。(C) scStereo-seq数据中所有细胞分布的空间可视化,以及显示着床部位定义的“功能”中心的示意图。(D)着床部位各细胞类型的scStereo-seq斑点覆盖图。
03
分析子宫内膜蜕膜化化过程中基质细胞的转分化途径
与H&E染色结果一致,scStereo-seq显示具有典型纺锤样形态的内皮细胞位于蜕膜的最外层,而在开始经历MET时具有上皮样形态的DSC前体细胞位于内皮细胞附近。许多成熟和成熟后靠近着床核心的DSC体积较大,呈单核或多核,表明它们是多倍体细胞,mRNA丰度高于eSF(图3A-C)。细胞外基质(ECM)重塑是子宫内膜蜕膜化过程中MET和细胞状态转变的关键事件,他们从MatrisomeDB数据库中获得的224个注释的ECM基因,并将它们分为6个ECM模式,这些模式富集在不同的DSC亚群中,可用于标记不同的蜕膜细胞状态(图3D)。
为了更准确地了解DSC的转分化过程,他们基于scStereo-seq数据执行Monocle3来分析DSC的轨迹(图3E)。正如预期的那样,这一分析揭示了eSF首先转化为DSC前体细胞,然后转化为增殖的DSC。有趣的是,增殖性DSC进一步分化为两个分支:位于系膜区血管生成的DSC,以及通过滋养的DSC分化为成熟后的DSC,大多数位于E8.5和E9.5着床部位的反系膜区,这两个分支分别对应于DSC的血管生成功能和营养功能(图2C-D、图3E)。有趣的是,基于MET相关基因的相对表达量和GO分析,进一步验证了上述DSC轨迹(图3F-I)。特别是,eSF高度表达间充质标记物(Vim、Fn1、Col3a1和Col1a1/2)和成熟的DSC富集的上皮标记物(Gja1、Lamc1和Lamb2)。DSC前体细胞为MET中间细胞,可由Igfbp5、Cdh11、Igf1和Fscn1标记(图3H-I)。
此外,他们在不同的时间点诱导子宫系膜间质细胞体外蜕膜化(IVD),并进行转录组分析(RNA-seq)(图3J)。间充质标志物在eSF中富集程度较高,而在DSC前体细胞中富集程度较低,在诱导后1天内迅速下降,显示典型的MET事件。此外,细胞增殖相关基因在IVD 1天后发生动态诱导,2天后减少,代表DSC增殖的中间阶段。IVD 3天后,与血管发育和凋亡相关的基因均发生显著诱导,这是DSC功能规范的两个分支(图3E-J)。IVD模型模拟了体内DSC转分化过程的关键事件,包括MET、细胞增殖、血管生成和营养的功能特化。
最后,他们发现了控制DSC命运转变和功能的基本转录因子(TF),鉴定出258个转录因子(TF)在不同的DSC中特异富集(图3K)。基于TF的调控网络,他们定义了TF的两个调控模块:免疫和增殖/凋亡。有趣的是, 在eSF和DSC前体细胞中,cAMP响应元件调节剂可以激活下游核因子(NF)-kB通路,表明这些细胞具有免疫相关功能。Dnmt1在增殖的DSC中起着细胞增殖的主要调节作用。最后,他们观察到多倍体因子E2f8在滋养、血管生成和成熟后的DSC中具有活性,而凋亡因子E2f3对成熟后的DSC具有特异性(图3K-L)。
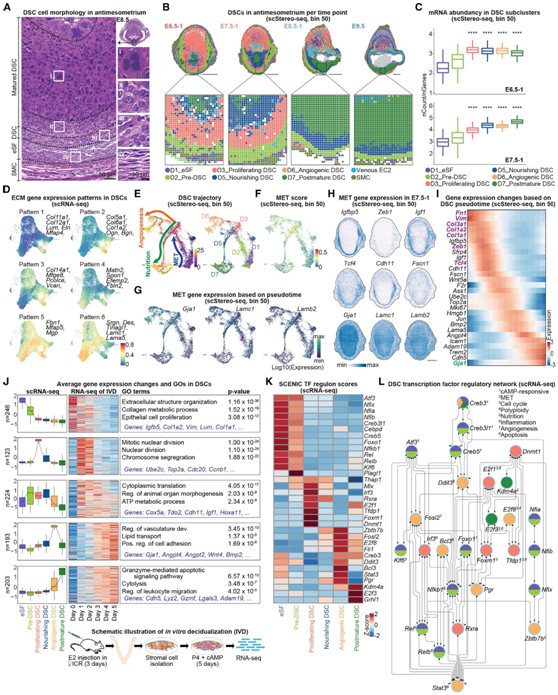
图3. 子宫内膜蜕膜化过程中基质细胞的转分化。
(A) H&E染色显示E8.5着床部位反对称膜的DSC形态。(B) 着床部位DSC亚聚类的scStereo-seq点重叠,插图显示抗子宫内膜面积增大。(C)箱形图显示了E6.5-E7.5着床部位DSC亚聚类的mRNA丰度。(D) UMAP可视化显示了DSC中ECM基因表达的六种模式。(E)用伪时间(左)和亚聚类(右)着色的DSC预测轨迹。(F) MET (GO:0060231)基因沿轨迹富集得分。(G)已知MET相关基因在轨迹上的表达。(H) MET相关基因表达的空间可视化。(I)热图显示沿DEC轨迹的基因表达变化。(J)使用scRNA-seq数据的DSC亚聚类之间的平均基因表达模式(左)和体外蜕膜化RNA-seq的数据(中)。(K)热图显示了DSC亚聚类中基于Z行分数的SCENIC转录因子(TF)调控子分数。(L) DSC亚聚类中TF的调控网络。
04
具有免疫相关特征的双特征型DSC的表征
在对免疫细胞重新聚类后,他们意外地发现一个细胞聚类同时表达免疫细胞相关基因和典型的DSC标记基因(图4A-B)。基于转录组的聚类和基因富集分析表明,与免疫细胞相比,这些细胞与血管生成性DSC的关系更密切(图4C)。因此,他们将其命名为免疫特征DCS (iDSC),这是一种特殊类型的DSC,具有免疫细胞相关基因的富集和某些免疫反应和活性的激活(图4C)。
通过进一步对iDSC重新聚类,他们确定了三个具有不同转录组特征的亚聚类,参与各种生物过程(图4D-E)。iDSC0 (Angpt2、Runx1、Jcad和Adam12)与血管发育有关,iDSC1(Clec4a2、Cxcl2、Ccl6和Aif1)与炎症反应有关,iDSC2(Prf1、Gzma/e、Tnfrsf9和Spp1)参与细胞溶解和凋亡(图4E)。此外,基于差异表达基因 (DEG) 的细胞相关性分析显示,iDSC0与血管生成的DSC具有相似的特征,而iDSC1和iDSC2分别具有髓细胞和NK细胞的特征(图4F)。值得注意的是,当使用scStereo-seq在着床位点可视化这三个iDSC亚聚类时,观察到E6.5时在MET中心共定位的所有三个亚聚类,以及在E9.5时iDSC0/iDSC2分离的动态空间变化(图4G)。E9.5着床部位组织切片的IF结果显示,iDSC(HAND2+ CD45+)/iDSC2 (HAND2+ PRF1+)主要位于血管和免疫细胞聚集中心(图4H)。此外,asmFISH显示,iDSC0和血管生成性DSC虽然高度相关,但它们是不同的细胞类型(图4I)。此外,ISS表明,在血管和免疫细胞组装中心可以清楚地检测到三个iDSC亚聚类,它们共同表达Hand2、Ptprc和iDSC亚聚类特异性基因,这与scStereo-seq结果一致(图4G-J)。
他们进一步研究了不同iDSC亚聚类之间的功能差异。配体受体信号分析显示,高表达Tnfrsf9的NK细胞和iDSC2都可以通过CD137通路由血管生成的DSC激活(图4K),导致穿孔素和颗粒酶基因表达。接下来,他们使用基于低CD45表达的荧光激活细胞分选(FACS)分离出iDSC进行bulk RNA-seq分析,结果表明iDSC存在于该细胞群中。随后,将iDSC与人白血病细胞系K562孵育,观察到iDSC能够诱导癌细胞的细胞溶解(图4L)。因此,这些结果表明,血管生成的DSC通过CD137信号激活iDSC(主要是iDSC2)可能触发颗粒酶介导的凋亡通路,这可能有助于子宫系膜区胎盘生长的空间清除。
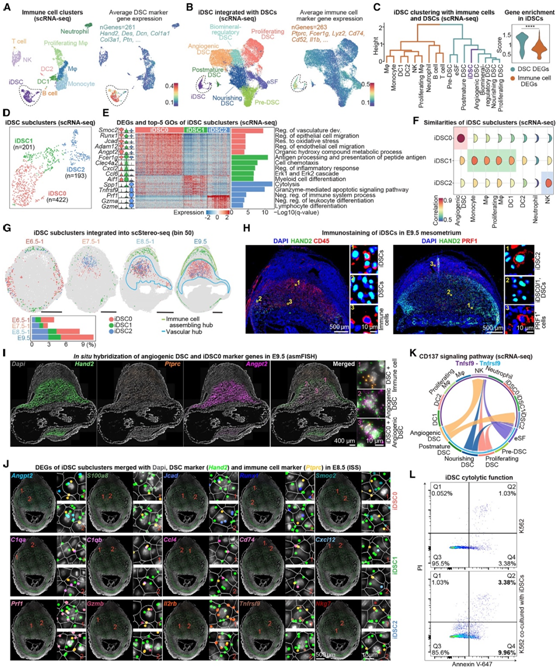
图4. 具有免疫特征的双特征DSC的鉴定。
(A-B) UMAP可视化显示了iDSC与免疫细胞和DSC亚聚类。(C) iDSC、DSC亚聚类和免疫细胞的层次聚类。(D) UMAP可视化显示iDSC重聚类。(E)小提琴图和热图显示了iDSC亚聚类的DEG。(F)月亮图显示iDSC亚聚类与血管生成DSC和不同类型免疫细胞之间的相关性。(G) iDSC亚聚类的scStereo-seq点叠加。(H) HAND2与CD45(左)和PRF1(右)共染色的免疫染色。(I) Hand2 (DSC)、Ptprc(免疫细胞)和Angpt2 (iDSC0/血管生成性DSC)的原位杂交(asmFISH)。(J)与Hand2和Ptprc合并的iDSC亚聚类DEG的原位测序(ISS)。(K) CD137信号在DSC(发送者)和免疫细胞/iDSC(接收者)之间的和弦图。(L)流式细胞分析iDSC对K562细胞的杀伤作用。
05
iDSC和血管生成性DSC控制蜕膜血管形成
蜕膜血管的形成和免疫细胞的募集和抑制对妊娠的成功至关重要,伪时间分析表明,uEC的命运特化从增殖的内皮细胞(EC)开始,以两个经典的转换分支结束。scStereo-seq数据显示,在E6.5时,静脉EC2与胚胎周围的血管生成DSC共定位,而其他uEC亚聚类位于MET中心。在E7.5着床部位的系膜区,增殖性EC和静脉性EC分别与iDSC和血管生成性DSC共定位。E8.5后,多个uEC亚聚类与血管生成DSC、iDSC0和iDSC2聚集,最终形成血管中心。在E9.5时,动脉内皮细胞分布在免疫细胞组装和血管中心(图2C-D,5A)。
然后,他们关注血管化相关的信号通路,发现iDSC和大多数DSC表达Vegfa/b/d。所有uEC亚聚类均表现出VEGF受体的富集,其中Flt1和Kdr在血管源性EC中表达最高(图1F、5B)。此外,他们还观察到ANGPT(L)/CALCR和CHEMERIN信号的配体,这些信号主要在血管源性DSC和iDSC0中表达(图5B)。
值得注意的是,与uEC类似,免疫细胞也始终与iDSC、eSF和DSC前体细胞共定位,在妊娠早期表现出动态变化(图2C-D,5A)。在E6.5时,与iDSC和uEC一起,所有免疫细胞都在MET中心。在E7.5时,当iDSC特别出现在子宫系膜区时,免疫细胞,包括NK细胞、单核细胞、增殖性巨噬细胞,以及血管生成的DSC和uEC也开始在那里聚集。此后,在E8.5时,各种类型的免疫细胞与iDSC1聚集在子宫系膜中形成环状层,而uEC仍与iDSC0和iDSC2在血管中心共定位。在E9.5时,免疫细胞组装中心(immune cell assembling hub)在两层eSF之间形成,确保了血管和免疫细胞组装中心之间的生理分离,以防止免疫反应和血管化过程之间的相互作用(图2C-D,5A)。因此,iDSC、eSF和DSC前体细胞能够介导免疫细胞的动态募集,最终在eSF的两个物理层之间建立免疫细胞组装中心。
免疫细胞募集信号配体主要表达于eSF(CXCL、CCL和MK)、DSC前体细胞(CXCL和MK)、iDSC0(CXCL和CCL)和iDSC1(CXCL、CCL和MK),与其他细胞类型相比,符合其在着床部位的空间基因表达(图5C)。同时,配体-受体相互作用分析表明,eSFs,DSC前体细胞和iDSC0/ 1具有独特的配体-受体识别机制,使它们能够募集定的免疫细胞群(图5D)。为了直接证明iDSC的免疫细胞募集功能,他们进行了Transwell迁移实验,结果表明,受刺激的iDSC能够分泌趋化因子,明显增强了永生化骨髓来源的巨噬细胞(iBMM)的迁移行为(图5F)。值得注意的是,他们还观察到妊娠早期免疫控制信号通路GALECTIN的激活,这表明免疫细胞募集和抑制之间的平衡可能对维持蜕膜化的稳态很重要(图5E)。
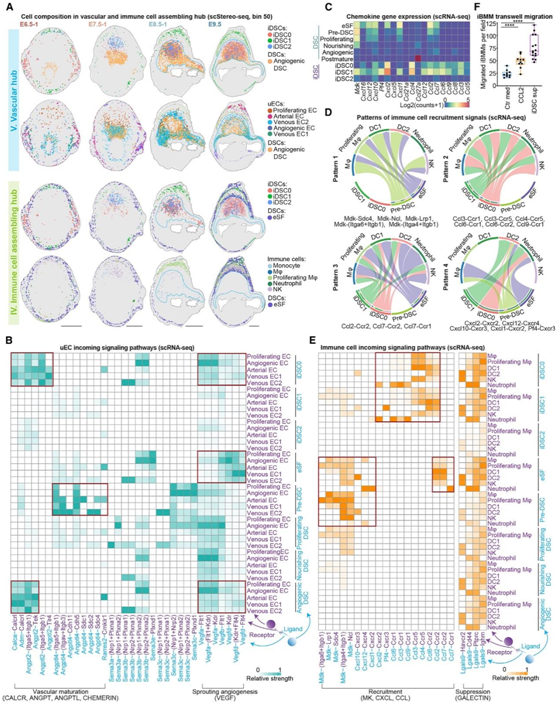
图5. iDSC有助于蜕膜血管形成和介导免疫细胞募集。
(A)带有iDSC和uEC亚聚类的血管生成性DEC和带有iDSC亚聚类和免疫细胞的ESF的scStereo-seq斑点覆盖。(B)热图显示从DSC和iDSC亚聚类接收的uEC亚聚类中的传入信号。(C)热图显示DSC亚聚类中MK、CXCL和CCL通路配体的表达。(D)弦图显示配体受体募集信号的不同模式,包括DEC和免疫细胞之间的MK、CXCL和CCL。(E)热图显示从DSC亚聚类接收的免疫细胞的传入信号通路。(F)条形图显示每个区迁移的永生化骨髓源性巨噬细胞(IBMM)的数量。
06
在易流产小鼠的着床部位发现异常的iDSC
接下来,他们在早期妊娠失败的小鼠中研究了iDSCs和相关功能性蜕膜中心的潜在病理效应(图6A)。他们将scRNA-seq和scStereo-seq应用于DBA/2修饰的CBA/J小鼠的E8.5/E9.5蜕膜组织,鉴定了五种主要的母体来源细胞类型,包括uEC、DSC、免疫细胞、SMC和Epi。
无监督的聚类分析进一步证明了DBA/2-标记的CBA/J小鼠和正常妊娠的ICR小鼠之间的DSC亚聚类和免疫细胞聚类具有可比性(图6C-D)。
出人意料的是,与正常妊娠的ICR小鼠相比,DBA/2交配的CBA/J小鼠出现了炎症内皮细胞和更高比例的血管生成内皮细胞(图6E)。转录组学比较表明,iDSC在DBA/2-交配CBA/J和正常妊娠ICR小鼠之间表现出明显差异。进一步的iDSC重聚鉴定出三个iDSC亚聚类 (iDSC0/1/2),与正常妊娠ICR小鼠一样(图6F)。然而,与iDSC0或其他DSC亚群相比,iDSC1和iDSC2显示出最大的出和入信号通路的变化(图6G)。在DBA/2交配的CBA/J小鼠中,iDSC亚聚类富集了与“对干扰素α / γ反应”相关的基因,表明在易于流产的小鼠中,iDSC的炎症反应异常增加。相反,在DBA/2交配的CBA/J小鼠中,iDSC0的血管化功能和iDSC2的细胞溶解功能发生明显抑制(图6H)。
这些结果表明,在易流产小鼠模型中的iDSC亚群的特征是炎症反应异常增加,血管化和细胞溶解相关功能受到干扰。
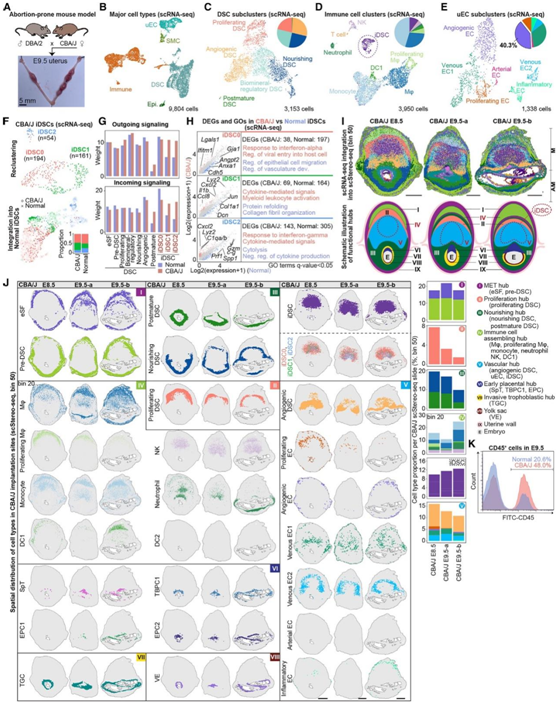
图6. 在易流产的CBA/J着床部位,功能的蜕膜中心和iDSC组织紊乱。
(A)易流产小鼠模型示意图。(B) CBA/J小鼠着床部位主要细胞类型的UMAP可视化。(C-E) E8.5/E9.5 CBA/J蜕膜中DSC、免疫细胞和uEC亚聚类的UMAP可视化,以及亚聚类比例的饼状图。(F) CBA/J着床部位iDSC亚聚类的UMAP可视化(上)和正常妊娠小鼠iDSC的整合(下)。(G)条形图显示了iDSC和DSC亚聚类中总体输出(上)和输入(下)信号的强度。(H)与正常妊娠小鼠相比,CBA/J各组iDSC亚群中DEG的散点图。(I) scStereo-seq数据中所有细胞分布的空间可视化,以及CBA/J着床部位定义的功能中心的示意图。(J) CBA/J E8.5和E9.5着床部位各细胞类型的scStereo-seq斑点覆盖图。(K) FACS分析显示CD45+细胞的百分比(FITC)。
07
iDSC的不正确定位和功能障碍导致小鼠蜕膜中心的失败
在scStereo-seq数据中,他们观察到DBA/2-交配的CBA/J小鼠的E8.5/E9.5着床部位存在功能失调的个体中心,其特征是空间紊乱和细胞组成改变(图6I-J,7A)。他们发现由eSF和DSC前体细胞形成的MET中心,约占DBA/2交配的CBA/J小鼠E8.5/E9.5着床部位切片的20%,这与正常妊娠小鼠的E6.5着床部位相当(图2D,6J),表明易流产小鼠的蜕膜化过程严重延迟。此外,通过FACS证实,免疫细胞,特别是单核细胞和巨噬细胞的数量显著增加(图2D,6J-K,7B)。
在DBA/2交配的CBA/J小鼠中,他们发现在E9.5时,iDSC1与iDSC0/2一起位于血管中心,而不是位于两个eSF层之间的免疫细胞组装中心。他们还观察到各种免疫细胞在血管中心的广泛存在,在E9.5时扩展到两个eSF层之间的区域,这导致了所有三个iDSC亚群与各种免疫细胞之间的直接相互作用(图7A-C)。
与正常妊娠ICR小鼠相比,DBA/2配对的CBA/J小鼠E8.5/E9.5着床部位的静脉和动脉EC明显减少。此外,所有三个iDSC亚聚类都与多个uEC共定位,但与血管生成的DSC明显分离,导致DBA/2-交配的CBA/J小鼠在E8.5和E9.5时血管中心紊乱(图7A-B)。
有趣的是,他们发现易流产小鼠的iDSC1具有增加的Ccl7/8/12和Cxcl1表达。此外,异常的iDSC2通过激活Ccl4/6/8和Cxcl2获得了免疫细胞募集能力,而其颗粒酶诱导的细胞凋亡功能可能由于颗粒酶表达减少而受到抑制(图7D-E)。因此,iDSC1的空间紊乱以及iDSC2通过CXCL/ CCL信号获得募集能力,导致易流产小鼠血管中心各种免疫细胞的异常聚集。
接下来,他们发现巨噬细胞和增殖巨噬细胞在DBA/ 2-配对的CBA/J小鼠血管中心异常定位,也可以激活Vegfb。巨噬细胞与血管生成性DSCs和iDSC0共同促进易流产小鼠血管生成。相反,在血管生成的DSC和iDSC0中,Angptl2、Angpt2、Calca和Adm的表达均明显降低,导致血管成熟受到抑制(图7F-H)。值得注意的是,这些血管化相关信号通路的改变与观察到的血管源性EC比例增加和动脉和静脉EC比例减少是一致的(图1G,6E,7B)。
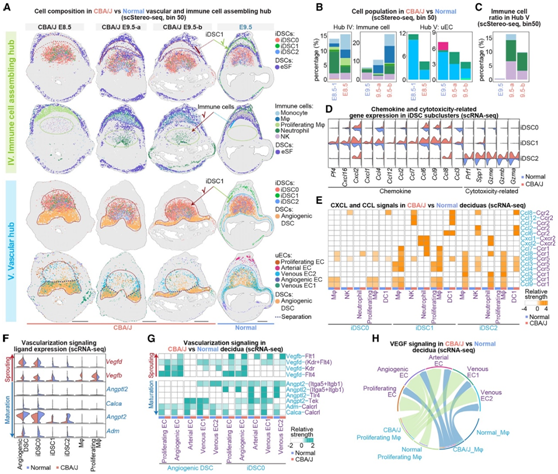
图7. iDSC功能失调和空间失调导致小鼠蜕膜区定位失败和妊娠并发症。
(A)具有iDSC亚聚类和免疫细胞的ESF和具有iDSC和uEC亚聚类的血管生成性DSV的scStereo-seq斑点覆盖。(B)条形图显示免疫细胞聚类(左)和uEC亚聚类(右)的百分比。(C)条形图显示血管中心免疫细胞聚类的百分比。(D)小提琴图显示了iDSC中趋化因子和细胞毒性相关基因的表达。(E)显示iDSC向免疫细胞募集信号(CXCL和CCL)的热图。(F)小提琴图显示参与血管形成过程的配体的表达。(G)显示血管相关信号的热图。(H)弦图显示(增殖)Mφ(发送者)和uEC(接收者)之间的VEGF信号。
+ + + + + + + + + + +
结 论
本项研究使用scStereo-seq技术在空间上可视化和定义早期怀孕小鼠中由不同的免疫、内皮、滋养层和DSC的动态功能性蜕膜中心。本项研究揭示了DSC的分化轨迹,并意外地发现了一种具有双重特征的免疫特征iDSC,未成熟的DSC在蜕膜化起始过程中吸引免疫细胞并在MET中心诱导蜕膜血管生成。iDSC能够实现免疫细胞的募集和支持,控制血管形成,并分别促进免疫细胞组装和血管中心的细胞溶解,以在后期建立蜕膜稳态。有趣的是,功能失调和空间紊乱的iDSC会导致免疫细胞在血管中心的异常积聚,从而破坏蜕膜中心的特性,并最终导致DBA/2标记的CBA/J小鼠的妊娠并发症。
+ + + + +



 English
English


