文献解读|(17.337):表观遗传重编程增强成骨细胞源性细胞外囊泡促进人骨髓干细胞成骨分化
✦ +
+
论文ID
原名:Epigenetic reprogramming enhances the therapeutic efficacy of osteoblast-derived extracellular vesicles to promote human bone marrow stem cell osteogenic differentiation
译名:表观遗传重编程增强成骨细胞源性细胞外囊泡促进人骨髓干细胞成骨分化
期刊:Journal of Extracellular Vesicles
影响因子:17.337
发表时间:2021.7.7
DOI号:doi.org/10.1002/jev2.12118
背 景
临床上对骨组织再生修复的需求量巨大,自体移植是目前修复临界大小骨缺损的金标准治疗方法,但是其有限的供应和供区发病率限制大规模临床运用。细胞外囊泡(EVs)作为再生医学的脱细胞工具获得了越来越多的关注。EVs是细胞衍生的纳米颗粒,含有多种生物活性物,包括蛋白质、核酸和生物活性因子,并大量参与细胞间通讯,调节组织发育和稳态。
组蛋白在调节染色质结构中发挥着关键作用。通过增强组蛋白去乙酰化酶(HDAC)和组蛋白乙酰化转移酶(HAT)的活性来改变组蛋白的乙酰化状态已经被证明可以改变细胞的转录活性。曲古抑素A( TSA)是一种天然衍生的基于羟肟酸的组蛋白去乙酰化酶抑制剂(HDAC inhibitors, HDACI),靶向I类和II类HDAC亚型。一些研究已经证明TSA通过高乙酰化诱导的染色质重塑和成骨转录因子激活来刺激干/祖细胞成骨分化。在本研究中,我们研究了利用HDACI TSA增强矿化成骨细胞的表观遗传功能,以促进成骨细胞来源的EVS对骨再生的治疗效力。
实验设计
结 果
01

TSA对成骨细胞表观遗传功能的影响
随着TSA剂量的增加,成骨细胞形态发生改变,细胞从拉长的成纤维细胞样形态转变为更大的扁平形态(图1a)。与未处理细胞相比(P≤0.001)(图1b),TSA浓度≥50nM处理3天和7天后,成骨细胞活力呈时间剂量依赖性下降,显著降低成骨细胞代谢活性。代谢活性的降低伴随着HDAC活性和组蛋白乙酰化水平的显著变化。TSA处理后HDAC活性呈时间剂量依赖性下降,浓度≥20nM(P≤0.05)和≥5nM(P≤0.001)分别在第3天和第7天显著降低(图1c)。此外,TSA引起组蛋白H3K9乙酰化呈时间剂量依赖性增加。在第3天和第7天,浓度≥5nm的组蛋白乙酰化水平显著高于未处理的细胞(P≤0.05-0.01,图1d)。
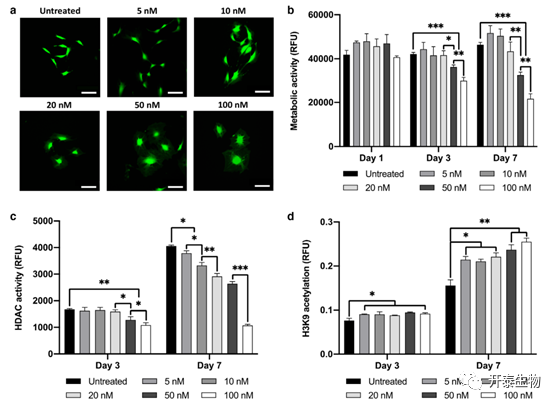
图1 TSA对成骨细胞活力和表观遗传功能的影响
TSA对成骨细胞a)形态(第3天)和b)代谢活性有时间-剂量依赖性影响。TSA对成骨细胞c)HDAC活性和d)H3K9组蛋白乙酰化的影响呈时间-剂量依赖性。
02

TSA促进成骨细胞矿化
通过定量ALP活性、胶原生成和钙化沉积来评估TSA对成骨细胞分化的影响(图2a)。TSA对成骨细胞ALP活性的影响呈时间剂量依赖性。在第7天和第14天,和未处理的细胞相比, 5 nm TSA显著提高了ALP活性(图2b)。ALP活性的变化伴随着细胞外基质胶原生成的显著变化(图2c)。在第14天和第21天,5 nm TSA显著增强胶原沉积。TSA对成骨细胞细胞外基质矿化的影响呈时间剂量依赖性。在第14天和第21天,5nM、10nM TSA处理组与未处理组和≥20nmTSA处理组相比,钙沉积显著增加(P≤0.001)(图2d,e)。因此,5 nm TSA处理用于后续实验。

图2 TSA治疗促进成骨细胞矿化
a)TSA对成骨细胞矿化的评估的示意图。TSA对成骨细胞的碱性磷酸酶活性b)、细胞外基质胶原生成c)和钙沉积d-e)均有时间剂量依赖性影响。
03

来源于TSA处理的成骨细胞的EVs特征
通过差速离心法从未经处理(Mo-EVs)或TSA处理(TSA-EVs)的成骨细胞条件培养基中分离出2周以上的EVs。TEM成像显示,在两组典型尺寸和球形形态的EVs中都存在颗粒,其中这些纳米颗粒在直径上显示出不均匀性(图3a)。免疫印迹证实两个EVs组均存在alix、CD9和Annexin A2蛋白,而Calnexin无表达(图3b)。NTA分析表明,Mo-EVs和TSA-EVs的平均直径分别为136和129 nm(图3c,d)(P>0.05)。TSA-EVs颗粒浓度(4.5±0.82×109/ml)比Mo-EVs颗粒浓度(6.4±0.92×109/ml)降低1.4倍,但无显著性差异(图3d)(P>0.05)。与TSA-EVs(PDI分别为0.34和0.45)相比,TSA-EVs显示出更多的单分散群体(1.34倍)(图3e)(P≤0.05)。此外,与Mo-EVs相比,TSA-EVs含有显著增强的RNA数量(3倍)(图3f)(P≤0.001)。与Mo-EVs相比,TSA-EVs的蛋白质含量显著降低(1.16倍)(图3g)(P≤0.001)。与Mo-EVs相比,TSA-EVsV组CD63阳性颗粒的数量减少了1.05倍(图4h),差异无显著性(P>0.05)。
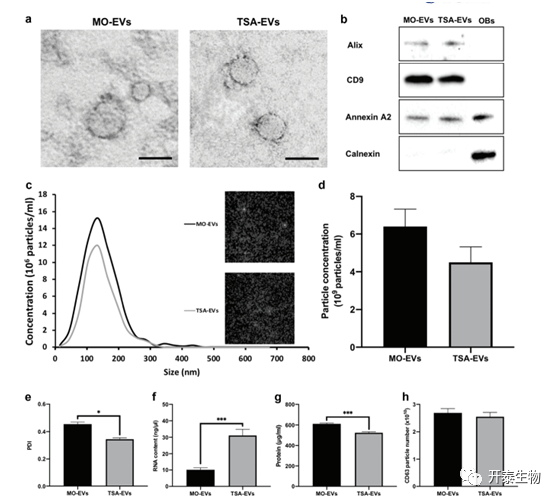
图3 TSA处理和未处理的矿化成骨细胞中分离的EVs的特征
a)从TSA处理和未处理的成骨细胞中分离的EVs的TEM图像。标尺=50nm。b)Western blot分析证实EVs标记物(Alix、CD9、Annexin A2、Calnexin)的存在。c)EVs样品的粒径分布。插入显示分析过程中粒子的快照。d)EV颗粒大小和浓度。e) EVs的多分散性指数。f)EVs RNA定量。g)EVs蛋白质含量。h)CD63阳性的颗粒数
04

TSA-EVs促进人骨髓间充质干细胞增殖、迁移和成骨分化
初步评估了TSA-EVs对HBMSCs一般行为的影响。Cell Mask标记的成骨细胞来源的EVS成功地被HBMSCs内化,标记的EVs位于细胞的细胞质内(图4a)。观察到HBMSCs中标记的EVs随时间的积累。对照样本如补充图1b所示。与MO-EVS处理(P≤0.05)和未处理(图4b)(P≤0.01-0.001)相比,TSA-EVS处理显著增加HBMSCs增殖,且呈时间依赖性。此外,TSA-EVS处理后HBMSC迁移显著增强,与MO-EVS处理(1.3倍)(P≤0.05)和未处理(2.1倍)(P≤0.001)相比(图4c)。通过检测成骨细胞相关基因表达和细胞内蛋白表达,发现TSA-EVs治疗促进HBMSCs成骨分化(图5)。

图4 SA-EVs对HBMSCs一般行为的影响
a)在指定时间拍摄Cell Mask标记的HBMSCs摄取成骨细胞源性EVS的免疫荧光图像。刻度=20um。TSA-EVs对HBMSCs增殖b)和迁移c)的影响。
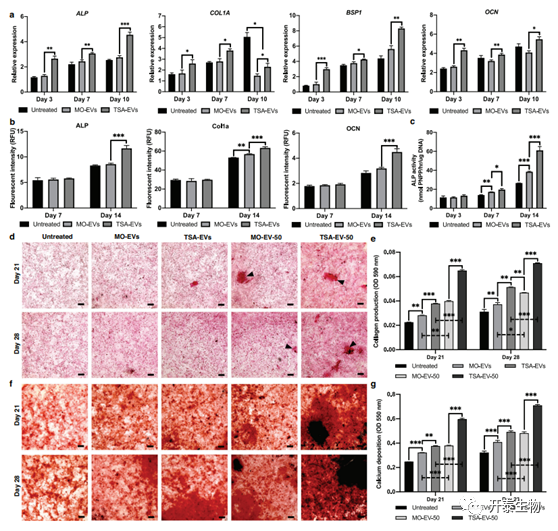
图5 TSA-EVs促进HBMSCs成骨分化和矿化
a)检测TSA-EVs、Mo-EVs处理和未处理HBMSCs成骨培养过程中ALP、COL1A、BSP1和OCN 4种基因的表达水平。b) EVs处理的HBMSCs细胞内ALP、COL1A和OCN蛋白水平。c)在成骨培养过程中,TSA-EVS对HBMSCs ALP活性的影响。d)经EVs处理后的HBMSCs进行天狼星红染色,观察胶原生成情况。黑色箭头突出富含胶原蛋白的矿物质结节样结构。e)红皮天狼星胶原染色定量分析。f)茜素红染色检测EVs处理后HBMSCs的钙沉积。黑色染色表明矿物结节形成。g)茜素红染色定量分析。刻度=200μm。
05

TSA-EVs/MO-EVs的microRNAs表达谱和蛋白表达谱
为了进一步阐明表观遗传修饰对成骨细胞来源的EVs的影响及其在增强骨诱导特性中的可能作用,作者对EV的microRNA表达进行了分析。如图6a所示,层次聚类揭示了 microRNAs在TSA-EVS和MO-EVS中的差异表达。在TSA-EVs和MO-EVs中,共有27种microRNAs上调,6种下调(图6b)。火山图显示了TSA-EVs和MO-EVs之间microRNAs表达的差异(图6c)。
采用非标记定量label free方法对MO-EVs和TSA-EVs的蛋白质组进行了比较。使用严格的标准,只允许包含至少两个生物重复中鉴定的蛋白质,至少一个重复中有>2个光谱计数。蛋白质数据库检索结果共鉴定出1325个蛋白质。其中,25个蛋白在TSA-EVs中显著上调,27个蛋白在MO-EVs中上调,1273个蛋白在TSA-EVs和MO-EVs中共同表达(图7a,b)。将所有生物样品组内相互比较,Pearson相关性分析显示在MO-EVs(0.90)和TSA-EVs(0.97)组(图7c)。将MO-EVs和TSA-EVs进行组间比较,平均相关系数为0.85,表明MO-EVs和TSA-EVs在蛋白表达上有明显的相似性。为了提供TSA-EVs中显著上调的蛋白质的主要过程、机制和细胞定位的概述,进行了GO分析。显著富集的TSA-EVs蛋白发现与GO功能注释有关,包括分子功能,如组蛋白乙酰转移酶活性、肽赖氨酸乙酰转移酶活性)、细胞成分,如组蛋白乙酰转移酶复合物、前催化剪接体和生物过程,如组蛋白乙酰化、组蛋白修饰(图7d-f)。
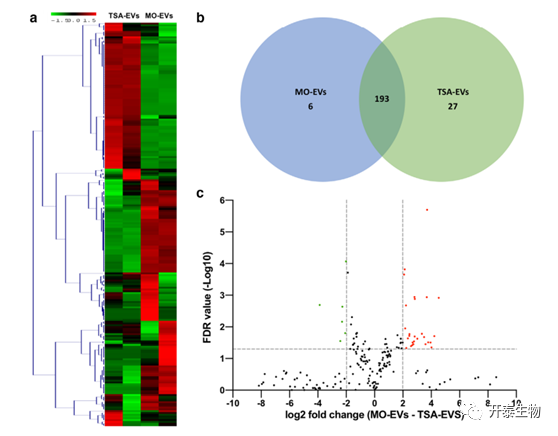
图6 TSA-EVs和MO-EVs来源的microRNAs的差异表达
a)对TSA-EVs和MO-EVs差异表达的microRNAs进行聚类分析。b)比较TSA-EVs和MO-EVs差异表达的microRNAs的Venn图。c)火山图,显示microRNAs差异倍数log2值与log10 FDR的关系。对数2倍差小于2且统计值>0.05的microRNAs不被认为有统计学意义(分别为垂直和水平线)。图中的红点代表显著升高的TSA-EVs microRNAs,绿点代表显著升高的MO-EVS microRNAs
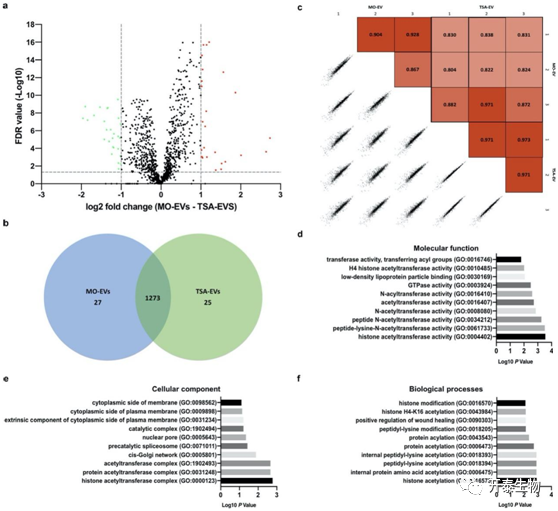
图7 TSA-EVs和MO-EVs差异表达蛋白的分析
a)对Log10 FDR的蛋白质差异倍数Log2值的火山图。对数2倍差小于1且统计值>0.05的蛋白质不被认为有统计学意义(分别为垂直和水平线)。图中的红点代表显著上调的TSA-EVs蛋白,绿点代表显著上调的MO-EVs蛋白。b)比较TSA-EVs和MO-EVs差异表达蛋白的Venn图。共有蛋白1273个;TSA-EVs中有25个蛋白上调,MO-EVs中有27个蛋白上调。c)测定了技术重复、生物重复和样品组之间的皮尔逊相关性。GO分析发现TSA-EVS中蛋白质显著上调。TSA-EVS中蛋白质的分子功能d)、细胞成分e)和生物学过程f)等领域的前十大GO预测得分显著提高。
+ + + + + + + + + + +
结 论
研究表明,通过TSA诱导的高乙酰化改变成骨细胞表观遗传功能,增强了亲代细胞的分化能力和EVs的诱导成骨能力。此外,microRNA测序图谱显示TSA-EVs中富集了与成骨相关通路相关的microRNA。蛋白质组学分析证实了TSA-EVS中富集表观遗传调控蛋白。本文研究结果表明,表观遗传调控作为一种新的工程方法,可以提高EVs作为一种脱细胞骨修复工具的治疗效果。
+ + + + +



 English
English

