文献解读|iScience(6.107):评估长期受辐射的腮腺中的转录景观和细胞间通讯
✦ +
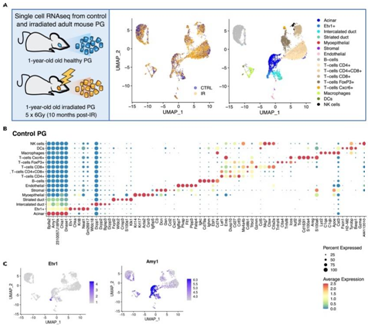
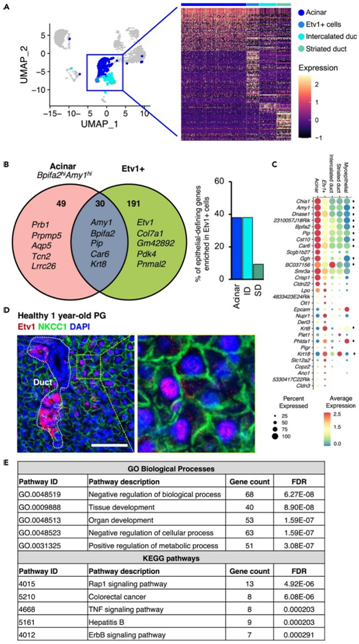
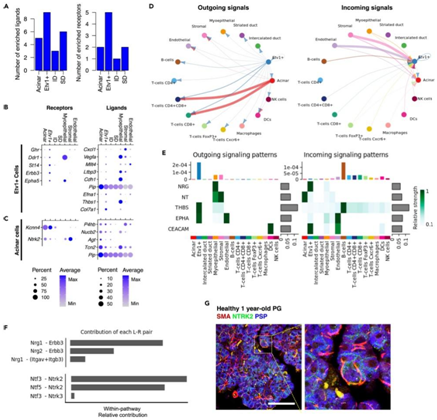
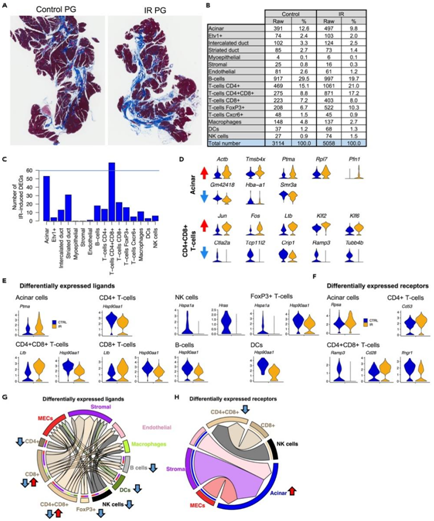
+ 论文ID 原名:Evaluating the transcriptional landscape and cell-cell communication networks in chronically irradiated parotid glands 译名:评估长期受辐射的腮腺中的转录景观和细胞间通讯网络 期刊:iScience 影响因子:6.107 发表时间:2023.4.11 DOI号:10.1016/j.isci.2023.106660 背 景 在三对主要的唾液腺 (SG) 中:腮腺 (PG)、下颌下腺 (SMG) 和舌下腺 (SLG),人类 PG 最大,产生的唾液量最大,特别是在对味觉模拟的反应中。在小鼠中,PG 比 SMG 小,但也有助于刺激唾液的大部分。PG是头颈癌放射治疗过程中对辐射 (IR) 损伤最敏感的部位,其损伤会引起永久性唾液功能减退。了解辐射后导致慢性唾液功能减退的转录情况将有助于确定损伤机制并开发再生疗法。 实验设计 结 果 01 健康和辐照小鼠腮腺单细胞鉴定 研究者团队在辐照后10个月分别收集健康小鼠和IR处理的小鼠PG,建立了2个独立的单细胞RNA测序 (scRNA-seq) 文库(图1A)。小鼠的头部和颈部区域连续五天接受 6 Gy (IR/天) 辐射,总剂量为 30 Gy,这种 IR 损伤 SG 的小鼠模型导致唾液慢性流失和上皮细胞的部分缺失。之后,他们建立了基因表达谱和先前生成的 SMG 发育图谱对产生的 17 个细胞聚类进行了注释,该图谱提供了细胞类型特异性标记(图1B)。鉴定的细胞群包括腺泡细胞 (Amy1+)、间质导管细胞 (Dcpp1-3+)、分泌管细胞 (Fxyd2+、Klk1+)、肌上皮细胞 (MEC) 细胞(Acta2+ Krt14+)、基质细胞 (Col1a1+Vim+)、内皮细胞 (Pecam1+) 和9个不同的免疫细胞群,包括B细胞(Cd79a+和免疫球蛋白基因)、5种T细胞亚型(CD4+; CD8+; CD4+CD8+; FoxP3+; Cxcr6+)、巨噬细胞 (Adgre1+)、树突状细胞 (S100a8/9+) 和自然杀伤细胞 (Gzma Nkg7+)。他们还确定了一个以前未表征的上皮细胞群,该上皮细胞群由Etv1的高表达和Krt8以及Amy1的适度表达(图1B-C)。 图1. 对照和辐照 PG 的 scRNA-seq 分析 02 Etv1 表达描绘了腺泡和导管室中的分泌亚群 Etv1+细胞中 Amy1 的表达表明存在腺泡样表型,当比较主要上皮细胞群的基因表达谱时,38% 的腺泡定义基因(79 个中的 30 个)在Etv1+细胞中富集(图2A-B)。两种细胞类型均表达浆液分泌标志物,如淀粉酶 (Amy1)、腮腺分泌蛋白 (Bpifa2)、催乳素诱导蛋白 (Pip)和碳酸酐酶6 (Car6),但它们在腺泡细胞中的表达明显较高,而Etv1+细胞中Krt8、Krt18和Phlda1的表达较高(图2C)。与导管群体相比,Etv1+细胞表达了 38%(19 个基因)的间质导管 (ID) 定义基因和仅 9.3% 的分泌管 (SD) 定义基因(图2B),表明Etv1+细胞在转录上与腺泡和 ID 群体相似(图2B)。因此,通过免疫荧光在导管和腺泡细胞的一个子集中检测到 Etv1 蛋白,导管细胞显示出强烈的细胞核和细胞质Etv1+信号,而NKCC1+腺泡细胞以细胞核为主(图2D)。 接下来,他们使用STITCH(化学物质相互作用搜索工具,http://stitch.embl.de/)对所有腺泡细胞和Etv1+细胞定义基因进行了功能分析,该工具整合了代谢和KEGG途径、晶体结构、结合实验和药物-靶标关系的相互作用信息。对腺泡基因的KEGG通路分析显示,唾液分泌是最重要的通路之一,相比之下,在Etv1+细胞中,顶端功能和通路与器官发育和Rap1、TNF和ErbB信号通路的激活有关,这表明尽管Etv1+群体的转录与腺泡细胞相似,但它们具有不同的功能(图2E)。 图2. 腺泡细胞和 Etv1+ 细胞的特征 03 腺泡和 Etv1+细胞通过Erbb3和Ntrk2与MEC和基质细胞通信 差异表达分析鉴定了Etv1+细胞定义基因中的 9 个配体基因和 5 个受体基因,以及腺泡细胞中的 5 个配体基因和 2 个受体基因(图3A)。已鉴定的富含Etv1+细胞的受体基因包括Ghr、Dddr1、St14、Erbb3和Epha5,它们对该群体具有高度特异性(图3B)。另一方面,在Etv1+细胞中发现的配体也在其他细胞类型中富集,但Col7a1除外,它具有高度特异性(图3B)。Etv1+细胞配体最强的外向相互作用发生在内皮细胞的受体上,而Etv1+细胞受体对应于肌上皮细胞和基质细胞的配体。相比之下,腺泡细胞配体的相应对主要在T细胞中表达(图3D)。 CellChat 分析确定 Etv1+细胞是血小板反应蛋白 (THBS) 和 EphrinA (EPHA) 信号通路的配体来源,并具有癌胚抗原细胞粘附分子 (CEACAM) 和神经调节蛋白 (NRG) 配体的受体,而腺泡细胞则接受神经营养素 (NT) 信号(图3E)。这些结果揭示了肌上皮细胞和 Etv1+ 细胞之间通过Erbb3受体及其两个配体 Neuregulin1 (Nrg1) 和Nrg2之间的显著相互作用,以及肌上皮细胞和腺泡细胞之间通过神经营养蛋白受体Ntrk2及其配体之一神经营养蛋白 5 (Ntf5) 之间的显著相互作用(图3E-F)。在scRNA-seq 数据中,Ntrk2也在Etv1+、肌上皮细胞和基质细胞中表达,免疫荧光染色证实了小鼠腮腺腺泡细胞中受体的富集(图3F-G)。 图3. Etv1+和腺泡细胞的配体-受体分析 04 CD8+ CD4+ T 细胞和腺泡细胞对 IR 的转录反应分析 本研究中使用的 SG-IR 模型基于连续5天6Gy的辐射处理,这会导致唾液大量流失,但它不会导致腺泡细胞的大量丢失和纤维化的发展(图4A)。B 细胞和 T 细胞受影响最大(图 4A-B),他们观察到 B 细胞比例相对减少 33%,CD4+ T 细胞增加 39%,CD4+CD8+ T 细胞增加195%。还注意到腺泡细胞比例减少了 22%。 在对照和照射的细胞类型之间使用 SEURAT 进行差异表达基因分析 (DEG),在所有已鉴定细胞群中,CD4+CD8+ T 细胞在 IR 后具有最多数量的失调基因,其次是腺泡细胞(图4C)。他们没有在 IR 后检测到 MEC 和基质细胞群中的 DEG,只有1个基因在 IR 内皮细胞中差异表达。MEC 中缺乏 DEG 的原因可能是因为分析的 MEC 数量较少(图4B)。基质细胞和内皮细胞也没有表现出显著的基因表达变化,但它们在本项研究的数据集中得到了很好的体现;因此,仅靠细胞数量不可能解释这些人群中 IR 后缺乏 DEG的原因。相反,缺乏 DEG 可能反映了这种 IR 损伤模型不是高度纤维化的事实(图 4A),内皮细胞和基质细胞群可能在 IR 损伤一年后恢复。IR 后腺泡细胞中上调最多的基因包括参与肌动蛋白聚合的Actb、Tmsb4x和Pfn1(图4D)。 在 CD4+ CD8+ T 细胞中,IR 后上调最显著的基因是Jun、Fos、Ltb、Klf2和Klf6,下调最显著的基因是Ctla2a、Tcp11L2、Crip1、Ramp3和Tubb4b(图4D)。当他们将 IR处理后的DEG 与公开的配体-受体对数据库进行交叉引用时,仅出现了少数配体和受体(图4E-F),其中只有少数具有对应的对(图4G-H)。大多数差异表达对存在于免疫群体、内皮细胞、基质细胞和内皮细胞之间。在受转录影响最大的腺泡和CD4+CD8+T细胞中,他们发现了5个配体(Ptma、Hsp90aa1、lbb、Hspa1a和Hras)和5个受体基因(Rpsa、Cd53、Ramp3、Cd28和Ifngr1)在IR处理后的差异表达(图4E-F)。 然而,这些DEG是在多个集群中表达的,并没有定义任何个体群体。例如,Hsp90aa1在除NK细胞和巨噬细胞外的所有免疫群体中均下调,Hspa1a和Hras在NK细胞中均下调(图4E)。同样,Rpsa在腺泡细胞中表达上调,而Ifngr1在CD4+CD8+T细胞中表达下调(图4F)。 多种信号通路发生改变,包括通过Lamb2-Rpsa与腺泡细胞的相互作用,以及NK细胞和CD8+细胞通过Ifng-Ifngr1与CD4+CD8+T细胞的相互作用(图4G-H)。免疫细胞通过Hsp90aa1向肌上皮细胞、基质细胞和内皮细胞中表达的Egfr传递的旁分泌信号可能减少,而Ltb与巨噬细胞、内皮细胞、树突状细胞和B细胞中表达的Tnfrsf1a和Cd40的相互作用可能增加。 图4. 细胞特异性 IR 诱导的 DEG 05 神经营养蛋白、神经调节蛋白、ECM 和免疫信号是 IR 后腺泡和 Etv1+ 细胞的主要改变途径 与对照腺体相比,CellChat 预测 IR-PG 中的配体-受体相互作用相似。虽然预测的相互作用强度略有降低,但IR后的相互作用次数从对照组的3128次增加到IR PG的3191次(图5A)。CellChat 预测 MEC、基质细胞和内皮细胞具有最多数量的差异相互作用,而 B 细胞和 T 细胞在相互作用强度上具有最大差异(图5B)。 CellChat 预测从 MEC、基质和内皮细胞到腺泡和Etv1+ 细胞的信号改变(图5C-D)。一般来说,这似乎主要是由Cd44和Sdc4与多种胶原蛋白和层粘连蛋白之间较少的相互作用介导的(图5E)。最近还报道了受辐射的人类唾液腺中神经营养蛋白信号的破坏,Etv1+ 细胞中改变的信号还涉及Igf1-Igf1r与基质细胞和内皮细胞相互作用的丧失,以及通过Nrg2-Erbb3与基质细胞的相互作用增加(图5E)。两种细胞类型之间的一个关键区别是它们在 IR 后与免疫群体的不同相互作用。在腺泡细胞中,与 T 细胞和 B 细胞的相互作用增加(图5C-F)。相比之下,Etv1+ 细胞与 T 细胞的相互作用通常更强,但 FoxP3+ 细胞的相互作用较少(图5D-G)。 图5. IR 后失调的配体-受体对分析 + + + + + + + + + + + 结 论 本项研究对照射后 10 个月收集的对照和辐射小鼠腮腺进行 scRNA-seq 分析,确定了由Etv1的特定表达定义的分泌细胞群,这可能是腺泡细胞前体。腺泡和Etv1+ 分泌物分别表达Ntrk2和Erbb3,而这些受体的配体在肌上皮细胞和基质细胞中表达。此外,本项研究的数据表明分泌细胞和 CD4+CD8+T 细胞在辐射慢性损伤期间受到的转录影响最大,表明主动免疫参与。最后,对细胞间通讯网络的评估预测神经营养蛋白、神经调节蛋白和免疫信号在辐射后失调,因此可能在缺乏修复中发挥作用。本项研究将有助于了解可能用于修复受辐射腺体慢性损伤的细胞特异性途径。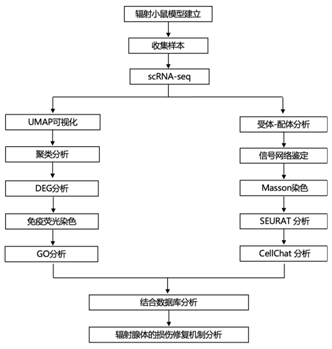



 English
English


