文献解读|Cell(64.5):来自胚胎干细胞高度贡献的活体嵌合体猴出生
✦ +
+
论文ID
原名:Live birth of chimeric monkey with high contribution from embryonic stem cells
译名:来自胚胎干细胞高度贡献的活体嵌合体猴出生
期刊:Cell
影响因子:64.5
发表时间:2023.11.09
DOI号:10.1016/j.cell.2023.10.005
背 景
哺乳动物多能干细胞具有植入前胚胎细胞样(幼稚)多能性,虽然已在啮齿类动物中证明了这种幼稚多能性,但由于供体细胞无法与宿主胚胎的发育状态相匹配,因此在包括非人类灵长类动物在内的其他物种中具有较差的嵌合状态。
实验设计
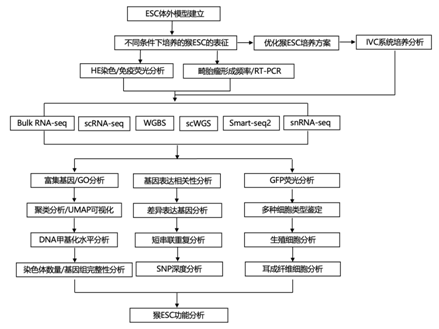
结 果
01
采用人类 PSC 培养方案捕获猴子囊胚内细胞团(ICM)样多能性
研究者团队从 17 个 E7(胚胎第 7 天)扩增的囊胚中建立了 9 个食蟹猴原始胚胎干细胞(ESC)系,这些猴原始 ESC 细胞表现出与人类的多能干细胞(PSC)相似的扁平形态(图S1A),衍生效率为53%(图S1B)。然后,他们选择了4种培养基进行原始-幼稚转换(primed-to-naive conversion):RSeT(基于NHSM)、5iLAF、PXGL和4CL。他们使用 5 个原始猴 ESC 系(两个雄性和三个雌性)不同条件下进行转换在。具有圆顶形态的克隆(类似于小鼠幼稚ESC)在 2-4 代内的所有条件下均出现(图 1 A)。使用4CL、RSeT和LCDM,所有5个原始猴ESC系都成功转化为稳定的培养物,而使用5iLAF和PXGL,分别只有2个和3个ESC系可以转化(图S1C)。在4CL、RSeT和LCDM中培养的ESC系在20多次传代后表现出稳定的克隆形态。在PXGL中,由于广泛的细胞死亡和分化,所有3个ESC系在第四代之后都失去了圆顶状的克隆形态。使用5iLAF,在10次传代后,只有2个雌性ESC系可以转化并获得介于原始样和幼稚样之间的中间形态(图S1D)。在单细胞分离后,所有稳定转化的猴ESC系的存活率和克隆效率都高于原始ESC(图S1E-S1F)。
他们使用畸胎瘤测定法检测了原始和转化的猴ESC的分化能力。无论培养系统如何改变,所有测试的猴ESC 都实现了高效畸胎瘤形成 (75-100%),并且在这些畸胎瘤中发现了来自所有三个胚层的衍生物(图S1G-S1H)。与原始 ESC 相比,所有转化的 ESC 均显示出四甲基罗丹明甲酯 (TMRE) 染色信号升高,表明存在活性氧化磷酸化(图S1I)。此外,在 4CL、PXGL 和 5iLAF 中培养的 ESC 显示出 TFE3(小鼠和人类中的天然 PSC 标记物)的核转位升高。TFE3 在原始 ESC 和在 RSeT 或 LCDM 中培养的 ESC 中主要表现出细胞质定位(图 S1 J)。
实时定量 RT-PCR (RT-qPCR) 分析表明,所有转化的 ESC 系均以与原始的 ESC 相当的水平表达经典多能性基因。在所有转化的 ESC 中,幼稚多能性基因的表达水平高于原始的 ESC,其中在 5iLAF 和 4CL 中培养的细胞中表达水平最高(图 S1K),通过 KLF17、SOX2 和 NANOG 的免疫染色进一步证实了这些结果(图 1 B)。
接下来,他们进行了bulk RNA测序(bulk RNA-seq),发现多个原始ESC富集基因发生下调,并且在4CL和5iLAF ESC中的幼稚多能性基因网络发生激活(图1C)。
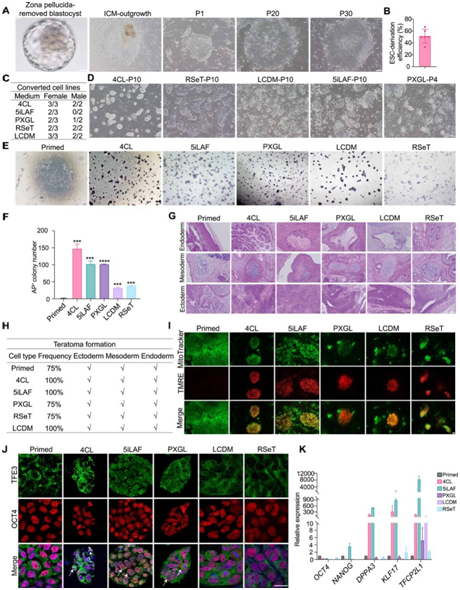
图S1. 六种不同条件下培养的猴ESC的表征。
(A) 代表性相差图像显示从猴囊胚中衍生出原始的 ESC。(B) 猴源 ESC 衍生效率分析。(C) 使用三个雌性和两个雄性原始 ESC 系在五种不同条件下的幼稚转换频率分析。(D) 代表性相差图像显示指定条件下的 ESC 克隆形态。(E) 代表性图像显示在指定培养条件下单细胞解离后的AP+ ESC 克隆。(F) AP +克隆的定量。(G) 对在指定条件下培养的 ESC 衍生的畸胎瘤进行 H&E 染色。(H)在指定条件下培养的ESC的畸胎瘤形成频率分析。(I) 通过线粒体标记物 (MitoTracker) 和 TMRE 的共染色显示活细胞在每个指定 ESC 培养条件下的线粒体活性的代表性图像。(J) 在所示条件下培养的 ESC 中 TFE3(绿色)和 OCT4(红色)的代表性免疫荧光图像。(K) RT-qPCR分析。
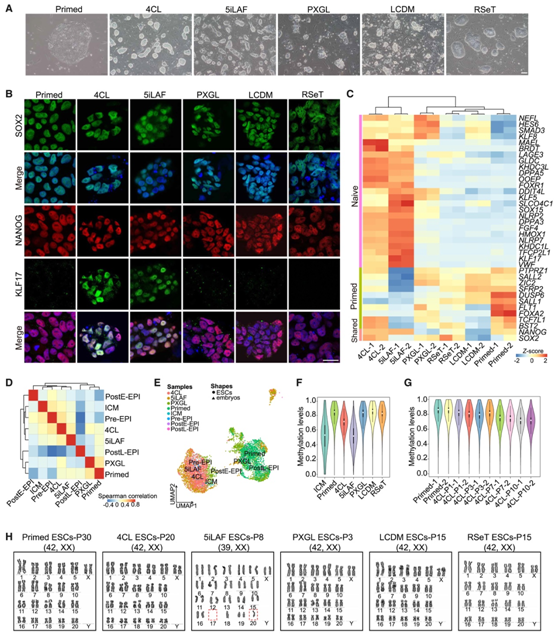
图1. 不同条件下培养的猴ESC的表征。
(A) 在指定条件下培养的猴子 ESC 的代表性图像。(B) 在指定条件下培养的猴 ESC 中幼稚 (KLF17) 和共有的 (SOX2/NANOG) 多能性标记的代表性免疫荧光图像。(C) 热图显示了在指定条件下培养的猴 ESC 中幼稚、共有和原始的多能性基因的表达。(D) 对 E8+K、4CL、5iLAF 和 PXGL 中培养的猴 ESC 的 scRNA-seq 数据与体内胚胎数据进行伪bulk相关分析。(E) UMAP可视化。(F) 小提琴图,显示在指定条件下培养的猴子 ESC 的 DNA 甲基化水平与 ICM DNA 甲基化水平的比较。(G) 小提琴图显示了在原始和 4CL 条件下培养的不同传代的猴子 ESC 的 DNA 甲基化水平。(H) 在指定条件下培养的猴 ESC 的 G 带核型的代表性图像。
GO分析显示,4CL和5iLAF ESC中与干细胞群维持和DNA修饰相关的基因富集,而轴突导向和神经分化相关基因在PXGL ESC中富集(图S2A)。这些结果表明,在4CL 和 5iLAF ESC 处于稳定的幼稚状态,但 PXGL ESC 处于不稳定状态,反映了对该介质的反应的物种特异性差异。然后,他们进行单细胞转录组分析(scRNA-seq),检测了猴原始ESC 和在 4CL、5iLAF 和 PXGL 中培养的 ESC 的发育状态。UMAP可视化表明,4CL和5iLAF的ESC更接近ICM和着床前的外胚层,而PXGL中的ESC更接近着床后晚期的外胚层(图1D-E)。
因为 DNA 去甲基化是一种表观遗传机制,通过该机制,原始 ESC 可以转化为幼稚多能状态,于是他们进行了全基因组亚硫酸氢盐测序(WGBS)。在RSeT、PXGL和LCDM中培养的ESC中,DNA甲基化水平较高(83%-86%),4CL 中的ESC的甲基化水平较低(72%),5iLAF ESC的甲基化水平最低(52%)(图1F,图S2B)。4CL和5iLAF ESC显示的印迹基因的DNA甲基化模式更接近ICM(图S2C)。他们还对 4CL 幼稚转化的不同传代中进行了 WGBS,发现所有基因组元件中都出现了进行性 DNA 去甲基化,包括幼稚多能性基因位点(KLF17、DPPA3 和DNMT3L3)(图1G,图S2D-S2G)。此外,在转换过程中,一些印记基因的启动子区域也检测到动态去甲基化(图S2 H)。在 RSeT、LCDM 和 4CL 培养基中培养 15 代或更多代后的 ESC 的核型分析显示染色体数量正常(图 1 H),表明基因组完整性得以维持。
为了进一步研究 4CL ESC 中的基因组完整性,他们进行了单细胞全基因组测序 (scWGS)。在相同次数 (10) 的传代后,他们没有观察到 4CL ESC 和原始 ESC 之间存在明显差异(图S2 I)。通过关联分析对两种条件下的全基因组拷贝数变异(CNV)进行进一步分析表明,在原始 ESC 和 4CL 幼稚ESC 之间不存在具有显著不同 CNV 的基因组区域(图 S2 J)。
总之,这些数据表明,与在其他人类 PSC 培养基中培养的猴 ESC 相比,4CL ESC 显示出更平衡的全基因组 DNA 去甲基化,同时具有高表达水平的幼稚多能性基因以及基因组稳定性。
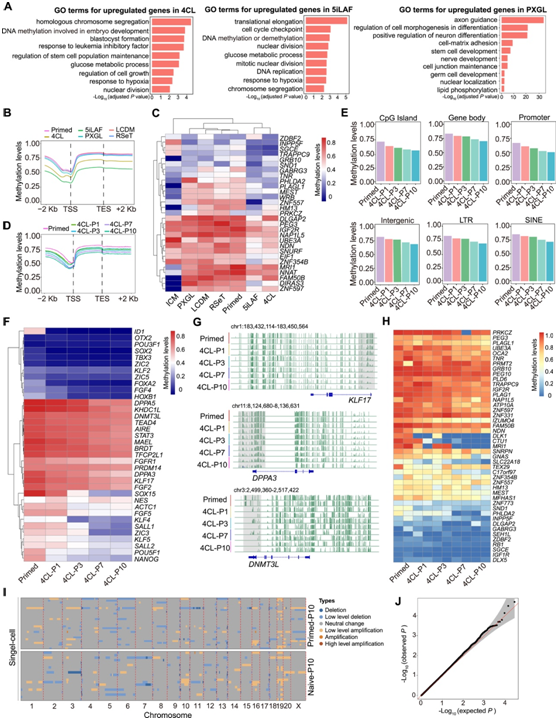
图S2. 不同条件下猴ESC的转录组和表观基因组表征。
(A) GO分析。(B-H)猴 ESC 中DNA 甲基化水平比较。(I) ScWGS,在 4CL 中从原始的 ESC 转化而来的猴 ESC 10 代,以及培养 10 代的相同的原始 ESC。(J)全基因组拷贝数变异分析。
02
用幼稚ESC制备嵌合猴早期胚胎的优化方案
他们专注于 4CL ESC,以优化注射的早期猴胚胎中 ESC 的存活率。4CL幼稚 ESC 由 GFP 标记的原始ESC 转化而来,并注射到桑葚阶段猴胚胎中(图 2 A)。当注射的桑葚在猴胚胎培养基 HECM9 中培养 72 小时(方案 1)时,他们观察到囊胚发育正常,但 GFP 信号较弱,表明存活的供体细胞很少。当注射的桑葚在 4CL 中培养 72 小时(方案 2)时,在大多数胚胎中观察到强烈的 GFP 信号,但没有观察到囊胚。当使用 4CL 和 HECM9 的 1:1 混合物将注射的桑葚培养 24 小时,然后在 HECM9 中培养 48 小时(方案 3)时,大多数胚胎中检测到 GFP 信号,并获得正常囊胚。然而,在这种情况下,每个囊胚中的 GFP 信号受到限制。因此,他们将注射的胚胎在 4CL 和 HECM9 的 1:1 混合物中培养 72 小时(方案 4)。这大大增强了 GFP 信号而不影响囊胚发育。将 4CL/HECM9 的比例进一步修改为 2:1(方案 5)导致胚泡形成缺陷。他们得出结论,方案 4(在 ESC 培养基和 HECM9 的 1:1 混合物中培养 72 小时)在 ESC 存活和囊胚发育之间实现了适当的平衡(图 2B-D)。
接下来,他们研究了方案 4 的变体(其中针对特定介质改变 4CL)是否对注射不同条件下生成的猴 ESC 的桑葚有影响。将 GFP 标记的猴原始 ESC 和 5iLAF ESC 注射到桑葚胚胎中,将其称为方案 6(原始 ESC)和 方案7(5iLAF ESC),在这两个注射组中,注射的桑葚胚显示出与 4CL ESC 相似的囊胚发育速率。同样,注射组之间GFP+囊胚的比例也没有显著差异(图2C-D)。在优化的培养方案下注射这三种类型的 ESC 的嵌合囊胚中的 OCT4 免疫染色显示 22-48% 的 GFP 和 OCT4 双阳性细胞位于 ICM 中(图 2 E-F)。
他们还在注射了三种类型 ESC 的嵌合囊胚中的 14-23% 的滋养外胚层 (TE) 中观察到了 GFP 信号(图 2D),表明猴 ESC 对胚胎和胚胎外谱系都有贡献。
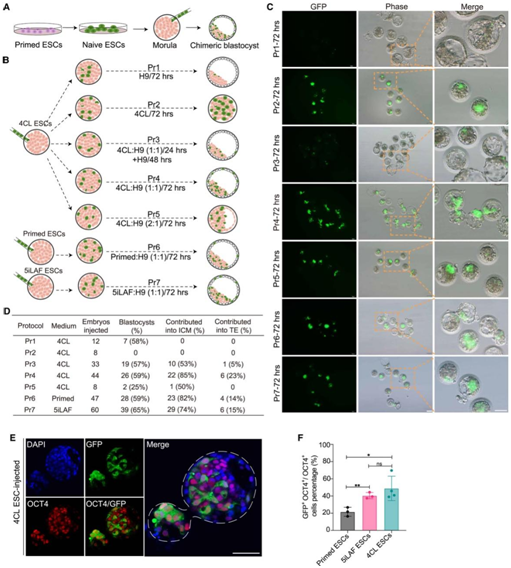
图2. 使用猴ESC生产嵌合囊胚的优化方案。
(A) 嵌合囊胚生成过程示意图。(B) 示意图显示使用不同方案将猴子 ESC 注射到桑葚中。(C) 代表性图像显示 GFP 标记的猴子 ESC 在囊胚阶段整合到宿主胚胎中。(D) 不同培养方案中囊胚发育和 GFP 信号检测。(E) 4CL ESC 注射的囊胚期嵌合胚胎中 GFP 信号和 OCT4(红色)免疫染色的代表性图像。(F)三个注射组的 ICM 中OCT4+ GFP+/OCT4+细胞百分比的定量。
03
长期培养中猴 ESC 对猴胚胎的贡献
接下来,他们使用长期体外培养 (IVC) 系统检测了注射的 ESC 在发育胚胎中的发育能力。本实验选择了在各自优化的培养方案 4、6 和 7 下用三种类型的 ESC(原始、4CL 和 5iLAF)生成的GFP+嵌合囊胚。大多数胚胎在受精后 (dpf) 10 天左右粘附在培养皿上。在 dpf 11-13 时观察到胚胎外滋养层细胞的快速增殖,而 ICM 仍保持为致密的细胞聚类。在 dpf 15-17 时,胚胎盘状结构清晰出现(图3A-B)。重要的是,在三个 ESC 注射组和对照组(未注射 ESC)之间观察到体外发育效率相当(39-45% IVC 胚胎具有胚盘样结构),这表明注射的 ESC 并未降低效率体外发育(图3C)。他们还观察到,在原始组、4CL 组和 5iLAF ESC 注射组中,分别有 3/7、8/11 和 5/7 的 dpf 17 胚胎显示出清晰的 GFP 信号(图 3D)。在 4CL 和 5iLAF 注射组中,随着培养时间的延长,GFP 信号显著增加(图 3 A)。
值得注意的是,他们在 dpf 17 时在 4CL ESC 注射组衍生的嵌合胚胎中观察到大量 GFP+ 细胞(图 3 A)。随后,他们进行了 Smart-seq2 scRNA-seq 分析,确定了 6 个聚类[外胚层细胞(EPI)、早期原始生殖细胞、原肠胚细胞、内脏/卵黄囊内胚层、胚胎外间充质细胞和 TE](图 3 E-F)。值得注意的是,嵌合IVC胚胎中的GFP细胞与自然胚胎和体外培养胚胎的注释细胞类型发生共聚集(图3G)。GFP +细胞对 EPI (68/74, 92%)、Gast1 (2/2, 100%) 和 TE (25/54, 46%) 有很大贡献(图 3H)。进一步分析显示,IVC胚胎中所有细胞的不同谱系中都存在细胞类型特异性差异表达基因(DEG)(图3I)。GO 分析表明,EPI 富集了 mRNA 分解代谢过程、翻译起始和干细胞群维持等通路,而 VE/YE 富集了涉及分化和细胞极性建立或维持的细胞形态发生的通路。EXMC和TE中富集了诸如细胞外结构组织、细胞外基质组织和子宫内胚胎发育等通路(图3J)。因此,使用 IVC 系统,他们证明猴幼稚 ESC 比原始ESC 具有更高的嵌合胚胎生成能力。
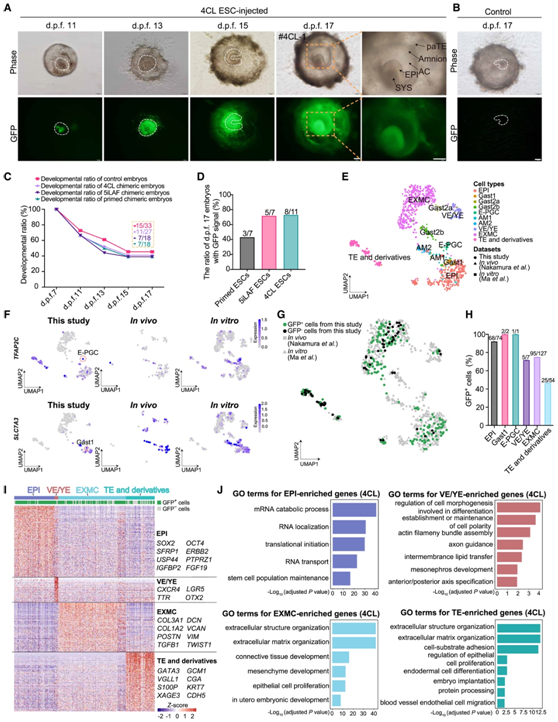
图3. 猴ESC对体外长期培养猴胚胎的贡献。
(A)嵌合猴胚胎在发育过程中指定时间点体外长时间培养的代表性图像和 GFP 信号。(B)未注射对照胚胎体外长时间培养的代表性图像和 GFP 信号。(C) 对照猴胚胎和用 4CL、5iLAF 和原始的 ESC 生成的嵌合猴胚胎的发育比率动态。(D) 直方图显示三组 dpf 17 时具有 GFP 信号的嵌合猴胚胎的百分比。(E-G) UMAP可视化。(H) 条形图显示IVC 嵌合胚胎的每种已识别细胞类型中GFP+细胞的百分比。(I) IVC 嵌合胚胎关键细胞类型之间 DEG 的热图。(J) GO 分析。
04
从同源ESC中产生嵌合猴
然后,他们通过将嵌合猴胚胎转移到代孕母猴体内来产生活产嵌合体。12例妊娠中,获得4例流产胎儿和6例足月活胎。通过 PCR 分析在一名流产雄性胎儿 (#9) 和一名活产雄性胎儿 (#10) 中检测到 GFP 序列,两者均对应于具有强 GFP 信号的嵌合囊胚(图4A-C)。10 号活猴婴儿的整个身体(包括手指、尾巴和眼睛)都显示出强烈的 GFP 信号,表明 ESC 衍生细胞的高贡献(图 4D)。短串联重复 (STR) 分析进一步证实了 ESC 在这两只猴子中的贡献(图4E-F)。存活10天后,嵌合猴#10的健康状况恶化,出现呼吸衰竭和体温过低,兽医将其安乐死进行详细分析(图4G)。
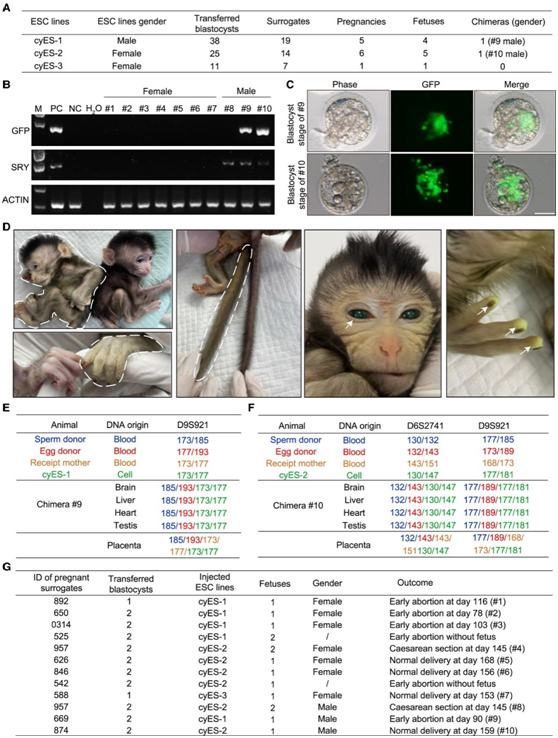
图4. 同源ESC的嵌合猴的产生。
(A)本研究中体内嵌合体测定结果。(B) 基因组 DNA PCR分析。(C) 移植前囊胚阶段的两个(#9 和 #10)嵌合胚胎的相位和 GFP 图像。(D) 显示 3 天龄活产嵌合猴 (#10) 不同身体部位绿色荧光信号的图像。(E-F) 两只嵌合猴(#9 和 #10)在 D6S2741 和 D9S921 位点的 STR 分析。(G) 嵌合胚胎替代物及其递送信息的总结。
将先前解剖并冷冻的两只嵌合猴的各种组织用于通过 PCR 进行 GFP 序列检测。在这两只猴子的几乎所有测试组织中,GFP 序列信号都很强(图 5A)。在10号猴子(#10)的样本中鉴定出了位于 mtDNA 中的 3 个单核苷酸多态性(SNP),深度测序显示 ESC 的贡献从 21% 到 92% 不等,在 26 个测试组织中平均为 67%(图 5B-C)。对位于 X 染色体上的另外 3 个 SNP 的分析显示,10号猴的 ESC 贡献平均为 63%(图5B-D)。
他们还通过 GFP 荧光成像检测了 ESC 的贡献,在两只嵌合猴的骨髓细胞 (BMC) 和10号猴的外周血单核细胞 (PBMC) 中发现了强信号(图5E)。FACS分析和细胞计数显示10号猴的PBMC和BMC中GFP+细胞比例为88%和78%,9号猴的BMC中GFP +细胞比例为20%(图5F)。在10号猴的其他9个组织(脑、心、肾、肝、肺、回肠、空肠、直肠、羊膜)和9号猴的4个组织(脑、心、肾、肝)中也观察到强GFP荧光信号(图5G–5I)。
在这两只嵌合猴的大脑皮层中,GFP和NeuN的共染色进一步证实了ESC对大脑的贡献(图5J)。通过免疫染色评估的这些组织中的GFP+比例,显示了与SNP定量方法大致相似的水平(图5K-L),进一步证实了这些嵌合猴中ESC的高贡献。
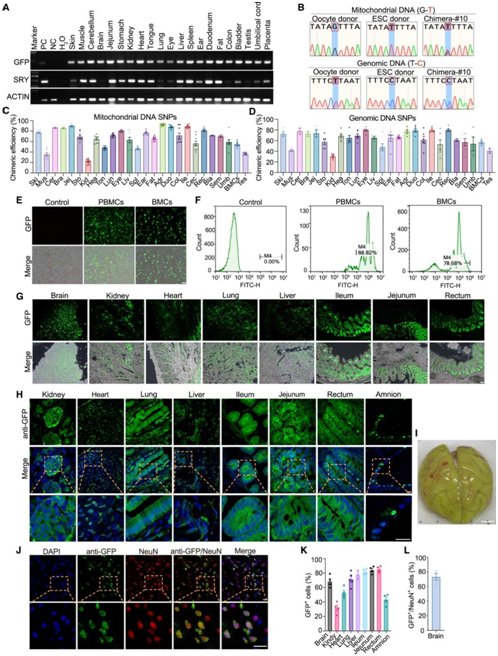
图5. 活产嵌合猴中猴幼稚ESC贡献的综合分析。
(A) 基因组 DNA PCR,用于检测嵌合猴 #10 所示组织样本中的 GFP、SRY 和肌动蛋白。(B) 嵌合猴 #10 中卵母细胞供体和 ESC 供体之间线粒体 DNA SNP 和基因组 DNA SNP 的鉴定。(C-D) 通过线粒体 DNA SNP 和基因组 DNA SNP 的深度测序对嵌合猴 #10 中 ESC 的贡献进行定量。(E) 代表性 GFP 荧光显示 GFP 标记的 4CL 幼稚 ESC 分化为嵌合猴 #10 的 PBMC 和 BMC。(F) FACS 分析显示嵌合猴 #10 的 PBMC 和 BMC 中GFP +细胞的百分比。(G-H) 代表性 GFP 荧光显示 GFP 标记的 4CL 幼稚 ESC 分化为嵌合猴 #10 的所示组织。(I) 嵌合猴 #10 的全脑图像。(J) 代表性图像显示 GFP 标记的 4CL 幼稚ESC 对嵌合猴 #10 大脑的贡献。(K)嵌合猴 #10 不同组织中GFP +细胞百分比的定量。(L)嵌合猴 #10 大脑中 NeuN 阳性细胞中GFP +细胞百分比的定量。
05
ESC衍生细胞与嵌合猴的功能整合
他们进行了转录组分析,以进一步表征这两只嵌合猴的实体组织和血液相关细胞。他们首先对冷冻保存的10号猴的 BMC 进行 Smart-seq2。在测序的 BMC 中,79%为 GFP+,与 SNP 和 FACS 分析一致(图 6 A)。他们根据标记基因表达对测序的细胞进行了注释,并鉴定了 10 种细胞类型,包括单核细胞、自然杀伤 T 细胞和红细胞(图 6B-C)。GFP +细胞对这些注释的细胞类型的贡献率很高,从 53% 到 100%,其中两个细胞谱系完全源自注射的 ESC(粒细胞-单核细胞祖细胞和自然杀伤 T 细胞)(图 6D)。接着,通过scRNA-seq,他们注释了 16 种细胞类型(图 6E-F)。GFP +细胞和 GFP -细胞注释了相同的细胞谱系组成。有趣的是,红系细胞在 GFP +细胞中更为富集,而单核细胞主要在 GFP-细胞中,表明嵌合体胚胎发育过程中存在潜在的分化偏差(图 6 G)。
他们对嵌合猴 #10 的液氮冷冻脑组织应用了相同的策略。使用提取的细胞核,他们分别进行了 Smart-seq2 和进行了单细胞核 RNA 测序 (snRNA-seq)。与 SNP 分析一致,根据 Smart-seq2 结果,注射的 ESC 贡献了 91% 的脑细胞(图 6 H)。确定的 GFP +脑细胞包括 93% 的兴奋性神经元、91% 的抑制性神经元和 77% 的小胶质细胞以及 100% 的神经前体细胞(图6I-K)。snRNA-seq 进一步证明,注射的供体细胞还对其他脑细胞有贡献,例如星形胶质细胞、少突胶质细胞以及 VIP +、 SST +和 PVALB +抑制性神经元(图 6L-N)。
这些结果证明来自供体ESC的GFP+细胞完整地整合到与宿主细胞具有相似特征的猴嵌合体中。
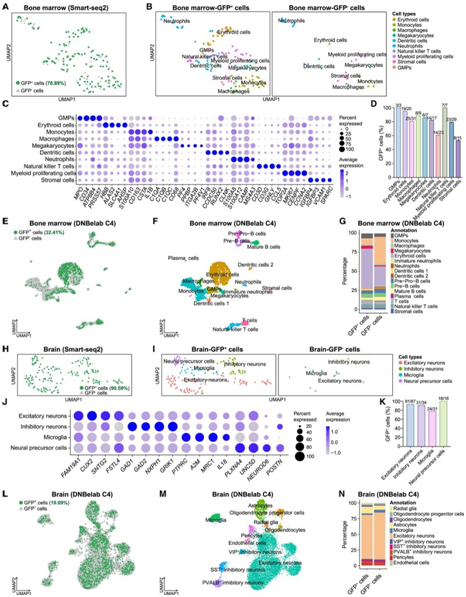
图6. 活产嵌合猴细胞谱系表征分析。
(A-B) UMAP 可视化。(C) 气泡图代表来自嵌合猴 #10 的骨髓 Smart-seq2 数据中细胞类型特异性标记基因的表达频率和平均表达。(D) 条形图显示嵌合猴 #10 的骨髓 Smart-seq2 数据中每种已识别细胞类型的 GFP +细胞百分比。(E-F) UMAP 可视化。(G) 条形图显示骨髓中鉴定的不同细胞类型中GFP +和 GFP -细胞的比例。(H-I) UMAP 可视化。(J) 气泡图代表来自嵌合猴 #10 的大脑 Smart-seq2 数据中细胞类型特异性标记基因的表达频率和平均表达。(K) 条形图显示嵌合猴 #10 大脑 Smart-seq2 数据中识别的不同细胞类型中GFP +的百分比。(L-M) UMAP 可视化。(N) 条形图显示了嵌合猴 #10 的基于脑液滴的 snRNA-seq 数据中识别出的不同细胞类型中GFP+和GFP-细胞的比例。
06
ESC 对嵌合猴生殖细胞和胎盘的贡献
生殖系细胞的分化涉及与其他组织不同的广泛的 DNA 去甲基化和再甲基化过程。胎盘起源于滋养外胚层,即胚胎外组织。同一细胞中 GFP 和生殖细胞特异性标记物 VASA 的联合免疫染色分析证实了供体 ESC 在体内分化为生殖细胞(图7 A)。所有睾丸细胞和所有 VASA +细胞中 GFP +细胞的平均百分比在猴子 #10 中分别为 58% 和 62%,在猴子 #9 中分别为 11% 和 28%(图 7B)。他们还使用来自嵌合猴 #10 睾丸的分离细胞和年龄匹配的野生型猴作为对照进行了 scRNA-seq。在猴#10中的 GFP+ 和 GFP- 细胞均包括间质/间质细胞、管周肌样细胞、支持细胞、内皮细胞、增殖细胞和精原细胞,整合聚类分析显示,来自嵌合猴#10的GFP +和GFP-细胞的这六个主要谱系与年龄匹配的对照猴的主要谱系聚集在一起(图7C-F)。XY GFP−支持细胞高表达支持细胞标记基因(SOX9、CITED1、DMRT1和SERPINA5),而XX GFP+支持细胞表达卵巢颗粒细胞标记基因(CYP19A1、WNT6、AMHR2和CRHBP)(图7G)。
对嵌合猴#10的胎盘进行免疫荧光分析,检测到GFP与绒毛滋养层细胞标志物KRT7、海绵滋养层细胞标志物MCT4和滋养层巨细胞标志物proliferin的共表达(图7H)。
GFP + BMC显示出比 GFP– BMC更高的 DNA 甲基化水平(图 7I-J)。BMC 中前100个表达基因的启动子中的 DNA 甲基化水平在 GFP+和 GFP– BMC 之间没有显著差异。这些发现与 GFP+和 GFP−BMC的单细胞转录组分析非常相似(图 7 K)。
他们还分析了印记基因的 DNA 甲基化水平,观察到 GFP + BMC的印记基因启动子区域的 DNA 甲基化水平略高。同时,这些印记基因在 GFP +和 GFP– BMC 之间的表达水平相似,表明用 4CL 幼稚 ESC 生成的猴嵌合体中基因组印记没有明显损失(图 7 L)。
在对 10 号猴子实施安乐死期间,他们还收集了耳尖和分离的成纤维细胞,将其扩增并冷冻保存。为了研究嵌合猴中供体 ESC 衍生细胞的基因组完整性,他们使用 GFP +和 GFP− BMC 以及耳成纤维细胞进行了全基因组测序。GFP+ BMC和 GFP +耳成纤维细胞几乎没有基因组异常(图 7 M)。
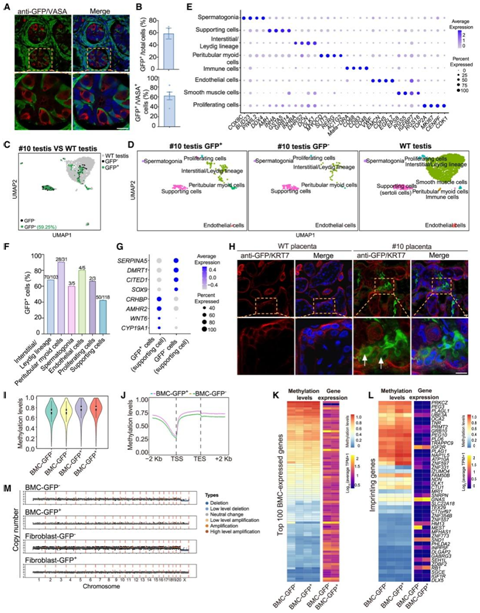
图7. 猴幼稚ESC对睾丸和胎盘的嵌合贡献以及ESC衍生细胞的基因组完整性和表观遗传状态。
(A) 代表性免疫荧光图像显示 GFP 标记的 4CL 幼稚 ESC 对嵌合猴 #10 睾丸的贡献。(B) 总细胞和 VASA +细胞中GFP +细胞百分比的定量。(C-D) UMAP可视化。(E) 气泡图代表 #10 嵌合猴和野生型猴睾丸中细胞类型特异性标记基因的表达频率和平均表达。(F) 条形图显示嵌合猴 #10 的睾丸 Smart-seq2 数据中鉴定的不同细胞类型中GFP +细胞的百分比。(G) 气泡图代表#10 嵌合猴的GFP +和 GFP -睾丸细胞中支持细胞特异性标记基因的表达频率。(H) 代表性免疫荧光图像,显示 GFP 标记的 4CL 幼稚 ESC 对 #10 嵌合猴胎盘和野生型胎盘的贡献。(I) 小提琴图显示 GFP- BMC 和 GFP + BMC中的全局 DNA 甲基化水平。(J) GFP– BMC和GFP+ BMC中 TSS 和 TES 的 DNA 甲基化水平比较。(K) BMC 表达基因的启动子区域 DNA 甲基化水平和基因表达水平的热图。(L) 热图显示 GFP -和 GFP + BMC中印迹基因启动子区域的 DNA 甲基化水平和基因表达水平。(M) 使用 GFP-和 GFP+ BMC以及耳成纤维细胞通过全基因组测序检测到的拷贝数。
+ + + + + + + + + + +
结 论
本项研究系统地测试了建立猴幼稚胚胎干细胞的各种培养条件,并优化了嵌合胚胎培养的程序,显著提升了胚胎干细胞注入胚胎后的存活效率,最终得到了出生存活的高比例胚胎干细胞来源的嵌合体猴,证明了注入的猴胚胎干细胞可以高效地促进包括胎盘和生殖细胞在内的各种不同组织和细胞发展。该研究对于理解灵长类胚胎干细胞全能性和发育潜能具有重要意义,为建立基于猴胚胎干细胞嵌合体的基因打靶和模型构建技术奠定了基础。
+ + + + +



 English
English


