文献解读|Cancer Cell(50.3)祖细胞样耗竭 SPRY1 + CD8 + T 细胞增强食管鳞状细胞癌对新辅助 PD-1 阻断的反应
✦ +
+
论文ID
原名:Progenitor-like exhausted SPRY1+CD8+ T cells potentiate responsiveness to neoadjuvant PD-1 blockade in esophageal squamous cell carcinoma
译名:祖细胞样耗竭 SPRY1 + CD8 + T 细胞增强食管鳞状细胞癌对新辅助 PD-1 阻断的反应
期刊:Cancer Cell
影响因子:50.3
发表时间:2023.10.07
DOI号:10.1016/j.ccell.2023.09.011
背 景
食管癌是全球第七大癌症相关死亡原因,其中食管鳞状细胞癌(ESCC) 约占所有病例的 90%。新辅助免疫检查点阻断(NICB)在可手术的ESCC中显示出巨大应用前景,但缺乏可用的有效生物标志物。
实验设计
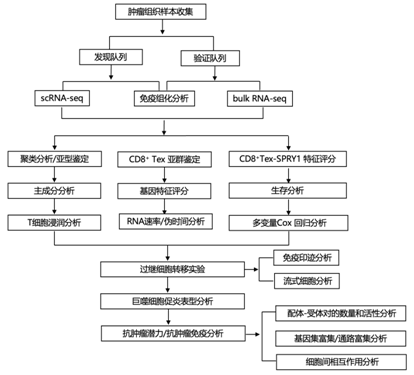
结 果
01
NICB 前后 ESCC 中的肿瘤微环境(TME)的动态变化
为了表征 NICB 反应性ESCC的肿瘤免疫特性,研究者团队从 II 期临床试验中收集了可手术的局部晚期 ESCC 患者的肿瘤标本(图1A)。在内窥镜检查和手术期间(治疗后)治疗前(治疗前)收集肿瘤组织,他们利用单细胞转录组数据(scRNA-seq)分析了来自 7 名患者(发现队列)的 14 个配对治疗前和治疗后肿瘤样本,以创建用于分析的细胞图谱。在NICB疗效评价中,病理评估食管及转移淋巴结内无残留肿瘤细胞定义为完全消退/缓解 (CR) ,部分或较差的消退/缓解定义为非完全消退/缓解(NCR)(图1B)。他们获得了111262 个细胞的scRNA图谱,并鉴定了患者、治疗和反应中共享的免疫和非免疫细胞聚类(图 1 C-D)。NICB治疗后,CR组病灶外观发生巨大变化,从典型的肿瘤特征(治疗前)到几乎完全恢复正常黏膜外观(治疗后)(图1B),表明NICB可能促进TME的细胞重塑。他们使用主成分分析(PCA)来检测TME内细胞组成的变化。在CR组中,NICB前后,可见类似于癌症向正常食管细胞转变的模式(图1E),反映了达到CR的患者成功的抗肿瘤反应。这些结果提示ICB在食管鳞癌中在单细胞水平上具有微环境重塑作用。
在有反应者之间所有细胞类型的细胞比例差异最大的是T细胞。PD-1的表达仅限于T细胞,治疗前后CR组的PD-1表达均高于NCR组(图1F)。值得注意的是,与NCR患者相比,CR患者在肿瘤中表现出更高的T细胞浸润(图1G),这表明 CD8+ T 细胞在 ESCC 的 NICB 中发挥着关键作用。
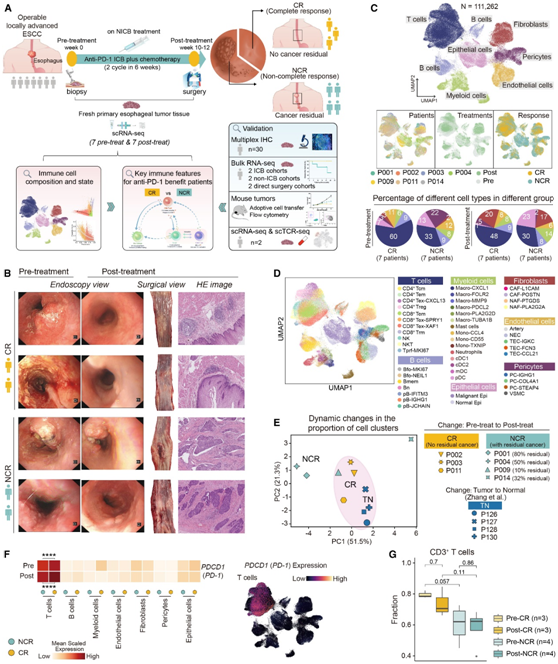
图1. 免疫治疗前后食管鳞癌的细胞概述。
(A) 研究概述。(B) NICB 前后 CR 和 NCR 肿瘤的代表性图像。 (C) UMAP 可视化(上)捕获的所有细胞,按主要细胞类型、患者、治疗和反应着色,饼图显示每组细胞类型的百分比(下)。(D) UMAP 显示所有细胞子集。(E)细胞聚类动态变化的主成分分析。(F) 标准化PD-1表达的热图和针对PD-1表达进行着色的 UMAP 。(G)所有 CD45 +细胞中 CD8 +和 CD4 + T 细胞的分数。
02
具有祖表型的不同CD8+ Tex群体
当使用基于图的聚类算法将T细胞进行亚聚类分析时,他们检测到两个CD8+ T细胞聚类和一个CD4+ T细胞聚类,它们高表达标志T细胞耗竭的PDCD1、HAVCR2和LAG3(图2A)。他们还鉴定了几个典型的T细胞群,包括调节性(Treg),中央记忆(Tcm),效应性记忆(Tem)和组织驻留记忆(Trm)T细胞亚群。他们首先研究了抗PD-1对耗竭T细胞(Tex)的调节。在NICB后,Tex的耗竭特征活性显著降低,并且这种降低在CD8+ Tex中比CD4+ Tex中更明显(图2B)。他们还观察到,在Tex治疗后,T细胞介导的抗肿瘤反应活性显著提高,证明NICB激活食管鳞癌TME内的Tex。
接下来,他们将重点放在CD8+ Tex上,因为最近的研究发现了不同的CD8+ Tex亚群具有不同的功能状态,包括末端CD8+ Tex和祖/前体CD8+ Tex (Tpex),它们优先对免疫检查点阻断(ICB)反应。
他们确定了两个不同的转录异质性 CD8 + Tex 细胞聚类(图 2C),其中一个细胞聚类(“CD8 + Tex-SPRY1”)专门表达高水平的SPRY1,另一个细胞聚类(“CD8 + Tex-XAF1”)高表达几种干扰素刺激基因(XAF1、IFI44L和MX1)。
为了研究ESCC中发现的CD8+ Tex聚类是否表现出Tpex表型,他们对单个细胞的祖细胞和终末细胞CD8+ Tex基因特征进行了评分。通过比较ESCC中CD8+ Tex-SPRY1聚类和CD8+ Tex-XAF1聚类的转录特征评分,他们发现ESCC中CD8+ Tex-SPRY1聚类与表达TCF7的Tpex具有显著更高的转录相似性(图2D)。
所有 CD8+Tex 细胞的 RNA 速度和伪时间推断分析表明,CD8 + Tex-SPRY1 聚类在伪时间中排序较早,而 CD8+ Tex-XAF1 聚类偏向较晚的伪时间值。这些结果表明 CD8+ Tex-SPRY1 细胞更有可能是早期衰竭细胞(图 2 E)。
为了进一步验证在伪时间的早期和晚期,CD8+ Tex细胞具有更多的祖细胞和终末耗竭表型这一假设,他们研究了祖细胞和终末CD8+ Tex标记的表达在伪时间轨迹上的动态变化。CD8+ Tex细胞的祖细胞耗尽信号的表达随着伪时间的推移而减少,而终端耗尽信号则随着伪时间的推移而增加(图2F)。然后,他们沿着动态生物学伪时间可视化标记基因和功能基因的表达(图2G);抑制检查点(TIM-3、LAG3和PD-1)的表达也随着伪时间的推移而显著增加。与肿瘤特异性CD8+ T细胞和终末耗竭相关的ENTPD1在伪时间后期表达增加。与更多祖细胞状态相关的TBX21和REL的表达水平均在轨迹早期增加,但在伪时间后期降低。相比之下,TOX和EOMES的表达在整个伪时间内逐渐增加,而这两种基因与更接近终末耗竭的表型。CD8+ Tex-SPRY1细胞聚类主要在伪时间中排序较早,表明CD8+ Tex-SPRY1细胞具有更“明显的祖细胞”活性和“早期耗竭”阶段。总的来说,这些数据证明了ESCC中CD8+ Tex-SPRY1细胞的祖细胞样表型。

图2. 祖细胞样 CD8 + Tex 细胞的鉴定。
(A) T 细胞的亚聚类,按亚型着色和标记。(B) Tex 聚类中耗竭的 T 细胞特征和 T 细胞介导的对肿瘤特征的免疫反应的富集。(C) CD8 + T 细胞聚类中选定标记基因的表达。(D) 箱线图显示了 CD8+ Tex 聚类的祖细胞与终末耗尽 CD8+ T 细胞的基因特征评分的比率。(E) CD8 + Tex 聚类的 RNA 速度分析。(F) 散点图显示祖细胞(左)和终末细胞(右)沿伪时间的耗尽特征的表达。(G) CD8 + Tex 细胞轨迹中选定基因沿伪时间的表达模式。(H) CR 和 NCR 肿瘤之间CD8 + Tex-SPRY1 细胞的频率。(I) 散点图显示治疗前 CD8 + Tex-SPRY1 细胞浸润与 NICB 治疗期间肿瘤 SUVmax 降低之间的显著相关性。(J) 肿瘤反应与不同 T 细胞子集细胞比例的排名相关性。
03
CD8+ Tex-SPRY1 细胞预测 ESCC 免疫治疗的临床获益
接下来,他们研究了CD8+ Tex-SPRY1细胞与NICB结果之间的关系,发现治疗前CR肿瘤中CD8+ Tex-SPRY1细胞的比例高于NCR肿瘤(图2H)。重要的是,在分析治疗前NICB诱导的肿瘤反应时, CD8+ Tex-SPRY1细胞浸润与肿瘤反应显著相关(图2I-J),表明 ESCC 中的 CD8+ Tex-SPRY1 细胞是免疫治疗的潜在生物标志物。
为了进一步研究 CD8+ Tex-SPRY1 细胞对免疫治疗的预测价值,他们纳入了额外的 ESCC NICB 队列和治疗前肿瘤样本,以进行多重免疫组化(IHC)[验证队列 1 (VC1)]和bulk 转录组分析(bulk RNA-seq)[验证队列 2 (VC2)](图 3 A)。CR的患者在肿瘤区域和肿瘤周围的间质区域有显著较高的SPRY1+CD8+PD-1+共表达细胞密度(图3B-C)。相反,NCR组CD8+PD-1+细胞上SPRY1的共表达水平较低。接下来,在VC2的bulk RNA-seq数据中,他们根据CD8+ Tex-SPRY1的标记基因(CD8、PDCD1和SPRY1)表达水平确定了CD8+ Tex-SPRY1细胞浸润的特征。与NCR组相比,在CR组观察到CD8+ Tex-SPRY1特征评分水平显著较高(图3D),且与更好的无病生存相关(图3E)。此外,与PD-L1相比,CD8 +Tex-SPRY1细胞在预测CR方面具有更高的价值(图3F)。进一步的亚组分析显示,无论PD-L1状态如何,CR组比NCR组CD8+ Tex-SPRY1特征表达更高(图3G)。针对其他临床特征(包括TNM分期和PD-L1)进行校正后,多变量Cox回归显示,CD8+ Tex-SPRY1细胞是预测NICB获益的关键因素(图3H)。
在单独使用抗 PD-1 治疗的晚期不可手术 ESCC 的外部验证队列 1 中,CD8+ Tex-SPRY1 特征的高表达与更好的临床反应和改善的总生存率显著相关(图 3I-J),与PD-L1相比,在预测ICB反应方面具有更高的价值(图3K)。这个独立的ICB单独队列验证了CD8+ Tex-SPRY1细胞作为ESCC的ICB生物标志物的有效性。他们进一步分析了与ICB反应相关的特征,发现CD8+ Tex-SPRY1特征在预测临床疗效方面表现出最高的效率(图3L)。

图3. CD8+ Tex-SPRY1 预测 ESCC 免疫治疗的良好结果。
(A) NICB 治疗的 ESCC 验证队列示意图。(B-C)多重 IHC 染色的代表性图像。(D) CD8+ Tex-SPRY1 特征评分。(E) Kaplan-Meier 生存曲线分析。(F)验证队列 2 中 CR 预测的CD8 + Tex-SPRY1 特征或 PD-L1 表达的受试者工作特征 (ROC) 曲线 (AUC) 下面积。(G) CR 和 NCR 之间的 CD8 + Tex-SPRY1 特征评分。(H) 验证队列 2 中临床因素和 CD8+ Tex-SPRY1 无病生存率的多变量 Cox 回归分析的森林图。(I) CD8+ Tex-SPRY1特征评分在 ESCC 外部验证队列 1 (EVC1) 中得到验证。(J) 针对来自EVC1的CD8+Tex-SPRY1特征生成的 Kaplan-Meier 生存曲线。(K) CD8+ Tex-SPRY1 特征或 PD-L1 表达对 EVC1 中响应者预测的ROC 曲线。(L) 在接受免疫治疗的食管鳞癌两组(右组和左组)中区分应答者的预测因素的 AUC 值。
04
祖细胞样 CD8+ Tex-SPRY1 细胞表现出功能性抗肿瘤表型
通过取三个独立研究中Tpex上调差异基因的交集,他们发现了Tpex相关基因的重叠,包括Spry1(图4A),从而证明其在Tpex和CD8+ Tex-SPRY1细胞的祖细胞样表型中的重要性。
接下来,他们进行了过继细胞转移实验,以检测肿瘤特异性CD8+ T细胞上的SPRY1的表达是否影响Tpex的比例。首先生成对照和Spry1过表达 CD8+ OT-I T 细胞,并通过免疫印迹分析Spry1的表达(图 4B-C)。这两种类型的 OVA 特异性 CD8+ OT-I T 细胞在接种后第 10 天转移到具有B16-OVA 肿瘤的小鼠体内。OT-I 转移后,受体小鼠腹腔注射同型 IgG 或抗 PD-1 抗体(图 4 B)。OT-I- Spry1组在抗 PD-1 治疗后表现出比 OT-I-Ctrl 组显著增强的抗肿瘤反应(显著抑制肿瘤生长)(图 4D)。在未接受ICB治疗的小鼠中,OT-I-Spry1组和OT-I-Ctrl组的抗肿瘤作用无显著差异。此外,他们进行了流式细胞分析,以评估Tpex在肿瘤浸润淋巴细胞中的比例(图4E-F)。在肿瘤特异性CD8+ T细胞中表达Spry1显著增加了Tpex的比例和数量(CD44+PD-1+LY108+TIM-3−CD8+)(图4G)。这些结果证明了scRNA-seq分析和临床验证,即CD8+ Tex-SPRY1细胞是祖细胞样Tpex,对免疫治疗的应答增强。
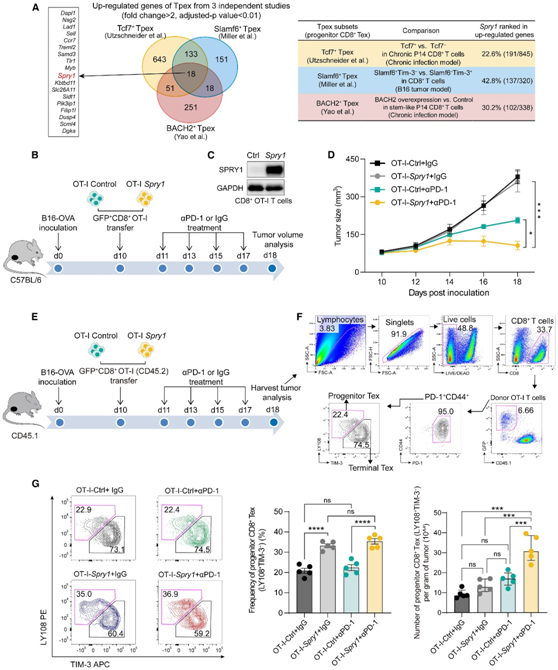
图4. CD8 + T 细胞中SPRY1的表达增加了 Tpex 的比例,并促进抗 PD-1 治疗肿瘤的反应。
(A) 三项独立研究中 Tpex 上调基因的交叉点。(B) OT-I T 细胞过继转移实验的示意图。(C)通过免疫印迹检测OT-I T 细胞中Spry1的过表达效率。(D) 平均肿瘤生长曲线。(E) OT-I T 细胞过继转移实验的示意图。(F) 小鼠肿瘤浸润转移 OT-I T 细胞中 Tpex 的代表性流式细胞术门控策略。(G)代表性流式细胞分析图。
05
与 CD8+ Tex-SPRY1相关的巨噬细胞促炎表型
骨髓来源的巨噬细胞可以极化为促炎/M1 或抗炎/M2,从而调节抗肿瘤免疫中的 T 细胞反应。对本项研究的 ESCC 数据中的骨髓细胞进行细分,确定了六个巨噬细胞聚类。比较NICB 之前 CR 和 NCR 肿瘤之间的转录组差异,发现 CR 组中巨噬细胞存在显著的 M1 极化,与促炎活性相关的表达特征增加(图 5 A),表明 ESCC 中的巨噬细胞偏向于促炎性与更好的 ICB 结果相关。在NICB前的CR患者的巨噬细胞亚群中,在Macro-MMP9、Macro-CXCL1和Macro-FOLR2亚群之间观察到M1特征和促炎活性的显著富集(图5B)。
他们假设T细胞可能塑造了促炎巨噬细胞表型,并研究了它们之间的相互作用。CD8+ Tex-SPRY1细胞与巨噬细胞的配体-受体相互作用最多。他们确定了CD8+ Tex-SPRY1细胞产生的细胞因子/趋化因子对巨噬细胞的生物学重要调节(图5C),其中IFNG和TNF显示出诱导促炎巨噬细胞的强大调节潜力。此外,他们观察到CD8+ Tex-SPRY1与M1样巨噬细胞亚群(Macro-MMP9、Macro-CXCL1和Macro-FOLR2)之间的潜在相互作用强于与其他巨噬细胞聚类之间的相互作用(图5D)。值得注意的是,M1样的Macro-MMP9细胞在基线和NICB后的细胞比例上都表现出与CD8+ Tex-SPRY1细胞的最高相关性(图5E), 表明它们在抗肿瘤免疫中的相互作用。重点关注配体-受体对,Macro-MMP9细胞与T细胞表现出强烈的相互作用(图5F),并且Macro-MMP9与CD8+ Tex-SPRY1细胞之间的配体-受体数量是T细胞聚类中最高的。重要的是,Macro-MMP9 细胞产生了多种配体(IL15、CXCL9/CXCL10),具有丰富的调节潜力,可在CD8+ Tex-SPRY1 细胞中诱导 T 细胞激活特征(图 5 G),包括 IFNG、CCL3和CCL4,以促进可诱导促炎巨噬细胞的正前馈循环(图 5 C)。值得注意的是,这些潜在的细胞间相互作用在CR组和NCR组中都很常见,但在CR组中更强(图5F)。与NCR肿瘤相比,观察到治疗CR前肿瘤中Macro-MMP9和CD8+ Tex-SPRY1细胞同时富集(图5H-I)。
总的来说,他们发现促炎巨噬细胞与ESCC中祖细胞样CD8+ Tex-SPRY1细胞密切相关。Macro-MMP9和CD8+ Tex-SPRY1细胞表达的促炎信号分子显示出促进正前馈循环的潜力,从而进一步诱导其具有抗肿瘤免疫的细胞状态。
图5. 促炎性 Macro-MMP9 与 CD8 + Tex-SPRY1相互作用。
(A)基因集富集分析 (GSEA) 。(B) NICB 之前 CR 患者与 NCR 患者的巨噬细胞子集中特征显著富集的标准化富集评分 (NES) 热图。(C) 热图显示 CD8 + Tex-SPRY1 细胞中驱动巨噬细胞促炎表型的优先配体的活性(左)和调节潜力(右)。(D)不同反应组中从 CD8 + Tex-SPRY1 细胞到巨噬细胞亚群的重要配体-受体对的数量。(E) 巨噬细胞亚群与 CD8 + Tex-SPRY1 细胞的细胞比例的相关性。(F) 从 Macro-MMP9 细胞到 T 细胞亚群的重要配体-受体对的数量。(G) 热图显示 Macro-MMP9 细胞中优先配体的活性(左)和调节潜力(右),驱动 CD8 + Tex-SPRY1 细胞的抗肿瘤潜力。(H-I) 验证队列 1 中 CR 和 NCR 患者治疗前肿瘤的多重 IHC 染色的代表性图像。
06
与 CD8+ Tex-SPRY1相关的具有增强抗肿瘤潜力的 TLS 相关 B 细胞
最新的研究强调了 B 细胞和三级淋巴结构 (TLS) 在塑造 ICB 反应和促进 T 细胞介导的抗肿瘤活性方面的相关性。他们观察到ESCC 肿瘤中对 NICB 有反应的B 细胞与 CD8+ PD-1+SPRY1+细胞 (CD8+Tex-SPRY1) 共定位(图 6 A),特别集中在TLS内。他们发现 ESCC 中 NICB 治疗后 TLS 活性显著增加(图 6 B),特别是在 CR 组中。
接下来他们试图评估哪些B 细胞亚群对于 ESCC 中的 ICB 功效和 TLS 活性很重要。对 ESCC 数据中的 B 细胞进行细分,确定了幼稚 B (Bn)、记忆 B (Bmem) 和滤泡 B (Bfo) 子集。值得注意的是,NICB 治疗后 Bfo-NEIL1 细胞丰度增加,尤其是在 CR 后肿瘤中富集(图 6 C)。Bfo-NEIL1 细胞是与接受前期手术的 ESCC 中无病生存率改善最显著相关的 B 细胞聚类,与其他临床参数无关(图 6D)。这些结果凸显了 Bfo-NEIL1 细胞在免疫治疗和 ESCC 预后中的双重意义。Bfo-NEIL1 细胞中上调基因的功能富集分析支持了这一点,该分析揭示了与免疫反应激活和淋巴细胞激活相关的通路的富集(图 6 E)。这些观察结果表明,TLS 相关的 Bfo-NEIL1 细胞可能与 CD8+ Tex-SPRY1 和 Macro-MMP9 细胞相互作用,在 ESCC 的抗肿瘤免疫中发挥作用。
为了进一步研究它们之间关联的潜在机制/相互作用,他们接下来进行了细胞间相互作用分析。
在 B 细胞亚群中,预计 Bfo-NEIL1 细胞与 CD8+ Tex-SPRY1 细胞表现出最高的相互作用潜力(图 6 F)。有趣的是,Bfo-NEIL1 衍生的 IL23 预计具有强大的调节潜力,通过靶向 T 细胞激活/扩增/效应相关基因(例如IRF1、PRDM1、REL、BRD2和NFKBIZ)来激活 CD8+ Tex-SPRY1 细胞(图6G)。
最近的研究表明,B 细胞诱导 CD4+ T 滤泡辅助细胞 (Tfh) 依赖性 IL21 产生并促进 CD8+ T 细胞免疫,他们进一步研究了 TLS 相关的 Bfo-NEIL1 细胞与 CD4+ Tex-的相互作用CXCL13 细胞,表现出耗竭标记和 Tfh 特征。配体受体分析显示Bfo-NEIL1细胞具有很强的调控潜力,可通过B-T相互作用(ICOSLG/ICOS、CD40/CD40L和CD86/CD28)诱导CD4+ Tex-CXCL13细胞激活Tfh表型(图6H)。值得注意的是,CD4+ Tex-CXCL13细胞中的BCL6是Bfo-NEIL1细胞的重要调控靶点,Bfo-NEIL1细胞是Tfh细胞分化的强制性谱系转录因子。
重要的是,细胞-细胞相互作用分析预测CD8+Tex-SPRY1细胞可以通过激活的相互作用(IFNG/IFNGR、ITGLA/ICAM1和TNFSF14/HVEM信号)激活B细胞的功能(图6I),促进生发中心发育和抗原呈递。
总的来说,这些发现表明祖细胞样CD8+Tex-SPRY1细胞在 ESCC 中具有多方面的作用。除了充当响应免疫治疗的关键 T 细胞外,CD8+Tex-SPRY1细胞还与 TME 内的促炎巨噬细胞和 TLS 相关 B 细胞进行细胞相互作用,从而增强抗肿瘤免疫力。
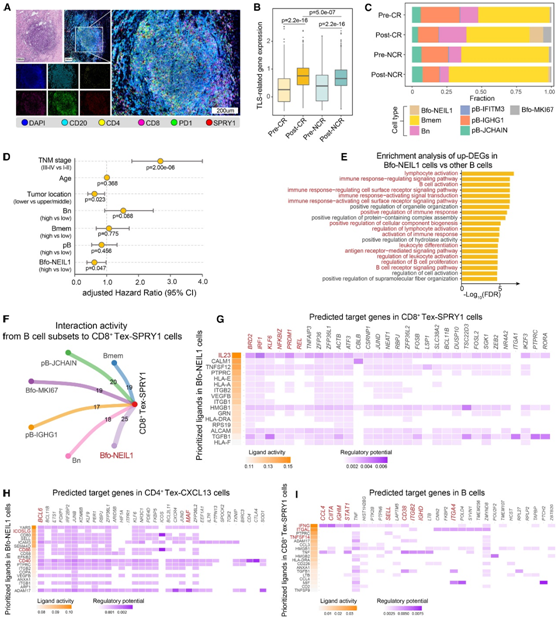
图6. TLS 相关 B 细胞与 CD8+ Tex-SPRY1相互作用。
(A) CR 患者治疗后肿瘤的多重 IHC 染色的代表性 TLS 图像。(B) 不同群体的 B 细胞中 TLS 相关基因的表达。(C) B 细胞聚类的细胞组成。(D) 对 ESCC 无病生存的临床因素和 B 细胞聚类进行多变量 Cox 回归分析。(E) 与其他 B 细胞相比,Bfo-NEIL1 细胞中的通路富集。(F) B 细胞亚群和 CD8 + Tex-SPRY1 细胞之间重要配体-受体对的数量。(G) 热图显示 Bfo-NEIL1 细胞中优先配体的活性(左)和调节潜力(右),驱动 CD8 + Tex-SPRY1 细胞的抗肿瘤潜力。(H) 热图显示 Bfo-NEIL1 细胞中优先配体的活性(左)和调节潜力(右)。(I) 热图显示 CD8 + Tex-SPRY1 细胞中促进 B 细胞激活的优先配体的活性(左)和调节潜力(右) 。
+ + + + + + + + + + +
结 论
本项研究对接受新辅助 ICB 的食管鳞癌患者的肿瘤进行scRNA-seq,揭示了表达 SPRY1 的耗竭 CD8+ T细胞子集(CD8+ Tex-SPRY1),其显示出祖细胞耗竭 T 细胞 (Tpex) 表型,并且与 ICB 的完全反应相关。他们使用独立的 ICB-/非 ICB 队列验证CD8+ Tex-SPRY1细胞作为改善反应和生存的 ICB 特异性预测因子,并证明 CD8+ T 细胞中 SPRY1 的表达增强了 Tpex 表型并增强了 ICB 功效。此外,CD8+ Tex-SPRY1 细胞有助于巨噬细胞的促炎表型和 B 细胞的功能状态,从而通过增强 CD8+ T 细胞效应功能来促进抗肿瘤免疫。总体而言,本项研究结果揭示了类祖细胞 CD8 + Tex-SPRY1 细胞在食管鳞癌 ICB 有效反应中的作用,并为未来个体化免疫治疗的机制生物标志物研究提供新的理论依据。
+ + + + +



 English
English


