文献解读|(38.104):全基因组测序揭示HBV相关肝细胞癌早期复发的进化轨迹
✦ +
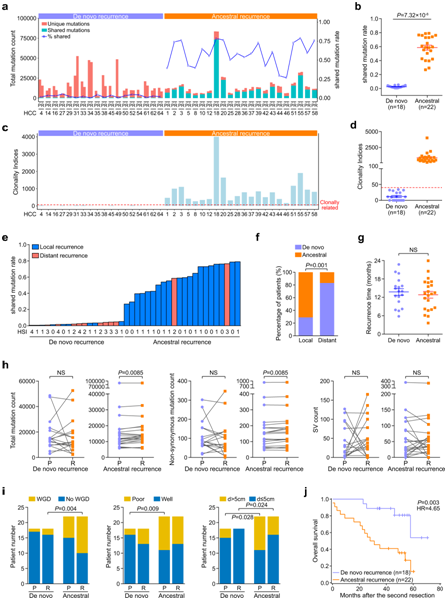
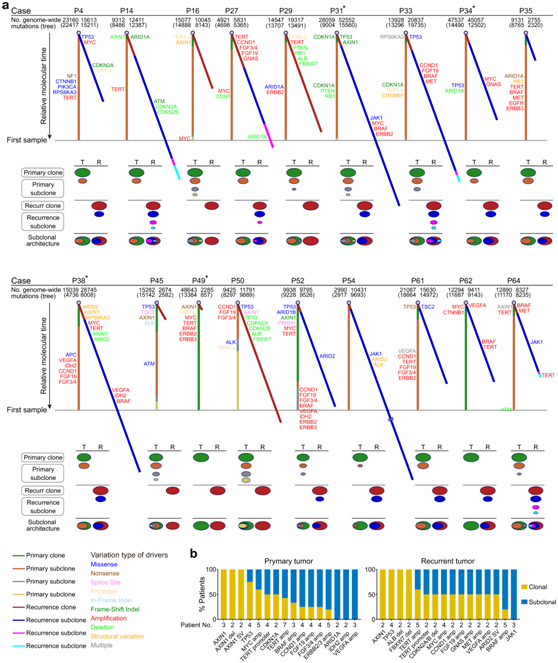
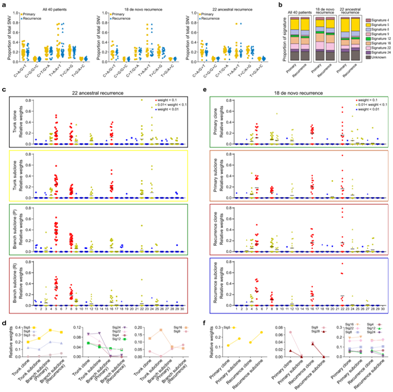
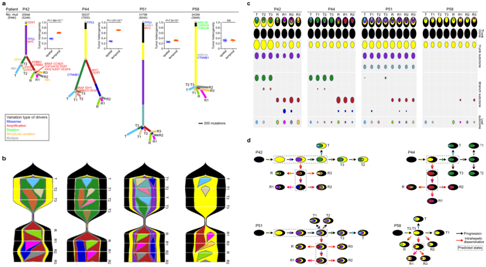
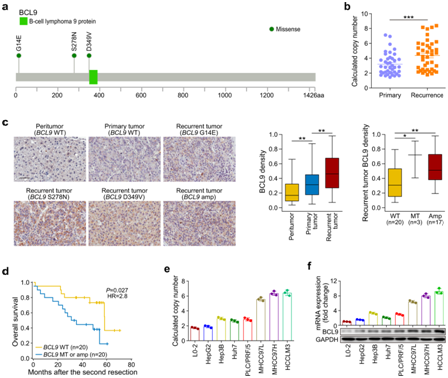
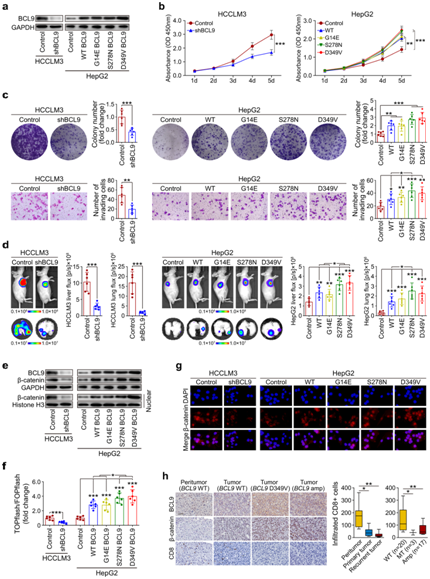
+ 论文ID 原名:Whole-genome sequencing reveals the evolutionary trajectory of HBV-related hepatocellular carcinoma early recurrence 译名:全基因组测序揭示HBV相关肝细胞癌早期复发的进化轨迹 期刊:Signal Transduction and Targeted Therapy 影响因子:38.104 发表时间:2022.1.26 DOI号:10.1038/s41392-021-00838-3 背 景 由于肿瘤早期复发率高,肝细胞癌(HCC)患者在治愈性切除后的长期生存率较差。人们对从原发性肝癌到早期复发性肝癌的基因组进化轨迹知之甚少。 实验设计 结 果 01 40 对匹配的原发性和早期复发性 HCC 的基因组图谱 研究者团队对 40 对匹配的乙型肝炎病毒 (HBV) 相关的原发性 HCC 和早期复发性 HCC 以及来自同一患者的匹配非癌性肝脏样本进行了全基因组测序(WGS)(图1a)。他们在原发性肿瘤中总共鉴定出了 667790 个体细胞单核苷酸变异 (SNV) 和插入缺失,而复发性肿瘤中的数量相当(图1b)。他们在原发肿瘤中鉴定了31个扩增片段,其中包含几种已知的癌基因,包括CCND1、TERT和MYC,还在原发肿瘤中发现了16个缺失片段,其中包含肿瘤抑制因子,包括TP53 (17p13)、RB1 (13q14)和CDKN2A (9q21)。在复发肿瘤中,发现了25个扩增的节段和20个缺失的节段(图1d)。此外,他们检测到丰富的基因组结构变异(SVs),每个原发肿瘤平均有43.8个SVs(范围:0-224),每个复发肿瘤平均有47.8个SVs(范围:0-204)。这些SVs包括839个缺失、37个反转缺失、335个插入缺失、692个串联重复、8个插入、5个反转和1747个染色体内或染色体间易位(图1c)。体细胞突变、CNV和SVs的综合分析揭示了几种常见类型的HCC驱动基因改变,这些改变在原发性和复发性肿瘤中具有相当的数量,包括TP53突变、MYC扩增、TERT扩增或启动子突变(图1e)。 图1. 40 对原发性和早期复发性 HCC 的基因组景观 02 肝癌根治性切除后早期复发的复发模式 在癌症进化过程中,拷贝数丢失可能会导致受影响区域的突变丢失,从而导致在未受拷贝数丢失影响的样本中出现独特的突变聚类。他们观察到所有患者中原发性肿瘤和复发性肿瘤共有的突变比例均有所增加。然而,就原发性肿瘤和复发性肿瘤之间共有的突变比例而言,两组患者之间也存在明显的区别(图2a-b)。 他们还根据非同义 SNV 和插入缺失来估计肿瘤的克隆指数,这表明两个肿瘤共享突变的可能性。根据计算的阈值 (36.59),将 40 名患者明确分为两组:克隆性指数低于阈值的患者(平均值= 12.24,范围:0–34.11)和克隆性指数高于阈值的患者(平均值= 883.2,范围:167.2–4007)(图2c-d)。他们确定了HCC早期复发的两种模式: 45% (40/18) 的患者经历了新生性复发,其中复发肿瘤与原发肿瘤基因独立,而55% (40/22) 的患者经历了遗传性复发,其中复发肿瘤与原发肿瘤克隆相关。 接下来,他们探讨了重复位置和重复模式之间的关联,将 40 对原发性和复发性肿瘤分类为局部复发(40 例中的28 例),肿瘤肝段间隔 (HIS) 为 0 或 1,或远处复发(40 例中的12 例),肿瘤 HSI 为 2 至 4。28名局部复发患者中,20名复发肿瘤是遗传性复发,而在12名远处复发患者中,只有2名复发肿瘤是遗传复发(图2e-f)。这些结果表明,局部复发倾向于遗传的,而远处复发倾向于新生的。他们发现复发模式和复发时间之间之间没有关联,这表明复发时间不能预测 HCC 的早期复发模式(图2g)。 在新发复发的患者中,他们观察到原发肿瘤和复发肿瘤之间的突变和 SVs 数量存在相当大的差异。在遗传复发的患者中,这种变异性较小,并且复发肿瘤总是表现出比原发肿瘤更高数量的突变(总突变和非同义突变)(图2h)。这些结果表明,尽管所有 40 名患者的原发性肿瘤和复发性肿瘤的突变数量相当,但遗传复发性肿瘤通常在进化过程中获得额外的突变。 肿瘤倍性异常是癌症的标志,对不同癌症的进化和结果具有重要影响。如果肿瘤的倍性大于 2.9,则表明其已进行全基因组加倍 (WGD)。WGD 在遗传性复发的患者中富集,尤其是在复发性肿瘤中,这些结果表明 HCC 中的 WGD 可能是遗传性复发的驱动因素(图2i)。遗传性复发患者在原发性 HCC 中往往细胞分化较差,肿瘤较大,并且在复发性 HCC 中也比新发复发患者中出现更大的肿瘤(图2i)。生存分析显示,遗传性复发患者第二次根治性切除后的生存率低于新发复发患者(图2j)。 图2. 治愈性切除后 HCC 早期复发期间的复发模式 03 全基因组水平上肝癌早期复发的演变 为了推断根治性切除后 HCC 早期复发的进化轨迹,他们根据全基因组水平上鉴定的突变(SNV 和 indels)构建了亚克隆结构和系统发育树,以代表每位患者原发性和复发性肿瘤的疾病进展(图3,图4)。 在遗传复发的患者中,发现每个原发肿瘤平均有 3.4 个不同的突变聚类,每个复发肿瘤有 3.6 个不同的突变聚类(图3a)。他们根据估计的癌细胞分数 (CCF) 将主干突变分为不同的克隆或亚克隆。树干顶部的突变为克隆突变,其余为亚克隆突变,CCF 沿树干向下逐渐减少。一个显著特征是,几乎所有患者的原发肿瘤和复发肿瘤中都存在一个或多个亚克隆突变聚类,复发分支亚克隆总是源自主干亚克隆突变。这表明 HCC 遗传复发中存在多克隆转移引发的可能性(图3a)。 然后,他们通过计算在每个进化树的主干(克隆或亚克隆)与分支上存在的给定改变的频率,推断出HCC遗传复发期间体细胞改变进化的大致顺序(图3b)。该分析证实AXIN1和TP53突变是最早发生的突变,其次是TERT启动子、CTNNB1或ARID1A突变,以及MYC或VEGFA的扩增或CDKN2A/2B和PTEN的缺失。 图3. 系统发育树和亚克隆结构揭示了22例遗传性早期复发HCC的进化轨迹 他们在新发复发的患者中,每个原发肿瘤平均有 2.6 个不同的突变聚类,每个复发肿瘤有 2.1 个不同的突变聚类(图4a)。与遗传性复发相比,新生复发与CTNNB1突变的缺乏和CCND1-FGF19扩增的富集相关,尤其是在原发肿瘤中(图3b,图4b)。此外,他们观察到每个新发复发患者的原发性肿瘤和复发性肿瘤之间涉及 HCC 驱动基因的改变完全不同。然而,在所有新生复发的患者中,大多数驱动基因改变在原发性肿瘤和复发性肿瘤之间具有相似的频率和克隆分布:AXIN1和TP53的改变总是发生在肿瘤进化的早期,而TERT启动子突变和扩增则发生在肿瘤进化的早期。 图4. 系统发育树和亚克隆结构揭示了18例HCC的早期复发进化轨迹 04 原发性和早期复发性 HCC 的突变谱和特征 他们分析了所有 40 对原发性和早期复发性 HCC 的突变谱,除了所有 HCC 中普遍存在的 C > A 颠换和 C > T 和 T > C 转换外,发现了所有 HCC 中的显性 T > A 颠换模式。但是,他们没有发现整个样本中原发性 HCC 和复发性 HCC 之间或在新发复发和遗传性复发亚组中的突变谱存在显著差异(图5a)。 突变特征分析的第一个显著特征是原发肿瘤和复发肿瘤的突变特征相似,即使是在新发复发的患者中,无论肿瘤的进化阶段如何(图5b-f)。突变特征分析揭示的第二个显著特征是,患者之间突变特征的异质性远大于给定肿瘤内不同进化阶段的异质性。在遗传复发的患者中,特征的相对贡献在主干突变和分支突变之间表现出相对较大的变异,而主干克隆和主干亚克隆突变之间的变异有限。例如,抽烟相关特征4,接触马兜铃酸 (AA) 特征22和黄曲霉毒素相关特征24在主干克隆和主干亚克隆事件中表现出显著富集,但在初级或复发分支亚克隆事件中显著减少(图5c-d),提示这些病因主要导致HCC的形成和发展。 在新发复发的患者中,原发肿瘤和复发肿瘤的克隆突变和亚克隆突变之间的大多数特征都是稳定的,包括特征4、8、12、16、22和24(图5e-f),这表明与特征相关的病因影响 HCC 复发过程中的整个进化过程。 图5. 原发性和早期复发性 HCC 的突变谱和特征 05 多区域全基因组测序揭示了 HCC 遗传性复发中的肿瘤时空异质性和多克隆、单系传播 他们在全基因组水平上探索了基于体细胞突变 (SNV+indels) 的肿瘤时空异质性,将空间异质性定义为原发性或复发性肿瘤内配对区域之间的肿瘤内异质性;将时间异质性定义为分别来自原发性和复发性 HCC 的配对区域之间的肿瘤间异质性。在四名患者中的三名(P42、P44和P51)中,观察到时间异质性明显高于空间异质性(图6a)。 他们构建了系统发育树,分析了亚克隆结构,并利用fishplot展示了进化过程(图6a-c)。确定了组成亚克隆之间的克隆关系,并发现了复发的多克隆播种的证据:多个突变聚类在多个复发区域以亚克隆方式呈现(图6c)。复发很可能是由来自原发肿瘤的多个不同的亚克隆引起的。在 4 名患者中的 3 名(P42、P44 和 P51)中,除了每个原发性和复发性肿瘤区域中具有不同 CCF 的 1 个主克隆(黑色椭圆形)和 1 至 3 个亚克隆(黄色、紫色和灰蓝色椭圆形)外,他们鉴定出在每个复发肿瘤区域但在原发肿瘤区域不包含亚克隆突变的红色簇,这表明该聚类可能包含重要的促进转移驱动因素,例如患者 P42 中的 ERBB2/3 扩增以及患者 P44 中的MYC和TERT扩增,这也是指示性的单系传播。这些结果揭示了时空异质性,并发现了多克隆、单系传播,这些传播是由 HCC 遗传复发中的分支传播共同形成的(图6d)。 图6. 多区域WGS显示4例复发患者的时空异质性和多克隆传播 06 BCL9发生突变,并且在 HCC 早期复发期间,复发性肿瘤中的拷贝数经常增加 他们在 40 个复发肿瘤中的 3 个(7.5%)中发现了BCL9(β-连环蛋白介导转录的辅激活因子)突变,包括 1 个遗传复发样本和 2 个新发复发样本,而原发肿瘤中没有BCL9突变(图7a)。BCL9位于染色体 1q21(chr1:143657015-147924399)的一个大基因组区域内,该区域在复发性肿瘤中经常出现。在 40 个复发性 HCC 肿瘤样本中,BCL9的体细胞突变和拷贝数增益分别发生在7.5%(40 个中的 3 个)和 65%(40 个中的 26 个)中(图7a-b)。他们通过免疫组织化学进一步评估了所有 40 个 HCC 中的 BCL9 表达。结果显示,与邻近的非肿瘤肝脏样本相比,BCL9表达在肿瘤样本中上调,尤其是在复发肿瘤样本中(图7c)。具有BCL9体细胞突变或复发肿瘤扩增的患者显示BCL9表达进一步增加(图7c)。生存分析显示,复发性肿瘤中存在BCL9体细胞突变或扩增的患者在第二次根治性切除后的生存率显著低于没有此类变化的患者(图7d),这些结果表明可能具有致癌作用BCL9在HCC早期复发中的作用。 为了测试BCL9在 HCC 中的功能作用,他们分析了七种 HCC 细胞系中BCL9的基因型和表达。qPCR结果显示,除了HepG2之外,六种HCC细胞系都有BCL9拷贝数增加,特别是高度转移的HCC细胞系MHCC97L、MHCC97H和HCCLM3,它们表现出BCL9扩增(图7e)Western blot和qPCR结果证实,与未转化的肝细胞系L0-2相比,7种建立的HCC细胞系,尤其是MHCC97L、MHCC97H和HCCLM3中的BCL9表达水平有所增加(图7f)。 图7. 40 对原发性和复发性 HCC 中 BCL9 基因组改变的临床意义 07 BCL9在 HCC 中发挥致癌作用 接下来,他们敲低HCCLM3细胞中的BCL9(图8a)。生物功能研究表明,BCL9 的敲低导致 HCC 细胞增殖、集落形成和侵袭能力下降(图8b-c)。体内HCC小鼠模型显示BCL9敲低减少了肿瘤生长和肺转移(图8d)。他们生成了慢病毒构建体以在HepG2细胞中重新表达WT BCL9或三个突变BCL9变体(图8a)。结果显示,WT或突变型BCL9的过表达显著增强HCC细胞增殖、集落形成和侵袭能力。特别是,BCL9D349V和BCL9S278N的表达导致更显著的增强(8b-c),表明两种类型的突变可能正在激活。 Western blot结果发现敲低BCL9后HCCLM3细胞中总β-连环蛋白表达降低,而在BCL9过表达后HepG2细胞中总β-连环蛋白表达上调,并且在BCL9突变后甚至进一步上调(图8e)。根据β-连环蛋白报告基因测定,敲低 BCL9 还显著降低了 HCCLM3 细胞中 β-连环蛋白的反式激活活性。相反,WT BCL9的过度表达诱导HepG2细胞中的TCF/LEF活性,并且BCL9突变诱导更高的活性水平(图8f)。此外,亚细胞分级分离和免疫荧光染色显示,BCL9的敲低导致HCCLM3细胞中核β-catenin的大幅减少,而突变型BCL9的过表达,导致HepG2细胞中β-catenin的细胞核积累(图8e-g)。他们在40对原发性和复发性HCC样本中观察到类似的结果,这表明在BCL9突变或扩增的样本中β-连环蛋白的核积累,伴随着CD8+细胞浸润的减少(图8h)。这些结果表明,BCL9 有助于激活 HCC 细胞和免疫排斥的肿瘤微环境中的 WNT/β-连环蛋白信号传导。 图8. BCL9 在 HCC 中的致癌作用 + + + + + + + + + + + 结 论 本项研究对 40 对原发性和早期复发性HCC 进行了WGS,确定了两种复发模式:新发复发 (18/40),其在遗传上独立于原发肿瘤并携带不同的 HCC 驱动因素;以及遗传复发 (22/40),其与原发肿瘤克隆相关且进展更快而非新发复发。他们发现复发位置可以预测复发模式:远处复发倾向于新生复发,而局部复发倾向于遗传。然后,根据在原发性和复发性肿瘤中观察到的亚克隆结构、驱动基因突变和突变过程揭示了进化轨迹。多区域全基因组测序证明了 HCC 遗传复发的时空异质性和多克隆、单系传播。还发现了复发特异性突变和拷贝数增加驱动基因突变以及在原发性和复发性肿瘤中观察到的突变过程。 此外,他们还发现了复发特异性突变和拷贝数增加BCL9导致 WNT/β-catenin 信号激活和免疫排斥的肿瘤微环境,这表明 BCL9 可能作为复发性 HCC 的新治疗靶点。这些结果分析了HBV 相关 HCC 早期复发过程中的基因组进化,为增强对 HCC 的了解提供了重要的分子基础,对提高患者生存率的个性化治疗具有重要意义。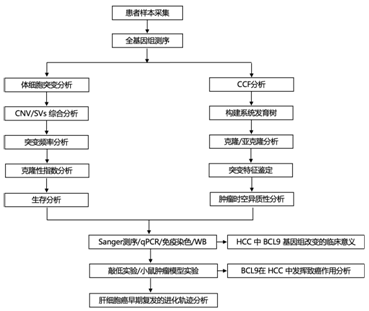




 English
English


