文献解读|Nat Commun(14.7):致癌组蛋白突变型胶质瘤的免疫景观揭示了不同的髓系群体和促肿瘤功能
✦ +
+
论文ID
原名:Immune landscape of oncohistone-mutant gliomas reveals diverse myeloid populations and tumor-promoting function
译名:致癌组蛋白突变型胶质瘤的免疫景观揭示了不同的髓系群体和促肿瘤功能
期刊:Nature Communications
影响因子:14.7
发表时间:2024.09.05
DOI号:10.1038/s41467-024-52096-w
背 景
尽管有多模式治疗方案,高级别胶质瘤 (HGG) 的治疗结果仍然不佳,并且仍然是儿童癌症相关死亡的主要原因之一。儿童 HGG (pHGG) 的一个显著特征是存在两个热点、获得功能的体细胞突变,它们位于编码组蛋白 3 (H3) 基因中,从而驱动肿瘤的形成和进展。组蛋白 H3 突变型神经胶质瘤是一种致命的脑肿瘤,其特征是表观基因组失调和分化停滞。与肿瘤细胞的大量数据集相比,关于其肿瘤微环境 (TME),尤其是免疫浸润的信息有限。
实验设计
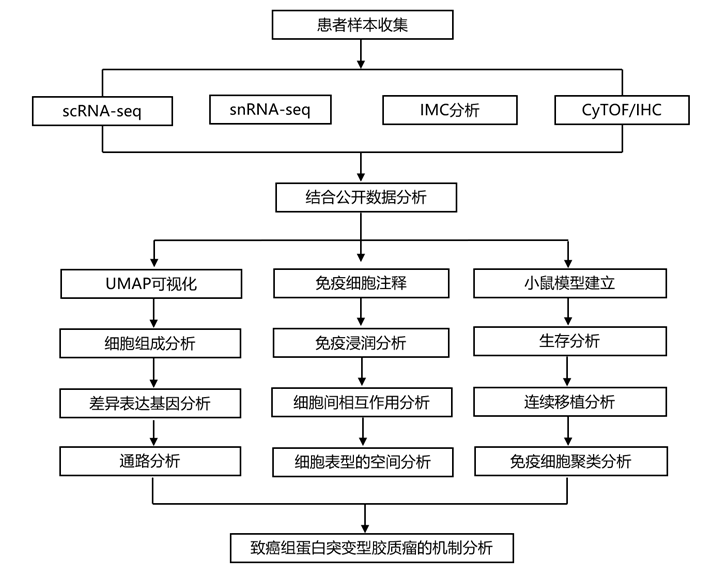
结 果
01
免疫分析显示儿童胶质瘤 TME 中存在丰富的髓系细胞群
为了表征H3突变体在单细胞分辨率下的免疫景观并将其与其他儿童神经胶质瘤进行比较,研究团队收集了来自所有级别和不同亚型的66个儿童神经胶质瘤样本,并进行了单细胞转录组分析(scRNA-seq)和单细胞核转录组分析(snRNA-seq)(图 1A)。他们在单细胞数据集中鉴定了 54431 个免疫细胞,在 4 个肿瘤实体中的单核数据集中仅鉴定了 8563 个免疫细胞(图 1B)。由于 H3.3G34R 肿瘤样本量较小,所有神经胶质瘤样本都由不同的、丰富的髓样细胞群浸润,包括巨噬细胞、小胶质细胞和增殖的髓样细胞(图 1E)。值得注意的是,与具有混合淋巴和髓样浸润的低级别胶质瘤(LGG)和室管膜瘤(EP)样本(图1C-F)相比,H3.3K27M 神经胶质瘤的淋巴细胞比例较低(图 1D),T 细胞、调节性 T 细胞和 NK 细胞很少(图 1F)。
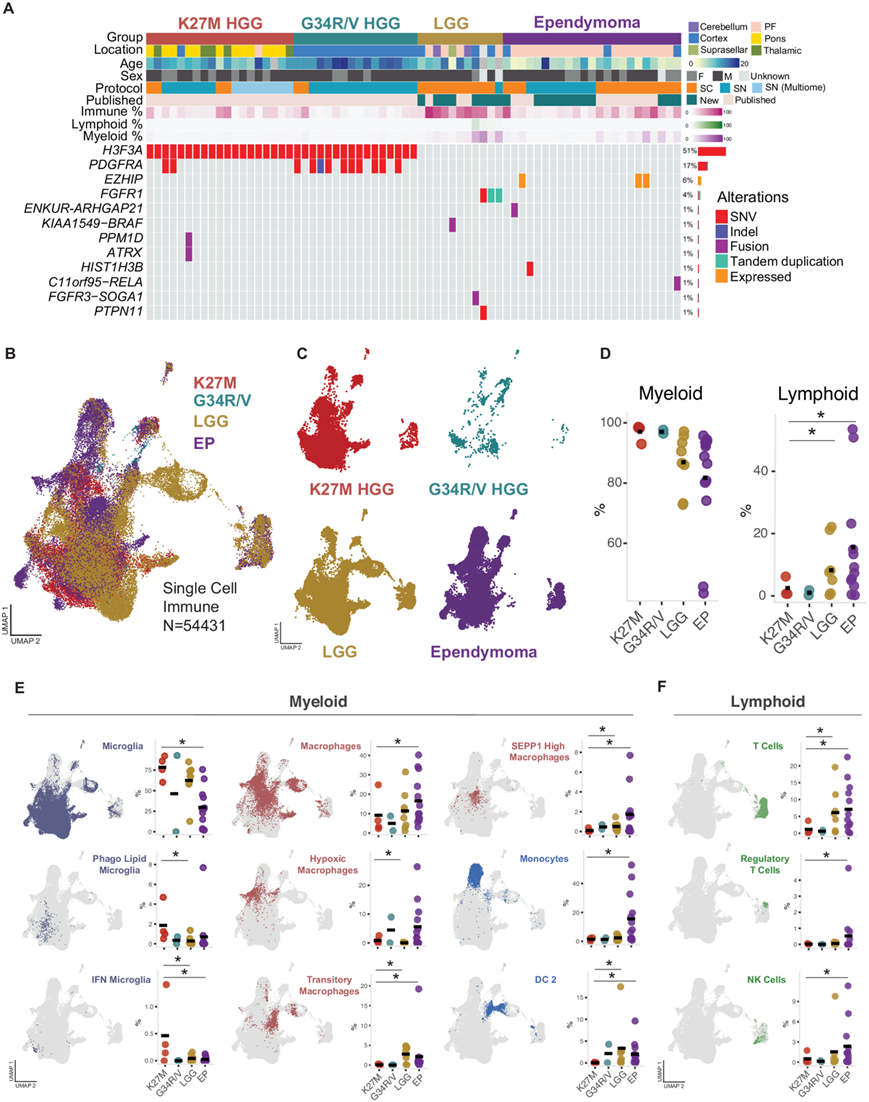
图1. 儿童神经胶质瘤中浸润着丰富多样的髓系细胞群。
(A) Oncoprint 总结了单细胞肿瘤样本,包括临床信息、免疫细胞比例和基因改变。(B-C)UMAP可视化。(D) 髓系和淋巴细胞比例。(E) 髓样细胞类型和活化状态的比例 。(F) 淋巴样细胞类型和活化状态的比例。
02
H3.3 K27M HGG 髓细胞表达免疫抑制基因
由于 H3.3K27M 肿瘤的免疫浸润与 LGG 相比显示出显著差异(图 1D -F),他们检测了与免疫激活/逃避、炎症和细胞募集的不同方面相关的基因特征是否在肿瘤的免疫区室中富集。在鉴定的免疫细胞状态中,大多数 K27M 衍生的小胶质细胞缺乏激活特征,以经典标志基因CSF1R和CX3CR1为突出表现,并且缺乏与疾病相关的小胶质细胞特征(图 2A-B)。H3.3K27M的TME中还包含一些富含免疫调节基因的稀有小胶质细胞和巨噬细胞群体。这些包括干扰素激活的小胶质细胞(表达IFIT1和IFIT3)和吞噬脂质(表达LPL)的小胶质细胞,以及缺氧的巨噬细胞(表达BNIP3),这些在LGG或室管膜瘤中则较少见(图1E,图2A-B)。使用 Hallmark 基因组进行通路分析显示,在这些肿瘤样本中,小胶质细胞显著下调 TNF 信号传导、免疫反应和补体通路,表明处于更强的免疫抑制状态(图 2C-E)。此外,巨噬细胞显著上调代谢通路活性,包括缺氧和糖酵解。
表达高水平免疫检查点(IC)的细胞无法发挥正常的抗肿瘤作用,因为机体将它们归类为无功能或耗竭的亚群,可能促进了免疫抑制的TME。因此,他们在单细胞数据集中研究了编码免疫检查点、免疫调节趋化因子和细胞因子的基因表达,这些基因也可能调节该TME。在H3.3K27M肿瘤中,小胶质细胞显著上调了免疫抑制基因,如CX3CR1、KLF2、TGFB1,与LGG相比,还表现出更高水平的HAVCR2(TIM3)、LGALS9(半乳凝素-9)和CD86(图 2C-D)。
与H3K27M来源的小胶质细胞相比,LGG肿瘤高表达CLL3/4和IL1B,这与更高的肿瘤浸润淋巴细胞比例和更高的肿瘤抗肿瘤能力是一致的(图 2C-D)。在LGG样本中,髓细胞和淋巴细胞亚型在与细胞因子、髓细胞募集和抗原呈递相关的免疫特征上表现出更高的分数(图 2F)。有趣的是,关键的免疫调节因子主要由髓系细胞表达,尤其是在 LGG 和 K27M HGG 肿瘤中。
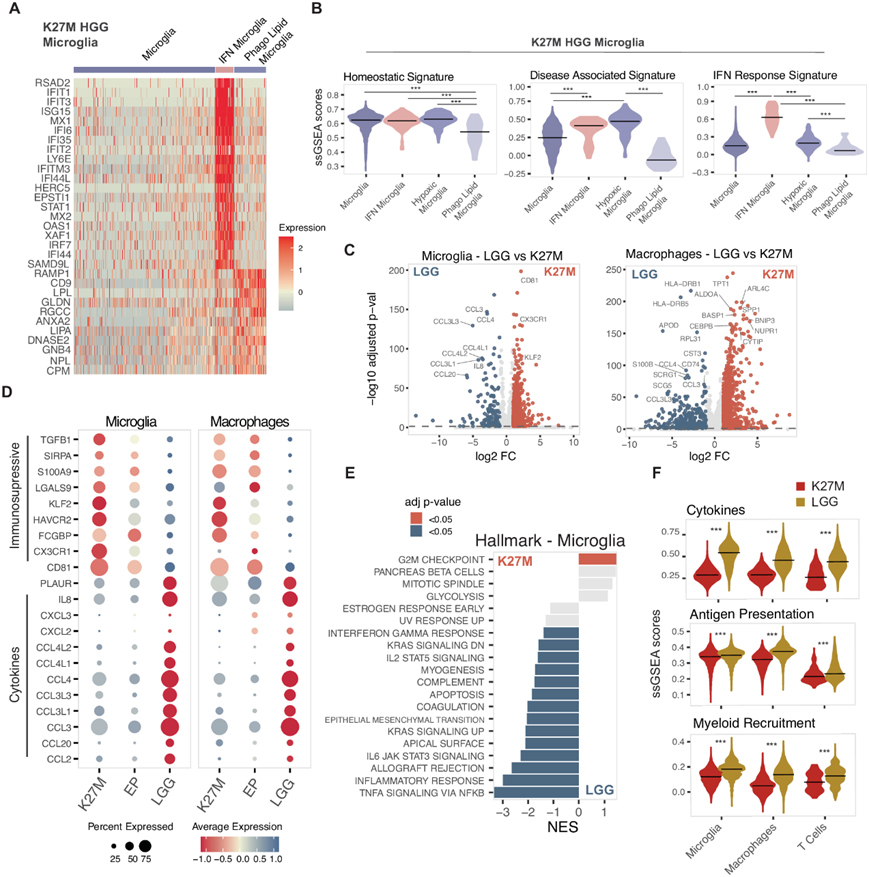
图2. H3.3 K27M HGG 髓细胞表达免疫抑制基因。
(A) H3.3K27M HGG 小胶质细胞群体中差异表达基因分析。(B) H3.3K27M HGG 小胶质细胞群体中免疫基因集的富集。(C)差异表达基因分析。(D) H3.3K27M、室管膜瘤和 LGG 中细胞因子和免疫检查点的表达。(E)通路分析。(F) 免疫基因集富集分析。
03
空间分析揭示癌症和髓系亚群之间存在显著的交流
为了在蛋白质水平和空间分辨的方式表征 H3 突变型胶质瘤的免疫结构,他们接下来应用了成像质谱流式细胞技术(IMC) 来分析 H3.3K27M 和 H3.3G34R 肿瘤细胞与它们各自的免疫浸润之间的相互作用(图 3A)。他们总共将35190 个细胞注释为 15 种不同的细胞亚型,包括淋巴细胞、髓细胞和肿瘤细胞群(图 3B-C)。将这些癌细胞鉴定为 H3.3K27M(K27me3 突变和额外丢失的标记)或 H3.3G34R 阳性细胞(图 3D-E)。髓系单核细胞通过 CD14 和 CD16 表达进行鉴定,并分为三类:经典(CD14 + CD16 -)、中间(CD14 + CD16 +)和非经典(CD14 - CD16 +)。将树突状细胞(DC)标注为CD11c +和 MHC II 类分子(HLA-DR+)细胞,将内皮细胞标注为CD31 +,将星形胶质细胞标注为GFAP +细胞。将淋巴亚群分为四个不同的亚型,即CD4 T 细胞(CD3 + CD4 +)、CD8 T 细胞(CD3 + CD8 +)、双阴性T 细胞(DN T 细胞)(CD3 + CD4 - CD8 -)和B 细胞(CD20 +),通过其典型细胞标记物进行识别(图 3B)。
他们将正常脑细胞、内皮细胞和癌细胞标记物呈阴性的细胞注释为免疫细胞。H3.3G34R 肿瘤中约有 34% 的免疫细胞,而 H3.3K27M 肿瘤中为 14%,平均占所有注释细胞的 24%。在大多数患者中都观察到了所有主要细胞亚型,一些 H3 突变样本中的细胞数量和淋巴亚群的缺失存在差异(图 3F-G)。H3.3 K27M 和 G34R 人类肿瘤都富含不同亚群的髓系细胞(占免疫细胞的 95%)。其中包括常驻经典小胶质细胞(CD68 + CD163 - P2Y12 +)、骨髓来源的巨噬细胞(BMDM、CD68 + CD163 - P2Y12 -)和两种不同的单核细胞群(CD3 - CD14 + CD16 -和 CD3 - CD14 - CD16 +)(图 3G-I)。
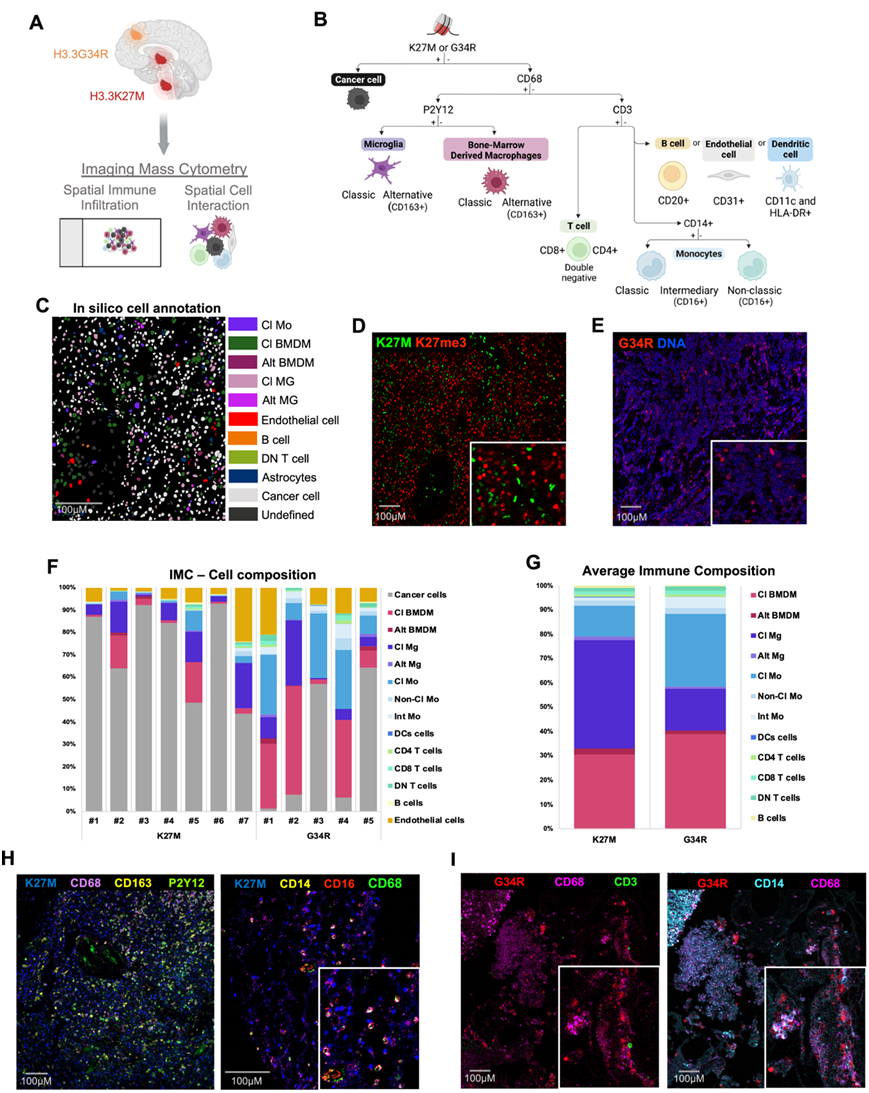
图3. IMC 显示小胶质细胞和骨髓来源的巨噬细胞群是儿童组蛋白突变肿瘤中的主要浸润免疫细胞。
(A) 用于分析 IMC 对人类 H3.3K27M 和 H3.3G34R 突变肿瘤免疫浸润的方法的示意图。(B) 细胞谱系分配树。(C)代表性图像分析。 (D-E) 代表性的多通道IMC图像分析。(F-G) 细胞组成和免疫细胞类型分析。(H-I) 细胞的代表性多通道 IMC 图像。
04
细胞间相互作用分析
为了表征肿瘤和免疫细胞之间的接近度和通讯,他们对 IMC 数据集进行了置换分析,以研究不同细胞的空间共现模式,并识别两种 H3 突变肿瘤类型中两个群体之间的相互作用,发现不同的髓系亚群与 H3 突变细胞相互作用。经典 BMDM 与 H3.3K27M 和 G34R 突变细胞均表现出强烈的相互作用,而单核细胞亚群则倾向于主要与 H3.3G34R 细胞相互作用(图 4A)。除星形胶质细胞外,H3.3K27M 癌细胞更有可能避开 TME 内的大多数非癌症谱系,而 H3.3G34R 细胞则很有可能与其他癌细胞、单核细胞亚群和星形胶质细胞相互作用(图 4A)。由于样本数量较少,淋巴细胞与癌细胞的相互作用没有观察到差异。有趣的是,在 H3.3K27M 突变肿瘤中,内皮细胞与癌症和髓系细胞(小胶质细胞、BMDM 和经典单核细胞)以及星形胶质细胞有显著的相互作用(图 4A),表明血管结构在肿瘤微环境中的重要作用。
scRNA-seq 和 IMC 结果一致表明,H3 突变型神经胶质瘤富集并与大量异质性髓系细胞群相互作用(图 1 D-F、3 G、4A)。鉴于它们的异质性和复杂的未知作用,他们使用 CellPhoneDB技术进一步分析了 H3.3K27M scRNA-seq 数据中免疫浸润细胞中的配体-受体表达,在这些样本中确定了几对预测介导免疫和神经样细胞类型之间通讯的配体-受体对。其中包括OSM / LIFR对,此前已证明它在成人 HGG 中能调节髓系细胞和肿瘤细胞的行为,而CD47受体及其配体半乳糖凝集素 9 (LGALS9) 也在免疫/髓系细胞中强烈表达,进一步表明在 H3.3K27M DMG 和 H3.3G34R 肿瘤中存在主动免疫抑制(图 4C-D)。
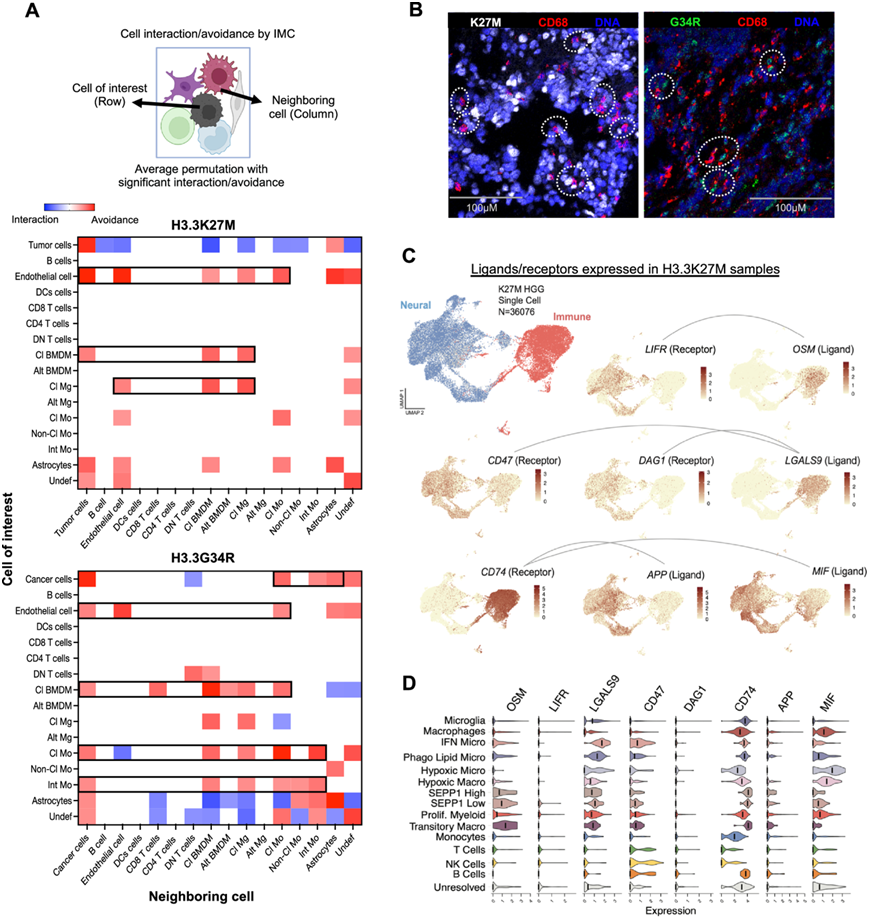
图4. 突变体 H3.3K27M 和 G34R 细胞在 TME 中的相互作用。
(A)热图显示了H3.3K27M和H3.3G34R肿瘤细胞表型之间的IMC空间分析及其细胞间相互作用。(B) 与 K27M 和 G34R 细胞相互作用的髓系细胞(CD68+)的代表性多通道 IMC 图像。(C)UMAP可视化。(D) H3.3K27M 免疫细胞群中的配体-受体对的表达。
05
H3.3K27M 小鼠模型具有丰富的免疫抑制髓系浸润肿瘤微环境
治疗性调节这些肿瘤的免疫微环境的主要挑战是缺乏经过验证的临床前模型。为此,他们研究了几种 H3.3K27M 小鼠模型中 TME 的免疫组成,使用飞行时间流式细胞技术 (CyTOF) 和免疫组织化学 (IHC) 技术探索了一系列现有小鼠模型中的 TME。其中包括两种之前发表的 H3.3K27M 小鼠模型:H3.3K27M 的同时表达和 Tp53 的缺失导致 HGG 形成,以及一种患者来源的原位异种移植模型 (PDOX),该模型位于 CD34 +人源化 NOD scid gamma (NSG) 小鼠中,其中包含来自 CD34 +干细胞的重建人体免疫系统(包括 T、B 和 NK 细胞)。在两种同源模型中,他们观察到髓系细胞浸润率高,T/B 细胞浸润率低(图 5A)。同样,在植入 SU-DIPG-XIII(一种代表性 H3.3K27M DMG 系)的人源化 PDOX 小鼠模型中也观察到了髓系细胞浸润率高。与在人类样本中观察到的情况类似,在人源化 NSG 小鼠中发现 T 细胞浸润有限,进一步证实大多数 H3.3K27M 肿瘤免疫浸润细胞来自髓系(图 5B)。
之后,他们又使用了两种模型:2-hit 模型,具有 H3.3 K27M 表达和Tp53缺失,以及 4-hit 模型,具有 H3.3K27M 和Pdgfra表达以及Atrx/Trp53缺失(图 5C)。通过流式 CyTOF 和 IHC 表征了肿瘤免疫浸润,并证实从头 H3.3K27M 小鼠肿瘤也含有丰富的髓系浸润(图 5D),主要由 P2 和 P3/P4 巨噬细胞、树突状细胞和髓系衍生的抑制细胞(MDSC)组成。接下来,他们使用2-hit 模型和4-hit 模型肿瘤建立可扩增并用于进一步体内实验的细胞系。为此,我们收集了同源模型的肿瘤 GFP +区域,分离细胞,分选 GFP +细胞并在体外扩增它们(图 5C)。使用 C57BL/6 免疫功能正常的同源小鼠 (BL6),他们验证了分离的细胞在注射到脑桥或丘脑(DMG 通常发生的主要脑区)时能够产生高度渗透的肿瘤(图 5E)。无论细胞剂量和肿瘤位置如何,在所有注射的小鼠中都观察到了相似的肿瘤动力学(图 5E),这表明从小鼠中获得的第一个肿瘤产生的细胞保留了肿瘤形成能力。他们观察到TME 中 髓样细胞(F4/80 +细胞)占优势,B 细胞和 T 细胞浸润有限(图5F-G)。CyTOF 分析显示,无论大脑位于脑桥或丘脑的哪个位置,CCR2 + P3/P4 巨噬细胞都是最丰富的细胞亚型(图 5F)。
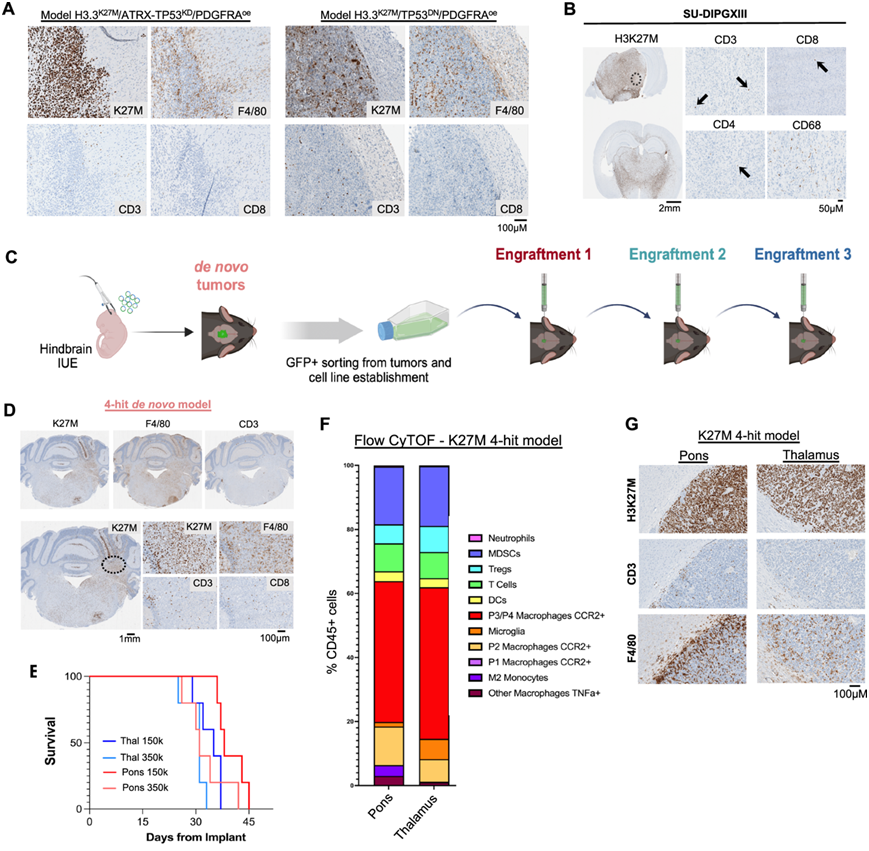
图5. H3.3K27M小鼠模型分析。
(A-B)免疫组织化学(IHC)分析。(C) H3.3K27M 同系小鼠模型生成的示意图。(D) IHC 免疫标记。(E)小鼠的总体生存曲线分析。(F) 流式细胞分析。(G) 代表性 IHC 图像。
06
髓系浸润细胞是 H3.3K27M 肿瘤发生的核心,可通过治疗进行调节
新注射的肿瘤细胞需要适应并募集特定的细胞类型,以使它们能够在新环境中建立和支持其生长。为分析这一现象,他们进行了体内连续植入以评估 TME 的演变。使用从 4 -hit模型形成的初始肿瘤建立的细胞系,他们原位植入 BL6 小鼠(植入1)。一旦小鼠出现肿瘤负荷症状,他们就分离肿瘤并将分离的细胞直接植入新宿主 BL6 小鼠(植入 2),并在新 BL6 小鼠中重复此过程(植入 3)(图 5C)。肿瘤植入更快,并且每次连续植入的小鼠存活率更低(图 6A)。一旦肿瘤形成,他们从每个植入队列中收集 GFP +区域并通过 CyTOF 分析它们的肿瘤免疫群,因为针对 IMC 的抗体不太可用且对小鼠免疫细胞的验证不充分。他们使用了 37 种标记物来识别免疫细胞谱系及其激活/抑制标记物,其中 29 种用于表型分析(图 6A)。在使用 FlowSOM 自动聚类后,使用真正的标记物对 19 种不同的免疫聚类进行免疫表型分析,他们使用 t 分布随机邻域嵌入在二维中可视化免疫群体(图 6B)。肿瘤植入之间 CD45 +细胞的总数没有差异(图 6C)。植入 1 中的肿瘤富含髓系细胞,含有大量粒细胞 MDSC 细胞和小胶质细胞,而其淋巴细胞群主要由 Treg 组成(图 6B)。随着每次植入,他们观察到髓系细胞比例的增加,导致第三次植入时免疫浸润的多样性大大降低(图 6B-D),这最能反映人类 H3.3K27M HGG 的 TME。在所有连续移植中,髓系细胞由常驻巨噬细胞组成,但也由BMDM(巨噬细胞 CCR2 +群)组成(图 6B),表明髓系细胞在肿瘤中募集。这些结果表明,连续植入中更具侵袭性和生长速度更快的肿瘤与髓系细胞(包括新募集的 BMDM)的扩增有关,而其他免疫群则受到损害。
髓系细胞在脑肿瘤的免疫反应中发挥多种作用,包括损害 T 细胞募集/激活、肿瘤识别和溶解。此外,表达 IC 的细胞不能发挥适当的抗肿瘤作用。他们目标是针对CSF1R,一种对中枢神经系统小胶质细胞、外周组织巨噬细胞和浸润性血髓细胞的存活和增殖至关重要的受体激酶(图6D),以及由TME内罕见淋巴细胞表达的PD1。荷瘤小鼠分别接受抗csf1r(一周内治疗3次)或抗pd1抗体单独治疗(4H2:每周治疗2次,持续4周),或联合治疗(图6E)。当单独使用每种抑制剂时,未观察到对肿瘤形成的影响。令人惊讶的是,通过 CSF1R 抑制和免疫检查点 PD1 联合靶向髓系细胞显著延长了小鼠生存期并增加了 CD3 + 浸润(图 6E)。
由于在抗 CSF1R 治疗(单独或联合治疗)后仍然观察到肿瘤中新募集的 BMDM,他们进一步研究了更长的治疗(每周 3 次,持续 4 周)是否会更有利于提高生存率(图 6F)。单独使用 CSF1R 抑制剂无法影响肿瘤形成,而抗 CSF1R 与 PD1 联合治疗延长了小鼠生存期,4/7 只小鼠存活超过 4 个月而没有明显的临床疾病迹象。他们对在终点收获的单独用抗 CSF1R 或与 PD1 联合治疗的小鼠的肿瘤进行了 IHC 和 CyTOF分析,以评估肿瘤免疫浸润,与单独用载体治疗的肿瘤相比(图 6G-H)。他们观察到接受联合治疗的小鼠的肿瘤中CD3+ T 细胞浸润增加(图 6G-H)。因此,髓系细胞调节可能导致 T 细胞募集改善和介导的细胞毒性杀伤不受 PD1 检查点阻碍,从导致小鼠存活率增加。
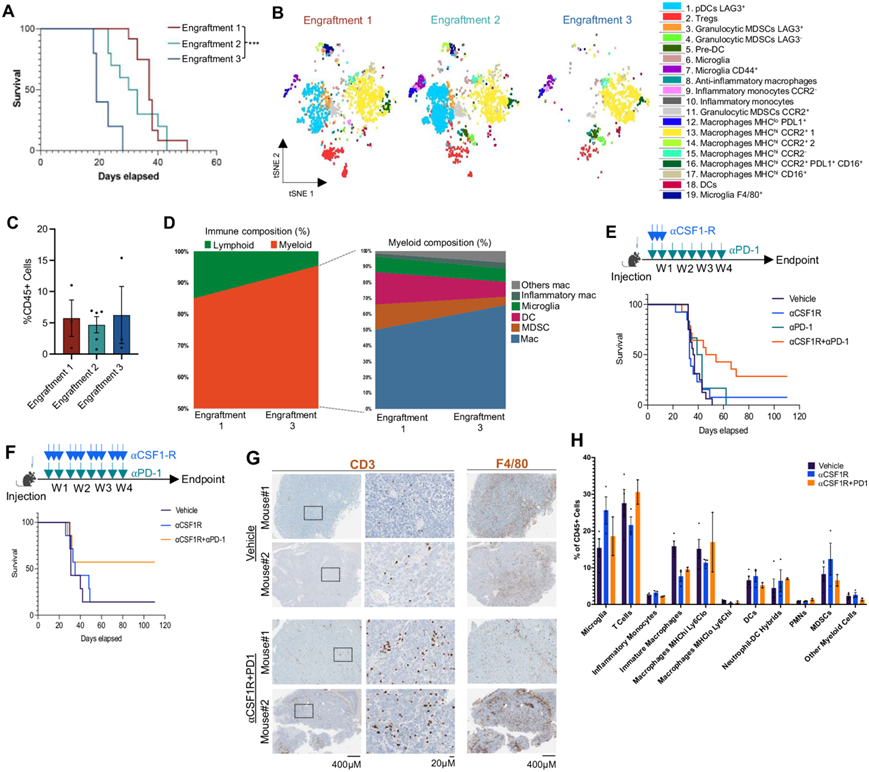
图6. 髓系募集是 K27M 肿瘤形成中的主要事件。
(A) 小鼠的总体生存率分析。(B) 来自 CyTOF 免疫浸润谱的t -SNE。(C-F) CD45 +活细胞的百分比。(D) 来自移植1、2 和 3 肿瘤的细胞频率。 (E-F) 实验示意图和生存率分析。(G) IHC 代表性图像。(H)免疫细胞聚类分析。
+ + + + + + + + + + +
结 论
本项研究使用转录组学和空间单细胞方法表征了 H3.3K27M 和 G34R/V 突变型神经胶质瘤以及多种 H3.3K27M 小鼠模型的免疫 TME。免疫谱系的消退表明 H3 突变型神经胶质瘤具有高度浸润性,具有多种髓系群体、免疫检查点标记的高水平表达和稀缺的淋巴细胞,这些发现在所有测试的 H3.3K27M 小鼠模型中均一致重现。这些髓系群体与 H3 突变细胞进行细胞间相互作用,介导免疫抑制并维持肿瘤的形成和维持。在临床前同种小鼠模型中,对髓系细胞和免疫检查点通路的双重抑制显示出显著的治疗效果。
+ + + + +



 English
English


