文献解读|Genome Biol(10.1):肠道菌群有助于人类适应高原缺氧环境
✦ +
+
论文ID
原名:Gut microbiota contributes to high-altitude hypoxia acclimatization of human populations
译名:肠道菌群有助于人类适应高原缺氧环境
期刊:Genome Biology
影响因子:10.1
发表时间:2024.08.24
DOI号:10.1186/s13059-024-03373-w
背 景
人类肠道菌群与高原低氧适应之间的关系仍存在很大争议。这主要源于人们对此类条件下菌群的潜在时间变化以及是否存在可能有助于宿主适应的主要或核心细菌的不确定性。
实验设计
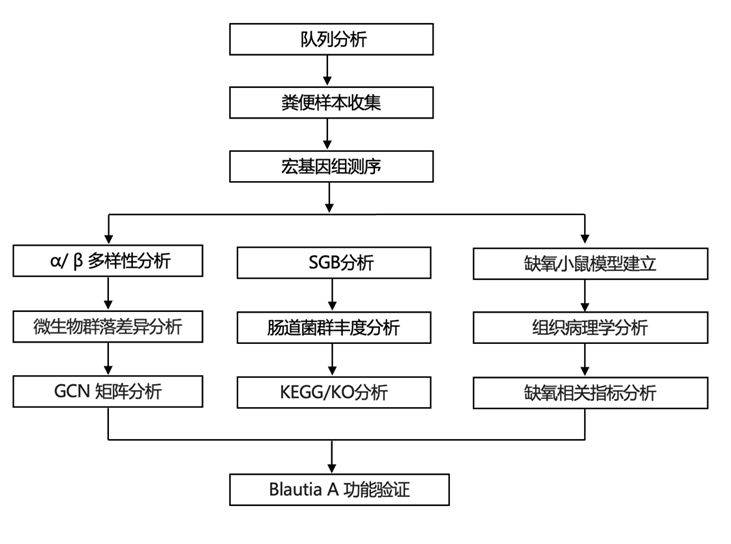
结 果
01
肠道微生物群多样性随高海拔缺氧暴露而发生时间变化
本研究招募了 45 名成年男性参与者(年龄 24.3 ± 1.75 岁),体重指数 (BMI) 为 22.17 ± 1.94 kg/m2)。总共从该队列的 7 个时间点采集了 256 个粪便样本,并对每个样本进行了全基因组测序 (WGSMS)(图 1 A)。为了研究肠道微生物多样性在暴露过程中是否随时间发生变化,研究团队分析了 肠道菌群随时间的α 多样性(Shannon 指数和丰富度指数)(图1 B-C)。与基线相比,肠道微生物多样性在高海拔缺氧暴露后的前 2 天内(LS1)没有显著变化。随后,在高海拔缺氧暴露后第24天(LS2)观察到 Shannon 指数和丰富度指数显著下降。在后期阶段(高海拔缺氧暴露 45 和 66 天,分别定义为 LS3 和 LS4),丰富度指数恢复,而 Shannon 指数在高海拔缺氧暴露结束时(LS4)仍低于基线,表明细菌种类的快速减少主要发生在高海拔缺氧暴露初期。虽然后期适应高原伴随低丰度细菌种类的增加,但整个微生物群落的Shannon多样性指数并未恢复到基线水平。有趣的是,当返回低地平原时(高海拔缺氧暴露结束后 7 天和 25 天,分别定义为 CQ2 和 CQ3),肠道微生物多样性水平恢复到基线水平,表明海拔变化与肠道微生物多样性之间存在密切的关系。
他们还比较了不同时间点的β多样性(图 1 D),在高海拔缺氧暴露的早期阶段,组内β多样性距离显著减小,这意味着参与者之间的微生物群落组成越来越相似。然而,在暴露的后期阶段,组内β多样性距离增加,表明参与者之间的微生物差异正在恢复。此外,群落组成在不同时间点也存在显著差异(图 1 E)。
为了研究肠道菌群多样性改变的功能后果,他们使用基因组内容网络 (GCN) 矩阵分析评估了本研究队列中的功能冗余,以探究菌群多样性在生态系统功能中的作用。在每个时间点计算 alpha 分类多样性 (TDα)、alpha 功能多样性 (FDα) 和 alpha 功能冗余 (FRα)(图1 F-H)。虽然存在波动,但在高海拔缺氧暴露 (LS1–LS4) 下观察到 FRα和 TDα总体上升的趋势,而 FD α则下降。在早期阶段(LS1–LS2),TDα的相对稳定性发生破坏,这反映在微生物种类和熵的显著减少上,表明 CQ1 显性细菌的核心地位削弱。 FDα的变化表明,在 LS1 之后,剩余微生物群的功能相似,几种肠道微生物随着高海拔缺氧暴露而减少。这些结果表明,肠道微生物群对缺氧暴露表现出快速反应,FRα明显且持续增加。与基线相比,暴露期间FRα的升高以及返回平原后FRα的持续增加表明健康成人肠道菌群在缺氧条件下维持群落稳定性的强劲而持久的驱动力。
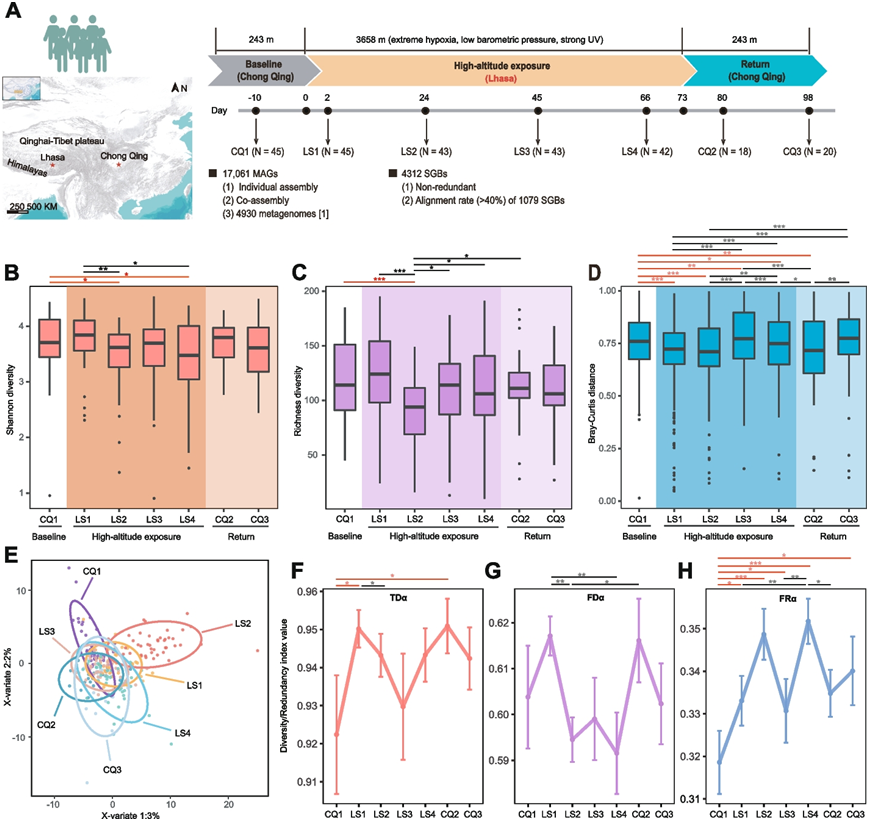
图1. 高原缺氧暴露队列和肠道菌群多样性特征概述。
(A) 研究设计概述,包括对 7 个时间点的人体粪便样本的纵向分析。(B-C) 肠道菌群的 Alpha 多样性(Shannon 和丰富度指数)呈现动态变化。(D) 不同时间点的群内 Bray-Curtis 距离。(E) 偏最小二乘判别分析 (PLS-DA) 揭示不同时间点微生物群落的显著差异。(F-H) 在每个时间点分析 Alpha 分类多样性、alpha 功能多样性和 alpha 功能冗余。
02
在高海拔缺氧环境中,Blautia A 丰度显著增加
在持续的高海拔缺氧暴露期间观察到肠道群落功能冗余度的增加,这表明微生物群组成可能也发生了变化。因此,他们探讨了不同分类单元水平(门、属和种)的群落组成的动态变化(图 2 A-C)。如 1079 个物种级基因组bin (SGB) 的分类注释所示,Firmicutes A在缺氧阶段成为优势门,其次是拟杆菌门、放线菌门、厚壁菌门、变形菌门。在这些门中,只有Firmicutes A在缺氧结束时表现出丰度显著增加。同样地,Firmicutes A在西藏日喀则长期居住汉族的六个不同人群中也显示出最高的丰度。
在属的水平上,Blautia A、Faecalibacterium和Prevotella是缺氧期间的优势细菌。其中,Blautia A的相对丰度表现出最大的升幅:从基线时的较低水平到整个缺氧期间的最高相对丰度。它的丰度与其所属的门(Firmicutes A)的丰度一致,表明它可能是 Firmicutes A 丰度增加的主要贡献者。与基线相比,在参与者返回低地平原后,Firmicutes A 和Blautia A的相对丰度均下降。具体来说, Blautia A的丰度迅速下降至基线水平。在来自西藏日喀则的独立验证队列中,这些参与者在高原缺氧环境中生活了较长时间(约 5-60 个月),也观察到他们体内Blautia A的丰度保持在最高水平,这表明Firmicutes A,特别是其属Blautia A与高原缺氧暴露之间的密切关联,例如快速而持续的反应。
为了确定哪些核心 SGB 是与高海拔缺氧暴露相关的潜在肠道微生物标记,他们使用 SGB 的丰度谱进行了指示种分析 (ISA)。共,在不同时间点区分出了 29 种指示种,其中 22 种 SGB(SGB2-SGB23)对暴露表现出明显的反应(图 2 C)。其中,20 种 SGB 是 LS2 的指示种,2 种 SGB 是 LS3 的指示种。在 LS2 中的 20 种指示种中,9 种(9/20,45%)来自Blautia A属。这九种 SGB 表现出的升高的指标值,加上它们的优势丰度,强烈证明Blautia A属可能作为在高海拔缺氧暴露期间调节肠道微生物群结构改变的关键细菌。
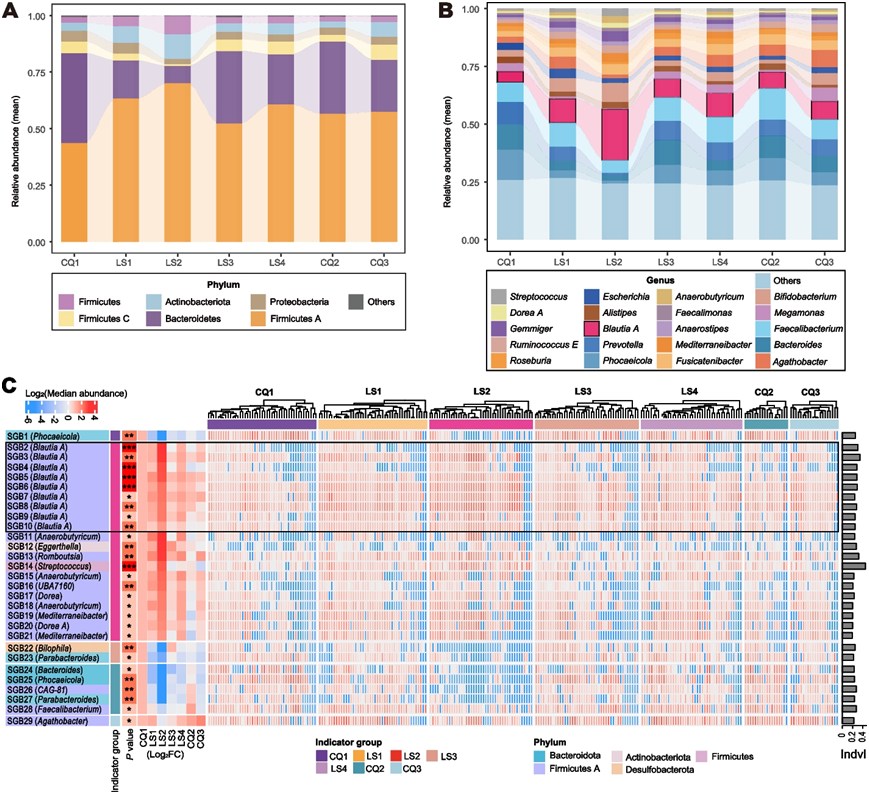
图2. 不同分类群(门、属和种)肠道菌群组成的时间变化。
(A-B) 冲积图显示最丰富的门和最丰富的属的相对丰度动态。 (C) 热图显示 29 个指示物种的详细特征。
03
Blautia A 在高海拔缺氧暴露过程中广泛参与多个功能模块
为了探究29个指示性SGBs所反映的群落组成变化所对应的功能,他们进行了KEGG 分析,以预测它们在模块级别的功能概况(图 3)。他们预测在四个时间点(CQ1、LS2、LS3和CQ2)的功能模块显著富集。在高海拔缺氧暴露期间较为富集的通路中,排名前两位的是“辅因子和维生素代谢”和“能量代谢”,多个功能模块集中在“钴胺素生物合成(map00860:卟啉代谢)”和“甲烷生成(map00680:甲烷代谢)”。有趣的是,这两个通路在 20 个指示 SGB 的单 SGB 富集分析中仍然是最富集的功能模块,其中来自Blautia A 的9 个 SGB呈现出强信号。
为了确定肠道菌群如何参与暴露后的“钴胺素生物合成”和“甲烷生成”功能模块,他们补充了基线(CQ1)和高海拔缺氧暴露(LS1-LS4)之间差异 SGB 的 KEGG 直系同源物 (KO) 富集(图4)。研究结果强调了在整个缺氧期间这两个功能模块的持续优势,同时伴随着Blautia A属内物种数量的不断增加(图 4 A-B)。在“钴胺素生物合成”模块中,L-谷氨酸通过多步反应参与卟啉代谢,产生腺苷钴胺素(维生素 B12 辅酶)(图 4 A)。在“甲烷生成”模块中,乙酰辅酶A脱羰基酶/合酶(ACDS)与甲烷和乙酰辅酶A的生成密切相关,并传递到与碳水化合物、能量和氨基酸代谢相关的通路(图 4B)。值得注意的是,Blautia A物种含有这些反应所需的大多数酶,在缺氧期间广泛参与了上述两个模块。
Blautia A表达丰富的丁酸生成通路相关酶,其可能通过ABC转运蛋白利用多种寡糖,然后经过一系列反应合成丁酸(图 5)。值得一提的是,6个SGB(在缺氧过程中丰度增加)的合成能力主要是通过调控丙酮酸相关的代谢通路实现的,这也验证了在上文提到的“产甲烷”模块中:丙酮酸代谢在暴露过程中得到增强(图 4B)。

图3. 点图显示 29 个指示性 SGB 的功能模块在不同时间点的富集情况。
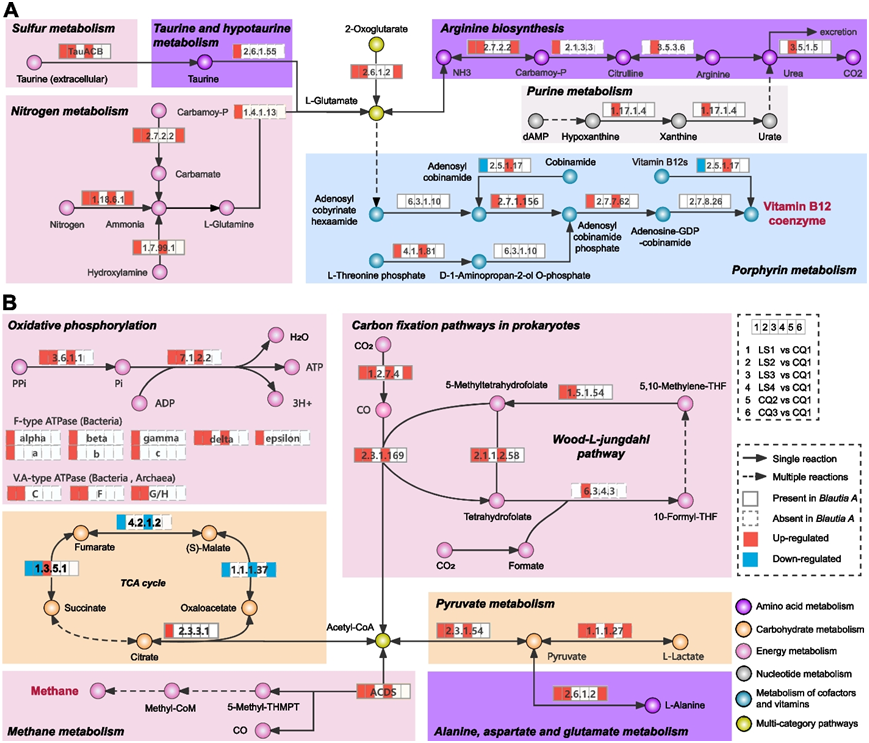
图4. 基于 1079 个 SGB 的高原缺氧暴露不同阶段下核心功能模块的动态。
(A) 维生素B12生物合成反应步骤。 (B) 甲烷生成反应步骤。
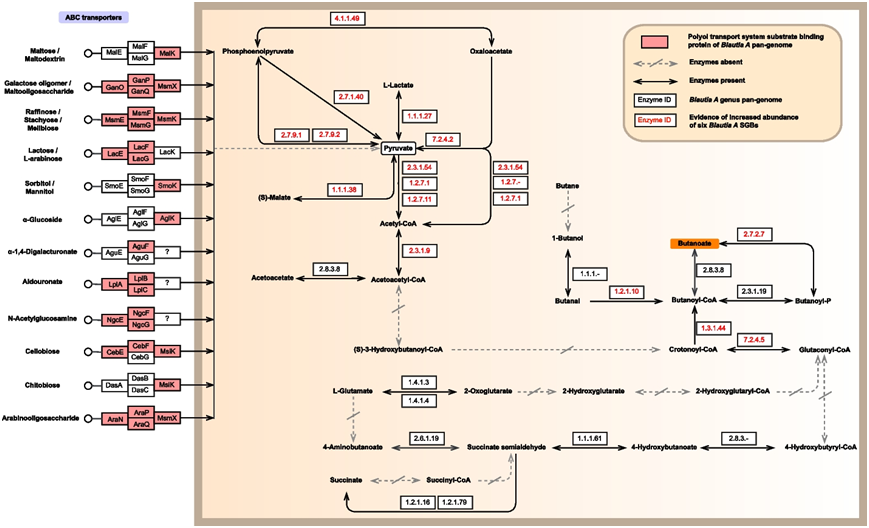
图5. 基于Blautia A SGB全基因组分析的丁酸生产路线。
04
给小鼠灌胃B. wexlerae可改善因长期缺氧引起的肠道损伤和适应不良
接下来,他们使用小鼠模型检测了Blautia A在缺氧暴露下的潜在作用。他们选择B. wexlerae作为目标物种,原因如下:(1) 在Blautia A属衍生的九种指示物种中,B. wexlerae在整个缺氧期间的相对丰度最高。(2) B. wexlerae的动态与Blautia A属和 Firmicutes A 门的一致性最高(图 2 A-B)。此外,他们通过严格的筛选标准将B. wexlerae DSM19850 (Bw)确定为目标菌株。
他们对小鼠进行了为期8周的PBS/Bw灌胃补充实验(图 6A),结果显示HYP+PBS小鼠的红细胞参数和外周血氧饱和度(SpO2)的变化与基于人群的短期和长期高原缺氧暴露分析结果一致,说明缺氧对人和小鼠的影响相似(图 6B)。虽然缺氧条件下 HYP + Bw 与 HYP + PBS 小鼠的血红蛋白 (HGB)、红细胞 (RBC)、平均红细胞体积 (MCV) 和红细胞比容 (HCT) 等几项与缺氧暴露密切相关的血液学参数没有显著差异,但长期缺氧的 HYP + Bw 小鼠的 SpO2 (图6B)和肺动脉压 (PAP) 均有显著改善,例如右心室收缩压 (RVSP)(图 6 C)和肺损伤评分(图 6 D)显著下降,胶原纤维沉积减少,肺组织蓝色染色减少(肺水肿特征)(图 6 E)。这些表明 Bw 处理后,由缺氧引起的症状有所改善。
由于缺氧也会引起肠水肿,他们随后探讨了Bw对缺氧暴露下肠道健康的影响,观察到肠道状态变化主要发生在回肠。具体来说,在缺氧条件下,HYP + Bw 组小鼠的回肠水肿明显改善,气体积聚比HYP + PBS 组的小鼠减少(图6 F)。同时,与HYP + PBS 组小鼠相比,HYP + Bw 组小鼠的回肠表现出轻微的疾病过程,包括组织学损伤评分显著下降(图6 G)。与 NOR + PBS 组小鼠相比,HYP + PBS 小鼠回肠中促炎因子 IL-1α 和 IL-1β 的表达水平升高,但在 HYP + Bw组小鼠中则显著受到抑制,表明 Bw 显著降低了缺氧引起的炎症(图 6 I)。肠道通透性受特定的紧密连接蛋白控制,其中 ZO-1 是紧密连接完整性的关键标志。肠道通透性增加会损害肠道屏障功能,导致潜在的健康问题。结果显示,与 HYP + PBS组小鼠相比,HYP + Bw组小鼠的 ZO-1 mRNA 表达水平显著增加(图 6 J),表明 Bw 处理可能有助于恢复和维持肠道屏障的完整性。
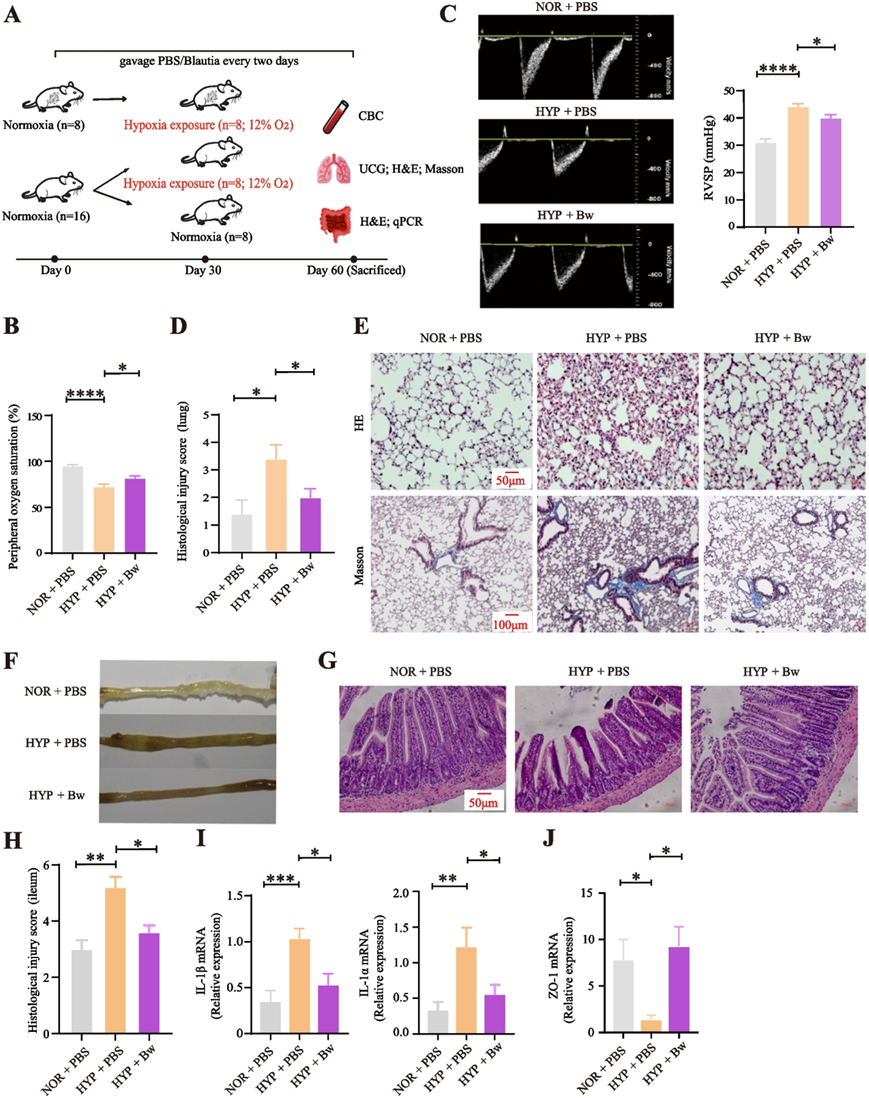
图6. 灌食B. wexlerae可抑制肠道炎症,促进高原环境适应。
(A) 动物实验设计。(B) 小鼠外周血氧饱和度(SpO2)。(C)定量肺动脉加速时间(PAT)。 (D) 小鼠肺组织学损伤评分。(E) 小鼠肺切片的代表性 H&E 和 Masson 三色染色。(F) 小鼠远端回肠的图像分析。(G) 小鼠远端回肠的代表性 H&E 染色切片。(H) 小鼠远端回肠组织学损伤评分的统计分析。(I) 回肠中 IL-1α 和 IL-1β 的相对 mRNA 表达水平。(J) 回肠中 ZO-1 的相对 mRNA 表达水平。
+ + + + + + + + + + +
结 论
本项研究通过对同一批处于高海拔缺氧环境中的人群进行为期 108 天的纵向研究,利用宏基因组学方法分析研究了 7 个时间点肠道菌群组成的时间变化。这项研究展示了人类肠道菌群如何快速应对缺氧应激,并确定了响应高海拔缺氧暴露的核心肠道细菌(如Blautia A种)。此外,在生活在较高海拔(低缺氧)不同持续时间(约 5-60 个月)的其他群体中进一步验证了Blautia A属的最高丰度。体内动物实验结果验证了Blautia A在促进宿主适应缺氧环境方面发挥关键作用,可能通过抗炎和保护肠道屏障来维持肠道健康,这表明Blautia A种可作为预防或治疗缺氧相关适应不良或疾病的候选益生菌,这些结果共同揭示了Blautia A在促进宿主适应缺氧环境中的作用。
+ + + + +



 English
English


