文献解读|Cell Rep(8.8):食蟹猴肥胖和 2 型糖尿病的转录组和蛋白质组图谱
✦ +
+
论文ID
原名:A transcriptomic and proteomic atlas of obesity and type 2 diabetes in cynomolgus monkeys
译名:食蟹猴肥胖和 2 型糖尿病的转录组和蛋白质组图谱
期刊:Cell Reports
影响因子:8.8
发表时间:2023.08.08
DOI号:10.1016/j.celrep.2023.112952
背 景
肥胖和 2 型糖尿病 (T2D) 仍然是全球医疗保健的主要挑战,尽管小鼠是研究代谢紊乱最常用的临床前动物模型,它们不像非人类灵长类动物 (NHP) 那样适合将研究结果转化为临床应用。例如,较高的葡萄糖与小鼠较低的死亡率相关,但 NHP 和人类的死亡率较高,这表明 NHP 中与年龄相关的代谢变化更直接地转化为人类。
在常用的NHP模型中,食蟹猴 (Macaca fascicularis) 是药物开发中使用最广泛的物种。尽管食蟹猴的饮食可以诱发肥胖和 T2D,但它们也可以自发地发展为肥胖和 T2D,使它们成为研究人类这些代谢疾病大部分发病机制的理想转化模型。然而,食蟹猴肥胖和 T2D 模型的多组学特征在很大程度上尚未探索,因此知之甚少。
实验设计
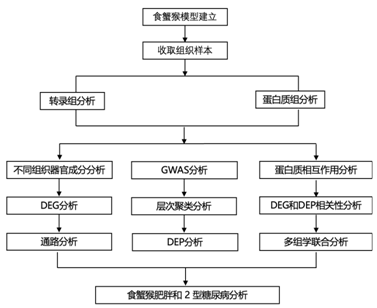
结 果
01
食蟹猴群体和组学数据生成
研究者团队收集了 22 只中华食蟹猴,其中包括 8 只肥胖个体和 4 只年龄匹配的健康个体,以及 6 只 2 型糖尿病个体和 4 只年龄匹配的健康个体(图1A)。所有患有肥胖症或 T2D 的猴子都会自发患上这种疾病。与非肥胖对照相比,肥胖猴子的身体质量指数(BMI) 显著增加(图 1 A)。与非 T2D 猴子相比,T2D 猴子的空腹血糖、糖化血红蛋白 (HbA1c)、甘油三酯和尿糖显著升高(图 1 A)。尸检后获得了涵盖所有主要器官的 27 个组织样本(图 1B–1D)并用于转录组和蛋白质组分析,最后得到了 516 个差异基因和 502 个差异蛋白质。
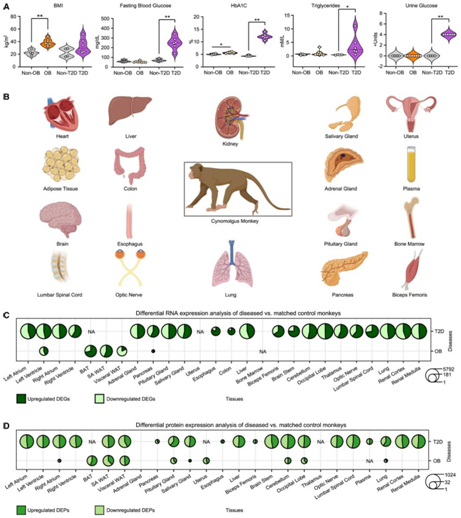
图1. 动物表型和器官以及患病和非患病队列的差异表达分析。(A)小提琴图显示了非肥胖(非OB)、肥胖(OB)、非糖尿病(非T2D)和2型糖尿病(T2D)猴子的BMI、空腹血糖、糖化血红蛋白、甘油三酯和尿糖。(B)本研究中收集的所有主要器官。(C-D) 肥胖和 T2D 的 DEG 和 DEP 数量。
02
跨组织肥胖的转录组分析
为了探究与肥胖相关的转录变化,他们对肥胖和非肥胖猴子的所有组织进行了差异表达分析。脂肪组织显示出最多数量的差异表达基因 (DEG),而大多数其他组织显示出很少甚至没有 DEG(图 1 C)。在三种脂肪组织中,在皮下腹部白色脂肪组织 (SA WAT) 中发现最多的DEG,其次是棕色脂肪组织 (BAT), 而内脏 WAT 的 DEG 数量最少。BAT 和 SA WAT 中的 DEG 在涉及免疫反应的通路中均过表达(图2A)。内脏 WAT 中只有一种通路(钙信号传导)富集了 DEG。
接下来他们检查了脂肪组织之间 DEG 的重叠。SA WAT 和 BAT 中有 232 个DEG,而这两种组织和内脏 WAT 之间的重叠 DEG 数量有限(分别为 30 和 29)(图 2 B)。在所有三种脂肪组织中,肥胖与非肥胖对照之间有 18 个基因存在差异表达,包括LEP和SLC2A1(图 2B-C)。LEP编码瘦素,在能量消耗中发挥着重要作用,其水平升高与肥胖和 T2D 相关。LEP在脂肪组织中最丰富,并且在肥胖猴的所有三种脂肪组织中表达上调(图 2D),表明瘦素在不同类型脂肪组织中的共同作用及其在人类和食蟹猴肥胖中的保守作用。
此外,在人类巨噬细胞和单核细胞中观察到 SA WAT(图 2E)和 BAT中 DEG 的最显著富集,但在肥胖猴子的内脏 WAT 中没有观察到,这表明肥胖的不同脂肪组织中存在不同的免疫反应。总而言之,利用食蟹猴进行的分析证实了巨噬细胞和单核细胞在人类肥胖中的作用,进一步表明 NHP 是研究肥胖的理想模型。
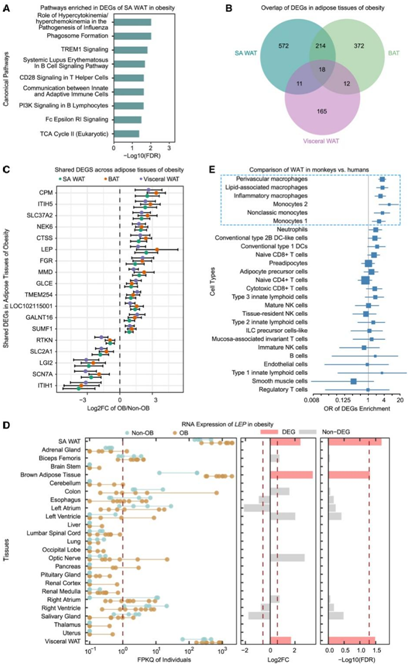
图2. 肥胖的转录组分析。
(A) 富含 SA WAT 的 DEG 的通路。(B) 维恩图显示脂肪组织之间 DEG 的重叠。(C) 脂肪组织中 18 个共享 DEG 的 Log2 差异倍数和 95% 置信区间。(D) LEP跨组织的转录表达。(E) 食蟹猴和人类之间 WAT 的跨物种比较。
03
跨组织肥胖的蛋白质组和蛋白质-蛋白质相互作用网络分析
接下来他们对肥胖和非肥胖猴子的蛋白质组进行了表征。SA WAT中差异表达蛋白(DEP)富集的通路包括氧化磷酸化、线粒体功能障碍、sirtuin 信号通路、乙酰辅酶 A (CoA) 生物合成 I 和脂肪酸 β-氧化 I(图 3A)。然而,在 BAT 和内脏 WAT 中,没有DEP富集于这些通路中。在小脑、子宫、枕叶和垂体中发现的 DEP 不足 30 个,但在其他组织中几乎没有发现。综上所述,肥胖引起的蛋白质组变化主要发生在脂肪组织中,这与转录组数据的模式一致。
为了更好地了解驱动肥胖蛋白质组变化的调控网络,他们使用 DEP 构建了蛋白质-蛋白质相互作用网络。对于 SA WAT,276 个 DEP 中的 216 个包含在一个网络中(图 3 B)。代谢和免疫反应通路在网络中占主导地位(图3C)。就相互作用数量而言,最突出的中心蛋白是脂肪酸合酶 (FASN)(图 3B),它在肥胖中的 mRNA 和蛋白质水平均下调。排名最高的关键基因是BAT中的MAPK1和内脏WAT中的VIM(图3D),它们分别与BMI和胆固醇水平相关。
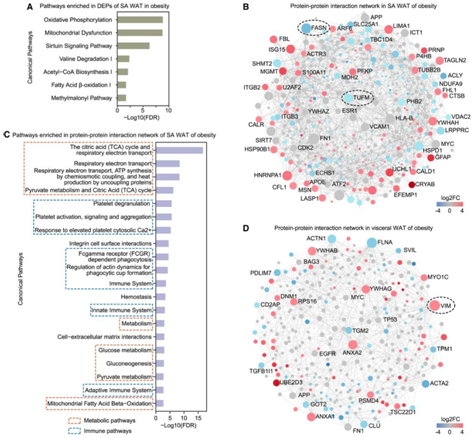
图3. 肥胖的蛋白质组学分析。
(A) SA WAT 的 DEP 中的通路显著富集。(B) SA WAT 的 DEP 的蛋白质-蛋白质相互作用网络。(C)蛋白质-蛋白质相互作用网络中富集的通路。(D) 内脏 WAT DEP 的蛋白质-蛋白质相互作用网络。
04
肥胖中转录组和蛋白质组改变的比较
为了检查肥胖的转录组和蛋白质组谱之间的关系,他们计算了 DEG 和 DEP 差异倍数的相关性。在SA WAT中,DEG和DEP基因之间存在很强的相关性(图 4A)。在SA WAT中有82个重叠的DEG和DEP(图4B),在内脏WAT中有5个重叠(图4C),但在任何其他组织中都没有。在所有三种脂肪组织中,只有一个基因(ITIH5)上调。ITIH5是一种肿瘤抑制基因,但在肥胖人群的人体脂肪组织中表达也有所增加。另一个基因(CPM) 在SA WAT和内脏WAT之间共享,另外三个基因(ATP6V1A、PC和SERPINB9)在SA WAT和BAT之间共享。然而,肥胖中的大多数 DEG 和 DEP 在同一脂肪组织中并不重叠(图4D-E)。
接下来,他们探究了 RNA 和蛋白质生物标志物的最佳列表,以区分肥胖和非肥胖猴子,使用潜在成分 (DIABLO) 方法进行生物标志物发现的数据集成分析。对于SA WAT,多组学生物标志物面板包括从第一个组件中选择的5种mRNA和6种蛋白质(图4F)。这11种生物标志物在肥胖中有差异表达,可以区分肥胖和非肥胖猴子(图4G)。在这些生物标志物之间观察到很强的相关性(图 4 H)。值得注意的是,这 11 个基因中的 6 个——AIFM1、ETFA、IDH2、MRPL12、NDUFS7和TUFM——在线粒体中发挥作用。IDH2肥胖中 mRNA 和蛋白质水平均下调。

图4. 肥胖的多组学综合分析。
(A) SA WAT 中 DEG 和 DEP 基因的 log2FC 相关性。(B-C) 雷达图分别显示 SA 和内脏 WAT 中的 82 个和 5 个共享 DEG 和 DEP。(D-E) Circos 图分别显示 SA 和内脏 WAT 中全基因组范围内的所有 DEG 和 DEP。(F) DIABLO 方法识别的 SA WAT 的最佳区分性分子特征热图。(G) 共识图显示使用 (F) 中的 11 种 SA WAT 生物标志物区分肥胖和非肥胖猴子。(H) 在相似矩阵上显示(F)中特征之间正相关和负相关的点图。
05
跨组织 T2D 的转录组和蛋白质组分析
为了剖析 T2D 的分子机制,他们在转录组和蛋白质组水平上对 T2D 与非糖尿病对照之间进行了差异表达分析。与肥胖不同,他们在大多数组织中观察到广泛的转录组和蛋白质组扰动(图1C-D)。T2D的主要特征是胰腺β细胞的胰岛素分泌受损,在胰腺中,鉴定出 646 个 DEG,最重要的富集通路是 Gαq 信号传导。相比之下,在胰腺中只发现了 8 个 DEP:胰岛素、ECHDC2、ARL6IP1、GON7、CISD3、SFRP1、SIAE 和 COL6A1。正如预期的那样,胰岛素是 T2D 中下降最显著的蛋白质,表明食蟹猴是研究 T2D 的有效模型。
接下来,他们关注既是 DEG 又是 DEP 的基因,并且与非糖尿病对照相比,T2D 组在 mRNA 和蛋白质水平上显示出同向变化(同向 DEG/DEP)。
肾脏和心脏组织也是包含这些基因数量最多的组织之一。在所有组织中,两个肾组织(肾髓质和皮质)的同向 DEG/DEP 数量最多(分别为 288 和 255),其次是两个脑组织(小脑和枕叶)和两个左心组织,最后是肝脏(图5A)。神经组织中存在中等数量的同向 DEG/DEP。此外,两种内分泌组织——垂体和肾上腺——分别有 50 个和 46 个同向 DEG/DEP,在其他组织中几乎没有发现 DEG。
他们还将 DIABLO 方法应用于 T2D,寻找区分患病猴子和健康猴子的多组学生物标志物组。对于胰腺,选择了包含 25 个 mRNA 和 5 个蛋白质的组(图5B)。蛋白质生物标志物与 mRNA 生物标志物高度相关(图 5C)。SLC2A2与 T2D 和肥胖相关,DNAJC27与肥胖和 BMI 相关。MAP3K11、RPGRIP1L和WFS1与 T2D 相关,而PPDPF、RPGRIP1L和RC3H2涉及与 BMI 相关。
他们的分析选择了跨组学数据类型的判别性和良好相关的分子特征,这为未来研究中的验证提供了潜在的 T2D 生物标志物。
为了识别 DEG 和 DEP 中与 GWAS 关联的基因,他们从 GWAS 目录中整理了 2009 个与 T2D 相关的基因列表,分别有 639 个和 388 个 GWAS 基因与 DEG 和 DEP 重叠。与非 GWAS 基因相比,GWAS 基因似乎更有可能在至少一种组织的转录水平上差异表达。胰腺中有49个具有GWAS信号的DEG,包括SLC30A8和SLC2A2,多项研究表明这两个基因与 T2D 相关。重要的是,由于疾病相关的胰岛损伤和坏死,仅在胰腺中表达的 SLC30A8 在 T2D 猴子中显著下调(图5D)。由于疾病相关的胰岛损伤和坏死。SLC2A2仅在少数组织中可检测到表达,在T2D组的胰腺、肝脏和肾脏髓质中表达明显较低。
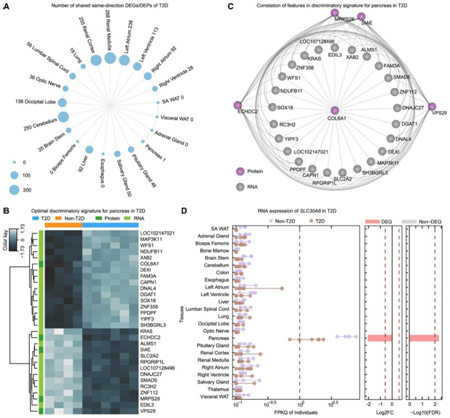
图5. T2D的多组学分析。
(A) 圆形点图显示跨组织共享同向 DEG/DEP 的数量。(B) 胰腺最佳区分分子特征的热图。(C) 相关性网络显示 (B) 中的特征之间的相关性。(D) T2D 中SLC30A8跨组织的转录表达。
06
肥胖和 T2D 之间共有的转录变化
考虑到肥胖是 T2D 的关键危险因素之一,他们试图确定患有肥胖和 T2D 的食蟹猴在多大程度上具有相似的转录变化。肥胖和 T2D 之间的胰腺中存在两个共享的 DEG:GAD2和LOC102137725 。GAD2在肥胖症中表达上调,但在 T2D 中表达下调。它是胰岛素依赖性糖尿病的主要自身抗原,并且与去脂体重有关。
接下来,他们利用加权基因共表达网络分析(WGCNA)分析了两组中两种脂肪组织的表达谱(SA和内脏WAT)。第一个模块(绿色模块)由肥胖和 T2D 中的 1075 个上调基因组成(图 6 A),这些基因在涉及免疫反应的许多通路中出现过多(图 6 B)。所有其他三个模块都包含肥胖和 T2D 中下调的基因。有趣的是,由 1653 个基因组成的棕色模块富含脂肪酸 β-氧化等代谢相关通路,其中氧化磷酸化和线粒体功能障碍是最重要的(图6C)。
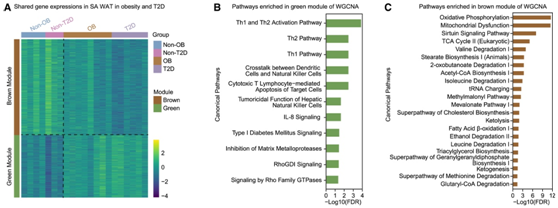
图6. 肥胖和 T2D 之间 SA WAT 中共有的转录改变。
(A) 热图显示了 WGCNA 识别的绿色和棕色模块中基因的表达。(B) 绿色模块基因中过度表达的重要通路。(C) 棕色模块基因中过度表达的重要通路。
07
肥胖与 T2D 之间蛋白质组变化的比较
为了分析与从肥胖到 T2D 的疾病进展相关的蛋白质组学特征,他们首先比较了这两种疾病之间相同组织内的 DEP。尽管大多数 DEP 似乎只针对一种疾病,但在 SA WAT 中观察到 71 个共享的 DEP(图 7A),在内脏 WAT 中观察到 21 个(图 7B),在小脑中观察到 10 个,而在其他组织中则很少甚至没有。在 SA WAT 中,71 个共享 DEP 中的 62 个在疾病之间表现出同向变化(图7C),这些基因富含乙酰辅酶A生物合成等代谢通路。其中四个基因— PCCB、CHDH、SERPINB1和ITGAX与 BMI 相关,另外三个基因LAMB2、PPIF和GCDH与 T2D 相关。在内脏WAT中,只有7个共享的DEP在疾病之间具有相同方向的变化,这表明当从肥胖进展到T2D时,内脏WAT可能比SA WAT经历更广泛的蛋白质组失调。此外,ITLN1在肥胖组中下调,但在 T2D 组的垂体中上调。ITLN1可能作为脂肪因子发挥作用,增强脂肪细胞中胰岛素刺激的葡萄糖摄取,这也与它在T2D的内脏WAT中上调一致。
接下来他们比较了脂肪组织和疾病的 DEP。尽管肥胖的内脏WAT与T2D的SA WAT显示DEP(24个蛋白质)有限的重叠,但T2D的内脏WAT与肥胖的SA WAT共享更多数量的DEP(132个蛋白质),其中除了一个表现出同向变化(图7D)。有趣的是,T2D 内脏 WAT 中 DEP 富集的顶部通路与肥胖 SA WAT 中的几乎相同,但与肥胖内脏 WAT 仅有两处重叠(图 7E),表明内脏 WAT 可能会发生部分转移。当从肥胖进展为 T2D 时,其代谢活动转向 SA WAT 的变化。三个基因— GPNMB、PC和PCYT2-在两种脂肪组织和两种疾病中显示出同向差异蛋白表达。它们都与肥胖或 T2D 无关。值得注意的是,PC基因编码丙酮酸羧化酶,该酶参与糖异生、脂肪生成和胰岛素分泌。
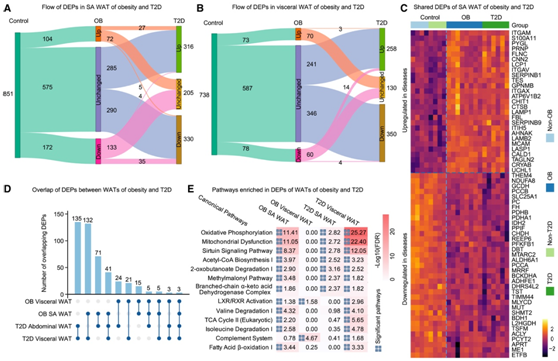
图7. 肥胖与T2D脂肪组织蛋白质组变化比较。
(A-B) 桑基图分别显示肥胖和 T2D 之间 SA 和内脏 WAT 中 DEP 的变化。(C) 62 个 DEP 的表达显示肥胖和 T2D 之间 SA WAT 的同向变化。(D) UpSet 图显示肥胖和 T2D 的 SA 和内脏 WAT 之间重叠的 DEP 数量。(E) 肥胖和 T2D 中 SA 和内脏 WAT 的 DEP 丰富的通路。
+ + + + + + + + + + +
结 论
本项研究展示了患有自发性肥胖或 T2D 的食蟹猴与健康对照相比的所有主要器官的转录组和蛋白质组图谱。分子变化主要发生在肥胖个体的脂肪组织中,而 T2D 个体中的广泛表达扰动存在于许多组织(例如肝脏和肾脏)。肥胖和 T2D 中免疫反应相关通路上调,而代谢和线粒体通路下调。此外,他们强调了一些潜在的治疗靶点,包括肥胖症中的SLC2A1和PCSK1以及SLC30A8和T2D 中的SLC2A2。本项研究为探索肥胖和 T2D 的复杂分子机制以及开发这些疾病的治疗方法提供了新的理论依据。
+ + + + +



 English
English


