文献解读|Cell Rep Med(14.3):从浸润前到浸润性肺腺癌的进化蛋白质组景观
✦ +
+
论文ID
原名:Evolutionary proteogenomic landscape from pre-invasive to invasive lung adenocarcinoma
译名:从浸润前到浸润性肺腺癌的进化蛋白质组景观
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.01.05
DOI号:10.1016/j.xcrm.2023.101358
背 景
肺癌仍然是全球癌症死亡的主要原因。随着低剂量计算机断层扫描(LDCT)筛查的广泛应用,早期肺腺癌的检出率不断提高,这主要是由于原位腺癌(AIS)和微创腺癌(MIA)病例的增加。AIS定义为局限性小(≤3cm)腺癌,其生长局限于肿瘤细胞沿原有肺泡结构生长,无侵袭性,而MIA是一种小腺癌(≤3cm),以鳞状形态为主,在任何一个病灶的最大尺寸上浸润≤5mm。病理上,肺腺癌通常是从AIS/MIA逐步发展为侵袭性病变。AIS和MIA都属于肺腺癌的侵袭前阶段,而侵袭性腺癌(IAC)代表侵袭期。因此,确定从AIS/MIA到IAC进展的分子结构和标志至关重要。
实验设计
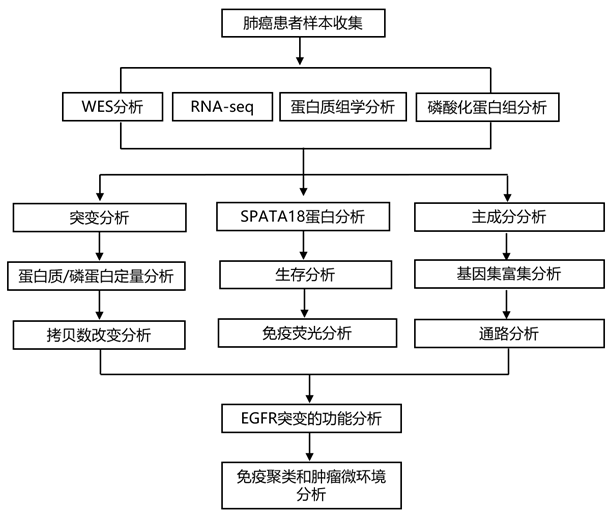
结 果
01
AIS/MIA 和 IAC 的蛋白质组景观
研究团队收集了来自东亚患者的 197 个肺部肿瘤和配对的正常邻近组织 (NAT),其中包括 98 个 AIS/MIA 和 99 个 IAC(图 1 A)。AIS 和 MIA 亚型之间没有观察到明显的差异,因此将AIS/MIA 亚型在本研究中分为一组。他们进行了综合分析包括全外显子组测序(WES)、转录组分析(RNA-seq)以及蛋白质组学和磷酸化蛋白质组学分析(图1A)。对比分析显示,在AIS/MIA组(图1B-E)以及复旦队列和其他研究中检测到较低的肿瘤突变负荷(TMB)。此外,排名第一的EGFR突变早在AIS/MIA亚型中就检测到,并持续到IAC亚型(图1C),表明EGFR突变是肺癌进展早期的关键事件。
在 AIS/MIA 队列中总共鉴定出 11708 个蛋白质,在 IAC 队列中检测到 19629 个蛋白质(图1F-G)。值得注意的是,与配对的正常组织相比,在肿瘤组织中检测到更多的蛋白质和磷蛋白位点(图1F-G)。
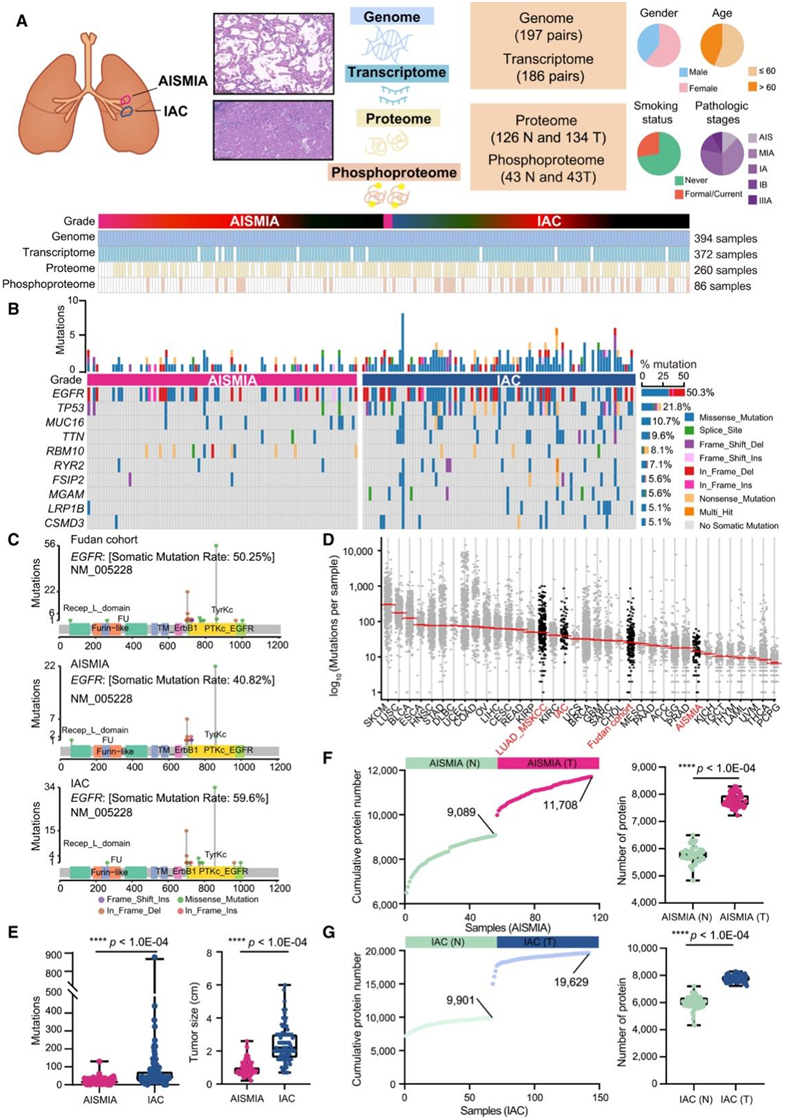
图1. AIS/MIA 和 IAC 队列的蛋白质组学概述。
(A)AIS/MIA 和 IAC 队列的蛋白质组学概述。(B) 按肿瘤侵袭程度分层的前 10 个变异基因。(C) Lollipop图显示了复旦队列(所有肿瘤)以及 AIS/MIA 和 IAC 队列中EGFR突变的详细信息。(D) 复旦队列和其他公共队列中的肿瘤突变负担。(E) AIS/MIA 和 IAC 中的基因突变数量(左)和肿瘤大小(右)。(F)在 AIS/MIA 队列的正常组织和肿瘤中鉴定出累积蛋白质数量(左)和绝对蛋白质数量(右)。(G) 在 IAC 队列的正常组织和肿瘤中鉴定出累积蛋白质数量(左)和绝对蛋白质数量(右)。
02
chr4q12的缺失是AIS/MIA向IAC转变过程中的关键事件
拷贝数改变(CNA)在肿瘤进展过程中发挥着关键作用,因此他们进一步研究了与生存结果相关的缺失峰。chr4q12 和 chr5q21.1 的缺失是与临床结果相关的两个主要改变(图2A-B)。仅在 IAC 中检测到 chr4q12 缺失,表明在 chr4q12 缺失期间发生了关键的分子事件(图2B)。为了研究 chr4q12 和 chr5q21.1 缺失的生物学效应,他们对在蛋白质和 RNA 水平上表现出体细胞 CNA (SCNA)顺式调节效应以及从 AIS/MIA 下调至 IAC 的基因进行了研究。为此,仅在两个水平上鉴定了精子发生相关蛋白 18(SPATA18,也称为Mieap)(图 2D),并显示出对其对应蛋白的顺式影响(图 2E)。与AIS/MIA相比,IAC中SPATA18的RNA和蛋白水平表达较低(图2F)。此外,SPATA18缺失事件和 SPATA18 蛋白低表达与较差的总生存期 (OS) 相关(图2G-H)。
SPATA18是一种新的p53诱导蛋白,影响线粒体的生物学功能。SPATA18能够诱导溶酶体样细胞器消除氧化的线粒体蛋白,这对线粒体质量控制至关重要。本项研究分析表明,SPATA18缺失与溶酶体样细胞器标记下调以及线粒体膜分子和氧化磷酸化(OXPHOS)上调有关(图2I)。下调SPATA18可显著促进细胞生长和细胞周期(图2J-K)。迁移和侵袭是肿瘤细胞脱离原发肿瘤部位,浸润淋巴和血管,最终促进肿瘤进展的关键步骤。
鉴于SPATA18在AIS/MIA向IAC进展中的潜在作用,他们进行了伤口愈合、迁移和侵袭试验。结果表明,下调SPATA18可增强肺腺癌的迁移和侵袭能力(图2L-M)。
接下来,他们研究了SPATA18对线粒体自噬的影响。转染两个靶向SPATA18的短发夹rna (shRNA)后,观察到LysoSensor的荧光密度显著降低,MitoTracker的荧光密度升高(图2N)。这些发现共同表明,线粒体自噬的抑制是SPATA18下调的结果。动物实验也证实了下调SPATA18的促肿瘤作用(图2O)。综上所述,chr4q12缺失可能是AIS/MIA向IAC过渡过程中的关键事件,其中SPATA18缺失通过抑制线粒体自噬来促进肿瘤生长(图2P)。
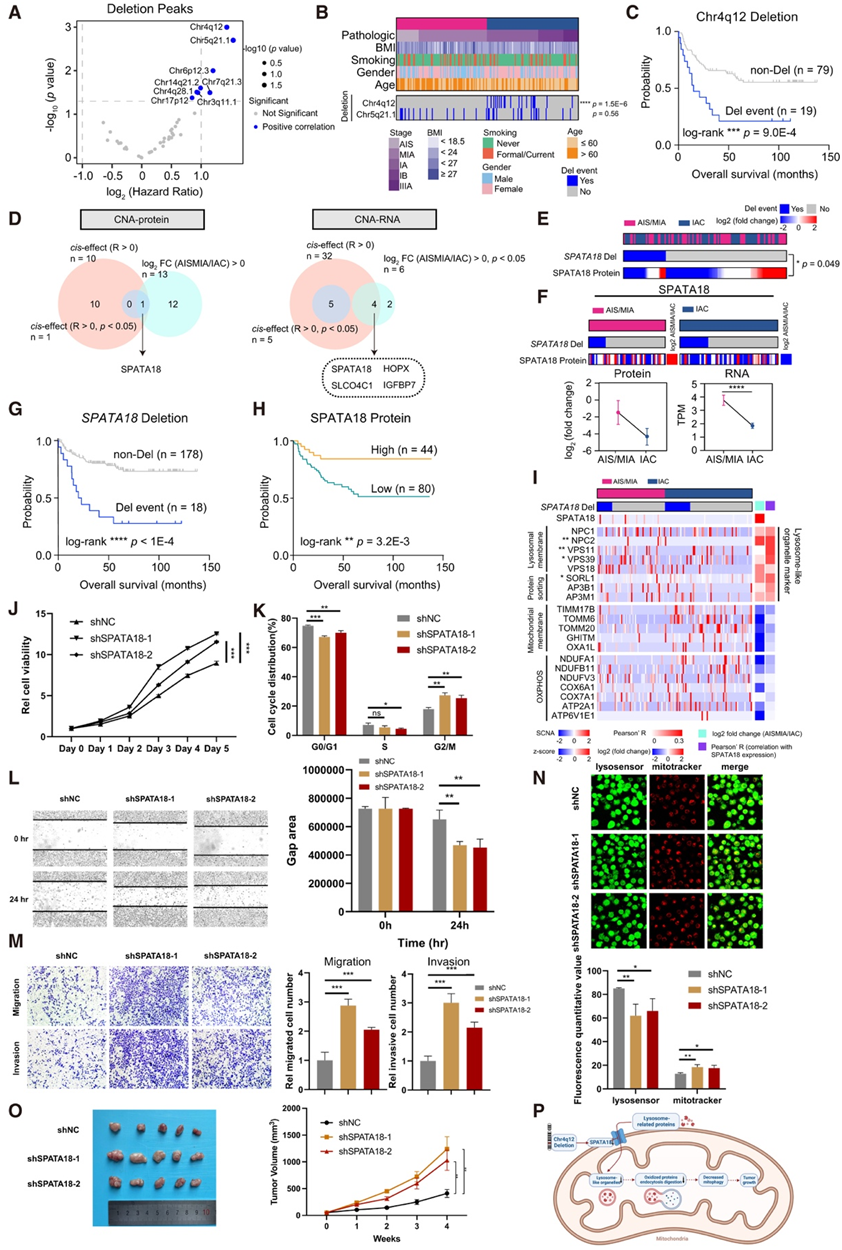
图2. 与从 AIS/MIA 到 IAC 进展相关的CNA。
(A) 与肺腺癌患者的生存相关的缺失峰。(B) AIS/MIA 和 IAC中两个最显著缺失峰(chr5q21.1 和 chr4q12 缺失)的分布。(C) 按 chr4q12 缺失分层的总生存期 (OS)。(D) CNA-蛋白和 CNA-RNA 的相关性。(E) SPATA18缺失与蛋白质水平表达之间的关联。(F) AIS/MIA 和 IAC 中 SPATA18 蛋白和 RNA 表达的比较。(G) 按SPATA18缺失进行分层的 OS。(H)按 SPATA18 蛋白水平分层的 OS。(I) 热图可视化SPATA18缺失与溶酶体样细胞器和线粒体标记相关基因之间的相关性。(J) 在用 shSPATA18 或 shNC 转染的 A549 中通过 CCK-8 测定进行细胞增殖分析。(K) 在用 shSPATA18 或 shNC 转染的 A549 中进行细胞周期分析。(L) 下调 SPATA18 对伤口愈合的影响。(M) 下调 SPATA18 对迁移和侵袭的影响。(N) 转染过表达 SPATA18 或 shSPATA18 的 A549 中 LysoSensor 和 MitoTracker 的免疫荧光图像。(O) SPATA18对裸鼠A549细胞异种移植的影响。(P) 该图显示了 chr4q12 缺失、SPATA18 下调、线粒体自噬减少和肿瘤生长之间的关联。
03
正常肺组织、AIS/MIA和IAC的蛋白质组学特征
主成分分析(PCA)显示了正常肺组织、AIS/MIA和IAC在RNA和蛋白质水平上的差异谱(图3A),显示了不同阶段肺癌进展的内在差异。
为了探讨肺腺癌发生发展的分子特征,他们进行了基因集富集分析(GSEA)(图3B-C)。正常肺组织主要与细胞粘附、氧运输和类维生素a代谢过程相关(图3B)。其中,正常肺组织中LAMC2、CDH5等高表达蛋白与肺癌患者预后呈正相关(图3D)。AIS/MIA在凝血、补体活化、细胞溶解和脂肪酸β-氧化方面有上调的特征(图3B-C)。在IAC中,主要通路包括MAPK级联、小gtpase介导的信号转导、细胞周期、NIK/NF-κB信号转导、ephrin受体信号转导通路、FGFR信号转导通路和脂肪酸生物合成过程(图3B-C)。同时,AIS/MIA-和iac -富集蛋白均与肺腺癌患者预后较差相关,包括CFB、C2(来自补体活化)、MCM2、YWHAB(来自细胞周期)、TIAL1和GRB2(来自FGFR信号传导)(图3D)。
为了了解EGFR突变在肿瘤发生和进展中的影响,他们随后研究了与EGFR突变相关的显著失调标志。GSEA结果显示,EGFR突变患者与柠檬酸循环(TCA)和NOTCH信号通路相关的蛋白显著富集(图3E-F)。在RNA水平上也观察到类似的趋势(图3F)。从其他三个数据集也检测到EGFR突变组中NOTCH信号的更高富集分数。NOTCH信号的关键调控蛋白NOTCH1对肺腺癌患者的生存有负面影响(图3G)。总的来说,这些结果显示了EGFR突变的下游蛋白质组学特征(图3H)。
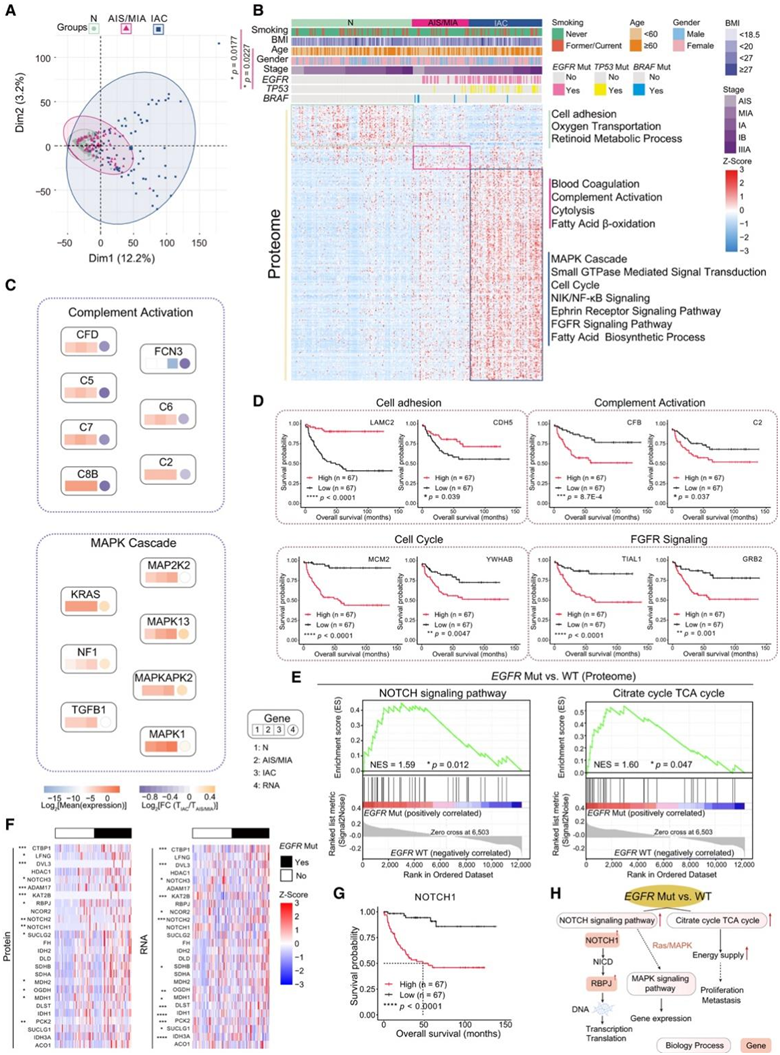
图3. 正常组织、AIS/MIA 和 IAC 的蛋白质组特征。
(A) 正常组织、AIS/MIA 和 IAC 中蛋白质组数据的主成分分析 (PCA)。 (B) 使用正常组织、AIS/MIA 和 IAC 中的蛋白质组数据绘制的富集通路热图。(C) 属于补体激活和 MAPK 级联的基因中的蛋白质水平和 RNA水平。(D)按细胞粘附、补体激活、细胞周期和 FGFR 信号转导相关基因的蛋白质水平分层的OS。(E) 基于按EGFR突变状态分层的蛋白质组数据的基因集富集分析 (GSEA)。(F) 按EGFR突变状态分层的与 NOTCH 信号通路和TCA 循环相关的基因的 RNA 和蛋白质表达水平。(G)按 NOTCH1(NOTCH 信号通路的关键分子)的蛋白质水平分层的 OS。(H) 显示EGFR突变和改变的通路之间相互作用的网络模型。
04
EGFR突变背景下AIS/MIA到IAC的蛋白质组学进化
细胞外基质(ECM)受体相互作用、补体和凝血级联以及内吞作用在egfr突变型AIS/MIA中富集(图4A-B)。当疾病阶段进展到IAC时,典型的EGFR下游信号通路发生激活,如PI3K-Akt、MAPK和mTOR信号通路(图4A-B)。随后,他们比较了两组之间的激酶丰度。AIS/MIA具有较高的MAPK7表达,而IAC与CSNK2A1和MTOR过表达相关(图4C)。随着病情进展到IAC期,DNA复制和自噬发生激活(图4D),相关磷酸化蛋白(如SSB_S366和ULK1_S638)与肺癌患者的预后呈负相关(图4E)。
总的来说,EGFR突变在 AIS/MIA 和 IAC 中发挥着不同的作用(图 4F)。
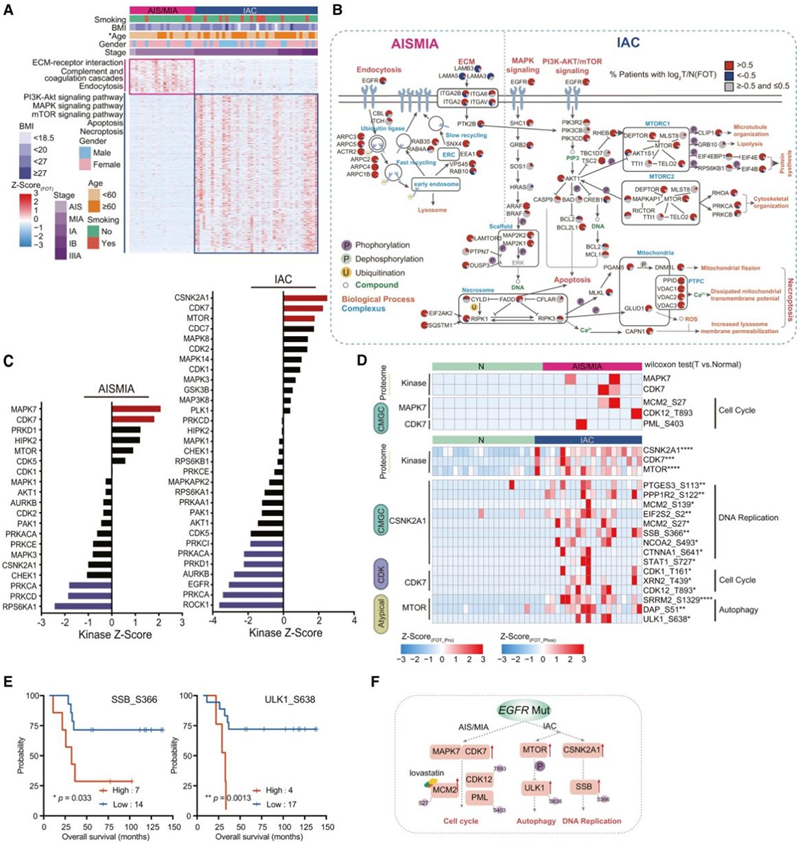
图4. 从EGFR突变体 AIS/MIA 到EGFR突变体 IAC 的蛋白质组学表征。
(A) 在EGFR突变背景下,使用 AIS/MIA 和 IAC 中的蛋白质组数据绘制富集通路的热图。(B) AIS/MIA 和 IAC 中与EGFR突变相关的失调通路概述。(C) EGFR突变体 AIS/MIA 和 IAC 中具有异常表达的蛋白激酶。(D) 上调激酶的蛋白质水平及其下游磷酸化位点。(E)按 SSB_S366 和 ULK1_S638 磷酸化水平分层的OS。(F) 描述 EGFR 突变在 AIS/MIA 和 IAC 中的不同作用的模型。
05
肺腺癌的蛋白质组亚型
他们进行共识聚类来分类蛋白质组亚型,并鉴定了三种亚型(SI、S-II、S-III)(图 5 A)。分类为 S-III 的患者表现出较差的 RFS 和 OS,而分类为 SI 的患者则表现出改善的 RFS 和 OS(图5B)。
他们进一步进行亚型特异性通路富集,以揭示三个亚组之间的不同分子特征。细胞外基质组织、细胞粘附、蛋白水解、白细胞迁移和中性粒细胞脱颗粒在 SI 中富集(图 5C-D)。S-II 主要与细胞外基质组织、细胞粘附、白细胞迁移、中性粒细胞脱粒、Rho 蛋白信号转导、LDL 颗粒介导的信号传导和补体激活的负调节相关(图 5C-D)。S-III的特点是高水平的Wnt信号通路、蛋白酶体介导的泛素依赖性蛋白质分解代谢过程、DNA修复、MAPK级联、自噬、整合素介导的信号通路、细胞周期、脂肪酸代谢过程、TOR信号传导、Toll-如受体信号传导通路和ERBB2信号传导通路(图5C-D)。三种蛋白质组亚型具有不同的分子背景,代表肿瘤进展的不同阶段。
随后,他们进一步研究了三种亚型之间拷贝数变异的差异,结果显示,chr1q21.1、chr5q35.1、chr7p11.2和chr14q13.3扩增在三个亚型中存在差异(图5A),这些扩增的出现预示着更糟糕的生存(图5E)。位于chr7p11.2的SUMF2、EGFR和GBAS是与拷贝数有显著相关性的前三种蛋白(图5F)。这三个基因的SCNA、RNA和蛋白水平从S-I增加到S-III,EGFR的蛋白水平与临床结果呈负相关(图5H)。
为了验证chr7p11.2扩增的效果,他们研究了与EGFR高表达相关的下游通路改变。Wnt信号传导、泛素介导的蛋白水解和细胞周期由EGFR上调(图5I)。因此,chr7p11.2扩增可能导致EGFR上调,最终促进肺腺癌的肿瘤进展(图5J)。
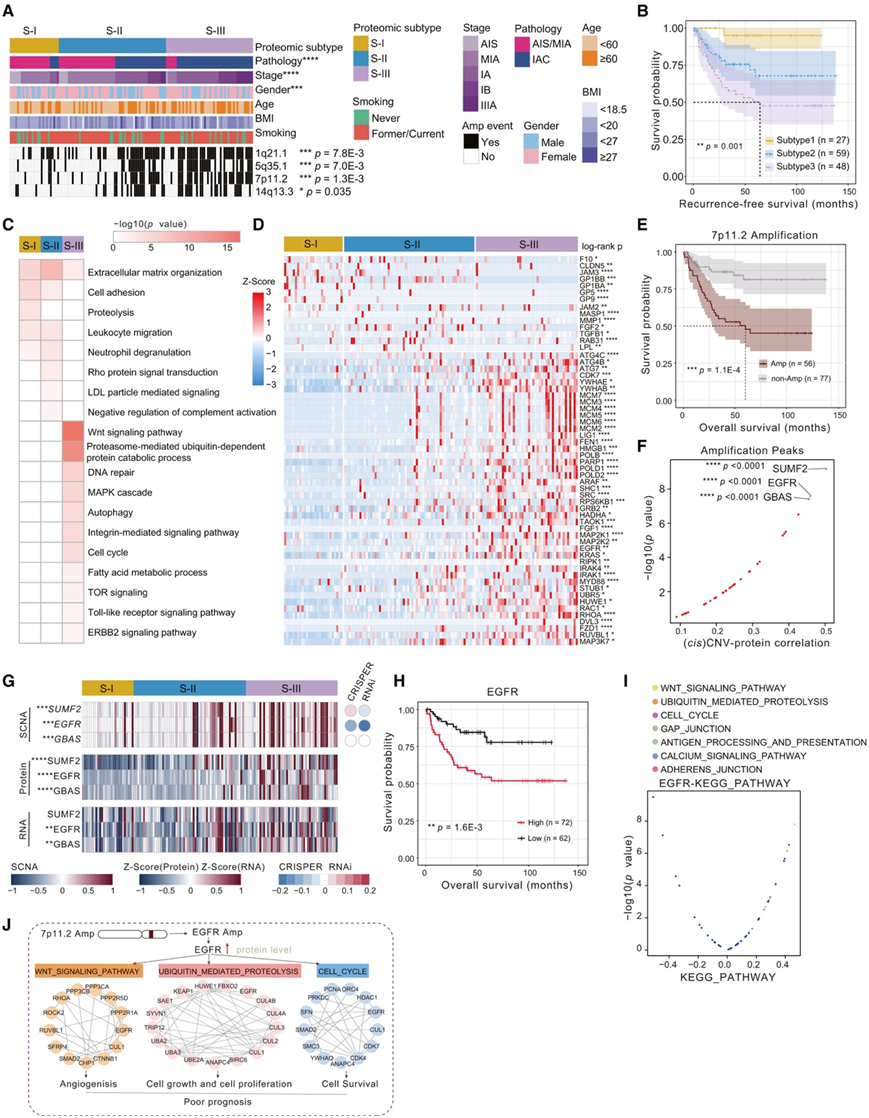
图5. 肺腺癌的蛋白质组亚型。
(A) 热图显示带有临床特征注释的蛋白质组亚型。(B) 比较不同蛋白质组亚型的无复发生存率的 Kaplan-Meier 图。(C) 三种蛋白质组亚型的富集通路。通过基因集变异分析(GSVA)计算富集分数。(D) 蛋白质组亚型之间差异表达蛋白质的热图。(E) Kaplan-Meier 图比较 7p11.2 扩增与否患者的OS。(F) 位于 7p11.2 的基因的拷贝数变异 (CNV)-蛋白质相关性。(G) 三种蛋白质组亚型中 SUMF2、EGFR 和 GBAS 的 SCNA、RNA 和蛋白质水平。(H) Kaplan-Meier 图比较按 EGFR 蛋白水平分层的患者的 OS。(I)与EGFR蛋白水平相关的富集通路。(J) 7p11.2 扩增通过EGFR上调促进肿瘤进展的工作模型。
06
AIS/MIA和IAC的免疫聚类与肿瘤微环境
他们在186个配对肿瘤样本中鉴定出4种不同的亚型(图6A)。Kaplan-Meier分析显示,与其他三种亚型相比,免疫抑制亚型患者的生存率更差(图6B)。大多数内皮细胞亚型患者有AIS/MIA,而大多数免疫抑制亚型患者有IAC(图6C)。他们进一步分析了按EGFR突变状态分层的四种免疫聚类的患病率,四种亚型间EGFR突变无分布差异(图6A)。内皮细胞亚型在EGFR突变组和WT组中AIS/MIA比例最高,免疫抑制亚型在两组中IAC比例最高。在内皮细胞亚型中,包括内皮细胞和中性粒细胞在内的免疫特征突出,如CD34/VWF/KDR/FLT1/LYVE1和CD16B的高表达(图6D),而B细胞亚型显示出更多的B细胞(图6D)。免疫抑制亚型与其他亚型不同,所有免疫细胞和CD分子的表达都很低(图6D)。
为了研究每个亚型的生物景观和功能过程,他们使用转录组和蛋白质组数据进行了基因集变异分析(GSVA)。内皮细胞亚型中的tnf -κB信号通路富集,B细胞亚型中富集的通路包括同种异体移植排斥反应和干扰素γ应答,DC亚型中富集了IL-2 STAT5信号通路和凝血通路,免疫抑制亚型中富集了DNA修复、缺氧、G2M检查点、E2F靶点、MYC靶点和糖酵解相关通路(图6E-F)。
有趣的是,TP53突变和60岁以上的患者在免疫抑制亚型中表现突出(图6A-F)。GSEA表明TP53突变在RNA和蛋白质水平上对DNA复制和碱基切除修复有积极影响(图6G-H)。
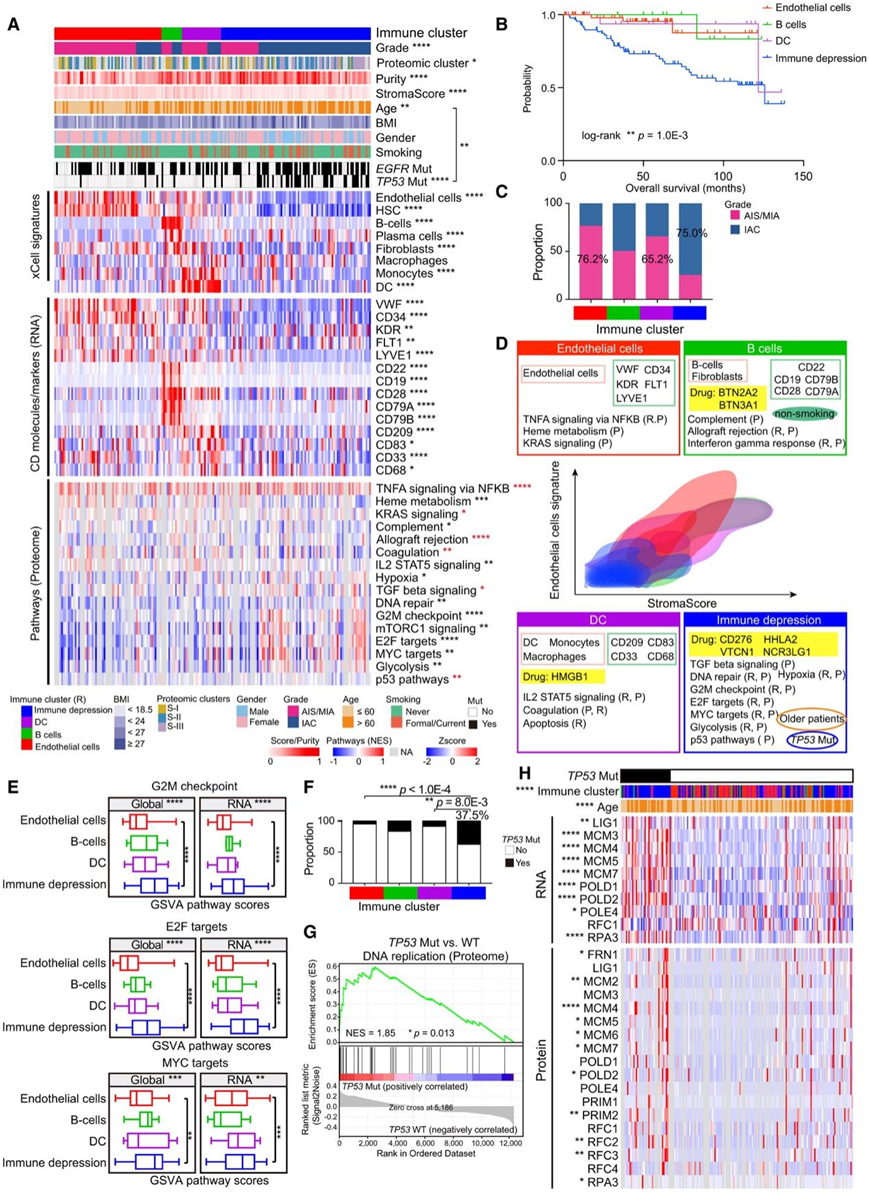
图6. 肺腺癌免疫聚类。
(A) 热图显示蛋白质组图谱,包括 xCell 特征、CD 分子 (RNA)、潜在可靶向的免疫检查点和四个不同免疫聚类中的富集通路(蛋白质组)。(B) 比较四个免疫聚类的OS的 Kaplan-Meier 图。(C) 四个免疫聚类中 AIS/MIA 和 IAC 的比例。(D) 基于基质评分和内皮细胞特征的密度等高线图。(E) 基于四个免疫聚类中的蛋白质组和转录组数据,通过GSVA计算出的 G2M 检查点和 E2F 靶信号转导富集分数的分布。(F)四个基于 RNA 的免疫聚类中TP53突变的比例。(G) 基于按TP53突变状态分层的蛋白质组数据的GSEA。(H) 根据TP53突变分层的 DNA 复制和碱基切除修复基因中 RNA 和蛋白质的分子谱。
+ + + + + + + + + + +
结 论
本项研究发现chr4q12 的缺失通过下调 SPATA18 从而抑制线粒体自噬并促进细胞侵袭,从而促进从浸润前腺癌进展为浸润性腺癌。蛋白质组学揭示了正常肺组织以及浸润前和浸润性腺癌中多种丰富的通路。蛋白质组学分析确定了三种蛋白质组亚型,它们代表了肿瘤进展的不同阶段。本项研究还发现了四种免疫聚类的分子特征,包括内皮细胞、B 细胞、DC 和免疫抑制亚型。总之,这项全面的蛋白质组学研究描述了从浸润前到浸润性肺腺癌的分子结构和标志,为更深入地了解这种疾病的肿瘤发生和进展提供了新的理论依据。
+ + + + +



 English
English


