文献解读|Cancer Cell(50.3):滤泡性淋巴瘤的多组学分析揭示了高危患者组织结构的变化和基质重塑的增强
✦ +
+
论文ID
原名:Multi-omic profiling of follicular lymphoma reveals changes in tissue architecture and enhanced stromal remodeling in high-risk patients
译名:滤泡性淋巴瘤的多组学分析揭示了高危患者组织结构的变化和基质重塑的增强
期刊:Cancer Cell
影响因子:50.3
发表时间:2024.02.28
DOI号:10.1016/j.ccell.2024.02.001
背 景
滤泡性淋巴瘤 (FL) 是一种通常无法治愈的恶性肿瘤,由发育受阻的生发中心 (GC) B 细胞演变而来。FL的B 细胞表现出基因组和表观基因组的改变,这些改变能够实现免疫逃逸、细胞凋亡抵抗、疾病进展,以及在某些患者中的组织学转化。肿瘤微环境 (TME) 在整个疾病过程中在支持恶性细胞的存活方面发挥着不可或缺的作用。重要的是,目前没有任何一种方法可以描述淋巴结 (LN) 的细胞组成,也不能识别与 FL 患者生存不良相关的转录组和组织学特征。
实验设计
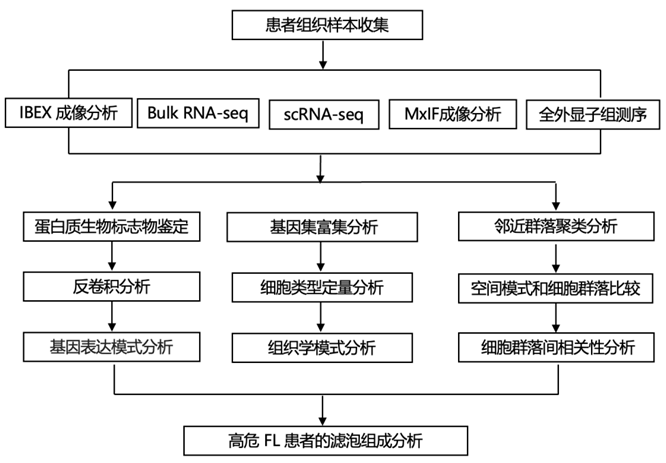
结 果
01
利用多种淋巴组织来源的数据建立细胞和组织水平图谱
为了创建正常和FL的图谱,研究团队使用了最先进的测序和迭代漂白扩展多重性(IBEX)成像(图1)。该研究检测了一项正在进行的临床试验的切除性LN活检[NCT03190928]、肠系膜LN (nLN1-2)和反应性LN (rLN1)。临床队列包括从研究开始至少2年未进展、2年内进展或早期复发的FL患者(∗)(图1A)。对FL患者治疗前的切除活检标本进行bulk 转录组分析(bulk RNA-seq)、单细胞转录组分析(scRNA-seq)、IBEX成像分析,并制备福尔马林固定石蜡包埋(FFPE)样本用于常规病理诊断和多重免疫荧光(MxIF)成像(图1B)。使用核标记物Hoechst和39种抗体在平均4-12 mm2的感兴趣区域靶向不同类型的细胞进行IBEX成像。该方法揭示了独特的组织学模式,可以使用从IBEX数据中鉴定的关键标记物在临床相关FFPE样本的更大区域(~ 37-115 mm2)中进行检测(图1C-D)。整合了几种方法,从而构建了跨尺度和模式的正常和恶性LN的分子和细胞图谱(图1E)。为了检验发现队列空间发现的有效性,他们在一个更大的队列中使用Cell DIVE和染料失活方案(这里和整个队列称为Cell DIVE-IBEX)进行了全玻片成像(约7 ~ 180 mm2)分析(图1E)。
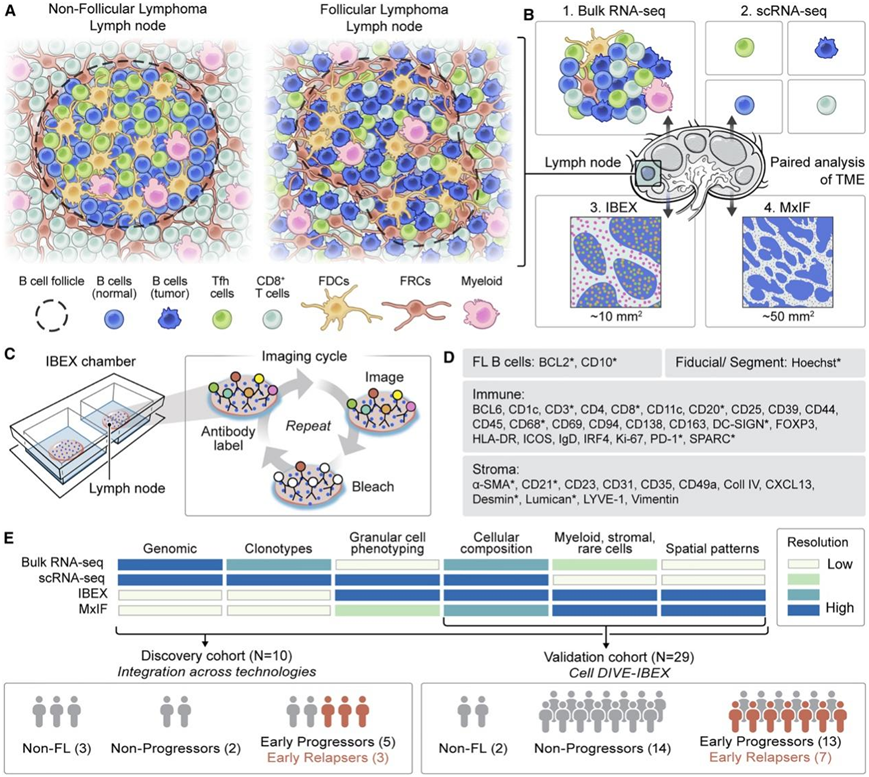
图1. 使用多种组学和成像技术构建 LN 图集。
(A) 对非 FL 和 FL LN 的组织进行分析。(B) 使用多种测定法对来自正常和 FL 患者的配对样本进行分析。(C) IBEX 成像技术示意图。(D)按细胞类型分组的IBEX或MxIF靶向蛋白生物标志物(∗)。(E)比较每项技术为每一队列提供的资料。
02
FL 异质性的基因组和转录组表征
他们首先通过全外显子组测序和bulk RNA-seq评估了肿瘤 B 细胞的基因组和转录组景观。除了编码抗凋亡蛋白 BCL2 的基因中预期的易位外,在先前与 FL 发病机制相关的反复突变基因中还发现了多种遗传损伤(图 2A)。染色质修饰基因如KMT2D、EZH2、ARID1A和CREBBP,以及参与细胞迁移和免疫调节的基因(CXCR4、TNFRSF14、CIITA)在进展者和非进展者中均观察到改变(图2A)。接下来,他们对来自bulk RNA-seq的数据采用反卷积算法评估了FL样本的细胞组成(图2B)。B细胞是最丰富的细胞类型,占整体分析中反卷积细胞的60%以上。骨髓细胞和基质细胞占每个样本比例不到2%,使用谱系特异性基因将其大致分为巨噬细胞、单核细胞、成纤维细胞和内皮细胞。除了分析FL患者样本的细胞组成外,基于优势免疫球蛋白(Ig)序列的部分,从bulk RNA-seq中鉴定出恶性B细胞受体(BCR)序列(图2C)。从bulk RNA-seq和scRNA-seq中鉴定出的恶性Ig谱在除FL-1外的所有样本中都显示出相似的单克隆Ig分布,这证实了使用bulk RNA-seq解构B细胞克隆型的实用性。
为了在单细胞分辨率下评估基因表达谱,他们对来自同一队列FL患者的样本进行了scRNA-seq,还将研究扩展到健康的LN,作为LN图谱构建工作的对照和潜在资源(图2D-F),淋巴细胞种群在不同样本中的相对丰度不同(图2F)。这些细胞群包括幼稚滤泡B细胞(MS4A1、CD19、FCER2和SELL)、GC B细胞(CD83、GMDS、AICDA、BCL6和CD81)、循环B细胞(MK167、UBE2C和CD81)和肿瘤B细胞(BCL2、MME和TCF4),仅在FL样本中发现(图2E-F)。T细胞分析显示CD4和CD8 T细胞亚群包括T调节细胞(Tregs、FOXP3、CTLA4、IKZF2和TIGIT),T滤泡辅助细胞[Tfh、PDCD1 (PD-1)、ICOS、 TOX2和TIGIT],以及表达几种细胞毒性(GZMA、PRF1和NKG7)和衰竭/激活相关[LAG3、HAVCR2 (TIM-3)、TIGIT]标志物的不同CD8+ T细胞群。这些“耗竭的CD8+ T细胞”在非FL患者中几乎不存在,但在FL患者的rLN1和LN中富集,提示这些组织中存在慢性炎症反应(图2F)。
通过scRNA-seq评估骨髓和间质群体通常需要专门的组织分离和细胞富集方案,这增加了基因表达谱改变的风险。虽然浆细胞样树突状细胞(IRF7、ITGAE、ITM2C、PLAC8和TCF4)、巨噬细胞(C1QA、IL1B和ITGAX)、cDC1 DC(C1orf54、CADM1和CLNK)和滤泡树突状细胞(FDC) (CR2、CXCL13和FDCSP)仅占总细胞的一小部分,但在正常和FL样本中以不同的频率分布(图2D-F)。
基因集富集分析显示,早期复发者中上调的主要通路均涉及 BCR 信号传导(图 2G)。接下来,他们将早期复发者的 B 细胞与所有其他 FL 患者的 B 细胞进行了比较。与之前一样,早期复发者的 B 细胞上调了 BCR 信号通路的成分以及参与细胞因子信号传导、免疫激活和免疫调节的分子(图 2 H)。他们还观察到与谷氨酸信号传导相关的基因组的富集,包括参与葡萄糖和谷氨酰胺代谢的转运蛋白(SLC38A1、SLC2A3、SLC38A2和SLC2A1)和酶(GLUL和GLS)。早期复发者的 B 细胞表现出参与细胞外基质 (ECM) 重塑的基因的高表达,包括编码生长因子、ADAM、膜联蛋白和半乳糖凝集素的基因(图 2H)。
他们还评估了与 FL 患者不良预后相关的基因特征以及其他血液恶性肿瘤中失调的 IRF4 相关分子特征(图2I)。早期复发者的 B 细胞中与高进展风险相关的基因转录本水平升高,然而,在 Huet 模块总结的各个基因的表达中观察到相当大的患者间异质性(图 2 I)。
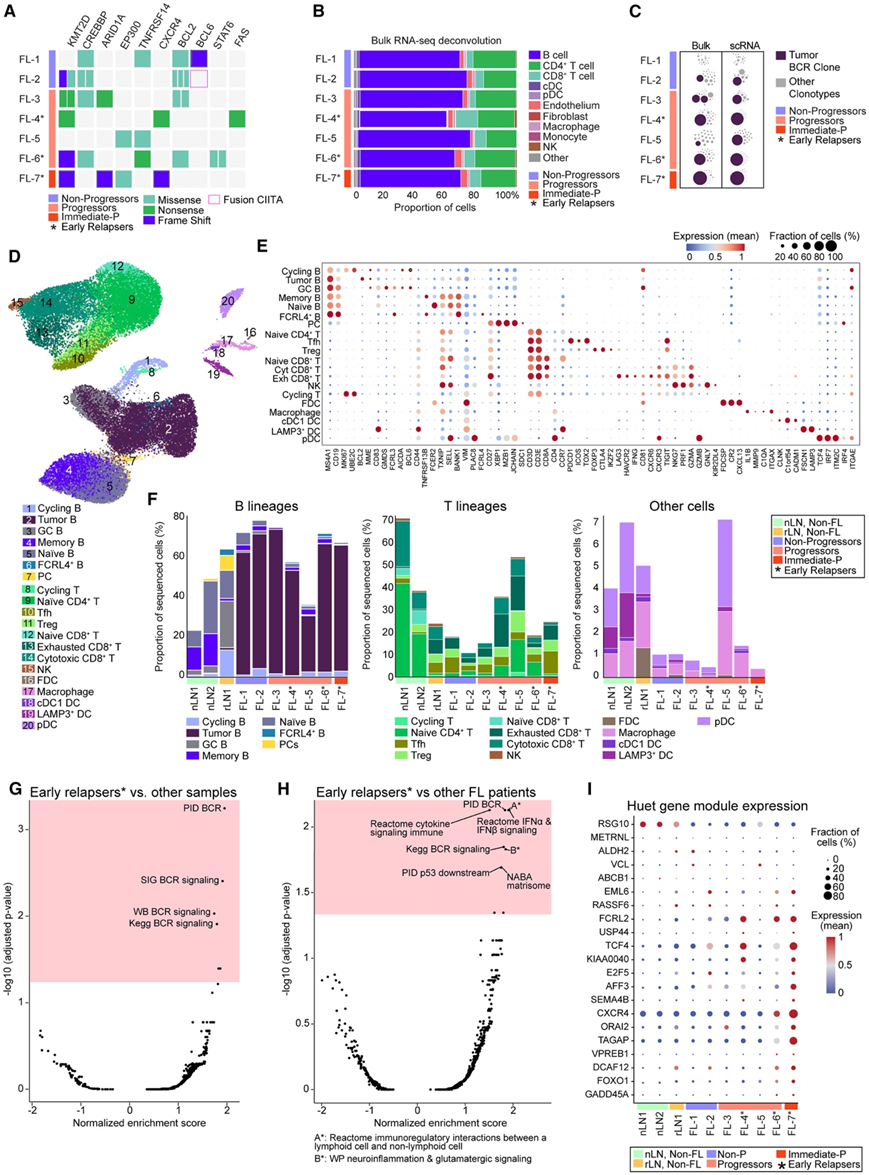
图2. 正常和 FL 样本的细胞组成和基因表达模式。
(A) 基因组改变景观。(B) 根据bulk RNA-seq 数据重建细胞组成。(C) RNA-seq 中的 BCR 调用。(D) 所有样本中 36212 个单细胞的 UMAP 图。(E) 用于 scRNA-seq 聚类的细胞注释的选定标记的表达。(F) 每个患者指定细胞类型频率。(G) 与所有其他样本相比,早期复发者 (*)的 B 细胞的基因集富集分析。(H) 与(G)相同,但仅将早期复发者的 B 细胞与其他 FL 样本进行比较。(I) 与 Huet 基因特征相关的单个基因的动态表达。
03
使用 IBEX 以单细胞和空间分辨率对多种细胞类型进行定量
为了提供在正常和 FL LN 中观察到的细胞异质性的空间背景,他们对来自该初始队列的组织样本进行了IBEX 成像分析(图 3 A),鉴定了 37 个表型聚类,产生了1.8 × 10 6个细胞的单细胞蛋白质组数据集(图 3 B-C)。IBEX 成像揭示了 FL 样本中 B 和 T 细胞群的多样性(图3A-E)。
他们开发了一种基于图像掩模的创建来分析骨髓和基质细胞的方法,该图像掩模使用像素级数据而不是离散的分段细胞。使用指示的标记物对骨髓和基质谱系进行细胞定量,并按成像区域对样本进行标准化(图3F-I)。通过这种方法,他们评估了先前在FL中发现的血液内皮细胞、淋巴内皮细胞、FDC和产生CD49a细胞因子/趋化因子的纤维母细胞网状细胞(FRC)的位置和相对丰度(图3F-I)。定量成像显示这些细胞类型远比常规组织分离方法所发现的要丰富(图3G-I)。结果数据强调了在完整组织中研究复杂细胞类型的重要性。
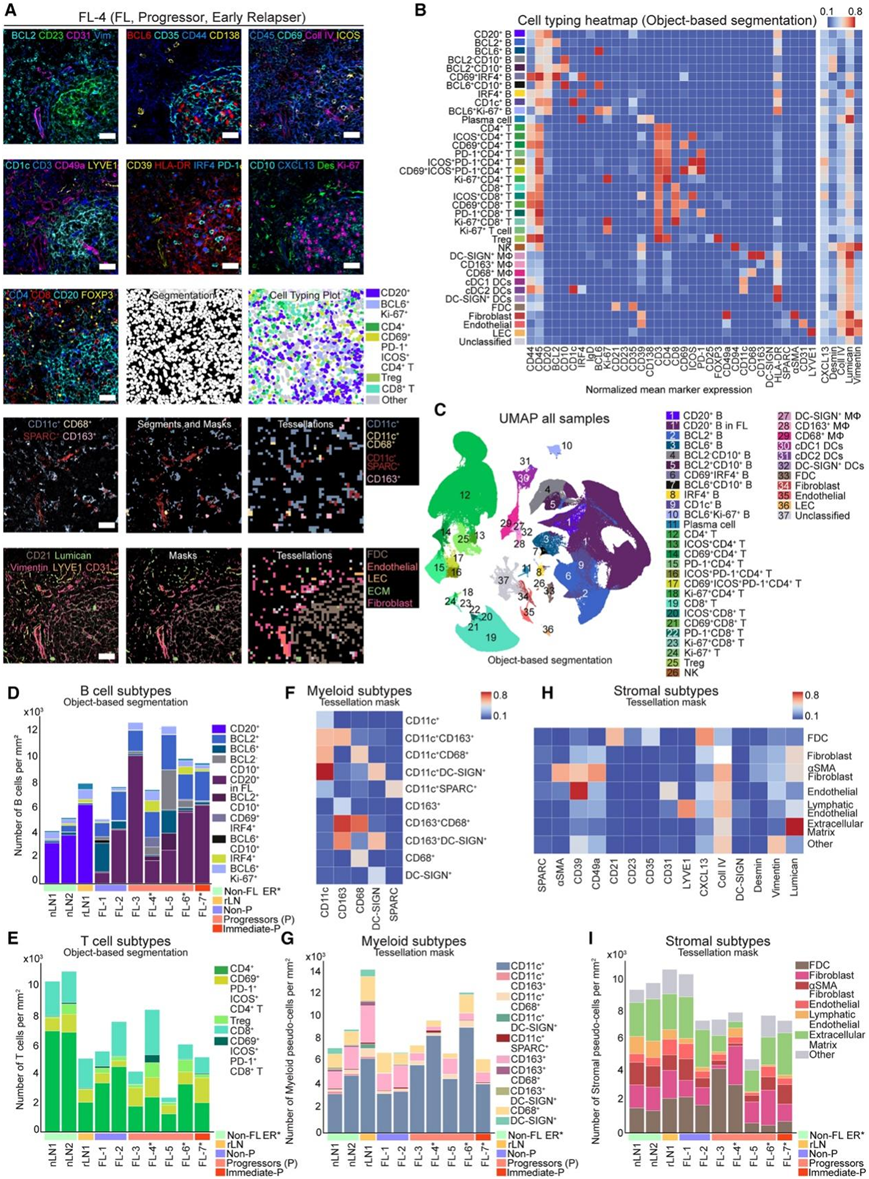
图3. 使用 IBEX 对复杂组织进行空间分析。
(A) 所选标记的代表性 IBEX 图像。(B) 用于定义细胞群的标准化平均标记表达的热图。(C) 来自所有样品的 0.9 × 106个细胞的 UMAP 图,由 IBEX 识别的细胞群着色。(D–E) 对从 IBEX 获得的 B 细胞或 T 细胞亚群进行定量。(F)骨髓细胞表型的生物标记物表达的热图。(G) 从 IBEX 获得的骨髓亚群的定量。(H)基质细胞表型生物标志物的表达热图。(I) 对从 IBEX 获得的基质亚群进行定量。
04
高危 FL 患者中发现的独特组织学模式
B细胞滤泡的数量和大小各不相同,并将其鉴定为CD20+CD21+结构。进一步的分析显示,在FL样本的肿瘤滤泡中,CD8+ T细胞、可溶体巨噬细胞(CD11c+ SPARC+、CD11c+ CD68+)和FDC(CD21+ CD23+ CD35+的组合)存在差异(图4A-B)。非FL淋巴结的次级滤泡富含GC (BCL6+Ki-67+) B细胞,滤泡辅助性T细胞(Tfh: CD3+CD4+CD69+PD-1+ICOS+)和巨噬细胞(图4B)。早期复发患者有几种不同的模式,包括desmin+成纤维细胞在B细胞滤泡周围和内部扩张(图4C)。相比之下,DC-SIGN通常在髓质和包膜下窦的CD163+巨噬细胞上发现,而在正常LN的次级滤泡中不存在(图4C)。
在所有3例早期复发患者中发现的组织学模式——B细胞滤泡周围的desmin+ FRC扩增和滤泡内的DC-SIGN+细胞——在治疗前开始出现在1例非进展者(FL-2)中(图4C)。有趣的是, scRNA-seq分析显示,该患者中Huet基因模块的表达高于其他早期进展者(图2I)。
总之,IBEX显示了TME髓系和基质成分的变化,具有诊断和预测潜力。
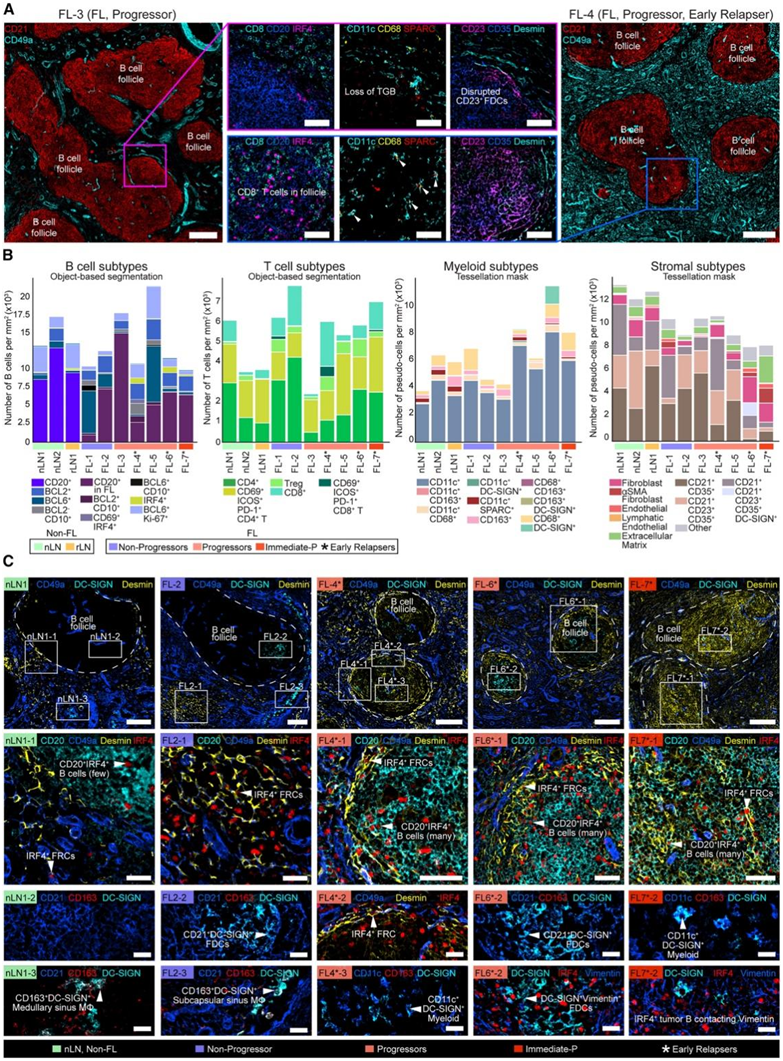
图4. 次级滤泡和肿瘤滤泡的细胞组成和组织学模式。
(A) IBEX 图像描绘了 FL 患者 B 细胞滤泡的形状和细胞组成差异。(B) B 细胞滤泡内发现的主要 B、T、骨髓和基质细胞的定量。(C) IBEX 图像描绘了早期复发者共有的组织学模式。
05
恶性肿瘤中 LN 细胞组成发生显著改变
他们使用图神经网络编码方法和 K 均值聚类评估了 IBEX 图像中存在的细胞生态系统,以识别包含相似细胞类型和分布的各个邻域。细胞间相互作用在示意性相互作用图上可视化,其中包括使用指定标记通过基于对象的分割识别的 8 种细胞类型、13 种基质掩模和 5 种骨髓掩模(图5A-B)。最终的方法产生了15个以每个群落的优势细胞类型命名的群落(图5A-B),将非FL的解剖结构划分为离散的群落,例如GC (B1)和地幔带(B2)(图5A-C)。相反,FL LN缺乏正常LN的标志结构(图5C)。B细胞富集聚类(B1-B2)主要位于非FL细胞的滤泡内(图5F)。所有其他B细胞富集聚类均分布在滤泡内和滤泡外(B3-B5),其中B3和B4在非FL细胞中基本缺失,并在某些进展者中扩增(图5E)。
大多数T细胞富集群落位于滤泡内皮层和/或副皮层(T2-T6);然而,在FL和非FL的滤泡内都发现了一个群落(T1)。其余群落为髓系(M1-M2)和间质(S1-S2)富集的聚类,与髓系和皮质旁窦等解剖结构相对应(图5E-F)。在非滤泡和滤泡样本中,继发性和肿瘤性滤泡的群落组成各不相同(图5G)。然而,单个滤泡在样品内比样品之间更相似(图5G-H)。因此,先进的图像分析鉴定了正常LN中存在的细胞群落,这些细胞群落在恶性肿瘤中发生了改变。
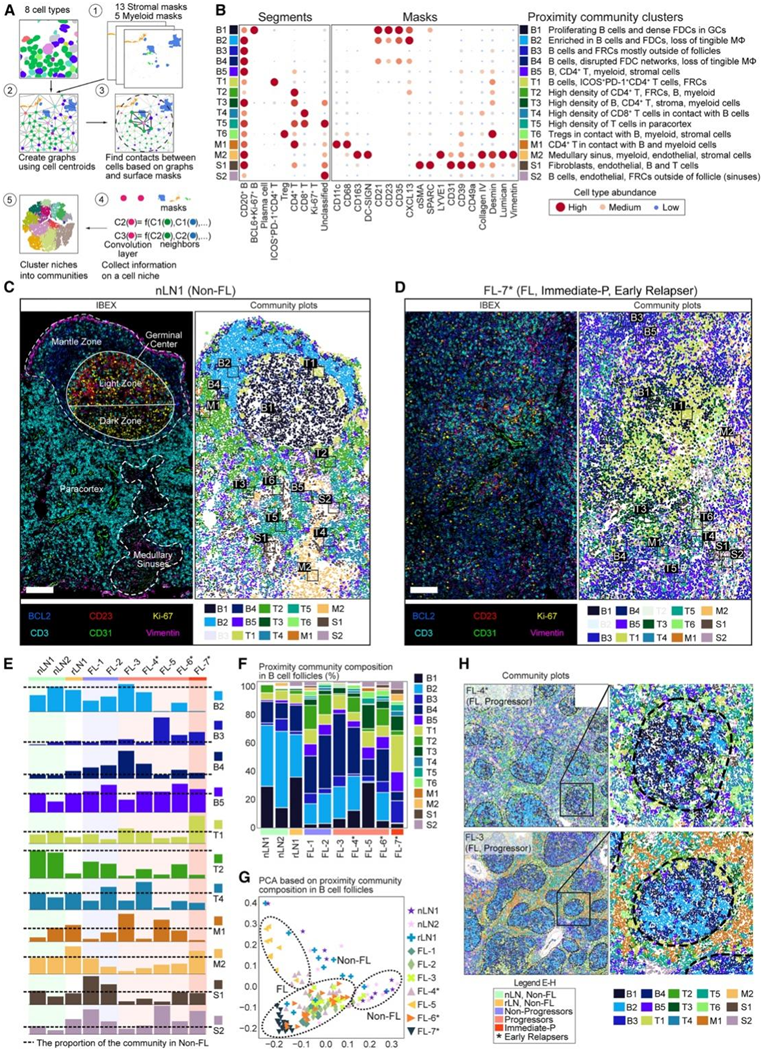
图5. 细胞群落在正常淋巴结中是共有的,但在肿瘤中是不同的。
(A) 邻近细胞群落聚类分析。(B) 左:热图显示每个邻近群落聚类中识别的细胞类型的相对内容。右:热图显示指定细胞群落邻近半径内的骨髓和基质掩模的比例。(C) 非 FL LN 以及相应的伪彩色群落图。(D) FL LN 以及相应的群落图伪彩色群落图。(E) 条形图显示了 IBEX 在整个成像部分识别出的最丰富的邻近群落。(F) B 细胞滤泡中 IBEX 识别的邻近群落的比例。(G) 基于主成分分析 (PCA) 的所有正常和 FL 样本中 B 细胞滤泡群落的分布。(H)来自指定患者的细胞群落图。
06
跨成像模式保留空间模式
他们使用感兴趣的关键标记将本项研究扩展到更大的组织切片。基于 IBEX 数据设计的多重成像面板应用于 FFPE 样品的连续切片。图像采集后,评估了 IBEX 小感兴趣区域 (ROI) 和 MxIF 大 ROI 之间组织病理学模式的保守性。通过 IBEX 成像鉴定出具有丰富滤泡 CD8+ T 细胞和 DC-SIGN+FDC 群体的样品,通过 MxIF 证实具有这些独特的细胞类型(图 6 A)。在具有不同抗体克隆的 FFPE 组织切片中还证实了早期复发者和非进展者的滤泡周围存在desmin+基质细胞(图 6 B)。
采用聚集聚类方法将滤泡细分为7个亚型,并在IBEX和MxIF图像之间比较其分布(图6C-D)。一般来说,来自同一供体的IBEX和MxIF图像具有相似的滤泡形状和大小(图6E)。
他们观察到小IBEX ROI和大FFPE ROI的滤泡组成之间的一致性(图6E),他们使用与图5中概述的方法相似的方法评估了这些组织的群落组成。根据11个与主要细胞系和关键解剖结构相对应的共同标记来定义细胞群落。结果,使用IBEX和MxIF数据获得了13个群落聚类(图6F-G)。群落分析提供了定性和定量的方法来评估样本和成像方式的相似性(图6H-I)。两名早期复发患者(FL-6, FL-7)的IBEX和MxIF图像均显示T细胞富集群落(T1, T2)减少,与CD4+ T细胞接触的B细胞比例增加(B1)(图6H)。为了提供一种度量来估计组织图像的面积以进行准确采样,他们基于不同大小的ROI评估了平均镶嵌相关性(图6J)。获得的相关性大于0.8,表明IBEX ROI相当具有整个组织切片的代表性。
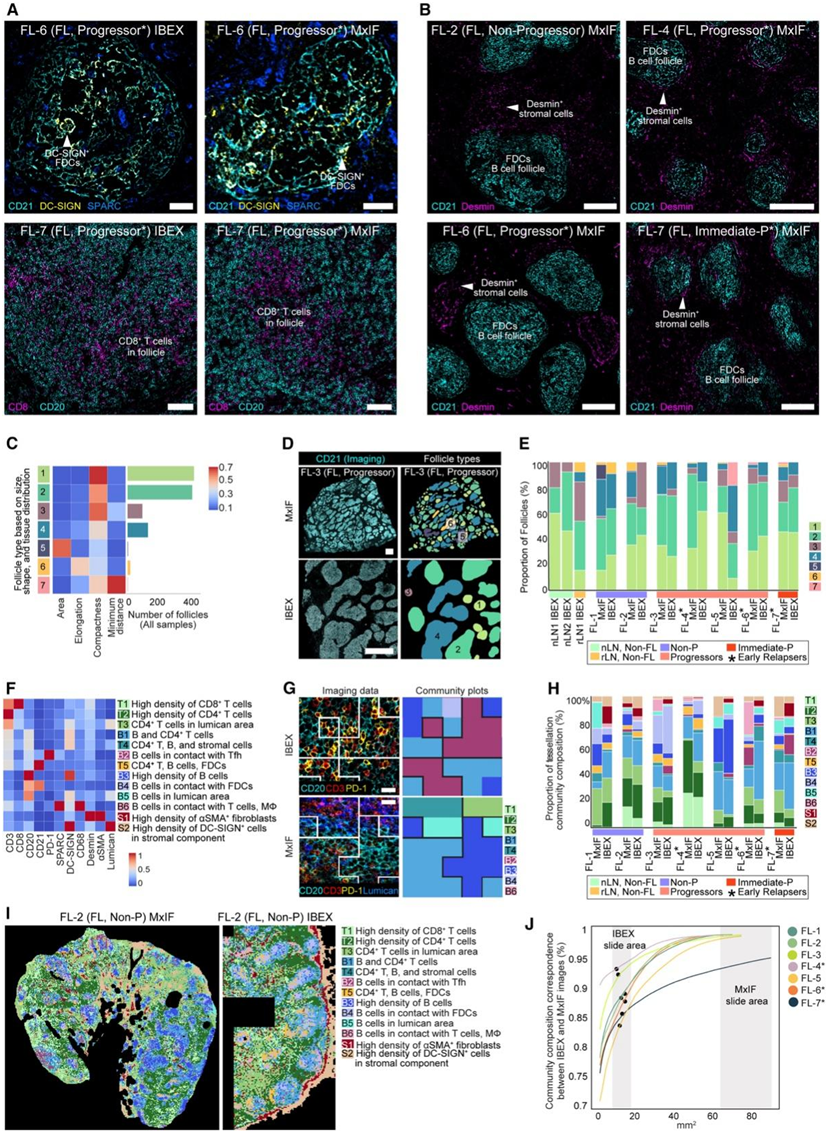
图6. IBEX 和 MxIF 图像之间的空间模式和细胞群落比较。
(A) 指定患者的 IBEX 和 MxIF 图像的比较。(B) MxIF 样品的共聚焦图像。(C) 显示所有样本的滤泡类型的热图。(D) 代表性 IBEX 和 MxIF 图像中的滤泡组成。(E) IBEX 和 MxIF 成像样本的滤泡组成。(F) 用于检测镶嵌细胞群落的标记的每个镶嵌方形的平均掩模百分比的热图。 (G) IBEX 和 MxIF 图像以及相应的镶嵌掩模。(H) 镶嵌群落图显示 IBEX 和 MxIF 图像之间的对应关系。(I) 来自一个代表性 FL 样本的镶嵌群落图。(J) IBEX 和 MxIF 群落组成的相似性百分比取决于成像和分析的组织区域。
07
数据整合揭示骨髓细胞和基质细胞采样不足
为了根据从最初队列中收集的样本中收集的数据创建参考图集,他们采取了多种途径来利用每种技术的优势,同时克服特定于平台的限制。通过反卷积、scRNA-seq 细胞分型以及使用细胞分割和掩模的 IBEX 图像分析,比较了通过bulk RNA-seq 鉴定的主要细胞群的相对丰度(图7 A)。不同技术观察到的主要淋巴细胞群比例相似(图 7A)。IBEX 图像的细胞数量是配对 scRNA-seq 数据集的 36 倍,这提升了研究稀有细胞的可能性(图 7 B)。
由于细胞因子和趋化因子对于正常组织和恶性肿瘤诱导的重塑至关重要,他们接下来评估了从bulk RNA-seq 中提取的基因特征与源自 IBEX 图像的细胞群落之间的相关性(图 7 C-D)。鉴于早期复发者中 ECM 重塑的基因和蛋白质水平证据(图 2 H 和图4 C),他们研究了与纤维化相关的基因特征,包括基质金属蛋白酶、胶原蛋白沉积和成纤维细胞(图 7 C)。T2群落富含表达CD49a (ITGA5)和结蛋白(Des)的FRC,主要发现于非FL淋巴结的旁皮质和两个早期复发患者的滤泡。T1群落与B细胞抗体产生、Th2免疫和T细胞衰竭相关的基因特征相关(图7C-D)。
scRNA-seq分析显示,来自两名早期复发患者(FL-4, FL-7)的FL B细胞中CCL4和CXCL13-CXCR5基因对升高(图7E-G)。LAG3 CD8+ T细胞仅存在于rLN1和FL LN中(图2F),CCL4-CCR5、CCL5-CCR5和CXCL13-CXCR5基因对水平升高(图7E-G)。
他们使用IBEX成像确认FL患者中存在CXCL13+ FL B细胞,以及CXCL13+ FDC和CD49a+ FRC扩增(图7H)。最后,在早期复发患者的滤泡周围发现密集的lumican+纤维网络(图7I)。
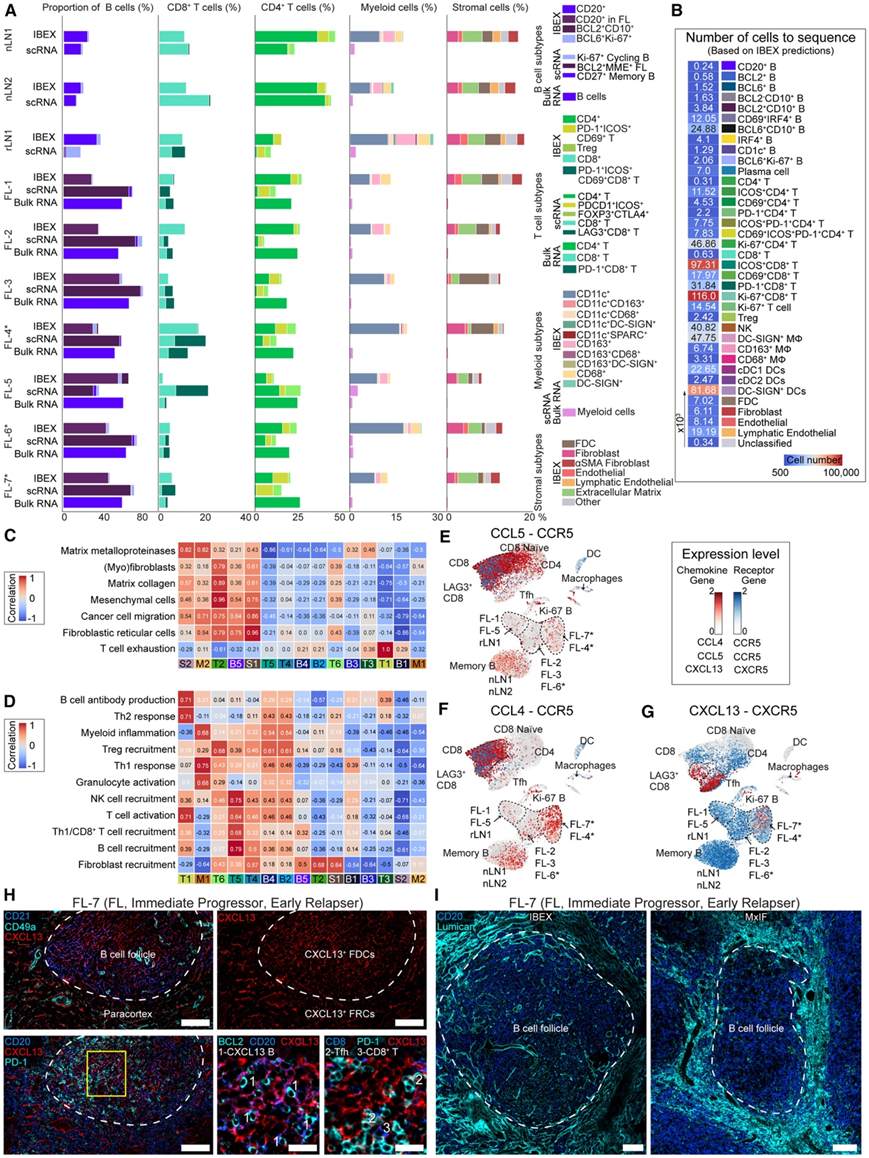
图7. 数据集成揭示了 FL TME 中基质欠采样和重构的程度。
(A) 通过bulk RNA-seq (Bulk RNA)、scRNA-seq (scRNA) 和IBEX 检测的主要细胞群的百分比。(B) 热图显示了通过 scRNA-seq 分析的估计细胞数量。(C) 热图显示通过bulk RNA-seq 检测的成纤维细胞基因特征表达与图 5中描述的邻近群落聚类之间的相关性。(D) 热图显示通过bulk RNA-seq 检测的细胞因子基因特征与图 5中描述的邻近群落聚类之间的相关性。 (E-G) UMAP可视化。(H) IBEX 图像显示 CXCL13+ FDC 和 FRC。(I) 患者样本中 ECM 扩张的 IBEX 和 MxIF 图像。
08
高风险患者的特征是结构变化和基质重塑增强
接下来,他们使用 Cell DIVE-IBEX 方法对 FFPE 标本进行了全玻片成像。他们将滤泡定量分析从1041个滤泡扩展到4681个滤泡,揭示了由6个与滤泡的大小、形状和分布相关的参数定义的5个聚类(图8A-D)。一般来说,非进展者和早期进展者表现出更多的滤泡临近分布,其特征是相邻滤泡之间的最小距离减少。虽然观察到形态连续,但早期复发的肿瘤滤泡往往更小,形状不规则,距离更远,如4型滤泡(图8D)。当对早期复发患者和未复发的进展患者的样本进行FL-5分析时,观察到滤泡组成的差异(图8D)。值得强调的是,在未经治疗的患者队列中,这些组织学模式在首次进展和首次复发前平均20个月活检时就存在(图8E)。
除了量化FL TME中的架构变化外,他们还将前面描述的镶嵌群落工作流程应用于Cell DIVE-IBEX图像(图8F-M)。
CD68+巨噬细胞与肿瘤B细胞之间的接触由M1和M1捕获,早期复发的DC-SIGN 巨噬细胞群落略有增加(图8H-I)。
他们证实了最小基质参与的B细胞群落(B1)的丧失,以及由B细胞、成纤维细胞和ECM组成的细胞群落(S3)的相应增加,分布在整个组织切片上(图8K-M)。
为了确定早期复发的主要驱动因素,他们使用16个细胞群落的每个组合构建了一个线性模型(图8N-P)。区分早期复发患者和其他FL患者最重要的模型包括3个富含desmin+vimentin+成纤维细胞的基质群落(S1、S4和S3)和ECM相关蛋白,包括lumican和富含半胱氨酸的酸性分泌蛋白(SPARC),一种由巨噬细胞、内皮细胞和参与细胞-基质相互作用的基质细胞表达的蛋白。巨噬细胞富集的免疫群落,包括DC-SIGN亚群,是显著模型中第二富集的群落(图8O)。然而,S1和S4群落是识别早期复发患者的关键驱动因素,因为在S1或S4群落中,这些患者的比例较高(图8P),因此这些患者可能有两种不同的复发机制。
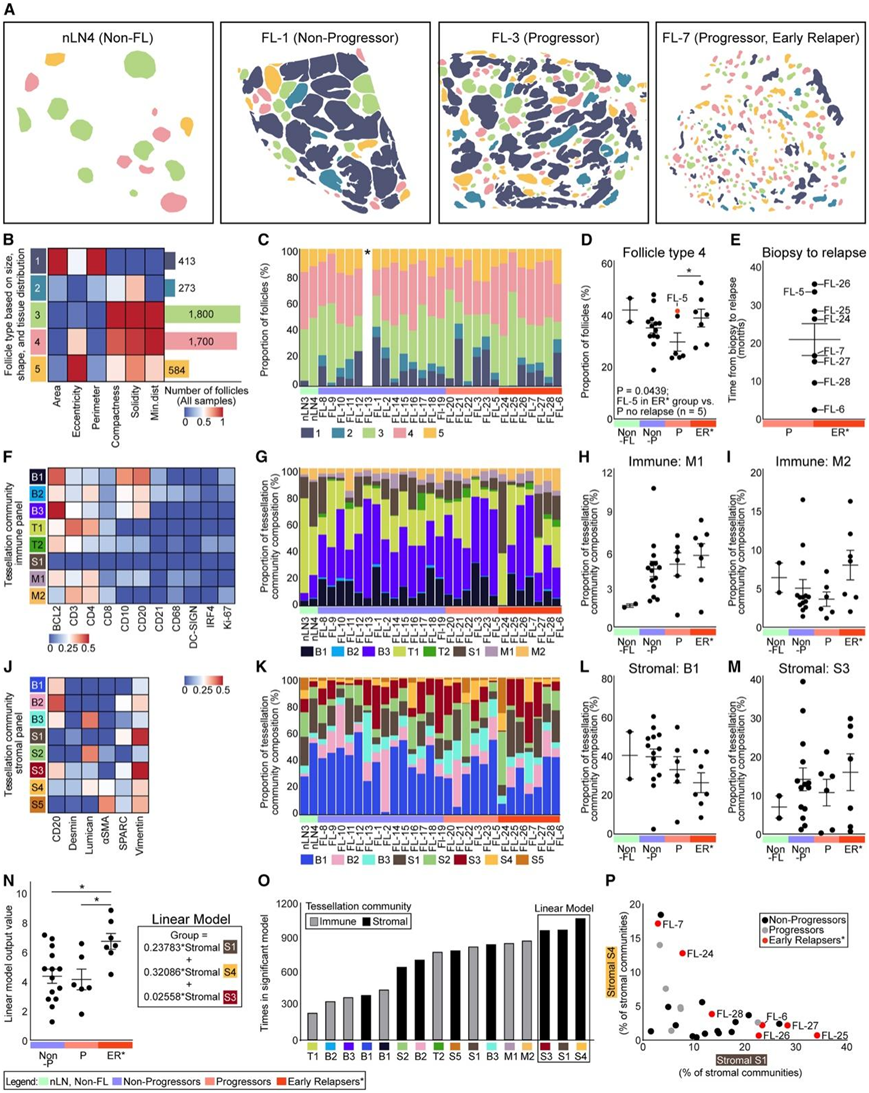
图8. 高危 FL 患者滤泡组成的变化和基质重塑的增加。
(A) 基于 Cell DIVE-IBEX 图像和 B 中的分类的滤泡组成。(B) 基于指定参数的滤泡类型热图。(C) 所有样品的滤泡组成。(D) 对早期复发者进行分析的所有 FL-5 样本中 4 型滤泡的比例。(E) 指定患者从活检到复发的时间(月)。(F) 每个镶嵌方块的平均掩模百分比的热图。(G) (F) 镶嵌群落图,描绘 M1 比例的图表。(H) 每个样本的 M1 镶嵌群落的比例。(I) 每个样本的 M2 曲面细分群落的比例。(J) 基质面板的每个镶嵌方块的平均掩模百分比的热图。(K) (J) 中的镶嵌群落图。描绘 B1 比例的图表。 (L) 每个样本的 B1 镶嵌群落的比例。(M) 每个样本的 S3 曲面细分群落的比例。(N) 区分早期复发者和其他 FL 患者的显著广义线性模型的描述和统计分析。(O) 群落按其在显著模型中出现的次数进行排序。(P) 基于 K 中 S4 和 S1 群落比例的样本分布。
+ + + + + + + + + + +
结 论
使用多模式策略,本项研究分析了参与前瞻性临床试验的 FL 患者的细胞内在和外在因素,这些因素控制着 FL 患者的进展和治疗结果。通过利用每个平台的优势,确定了一些肿瘤特异性特征和微环境模式,这些特征和微环境模式在经历早期复发的个体(最高风险的 FL 患者)中富集。这些特征包括基质结缔组织增生和首次进展和首次复发前 20 个月出现的滤泡生长模式的变化。
+ + + + +



 English
English


