文献解读|Cell Rep Med(14.3):外周 T 细胞淋巴瘤的基因组和转录组分析揭示了不同的分子和微环境亚型
✦ +
+
论文ID
原名:Genomic and transcriptomic profiling of peripheral T cell lymphoma reveals distinct molecular and microenvironment subtypes
译名:外周 T 细胞淋巴瘤的基因组和转录组分析揭示了不同的分子和微环境亚型
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.02.12
DOI号:10.1016/j.xcrm.2024.101416
背 景
外周 T 细胞淋巴瘤 (PTCL) 是一组异质性非霍奇金淋巴瘤,其临床、表型和遗传特征各不相同。人们对 PTCL 中肿瘤微环境的分子发病机制和作用知之甚少,可用于遗传亚型和靶向治疗的生物标志物有限。
实验设计
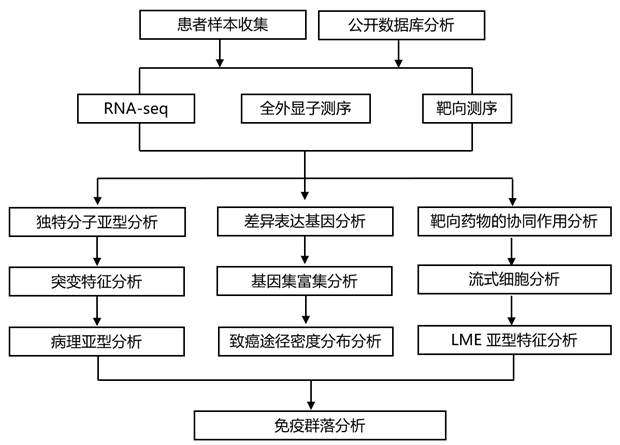
结 果
01
由遗传景观定义的 PTCL 独特分子亚型
基于 101 名 PTCL 患者的全外显子组测序(WES)数据,研究者团队总共检测到 36625 个体细胞突变。在所有突变基因中,选择了82个候选基因(snv和插入或缺失[indels]),在肿瘤发生中预测功能改变,在另外120名PTCL患者中进行深度靶向捕获测序。结合WES和靶向测序的结果,在82个基因中发现了1412个非沉默体细胞突变,其中错义突变1065个,无义突变96个,插入/缺失突变229个,剪接位点突变22个,显示了高频率的错义突变(图S1A)。在这82个基因中,每个样本平均检测到6个突变,突变范围为1 ~ 20个(图S1B)。PTCL的SNV以C>T和T>C转换为主,类似于其他癌症的体细胞SNV谱。此外,对WES样本进行拷贝数畸变(CNA)分析,结果显示拷贝数增益/扩增或丢失/缺失相对常见(图S1D-E)。与先前的研究一致,经常观察到包括TP53、CDKN2A和PTEN在内的重要基因的丢失(图S1F)。
在PTCL的全面突变列表中,有40个基因鉴定为反复突变,因为它们在所有病例的5%以上检测到(图1A)。最常发生突变的基因包括TET2(49%)、RHOA(27%)、KMT2C(20%)、DNMT3A(16%)和KMT2D(12%)。涉及的途径包括DNA甲基化(如TET2、DNMT3A和IDH2)、TCR信号传导(如RHOA、CARD11和FYN)、PI3K-AKT信号传导(如VAV1、PI3KR1和ITPR3)、组蛋白修饰(如KMT2C、KMT2D、CREBBP和EP300)、p53信号传导(如TP53、ATM和JMY)、Janus激酶信号传导和转录激活因子(JAK-STAT)信号传导(如PTPN13和JAK3)、免疫监测(如HLA-A和HLA-B)、染色质重塑(如ARID1A和ARID1B)、NOTCH信号传导(如NOTCH1和NOTCH3),以及肿瘤抑制(如MGA和CIC)。值得注意的是,所有患者都有这10种类型的突变,这表明PTCL的内在缺陷具有复杂的致病作用。对复发性遗传病变的两两关系分析揭示了一系列共同发生和相互排斥的突变(图S1G)。他们发现tfh相关基因,包括TET2、RHOA、DNMT3A和IDH2,以及免疫相关基因PTPN13和HLA-B有很强的共改变趋势。然后,他们对突变数据进行主成分分析(PCA),确定了PTCL中与遗传改变相关的3种主要分子亚型,包括T1(60例,以TET2和RHOA突变为特征),T2(49例,以TET2不含RHOA突变为特征)和T3(112例,以TET2和RHOA野生型突变为特征)(图1B)。
T1亚型由于其独特的TET2和RHOA突变共存而广泛研究。此外,他们还研究了DNA甲基化和TCR信号通路相关的其他突变的频率增加,如DNMT3A、IDH2和CARD11。另一方面,发现T2亚型在PI3K-AKT信号通路中频繁发生突变,如TSC2和VAV1。最大的PTCL亚型T3占本项研究队列的51%,其特征是参与复杂的生物学功能的异质遗传改变。随后,利用无监督分层聚类进一步分层,根据其离散的遗传性状和基因功能,发现了T3.1(71例)和T3.2(41例)2个亚型(图1C)。为了探索区分T3.1和T3.2的决定性改变,他们比较了两种亚型之间的突变负荷(图1D)。T3.1中与组蛋白修饰有关的突变显著富集,包括甲基化(KMT2C, 31%;KMT2D, 21%;KDM6B, 17%)和乙酰化(YEATS2, 13%,CREBBP, 7%)。同样,与T1和T2相比,T3.1在这些突变中也表现出明显的高频率,从而确定了其突变特征为组蛋白修饰改变。在T3和整个队列中,T3.2倾向于免疫相关突变,如PTPN13(17%)、HLA-B(12%)和HLA-A (7%)(图1E)。此外,一些相对常见的基因突变在各亚型中分布均匀,尤其是ARID1A和ARID1B(SWI/SNF)。
综上所述,根据RHOA、TET2、组蛋白修饰和免疫相关基因的突变情况,将PTCL分为4个亚组(图1E)。
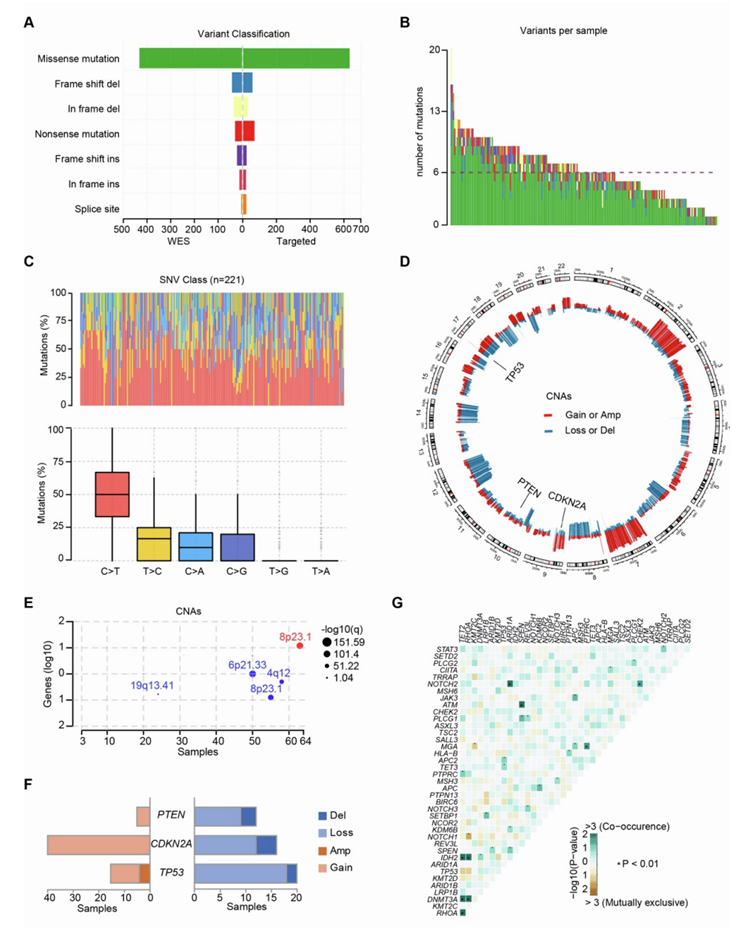
图S1. PTCL的遗传改变。
(A)根据突变类型,WES和靶向测序鉴定的突变比较。(B) 82个基因中每个样本的突变数。(C)每个样本中发现的非沉默体细胞snv的百分比(上)和基本变化类型的百分比(下)。(D) CIRCOS图显示WES样品中检测到的拷贝数改变(CNA)。(E) WES样本中染色体获得和丢失的CNA频率。(F) WES显示的TP53、CDKN2A和PTEN的CAN。(G)复发性遗传病变之间的相关性,揭示了一系列共同发生和相互排斥的突变。
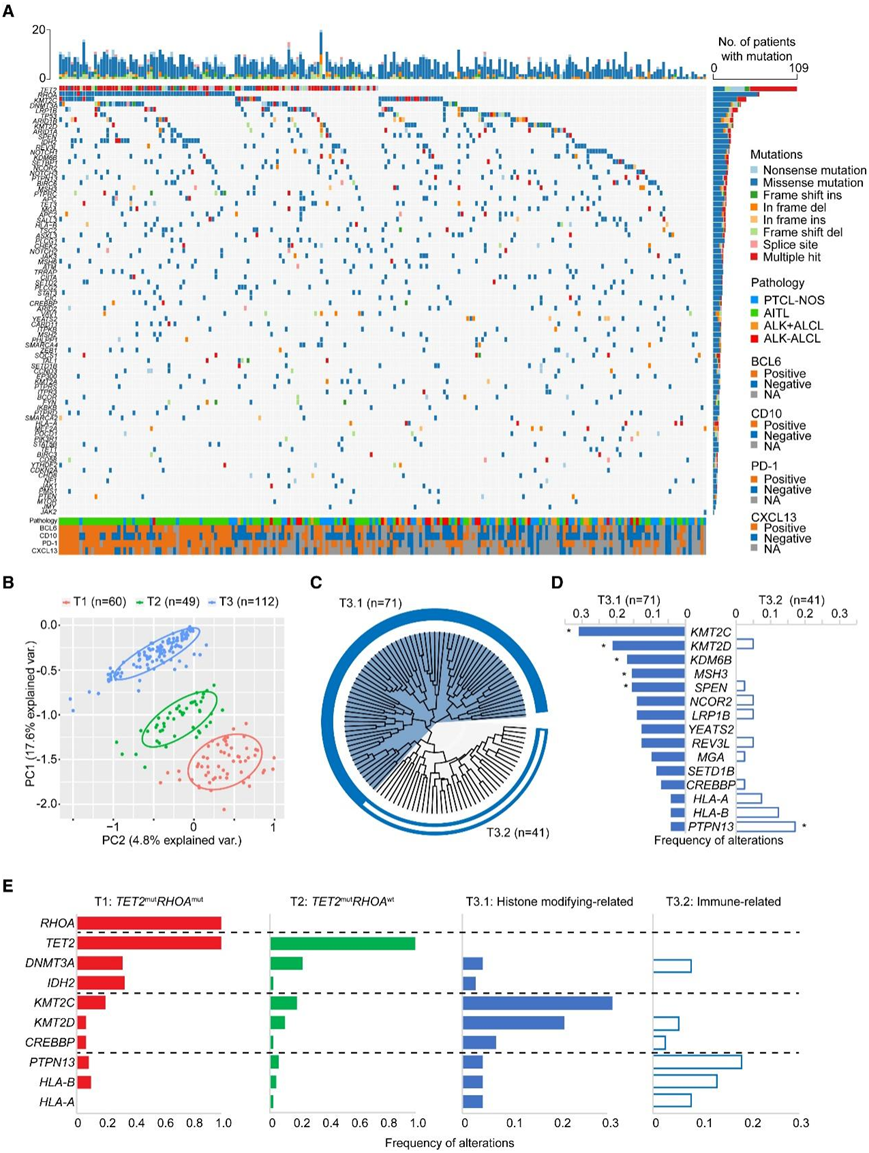
图1. PTCL的基因组图谱和突变特征。
(A) 通过 WES和靶向测序在 221 名 PTCL 患者中检测到的体细胞突变情况。(B) 遗传数据的 PCA 和代表性聚类的投影。(C) T3 亚型内无监督层次聚类的进化树图,揭示了 2 个亚型:T3.1 和 T3.2。(D) T3.1 和 T3.2 之间显著不同的定义变更的条形图概述。(E) 4 种分子亚型常见基因突变的频率。
02
PTCL分子亚型与不同的临床病理表现相关
分子亚型的病理分布差异显著(图2A)。TET2、RHOA、DNMT3A和IDH2是 Tfh 相关基因改变,在 Tfh 起源的 AITL 和 PTCL-Tfh 实体中经常发生改变。因此,T1和T2主要由AITL组成,分别占该亚型的85%和49%,其次是PTCL-NOS(T1中13%,T2中37%)。T3.1 具有异质性,包括 AITL、PTCL-NOS、ALK+ ALCL 和 ALK− ALCL 病例,分别占 23%、34%、23% 和 21%。也就是说,无论病理分类如何,组蛋白修饰基因改变都经常发生。T3.2也代表了具有病理异质性的亚组,因此表明免疫相关突变在不同病理亚型中的重要作用。
在4种病理亚型中,ALK+ ALCL患者的低风险国际预后指数(IPI)比例最高。值得注意的是,T1 期低风险 IPI 患者的比例最低(图 2B)。有趣的是,T1 亚型表现出明显较高的 EBER 阳性比例,这意味着TET2和RHOA突变与 PTCL 中的 EBV 感染存在潜在关联(图 2C)。根据分子亚型,所有 4 种分子亚型均表现出较差的无进展生存期 (PFS) 和总生存期 (OS)。T1、T2、T3.1 和 T3.2 亚型的预测 3 年 OS 率分别为 41.3%、55.5%、54.8% 和 41.8%(图 2D)。
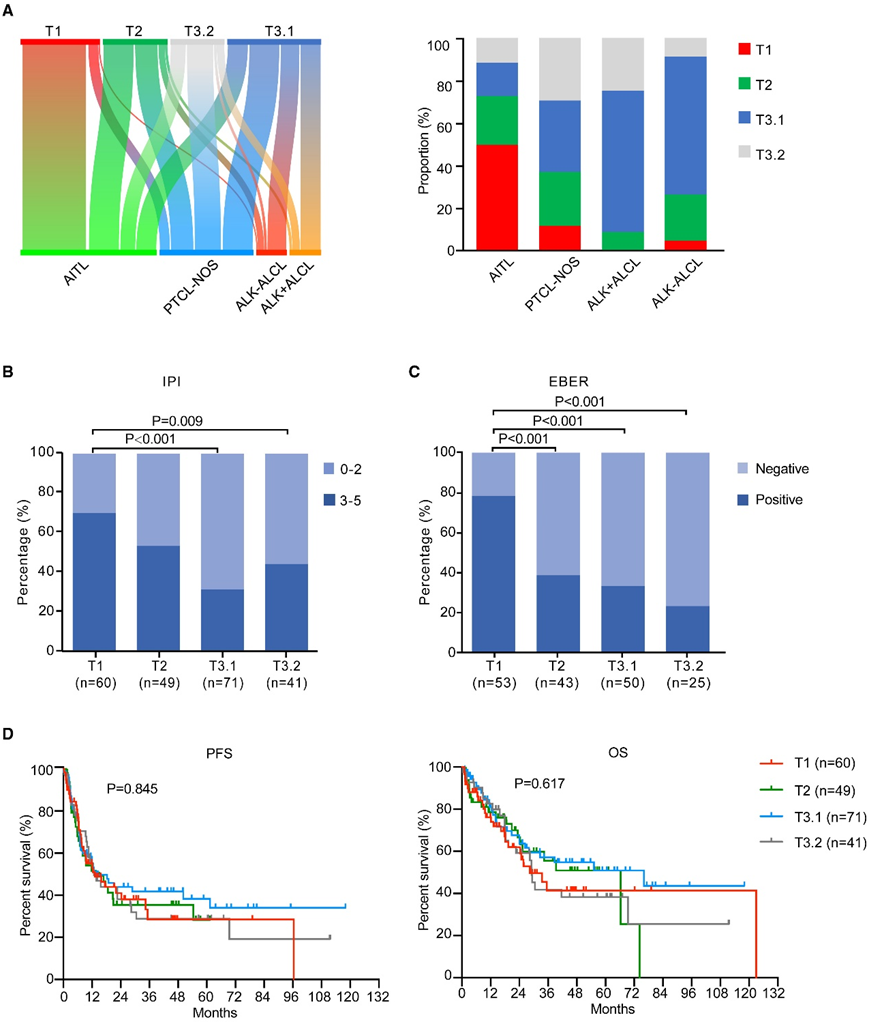
图2. PTCL分子亚型的临床特征。
(A) 每个分子亚型内病理类别分布的桑基图(左)以及分子亚型与病理类别之间的相关性(右)。(B) 根据分子亚型的 IPI。(C)通过原位杂交获得 EBER(阳性与阴性)。(D) 根据分子亚型的无进展生存期 (PFS) 和总生存期 (OS) 的 Kaplan-Meier 曲线。
03
与不同转录特征相关的 PTCL 分子亚型
接下来,他们研究了 RNA-seq 数据,以分析不同分子亚型的生物学特征,进行了差异基因表达 (DGE) 分析,将每个亚型与所有其他亚型进行对比,并揭示了 4 种分子亚型的基因表达模式存在差异(图 3 A)。基因集富集分析(GSEA)显示,TCR信号通路是T1中最富集的基因集,其次是PI3K-AKT、趋化因子、JAK-STAT、ERBB、Hippo、VEGF、丝裂原。激活蛋白激酶 (MAPK) 和哺乳动物雷帕霉素靶蛋白 (mTOR) 信号通路(图3B)。在T2阶段,PI3K-AKT信号通路最显著激活,TCR和MAPK信号通路略有富集。相反,T3.1 参与其他细胞过程,包括细胞周期检查点、DNA 复制和翻译,而 T3.2 则以 NOTCH、干扰素 (IFN)-α/β 和 VEGF 相关基因为特征。他们鉴定出了每种亚型中富集的信号通路和相应的基因组改变(图3C-D)。T1 的特点是 TCR 信号通路富集,与RHOA突变一致。相比之下,T2 在转录和遗传上表现出 PI3K-AKT 信号通路的富集,而 TCR 信号通路的富集程度较小,这可能是由于缺乏RHOA突变。另一方面,T3.1 包含涉及组蛋白修饰、染色质建模、肿瘤抑制因子和 p53 通路的遗传改变,与同源通路(包括翻译和细胞周期检查点)的富集一致。最后,T3.2 表现出免疫监视缺陷的遗传特征,并伴有 IFN-α/β 和 VEGF 信号通路的富集。
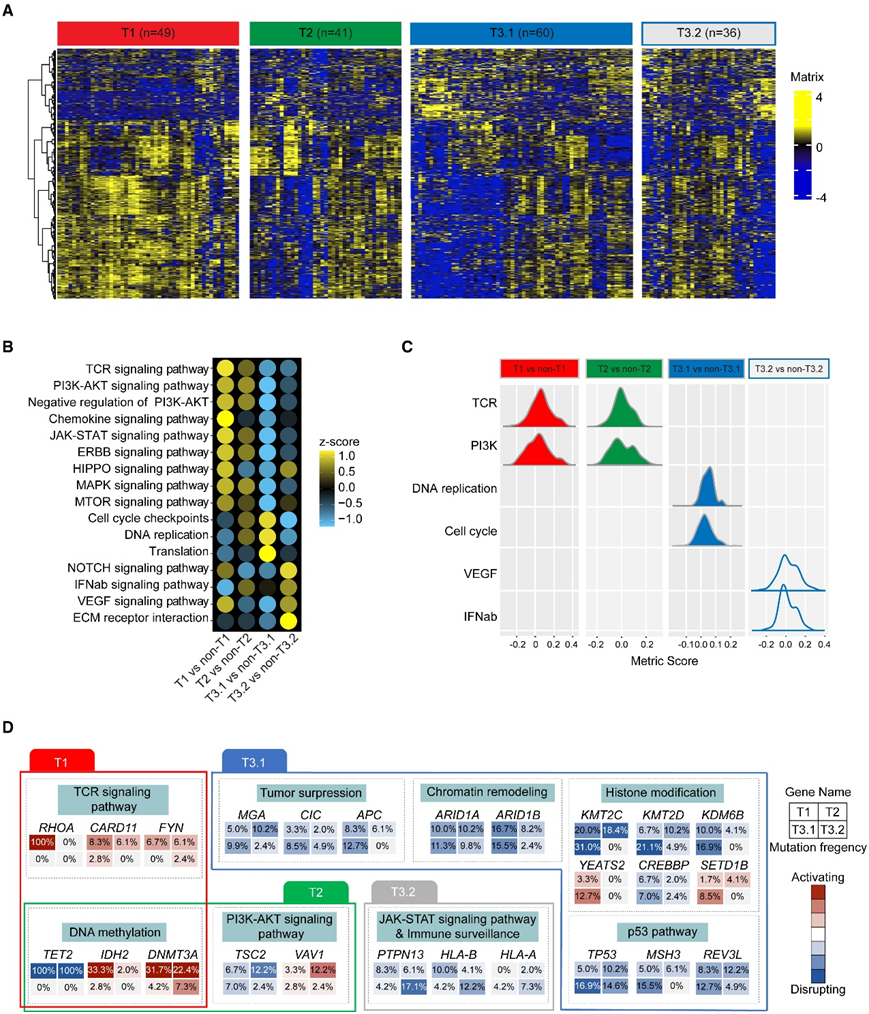
图3. 与不同转录组特征相关的 PTCL 分子亚型。
(A) 热图显示 4 种分子亚型的基因表达谱。(B) 点图代表通过基因集富集分析 (GSEA) 与所有其他患者相比每个分子亚型的富集分数特征。(C) 根据分子亚型的致癌途径的密度分布。(D) 选择并总结影响 PTCL 功能途径的驱动突变,以在 T1、T2、T3.1 和 T3.2 之间进行比较。
04
靶向药物的协同作用以及 T1 和 T2 亚型潜在单一疗法的探索
为了更好地了解 T1 和 T2 亚型(均含有TET2突变)的特征,他们比较了两种亚型之间致癌途径的基因表达。正如预期的那样,与 T2 亚型相比,T1 亚型显示出 TCR 信号通路以及趋化因子、NOTCH、VEGF 和 PI3K-AKT 负调节的富集(图4 A)。由于TCR和PI3K- akt信号通路可能分别是T1和T2亚型的潜在治疗靶点(图4B),他们探索了靶向TET2突变的低甲基化剂5-氮杂胞苷与T1亚型中抑制TCR信号的多激酶抑制剂达沙替尼和T2亚型中PI3K抑制剂duvelisib联合处理。在体外实验中,不同浓度的5-氮杂胞苷和达沙替尼分别作用TET2mutRHOAmut Jurkat和H9细胞48 h,大多数数据点位于联合指数(CI)曲线<1的区域,表明协同相互作用(图4C)。联合处理导致与癌症相关的多个信号通路显著下调,尤其是 TCR 信号通路(图 4D)。此外,具有TET2和RHOA突变的临床前斑马鱼患者来源的异种移植 (zPDX) 模型在联合组中比未处理组和单药组表现出更长的生存期(图 4 E)。同时,用不同浓度的5-氮杂胞苷和duvelisib处理TET2 mut RHOA wt Jurkat和H9细胞48小时,在联合组中发现了协同抑制作用(图4F)。伴随着1487个基因的特定模式,以及通过TLR信号通路下调PI3K-AKT和使IRF7失活(图4G)。在zPDX模型中,联合处理也导致具有TET2突变的患者的生存率增加(图4H)。
为了寻找选择性靶向TET2 mut RHOA mut和TET2 mut RHOA wt细胞的试剂,他们检测了暴露于 7316 种靶向试剂的 Jurkat 细胞的细胞生长。PAK4和烟酰胺磷酸核糖基转移酶(NAMPT)的双重抑制剂KPT-9274具有选择性抑制功能,可抑制TET2mutRHOAmut Jurkat和H9细胞的生长(图4I-J)。在筛选TET2mutRHOAWT Jurkat细胞时也得到了类似的结果(图4K)。TGF-β1受体I (tβri)抑制剂LY-364947在TET2mutRHOAWT Jurkat和H9细胞中观察并验证了其疗效(图4L)。这些结果表明KPT-9274和LY-364947分别作为T1和T2亚型的单药治疗的潜力。
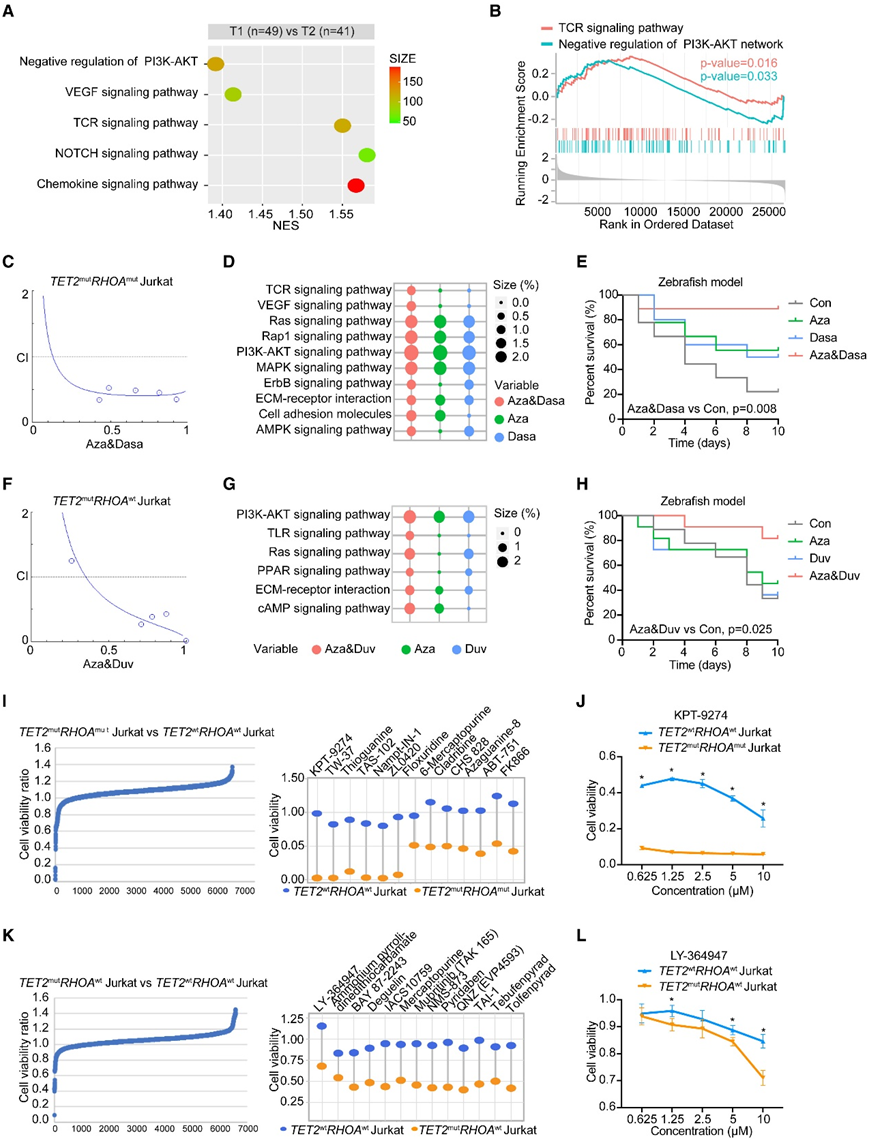
图4. 靶向药物的协同作用以及T1和T2亚型潜在单一疗法的探索。
(A) 根据京都基因和基因组百科全书 (KEGG) 和 Reactome 数据库对 T1 和 T2 进行通路富集分析。(B) 与 T2 相比,GSEA 在 T1 中富集了 TCR 信号通路的差异表达基因和 PI3K-AKT 网络的负调控。(C) 在用 5-氮杂胞苷 (Aza) 和达沙替尼 (Dasa) 处理 48 小时后,通过 Compusyn 软件计算的组合指数 (CI) 曲线。(D) 用 Aza 和/或 Dasa 处理后各组差异下调基因的通路分析。(E) 单独或联合使用 Aza 和/或 Dasa 治处理后,斑马鱼患者来源的异种移植物 (zPDX) 的存活率。(F) 在用 Aza 和 duvelisib (Duv) 处理的TET2 mut Jurkat 细胞中通过 Compusyn 软件计算的 CI 曲线。(G) 用 Aza 和/或 Duv 治疗后各组差异下调基因的通路分析。(H) 单独或联合使用 Aza 和/或 Duv 治疗后 zPDX 的存活率。(I)用 7316 种 0.4 μM 化合物处理 72 小时后,TET2 mut RHOA mut Jurkat 细胞和TET2 WT RHOA WT细胞的细胞活力比率(左)。右图列出了专门抑制TET2 mut RHOA mut Jurkat 细胞生长的化合物。(J)用不同浓度的 KPT-9274 处理 48 小时后TET2 mut RHOA mut Jurkat 细胞的细胞活力。(K)用 0.4 μM 7316 种化合物处理 72 小时后,TET2 mut RHOA WT Jurkat 细胞与TET2 WT RHOA WT细胞的细胞活力比(左)。右侧列出了专门抑制TET2 WT RHOA WT Jurkat 细胞生长的化合物。(L)用不同浓度的 LY-364947 处理 48 小时后TET2 mut RHOA wt Jurkat 细胞的细胞活力。
05
T3.1和T3.2亚型靶向药物的协同作用和潜在单药治疗的探索
接下来,他们评估了 T3.1 和 T3.2 亚型之间的差异表达基因。GSEA 证明,T3.1 亚型中与 DNA 复制、翻译、细胞周期检查点和 p53 信号通路相关的基因表达较高,而 VEGF、TGF-β、NOTCH、WNT 和 MAPK 信号通路在 T3.2 亚型中表达较高(图 5 A-B)。由于T3.1亚型以组蛋白修饰基因突变为特征,他们在KMT2Cmut Jurkat和H9细胞中检测了组蛋白去乙酰化酶抑制剂西达本胺与地西他滨的联合作用,并观察了与KMT2CWT细胞的协同作用(图5C)。与细胞因子-细胞因子受体相互作用相关的基因在联合用药组和MAPK信号通路中富集(图5D)。T3.1亚型zPDX模型在联合治疗组的生存期长于未治疗组和单药组 (图5E)。同时,检测Ki-67表达,检测抗血管生成剂阿帕替尼和PD-1抑制剂纳武单抗在PTPN13mut Jurkat和H9细胞中与外周血单个核细胞(PBMC)按1:5比例共培养时的抑制活性。阿帕替尼和纳武单抗在PTPN13mut Jurkat和H9细胞中显示出更高的抗肿瘤活性(图5F)。在Jurkat细胞与PBMC共培养体系中,通过多色流式细胞免疫分型发现,与未处理组相比,联合组显著降低了PTPN13mut Jurkat细胞共培养体系中CD3+/CD4+ Th2细胞的GATA3表达,而在PTPN13WT细胞中未观察到抑制作用(图5G)。因此,通过PTCL患者的RNA-seq数据,在T3.2亚型中观察到GATA3的上调(图5H)。他们还利用药物敏感性筛选分别研究了KMT2C和PTPN13突变对单药治疗诱导的细胞脆弱性。KMT2C突变对KDM4D抑制剂KDM4D-in-1的选择性敏感性通过KMT2Cmut Jurkat和H9细胞验证(图5I-J),PTPN13突变对VEGFR2抑制剂anlotinib的选择性敏感性通过PTPN13mut Jurkat和H9细胞验证(图5K-L)。
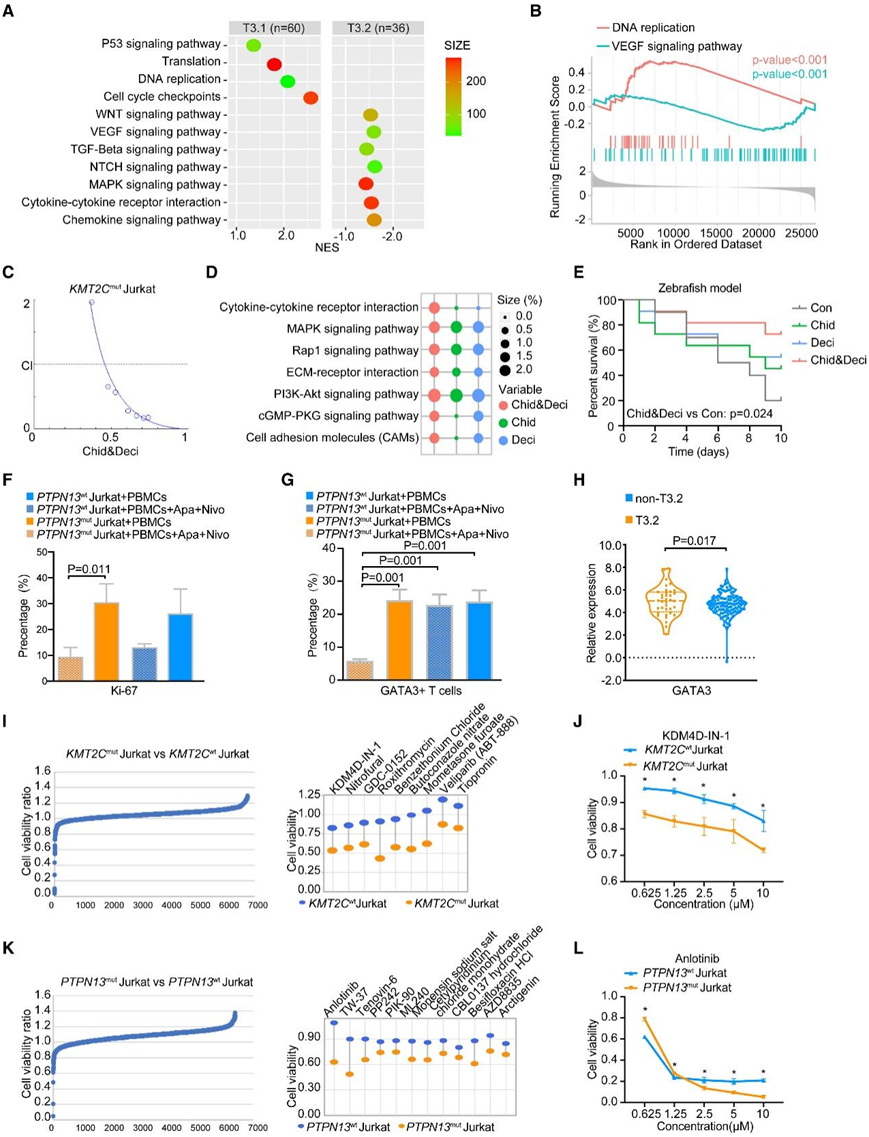
图5. T3.1和T3.2亚型靶向药物的协同作用和潜在单一疗法的探索。
(A) 根据 KEGG 和 Reactome 数据库对 T3.1 和 T3.2 进行通路富集分析。(B) GSEA 富集了 T3.1 中 DNA 复制的差异表达基因和 T3.2 中 VEGF 信号通路的差异表达基因。(C) 在用西达本胺(Chid) 和地西他滨 (Deci) 处理 48 小时的KMT2C mut Jurkat 细胞中通过 Compusyn 软件计算的 CI 曲线。(D) Chid 和/或 Deci 治疗后各组差异下调基因的通路分析。(E) Chid 和/或 Deci 单独或联合治疗后 zPDX 的存活率。(F)纳武单抗 (Nivo) 和阿帕替尼 (Apa) 治疗 72 小时后,转染PTPN13 WT和PTPN13 mut的 Jurkat 细胞的 Ki-67 阳性。(G) PBMC 中 Th2 细胞标记物(CD4 和 GATA3)的流式细胞分析。(H) RNA-seq 揭示的 4 个分子亚型中 GATA3 的标准化 mRNA 表达。(I)用 7316 种 0.4 μM 化合物处理 72 小时后,KMT2C mut Jurkat 细胞和KMT2C WT细胞的细胞活力比。(J)用不同浓度的 KDM4D-IN-1 处理 48 小时后KMT2C mut Jurkat 细胞的细胞活力。(K)用 7,316 种 0.4 μM 化合物处理 72 小时后,PTPN13 mut Jurkat 细胞和PTPN13 WT细胞的细胞活力比。(L)用不同浓度的安罗替尼处理 48 小时后PTPN13 mut Jurkat 细胞的细胞活力。
06
由基因表达谱定义的PTCL的独特淋巴瘤微环境 (LME)亚型
除了 PTCL 中肿瘤细胞的分子改变外,它们与 LME 的相互作用也在肿瘤生物学和临床行为中发挥着关键作用。为了定义 PTCL 中 LME 组成的多样性,他们根据基本免疫分析基因列表对 RNA-seq 数据进行了无监督分层聚类,并确定了与免疫浸润和基质成分相关的 4 种不同亚型:LME1(39.2%)、LME2 (19.9%)、LME3 (11.8%) 和 LME4 (29.0%)。
为了进一步探索不同LME亚型的具体特征,他们在前期研究的基础上开发了25个功能基因表达特征,涵盖了PTCL微环境的各个方面,包括肿瘤来源细胞(例如Tfh、Th1、Th2和Th17细胞)、免疫细胞(例如,B 细胞、浆细胞、调节性 T [Treg] 细胞以及 M1 和 M2 巨噬细胞)、基质相关细胞和非细胞成分(例如,淋巴内皮细胞 [LEC]、血管内皮细胞 [VEC]、癌症相关成纤维细胞 [CAF]、成纤维网状细胞 [FRC] 和细胞外基质 [ECM])以及 LME 依赖性信号传导和转录途径(例如 B 细胞运输、TNF、免疫检查点、IFN-α/β、VEGF、和 HIF)。为了重建一般组成和生物学特征,比较了 4 个 LME 亚型的单样本 GSEA (ssGSEA) 值(图 6 A)。根据每个亚型内的特征组合,将它们称为“Tfh 样”,因为 Tfh 细胞在 LME1 中作为其肿瘤起源细胞 (COO)进行了独特的富集;由于LME2中免疫细胞(例如Treg细胞和M1巨噬细胞)的聚集以及各种免疫浸润信号通路(例如VEGF、IFN-α/β和免疫检查点)的广泛激活而导致“炎症”。与其他亚型相比,LME4 的大多数微环境特征的表达总体较低。当比较 4 个 LME 亚型的肿瘤含量时,观察到显著差异。耗尽的亚型表现出明显更高的纯度,这与该亚型中免疫或基质相关特征的缺乏以及强劲的细胞增殖一致。炎症和间充质亚型显示肿瘤含量较低,因为它们都具有丰富的LME成分,LME亚型病理分布不均匀(图6B)。Tfh样亚型主要由AITL和PTCL-NO组成,对应于AITL和Tfh起源的PTCL-Tfh实体。炎症亚型的主要成分也是AITL(56.8%)和PTCL-NOS(29.7%)。值得注意的是,大多数间充质亚型是 ALK+ ALCL,具有 Th17 细胞和基质富集特征。
他们还对已发表的基因表达数据进行了 ssGSEA 分析,并且每个 LME 亚型的所有免疫相关特征均由外部队列进行了验证(图 6 C)。炎症亚型与以RHOA突变为特征的 T1 亚型关系最为密切。间充质亚型富含 M2 巨噬细胞和 Th17 起源肿瘤细胞,这两种细胞都与组蛋白修饰突变相关,主要由T3.1亚型组成(图6D)。本项研究队列中的 PFS 和 OS 均表明间充质亚型与其他亚型相比具有更好的预后(图 6 E)。
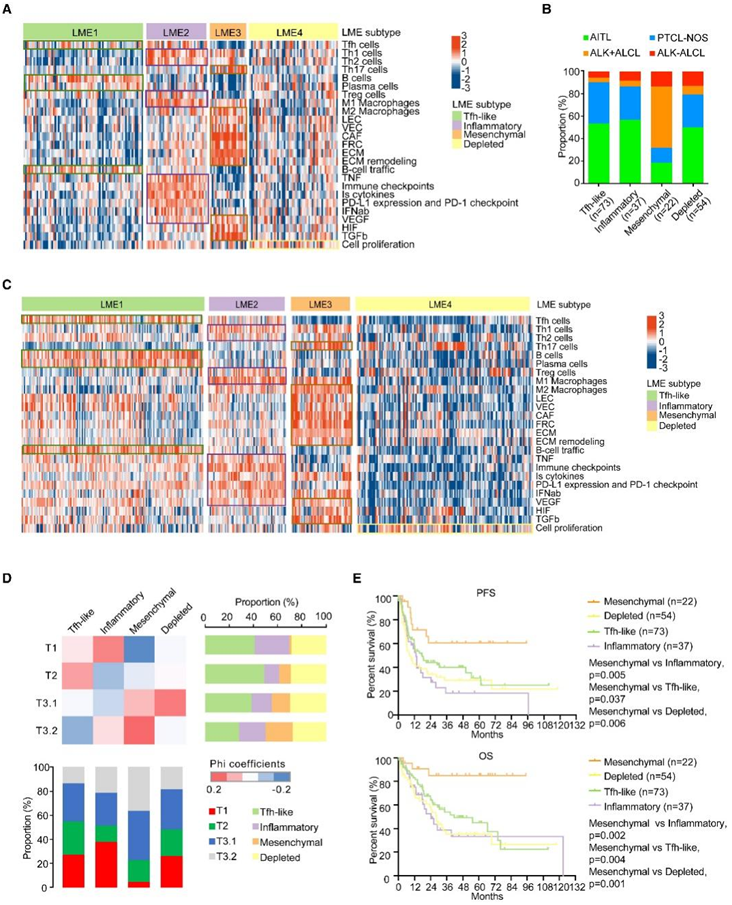
图6. PTCL 的免疫聚类揭示了不同的基于基因表达的淋巴瘤微环境 (LME) 亚型。
(A) 25 个功能基因表达特征的活性得分热图。(B)四种LME亚型的病理类别分布比例。(C) 396 名 PTCL 患者外部 GEP 的 25 个功能基因表达特征的活动评分热图。(D) LME 亚型和分子亚型之间的关系。(E) 186 名 PTCL 患者根据 LME 亚型的 PFS 和 OS 曲线。
07
按 LME 亚型剖析的不同免疫群落
为了更好地分析每种 LME 亚型的免疫性质,他们使用 Cibersort 计算了每种 LME 亚型内的细胞丰度和相对细胞群体。LME 亚型的可重复性在外部队列中得到了验证,显示了每个 LME 亚型中可比较的群落富集特征(图 7)。Tfh 样亚型揭示了淋巴瘤细胞的 Tfh 起源(图 7A),以及明显更高比例的 B 细胞和浆细胞(图 7B-C)。炎症亚型主要起源于Th1或Th2细胞(图7D),同时富集Treg细胞和M1巨噬细胞(图7E-F)。间充质亚型主要起源于Th17细胞(图7G),富含M2巨噬细胞和广泛的基质成分,包括LEC、VEC、CAF、FRC和ECM(图7H-I)。至于可能的免疫治疗靶点,Tfh 样亚型中 Cereblon (CRBN)、T 细胞免疫球蛋白和 ITIM 结构域 ( TIGIT ) 以及CD52 的表达水平高于其他 LME 亚型,表明潜在的治疗靶点(图 7J)。在炎症亚型中观察到各种免疫检查点基因的表达增加,例如PD-L1、LAG3和IDO1(图7K),以及在间充质亚型中的TIM-3(图7L)。此外,在间充质亚型中发现了CD30表达的富集,表明抗CD30抗体具有潜在的靶向治疗作用(图7L)。因此,免疫抑制条件可能有效地有助于每个LME亚型抗肿瘤免疫的重建和随后的肿瘤生长抑制。
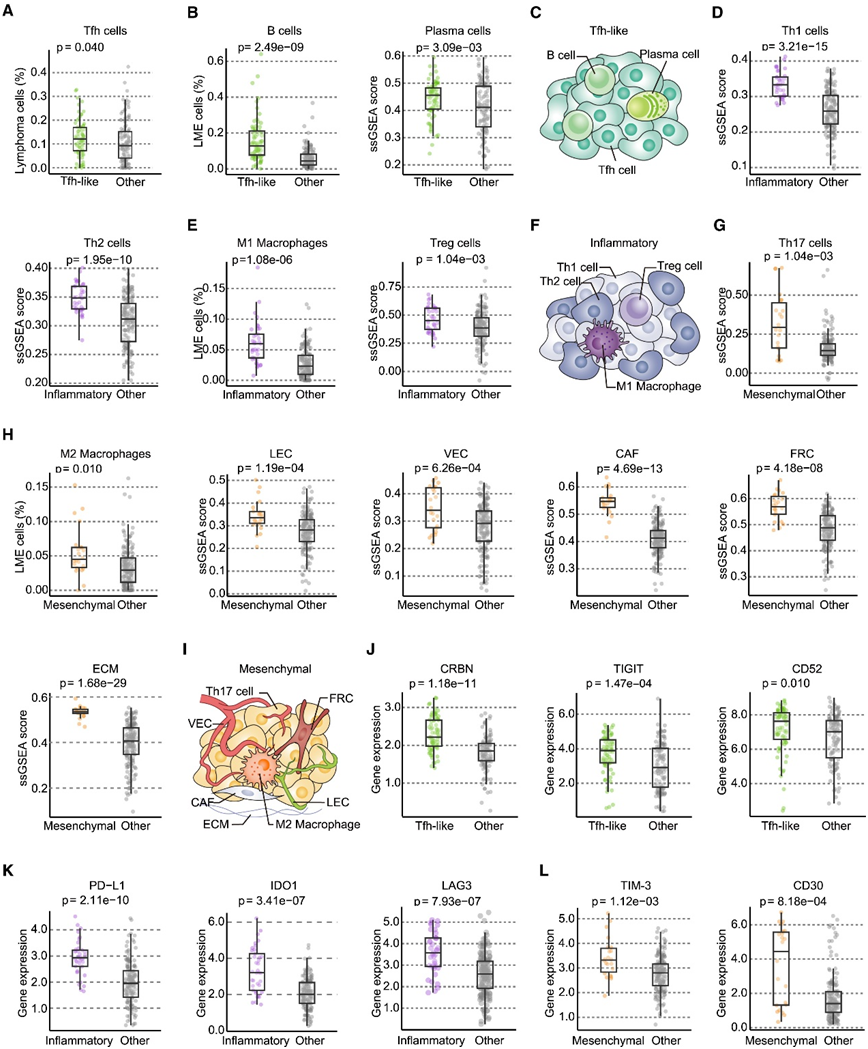
图7. LME 亚型的分析揭示了独特的免疫群落。
(A) 通过 Cibersort 获得的 Tfh 样 LME 中 Tfh 细胞的显著富集。(B) 分别通过 Cibersort 和单样本 GSEA (ssGSEA) 获得的 Tfh 样 LME 中 B 细胞和浆细胞的显著富集。(C) 类似 Tfh LME 的选定特征的示意图。(D) ssGSEA 获得的炎症性 LME 中 Th1 和 Th2 细胞显著富集。(E) 分别通过 ssGSEA 和 Cibersort 获得的炎症性 LME 中 Treg 细胞和 M1 巨噬细胞的显著 富集。(F) 炎症性 LME 选定特征的示意图。(G) ssGSEA 获得的间充质 LME 中 Th17 细胞显著富集。(H) 通过 Cibersort 或 ssGSEA 获得的间充质 LME 中 M2 巨噬细胞、LEC、VEC、CAF、FRC 和 ECM 显著富集。(I) 间充质 LME 选定特征的示意图。(J) RNA-seq 揭示的 Tfh 样 LME 与其他 LME 中 CRBN、TIGIT 和 CD52 的标准化 mRNA 表达。(K) RNA-seq 揭示的炎症性 LME 与其他 LME 中 PD-L1、LAG3 和 IDO1 的标准化 mRNA 表达,以及 RNA-seq 揭示的炎症性 LME 与其他 LME 中 TIM-3 和 CD30 的标准化 mRNA 表达序列。
+ + + + + + + + + + +
结 论
本项研究通过对 221 名 PTCL 患者进行综合基因组和转录组研究,描绘了 PTCL 的遗传图谱,从而实现了分子和微环境分类。根据RHOA、TET2、组蛋白修饰和免疫相关基因的突变状态,将PTCL分为4个分子亚型,这些亚型具有离散的基因表达模式、生物畸变和对靶向药物的脆弱性。本研究还对微环境转录特征进行无监督聚类,并根据致癌途径的特征激活和免疫群落的组成将 PTCL 分为 4 种淋巴瘤微环境亚型。本项研究研究结果强调了未来针对 PTCL 分子和微环境改变的精准医疗策略的潜在临床原理。
+ + + + +



 English
English


