文献解读|Cell Metab(29.0):高胰岛素血症通过腺泡胰岛素受体发挥作用,通过增加消化酶的产生和炎症来引发胰腺癌
✦ +
+
论文ID
原名:Hyperinsulinemia acts via acinar insulin receptors to initiate pancreatic cancer by increasing digestive enzyme production and inflammation
译名:高胰岛素血症通过腺泡胰岛素受体发挥作用,通过增加消化酶的产生和炎症来引发胰腺癌
期刊:Cell Metabolism
影响因子:29.0
发表时间:2023.10.31
DOI号:10.1016/j.cmet.2023.10.003
背 景
胰腺导管腺癌 (PDAC) 的 5 年生存率低于 10%,预计到 2030 年将成为癌症死亡的第二大原因。慢性胰腺炎、家族史、吸烟、肥胖和 2 型胰腺癌糖尿病 (T2D) 是胰腺癌的危险因素。已有研究证明,减少胰岛素的产生可抑制Kras突变小鼠的胰腺上皮内瘤变 (PanIN) 的癌前病变。然而,其病理生理学和分子机制仍不清楚,特别是不清楚高胰岛素血症是否直接或间接影响 PanIN 前体细胞。
实验设计
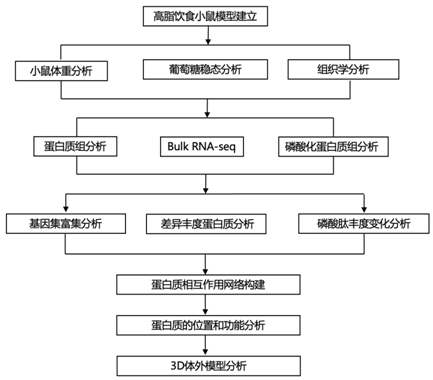
结 果
01
腺泡特异性Insr损失对体重和葡萄糖稳态的影响
研究中团队首先提出假设:高胰岛素血症通过 Insr 细胞自主驱动胰腺癌发展。他们构建了小鼠模型,其中在腺泡细胞中诱导了Kras G12D表达和Insr缺失。本项研究的队列包含具有完整Insr基因剂量的小鼠Ptf1a CreER;KrasLSL−G12D ; Insr w/w;nTnG (PK- Insr w/w); Insr、Ptf1a CreER部分敲除的小鼠:KrasLSL−G12D ; Insr w/f ;nTnG (PK- Insr w/f)。或不含任何Insr、Ptf1a CreER 的基因敲除小鼠:KrasLSL−G12D ;Insr f/f;nTnG (PK- Insr f/f)(图1A)。他们还建立了有限数量的Ptf1a CreER;Insr w/w;nTnG 和Ptf1a CreER;Insr f/f ;nTnG 小鼠以评估Insr在腺泡细胞中的基线作用(图1A)。所有小鼠均以高脂饮食 (HFD)喂养(图1B),这会产生持续的高胰岛素血症并加速 PanIN/PDAC 的发育。在4周龄时注射他莫昔芬,以同时诱导突变型KrasG12D和核GFP的表达,以及floxed Insr等位基因的缺失,特别是在腺泡细胞中(图1B)。正如预期的那样,摄入HFD的小鼠随着时间的推移体重增加(图1C-D),在43.5周时,体重分别超过了44周龄的C57Bl6J雄性或雌性小鼠的平均体重。在突变型Kras背景下,腺泡Insr缺失未影响雄性或雌性小鼠的体重增加(图1C-D),但与Kras野生型小鼠相比,突变型Kras等位基因的存在影响了雄性小鼠的体重随时间的增加(图1C)。空腹血糖在基因型之间没有差异(图1E-F)。HFD 在两种基因型中诱导相似水平的高胰岛素血症(图 1G-H)。
这些结果表明,腺泡特异性Insr缺失不会对小鼠的葡萄糖稳态产生重大影响。因此,该模型能够检测腺泡细胞Insr在高胰岛素血症和正常血糖情况下的作用,模拟典型的肥胖、非糖尿病状态。

图1. 胰腺腺泡细胞中Insr的缺失对葡萄糖稳态或高胰岛素血症没有影响。
(A) 示意图描述了只在测试胰岛素受体信号传导对 HFD 加速 PDAC 启动的作用的小鼠模型。(B) 三周大的小鼠断奶并在研究期间提供高脂肪饮食 (HFD)。(C–H) 雄性和雌性小鼠的体重、空腹血糖以及空腹胰岛素测量值。
02
腺泡的Insr敲除限制了 KrasG12D导致的正常胰腺实质的损失
为了测试Insr缺失是否影响 Kras G12D介导的腺泡细胞 PDAC 形成,他们检测了一组 5-16 只 PK- Insr w/w、PK- Insr w/f和 PK- Insr f/f小鼠。一半的雄性 PK- Insr w/w小鼠和一些雌性 PK- Insr w/ w小鼠较早死亡(图2A)。因此,他们选择在 Kras G12D小鼠43.5 周龄时结束研究。他们发现4只雄性pk-insrw /w小鼠中存在胰腺导管腺癌(PDAC),但更重要的是,雄性pk-insrw/w小鼠的几乎整个实质都由囊肿、PanIN和ADM组成的导管化生所取代(图2A-E)。三只雄性 PK-Insr w/f小鼠在 43.5 周之前死亡,没有肉眼可见的肿瘤(图2A-B),但该基因型的更多动物保留了正常的腺泡细胞区域(图2C-E)。没有雄性 PK-Insr f/f小鼠在 43.5 周龄前死亡(图 2A-B),并且它们平均保留了更多正常的腺泡细胞面积(图 2C-E)。一只雌性 PK-Insr w/w小鼠以及一只雌性 PK- Insr w/f小鼠在 43.5 周龄之前死亡,而没有雌性 PK-Insr f/f小鼠在 43.5 周龄时死亡(图2A-B)。尸检时未发现肉眼可见的肿瘤(图2A-B),但从组织学角度来看,发现雌性中 PDAC 的发生率呈Insr剂量依赖性(图2B-D)。每种基因型的大多数雌性小鼠都保留了一些正常的实质组织(图2D-E)。
接下来,他们仅量化 43.5 周龄小鼠的组织破坏和病变形成的程度,以评估存在或不存在Insr的情况下疾病的程度。大多数腺泡细胞和 PanIN 病变呈 GFP 阳性,证实病变由 Ptf1a +腺泡细胞引起。雄性和雌性 PK- Insr w/w、PK- Insr w/f和 PK- Insr f/f小鼠的胰腺均含有具有化生导管组织学特征的导管病变,包括腺泡到导管化生 (ADM)、低级别和高级别- PanIN,有时还有 PDAC 肿瘤(图2C-D)。在小鼠模型中,表达Kras G12D的腺泡细胞中Insr 的降低可以减少 PanIN +肿瘤、单独的PanIN 或肿瘤面积(图 2F-H)。
这些数据表明,在饮食诱导的高胰岛素血症的情况下,腺泡细胞Insr剂量依赖性地调节致癌性 Kras 诱导的 PanIN 形成。
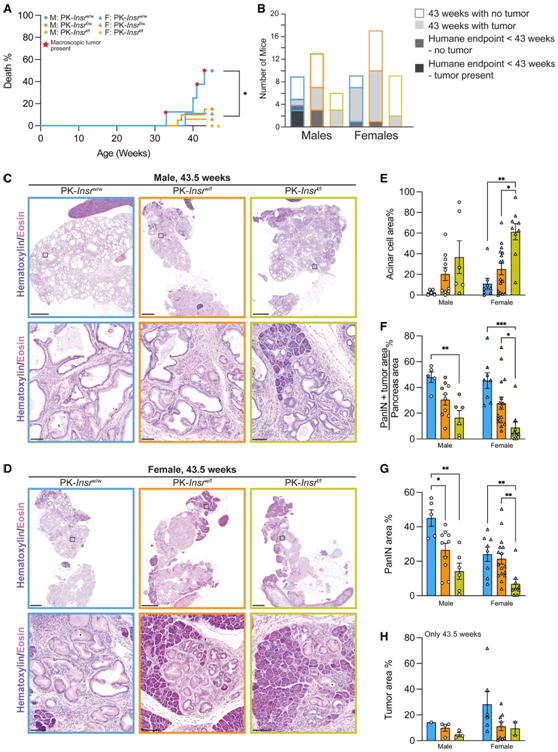
图2. 腺泡细胞中Insr的缺失减少了 PanIN 和 PDAC 的形成。
(A)在整个研究过程中,指定基因型小鼠死亡的百分比。(B) 在有或没有肿瘤存在的情况下,在 43 周之前或 43 周时死亡的小鼠数量。(C-D) 43.5 周龄雄性和雌性小鼠的胰腺切片的代表性全切片。 (E–H) 43.5 周时各基因型和雄性/雌性胰腺中腺泡细胞面积 (E)、PanIN +肿瘤面积、仅 PanIN 面积或肿瘤面积的定量。
03
KrasG12D表达腺泡细胞中Insr的缺失阻碍了早期 PanIN 的启动
为了分析早期 PanIN 的启动是否特别受到腺泡细胞中Insr损失的影响,他们对 12 周龄的小鼠进行了检测。用他莫昔芬注射后 8 周,腺泡细胞和 PanIN 病变呈 GFP 阳性,表明重组效率良好。与 PK-Insr w/ w小鼠相比,来自 PK-Insr f/f小鼠的胰腺主要是正常的,并且具有 ADM 或低级别 PanIN 特征的导管病变明显较少(图3A-C)。转录组分析(bulk RNA-seq)和GO分析显示,与PK-Insr f/f相比,PK-Insr w/ w胰腺中与Ras信号、增殖和炎症相关的基因表达更高,这些基因通常与PanIN起始相关(图3D-E)。仅通过减少腺泡细胞中的Insr即可显著抑制 12 周龄 PanIN 的形成。
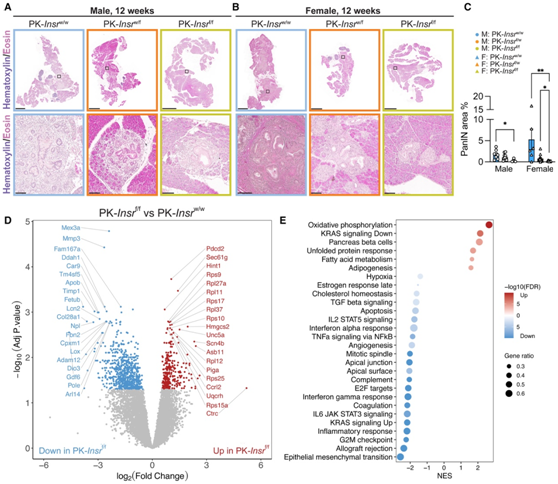
图3. 腺泡细胞中Insr的缺失减少了 PanIN 病变的发生。
(A-B) 12 周龄雄性和雌性小鼠的胰腺切片。(C) 对每个基因型和雄性/雌性的 12 周龄胰腺中 PanIN 面积进行定量。(D) 与 PK- Insr w/w小鼠相比,PK-Insr f/f小鼠中显著上调或下调的基因的火山图。(E)基因集富集分析。
04
缺乏腺泡细胞 Insr 的小鼠的胰腺消化酶减少
为了确定 PanIN 启动过程中Insr作用的潜在分子机制,他们对使用 12 周龄雌性小鼠的胰头进行了蛋白质组和磷酸化蛋白质组分析(图 3)。与Ptf1aCreER;Insrw/w;nTnG胰腺相比,炎症和PanIN相关蛋白Reg3a、Reg3b、Reg2、Tff1、Gkn1、Gkn2和Agr2在PK-Insrw/w中显著富集的124种蛋白中,这与他们发现的PanIN频率变化一致(图4A)。与腺泡细胞功能相关的蛋白,如Ctrc、Dbi、Pla2g1b和Clps,在122种蛋白中都因腺泡细胞中KrasG12D的表达而显著下调(图4A)。有趣的是,他们还发现 92 个蛋白质丰度增加,155 个蛋白质丰度减少,这仅仅是由于Kras 野生型腺泡细胞中Insr的缺失(图 4 B)。然而,本分析中 Ctrc、Clps 和 Pla2g1b 的减少(图 4B)表明Insr可能在调节 HFD 喂养小鼠野生型腺泡细胞的功能中发挥作用。
为了确定突变Kras中与Insr缺失相关的分子机制,他们进一步分析了PK- Insr f/f与PK-Insrw/w胰腺的比较。与PK-Insrw/w对照相比,PK- Insr f/f小鼠中135个蛋白富集,117个蛋白减少(图4C)。然后,他们对所有基因型中这些差异富集蛋白质的丰度值进行了 K 均值聚类分析,以识别因Insr状态、Kras 突变或两者而变化的蛋白质组(图 4 D)。

图4. 胰岛素受体对 PanIN 启动影响的蛋白质组学分析。
(A)与Ptf1a CreER相比,PK- Insr w/w小鼠中显著上调或下调的蛋白质的火山图。(B)显著上调或下调的蛋白质的火山图。(C) 火山图显示与 PK- Insr w/w小鼠相比,PK- Insr f/f小鼠中蛋白质显著上调或下调。(D) PK- Insr w/w和 PK- Insr f/f小鼠之间丰度差异的蛋白质,并将它们在所有基因型上的平均丰度用于 K 均值聚类。通过热图对聚类进行可视化。
为了研究基于细胞信号传导、细胞内定位和生物过程的蛋白质组的潜在功能富集,他们还针对PK-Insrw/w和PK-Insrf/f小鼠之间差异富集的蛋白质,使用STRING构建了蛋白质-蛋白质相互作用网络,并利用GeneCards的“COMPARTMENTS”部分在图中将这些蛋白质分配到它们的细胞内细胞器位置(图5A)。总蛋白质组学分析证实,与Ptf1aCreER;Insrw/w;nTnG和PK-Insrf/f胰腺相比,与PanIN起始或形成相关的蛋白质(如Reg3a、Reg3b、Reg2、Tff1、Gkn1和Gkn2)在PK-Insrw/w胰腺中较高(图4C-D和图5A)。蛋白质组学分析强调,与Ptf1a CreER ;Insr w/w;nTnG 和 PK- Insr w/w小鼠相比,PK- Insr f/f中包装到酶原颗粒中用于分泌的大多数蛋白质显著下调(图 4D和图5A-B)。腺泡细胞每天产生大量的蛋白质,检测到的所有肽中约 19% 与酶原颗粒相关(图 5 C)。然而,在 PK- Insr f/f胰腺中,这一百分比显著降低至 12.2%(图 5 C)。总之,在 HFD 情况下,腺泡细胞中Insr的缺失导致腺泡细胞产生的消化酶显著减少。

图5. 腺泡细胞中Insr的丢失减少了消化酶的产生。
(A) 使用 STRING 连接 PK- Insr w/w和 PK- Insr f/f胰腺之间差异丰富的蛋白质。(B) 热图显示参与胰腺消化酶分泌的蛋白质基因型之间蛋白质丰度的变化。(C) 每种基因型的总测量蛋白质中消化酶丰度的百分比。
05
腺泡细胞中Insr 的缺失减少了参与翻译的蛋白质的磷酸化
通过比较 PK- Insr f/f胰腺与 PK- Insr w/w对照,平行磷酸蛋白质组分析鉴定了 225 个下调的磷酸肽和 177 个上调的磷酸肽(图6A-D),并绘制了修饰蛋白的位置和功能图(图 6-D)。与 PK- Insr w/w胰腺相比,PK- Insr f/f中参与转录延伸(Eloa、Top2a 和 Supt5h)、mRNA 剪接和核斑形成(Srpk1、Srsf、Cherp、Srrm1 和 Srrm2),以及蛋白质翻译起始(Eif4b、Eif5b 和 eIF3 复合蛋白)和延伸(Eef1b、Eef1d 和许多核糖体亚基)的蛋白的磷酸化显著降低。Cavin3 的磷酸肽也有所减少,Cavin3 与 Akt-Erk 信号偏倚有关,和 PP1 抑制因子Ppp1r2 在受胰岛素信号传导影响的位点也有所减少(图6D)。
本项研究的蛋白质组数据表明,胰岛素/Insr 部分通过调节 Larp1 和许多其他控制消化酶转录、翻译和分泌的成分来促进腺泡细胞中蛋白质的产生。有趣的是,胆囊收缩素 (Cck) 受体 (Cckar) 上的多个位点也显示出磷酸化的改变(图 6 C-D),包括主细胞内环中配体诱导脱敏的位点和 C末端中的磷酸位点。
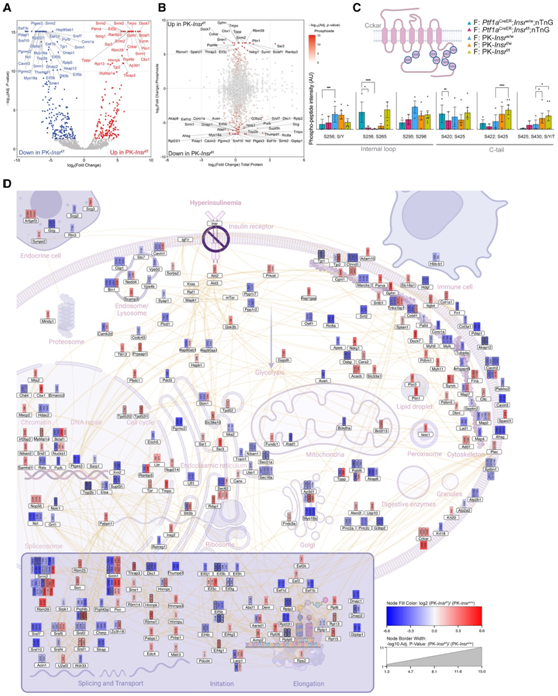
图6. 胰岛素受体对 PanIN 启动影响的磷酸蛋白质组学分析。
(A) 与 PK-Insr w/w小鼠相比,PK- Insr f/f小鼠中具有显著上调或下调的磷酸位点的蛋白质的火山图。(B) 与 PK- Insr f/f小鼠和 PK- Insr w/w小鼠之间相应蛋白质丰度的变化相比,磷酸肽丰度的变化。(C) 上:Cckar 上磷酸化位点的示意图,这些位点在任何比较中都存在差异丰富。下:所有样品和基因型的每个检测到的磷酸肽的相对磷酸肽丰度。(D) 不同丰度磷酸位点及其相应蛋白质的细胞内位置和功能。
06
减少腺泡细胞中的胰岛素受体信号传导可减少纤维化和炎症
为了检测腺泡细胞中Insr的缺失是否减少了通常与 KrasG12D激活和 PanIN 形成相关的损伤、炎症和纤维化,他们在 12 周内对Sirius Red、α 平滑肌肌动蛋白 (αSMA) 和 F4/80 进行了成像分析以量化基质中存在的胶原蛋白、活化的成纤维细胞和巨噬细胞的数量(图7A-B)。在PK-Insrw/w对照组中,Sirius Red、αSMA和F4/80染色包围着含有ADM和PanIN的化生性导管,以及周围小叶的腺泡(图7A-B)。相比之下,在PK-Insrf/f胰腺中,形成的腺泡导管化生水平往往与与较少的Sirius Red,αSMA和F4/80染色以及在邻近小叶中较低的染色水平相关(图7A-C)。这支持了他们的假设,即表达Kras G12D的腺泡细胞中缺乏Insr时炎症会减少。
他们利用腺泡细胞形成 ADM 的 3D离体模型来确定胰岛素水平是否影响腺泡到导管的转变(图 7D)。从正常饲料喂养的野生型雄性或雌性CD1或Bl6小鼠中分离腺泡细胞。如前所示,野生型雌性和雄性腺泡细胞聚类在胶原中生长5天,主要保持其腺泡形态(图7E)。TGF-α诱导这些聚类形成管状管腔结构(图7E)。增加胰岛素浓度可显著增强TGF-α诱导的环形成(图7E-F)。值得注意的是,胰岛素与TGF-α的协同作用由胰蛋白酶抑制剂完全阻断(图7F)。来自Ptf1aCreER;Insrf/f;nTnG小鼠的腺泡在有TGF-α的情况下形成的ADM环较少,并且不受胰岛素影响(图7G),表明胰岛素的这些效应是通过Insr介导的。总之,这些数据表明,高胰岛素血症介导的胰蛋白酶原原酶过度产生和随后的自身激活促进了局部炎症和PanIN病变的启动。
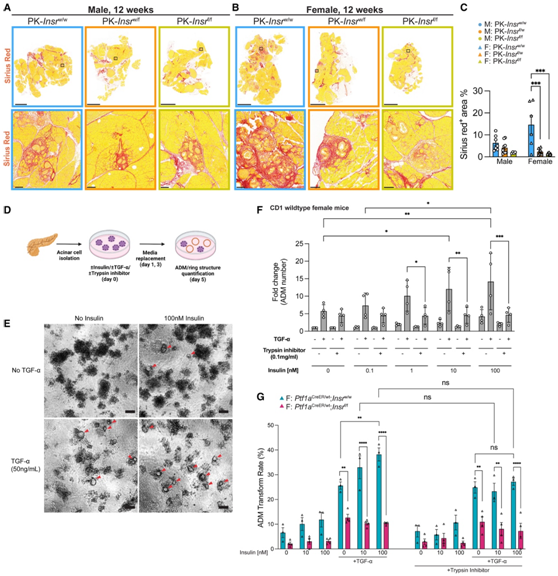
图7. 胰岛素受体信号传导通过增加与过度活跃的消化酶产生相关的炎症来促进 PanIN 的启动。
(A-B) 12 周龄雄性和雌性胰腺的染色的代表性全切片。(C) 每个基因型和雄性/雌性小鼠的Sirius red阳性区域的定量。(D) 使用 3D 腺泡细胞外植体系统进行 ADM 形成测定的实验设计示意图。(E)腺泡细胞聚类和导管形成(环形结构)的代表性明场图像。(F)原代小鼠腺泡细胞3D外植体(CD1雌性)中ADM的倍数差异进行定量。(G) 每孔所有腺泡聚类的 ADM 转化率的量化。
+ + + + + + + + + + +
结 论
本项研究的数据表明腺泡细胞中的胰岛素受体信号传导有助于 PanIN 和 PDAC 的发展,高胰岛素血症通过腺泡细胞 Insr 直接促进早期胰腺肿瘤发生。因此,针对胰岛素受体信号通路或高胰岛素血症本身可能有益于治疗和预防患者的胰腺癌。在体外,胰岛素以胰蛋白酶和Insr依赖性方式剂量依赖性地增加腺泡到导管化生的形成。总的来说,本项研究的数据揭示了肥胖驱动的高胰岛素血症与胰腺癌发展之间的联系机制。
+ + + + +



 English
English


