文献解读| Cell Reports(8.8):人类大脑类器官的单细胞长读长测序揭示了细胞类型特异性和自闭症相关的外显子
✦ +
+
论文ID
原名:Single-cell long-read sequencing in human cerebral organoids uncovers cell-type-specific and autism-associated exons
译名:人类大脑类器官的单细胞长读长测序揭示了细胞类型特异性和自闭症相关的外显子
期刊:Cell Reports
影响因子:8.8
发表时间:2023.10.26
作者/通讯作者:Yalan Yang/ Xiaochang Zhang
单位:芝加哥大学人类遗传学系
DOI号:10.1016/j.celrep.2023.113335
背 景
选择性剪接(AS)的失调已多次与神经发育障碍相关,但人类神经发育中细胞类型特异性剪接的程度在很大程度上仍然未知。
实验设计
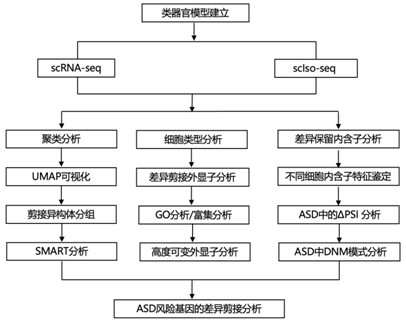
结 果
01
人类大脑类器官的单细胞和长读长 RNA 测序
研究者团队进行了长读长单细胞RNA异构体测序(scIso-seq)来研究人脑类器官中的细胞类型特异性剪接(图1 A)。为了捕获神经祖细胞和神经元,他们根据已发布的方案从人类诱导多能干细胞(iPSC)中生成了背侧前脑类器官,然后对生长 3-5 个月的六批大脑类器官进行了 scRNA-seq。通过均匀流形近似和投影 (UMAP) 将总共 28290 个细胞投影到调整后的二维空间中。所有细胞均使用 Seurat 分为 22 个聚类,并根据标记基因进行注释(图 1 B-D)。表达STMN2 的神经元包括五个表达GRIA2、SLC17A6、BCL11B和NEUROD6的兴奋性神经元聚类(C1、C4、C6、C9 和 C12) ;聚类14 (C14) 表达GAD1和GAD2的抑制性神经元;聚类18 (C18)是表达RELN的Cajal-Retzius 细胞。将表达OLIG1和OLIG2的C19聚类标记为少突胶质祖细胞(OPC)。由VIM表达标记的祖细胞包括表达HES5、SOX2和NES的神经祖细胞的三个聚类(C3、C8 和 C15)以及表达MKI67、APSM和UBE2C的分裂祖细胞的两个聚类(C11 和 C21)(图 1C-D)。他们根据GENCODE v.40人类参考转录组将检测到的亚型分为4个主要组(图1E)。在检测到的103007个亚型中,38.9%的特征是与GENCODE中现有注释的完全剪接匹配(FSM), 29.2%的特征是不完全剪接匹配(ISM)。重要的是,17.5%的同种异构体以前未在目录中注释(NIC),12.8%未在目录中标注(NNC)。此外,他们确定了一部分异构体,分类为反义、基因型(与内含子重叠的异构体)、基因间型(基因间区域的异构体)和融合型(两个或多个相邻基因之间的转录通读)(图1F)。单细胞全长(FL)转录组数据极大地扩展了人类大脑类器官中细胞类型的同种异构体目录。例如,在PTEN基因中发现了13个FSM、8个NIC和8个ISM亚型,PTEN是一种肿瘤抑制基因,也是研究最广泛的自闭症基因之一。对预测蛋白序列的分析表明,先前未注释的PTEN剪接形式可能导致催化N端磷酸酶结构域的缺失或C2结构域的缩短(图1G)。
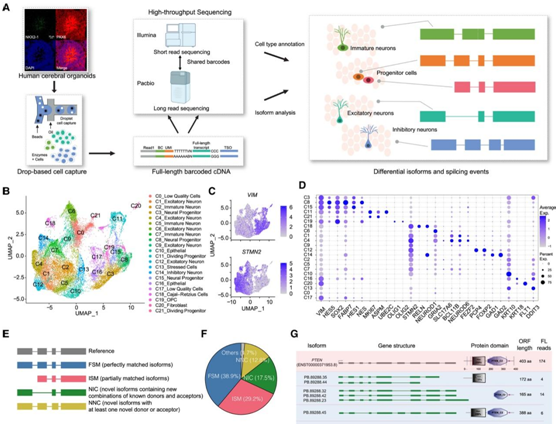
图1. 人脑类器官中的 scIso-seq 揭示了之前未注释的剪接亚型。
(A) scIso-Seq 的工作流程。(B) 人脑类器官 scRNA-seq 数据的 UMAP 可视化。(C) 显示神经元标记STMN2和神经祖细胞标记VIM表达的特征图。(D) 每种细胞类型中的代表性标记基因。(E) scIso-seq 鉴定的亚型的类型。(F) 饼图显示不同类型异构体的比例。(G) PTEN基因中先前未注释的剪接亚型的外显子-内含子结构和预测蛋白结构域 (SMART) 。
02
scIso-seq揭示了人类大脑类器官中广泛的替代外显子使用
他们检索了1247万个FLNC读数的细胞条形码,发现54.9%的这些读数可以分配给注释的细胞类型(图2A)。与 scRNA-seq 中细胞和读数的分布相比,scIso-seq读数包含了七种主要细胞类型,例如兴奋性神经元、未成熟神经元和神经祖细胞(图 2 B)。他们进一步使用 FLAIR 在三个水平上分析了细胞类型之间的差异剪接事件,例如跳过外显子 (SE)、选择性 5' 剪接位点 (A5SS) 和选择性 3' 剪接位点 (A3SS)并确定 (1) 神经元、祖细胞和 OPC 之间的差异 AS 事件;(2)神经元类型之间的差异AS事件;(3)兴奋性神经元亚型之间和祖细胞亚型之间的差异AS事件(图2C)。从 25 个成对比较中鉴定出总共 2393 个差异剪接外显子(DSE),其中包括神经元和祖细胞之间的 1216 个 DSE(图 2 C-D)。
神经元和祖细胞之间最显著的 DSE 包括已知和未注释的选择性剪接外显子,例如CLTA、CLTB、DYNC1I2和MEAF6中的 SE (图 2D)。含有神经元特异性外显子的基因富含突触后密度(PSD)蛋白(图2G)。
他们使用XSTREME鉴定了DSE临近内含子中富集的细胞类型特异性顺式调控序列基序。在神经元中包裹度较高的DSE中,上游内含子中富集了PTBP1和CPEB2的结合基序,下游内含子中富集了RBFOX1和HuR/ELAVL1的结合基序(图2E)。与此一致的是,RBFOX1和CPEB2在神经元中高表达,而PTBP1和ELAVL1在祖细胞中富集(图2F)。与此同时,在神经元中具有较高包涵体的外显子的基因也富集于RBFOX1和FMRP的靶点,但未富集于HUR靶点(图2G)。
兴奋性神经元与未成熟神经元之间存在615个DSE,兴奋性神经元与抑制性神经元之间存在80个DSE(图2C),这些DSE在大脑发育和轴突延伸负调控的通路中显著富集。使用在七种主要细胞类型中检测到的替代外显子,他们计算了它们的PSI值,并考虑了这些细胞类型之间的最大值ΔPSI,发现变异最大的外显子(max|ΔPSI|≥0.75)的长度明显较短(图2H)。他们确定了73个高度可变的开关样(switch-like)外显子,如ADD1中的外显子15,这些外显子包含在神经元中(图2I)。
在 68 个具有高度可变外显子的基因中,其中的9 个(DYNC1I2、NRCAM、KIF1B、ADD1、DNM1、DLG3、VPS13C、KAT6A和DTYMK)确定为神经发育障碍的病因。基于这些外显子 PSI 值的聚类分析将神经元与祖细胞区分开来(图 2 J)。这些结果表明细胞类型特异性外显子在神经发育中普遍存在。
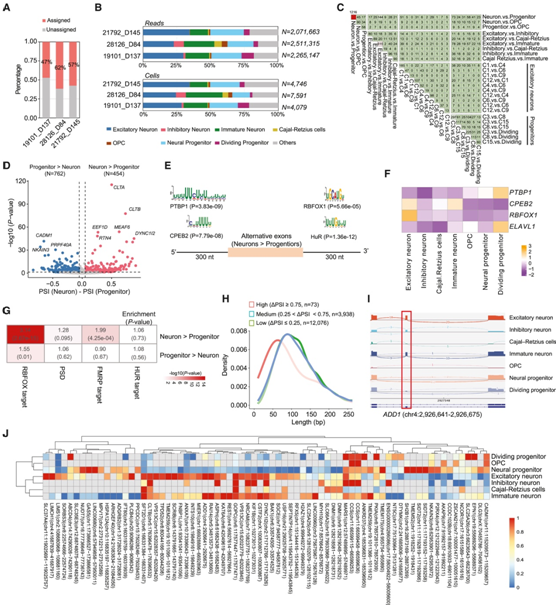
图2. 人脑类器官中细胞类型特异性外显子。
(A) 条形图显示分配给特定细胞类型的长读取的比率。(B) 7种主要细胞类型的scIso-seq读数和细胞分布。(C) 成对比较显示在三个层次级别上不同细胞类型之间检测到的 DSE 分布。(D) 火山图显示神经元和神经祖细胞之间的 DSE。(E) 神经元特异性 DSE 的临近内含子中富集的序列基序。(F) 基于 scRNA-seq 数据的热图。(G) 对编码 PSD 蛋白和 FMRP、HuR 和 RBFOX1 靶标的基因的神经元和祖细胞之间的 DSE 基因进行富集分析。(H) 七种主要细胞类型的外显子变异性密度图。(I) scIso-seq 的Sashimi图显示ADD1基因中的神经元特异性外显子。(J) 热图显示了不同细胞类型中高度可变的外显子的 PSI 值。
03
神经细胞类型之间差异保留的内含子
内含子保留(IR)通过将转录物保留在细胞核中或促进降解来影响基因表达。利用人类大脑类器官的长读长测序数据,通过 IRFinder-S 鉴定了 IR45并比较了不同细胞类型的IR。总共鉴定出 1427 个差异保留内含子 (DRI)(图 3 A)。具有 DRI 的基因富含与 RNA 剪接和翻译相关的通路(图 3 B)。KEGG 分析表明,这些基因在剪接体、核糖体、肌萎缩侧索硬化症 (ALS)、亨廷顿病和帕金森病的通路中富集。
神经元和祖细胞之间有 397 个 DRI。IR 在神经元中比在祖细胞中更常见(图 3 C)。REXO2基因中的 DRI(内含子 3)部分保留在神经元中,而在祖细胞中剪接(图 3D)。进一步分析表明,该 IR 几乎完全源自兴奋性神经元,该内含子的上游和下游外显子相互关联(图 3D)。然后他们研究了神经元中显著升高的内含子是否具有独特的特征,发现在神经元中表现出较高保留的内含子往往具有较短的长度、较高的GC含量、较高的保守分数和相对较弱的5'剪接位点,但3'剪接位点的强度没有显著差异(图3E)。这些结果表明,较弱的 5' 剪接位点和较高的 GC 含量可能在神经元的 IR 中发挥作用。
有趣的是,兴奋性神经元和抑制性神经元之间的DRI数量比神经元亚型之间的比较大得多,并且兴奋性-抑制性神经元DRI在抑制性神经元中显示出更高的滞留(图3F)。使用已发表的小鼠兴奋性和抑制性神经元的 RNA-seq 数据集,他们发现小鼠血管活性肠肽(VIP)抑制性神经元中保留的内含子多于兴奋性神经元中的内含子。他们进一步计算了每种细胞类型的平均 IR 比率,并证实抑制性神经元中保留的内含子显示出明显高于兴奋性神经元中的内含子(图 3G)。这些结果表明,一组内含子在神经元细胞类型之间保留有差异。

图3. 人脑类器官中差异保留的内含子。
(A) 成对比较显示在三个水平上在不同细胞类型之间检测到的细胞类型特异性 DRI。(B) GO分析。(C) 火山图显示神经元和神经祖细胞之间差异保留的内含子。(D) IGV 浏览器轨迹显示REXO2内含子 3 保留在兴奋性神经元中。(E) 箱线图分别显示了神经元中保留较多的内含子、祖细胞中保留较多的内含子以及神经元和祖细胞之间没有差异保留的内含子的长度、GC 含量和 PhastCons 保守评分。(F) 火山图显示兴奋性神经元和抑制性神经元之间保留有差异的内含子。(G) 箱线图显示不同细胞类型中保留内含子的 IR 比率。
04
DSE 揭示了自闭症的剪接破坏和遗传学
与疾病相关的外显子相比,与非疾病相关的外显子相比,不同细胞类型的疾病相关外显子表现出显著更高的变异性,其中在自闭症谱系障碍(ASD)中观察到最显著的差异(图4A-B)。此外,神经元和祖细胞之间的 DSE 在 ASD 相关外显子中表现出显著富集,但在 ALS 或精神分裂症相关外显子中没有表现出显著富集(图 4 C)。在某些兴奋性神经元亚型、祖细胞亚型和神经元类别之间的比较中,观察到疾病相关外显子的显著富集(图4C)。在神经元和祖细胞之间以及 ASD 个体和对照受试者之间差异剪接的 144 个外显子中,他们发现它们的剪接变化 (ΔPSI) 在这两个比较之间呈负相关(图 4 D) 。这些观察结果表明,在 ASD 个体中观察到的 AS 模式似乎比分化神经元中的剪接状态更接近祖细胞中的剪接状态。
他们研究了 ASD 中的从头突变 (DNM)模式,作为探索剪接程序与 ASD 之间联系的另一种方法。自闭症谱系障碍先证者中外显子连接区域(上游和下游 400 bp)周围的剪接突变富集。
值得注意的是,当关注神经元和祖细胞之间的 DSE 时,富集程度甚至更加明显。在这些 DSE 中,他们在 ASD 先证者中发现了 9 个 DNM,而在他们的兄弟姐妹中仅发现了 1 个 DNM(图 4 E),这表明 DSE 的破坏可能会导致自闭症谱系障碍。
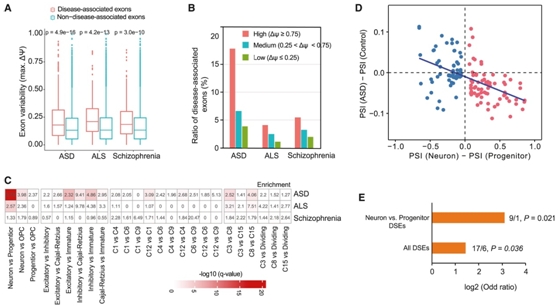
图4. DSE 与 ASD 病因相关。
(A) 箱线图显示与疾病相关的外显子与该疾病没有已知关联的替代外显子相比的外显子变异性。(B) 不同变异组(高、中、低)中疾病相关外显子的比例。(C) 对具有三种不同神经系统疾病中鉴定的替代外显子的细胞类型之间的 DSE 进行富集分析。(D) 神经元祖细胞 DSE 的 ΔPSI 值与 ASD 个体和对照受试者之间的 DSE ΔPSI 值呈负相关。(E) 自闭症先证者在 DSE 中具有明显更多的 DNM。
05
ASD风险基因的AS
他们进一步检测了 SFARI 数据库中编录的特定 ASD 基因的剪接模式,发现 142 个 ASD 基因在神经细胞类型之间存在差异剪接(图 5A-B),例如SPAST和PTEN。NCKAP1调节神经元细胞骨架动力学,NCKAP1的破坏性变异已证明会导致自闭症谱系障碍 (ASD)。他们在NCKAP1中发现了一个 18 bp 的微外显子(外显子 2),它包含在神经元中,但在祖细胞中跳过(图 5 C)。
对 NMD 敏感 DSE 基因的 GO 分析表明,RNA 剪接相关过程高度富集。使用每次比较中的非DSE作为阴性对照,神经元和祖细胞之间的DSE表现出NMD敏感外显子的显著富集,并且成熟神经元中的NMD敏感外显子比未成熟神经元中更多(图5D)。此外,他们还鉴定了 5 个 ASD 基因(SNAP25、HNRNPD、SF3B1、METTL26和JMJD1C),其中 AS 可能与 NMD 偶联。例如,在SNAP25基因中发现了一个 DSE (chr20:10,284,724–10,284,772),它在神经元中的包含程度高于在祖细胞中的包含程度。同时,DSE还包含一个从头错义突变(图5E),预计是有害的,并可能影响 SNAP25 蛋白功能。他们发现UBE3A基因含有一个与其上游外显子共同调控的隐秘外显子,并在兴奋性神经元中引入了替代翻译起始位点(图 5 F)。这些结果表明,细胞类型特异性 NMD 外显子调节基因表达,并可能导致自闭症发病机制。
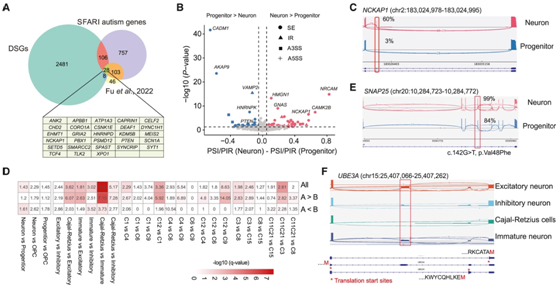
图5. ASD基因在不同细胞类型中的剪接差异。
(A) 显示细胞类型、ASD风险基因和SFARI自闭症基因之间的DSE基因的韦恩图。(B) 火山图显示神经元和祖细胞之间 SFARI 基因中的 DSE。(C) sashimi图显示NCKAP1基因中的 DSE 。(D) NMD 敏感外显子 DSE 富集分析。(E) sashimi图显示SNAP25基因中的 DSE。(F) UBE3A基因中的一个NMD敏感的DSE预计会在神经元中引入一个替代翻译起始位点。
+ + + + + + + + + + +
结 论
本项研究中的诱导多能干细胞 (iPSC) 衍生的大脑类器官中的单细胞长读长测序识别出超过 31000 个未注释的亚型和 4531 个细胞类型特异性剪接事件。长读揭示了协调的剪接和细胞类型特异性内含子保留事件,而用短读来研究这些事件具有挑战性。保留的神经元内含子富含RNA剪接调节因子,表现出更短的长度、更高的GC含量和更弱的5'剪接位点。他们使用该数据集来探索神经系统疾病的生物过程,重点关注自闭症。与公开的转录组数据相比,发现自闭症大脑中的剪接程序比分化的神经元更接近祖细胞状态。此外,自闭症先证者中细胞类型特异性外显子的新生突变明显多于兄弟姐妹。总的来说,这些结果强调了细胞类型特异性剪接在自闭症和神经元基因调控中的重要性。
+ + + + +



 English
English


